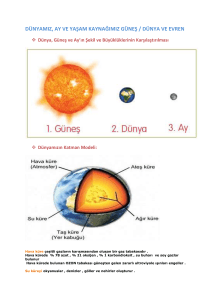
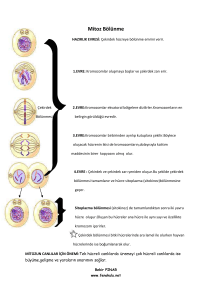
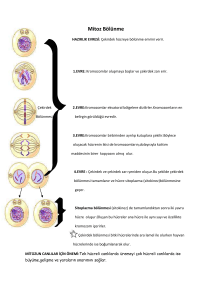
Epitelyal_Over_Tumorleri2.55 MB
advertisement

EPİTELYAL OVER TÜMÖRLERİ Prof.Dr. Macit Arvas Genital Kanserlerde Yeni Olgu ve Ölüm İnsidensi Kanser Tipi Endometrial Yeni vaka sayısı 41.200 Ölen vaka sayısı 7.350 Ovarian 20.180 15.310 Serviks 9.710 3.700 Vulva 3.740 880 Vagina 2.420 820 Jemal A, Cancer Statistics 2006; CA Cancer J Clin; 2006 Sağlık Bakanlığı Kanser Verileri2000 Olgu Sayısı İnsidans (Yüzbin) Over 634 1.89 Endometrium 432 1.29 Serviks 417 1.25 81 0.24 Vulva/Vajen Over Kanseri Her yıl dünyada 165,000 yeni olgu tanı almaktadır. Bu olguların % 70 ‘i ölüyor. Ortalama yaş: 53 Çoğu kadında 60-64 yaşta teşhis edilir Endüstrileşmiş toplumlarda daha sık izlenmektedir. 50 yaş üzerinde insidansı artıyor 50/100,000 Yakın akrabasında varsa 390/100,000 Evrelere Göre Sağkalım FIGO Evresi 5 yıllık sağkalım % Olguların %’si Ia 89.3 11,7 Ib 64,8 1,4 Ic 78,2 14,0 Iıa 79,2 1,8 Iı b 64,3 2,6 Iı c 68,2 5,1 IIIa 49,2 3,0 IIIb 40,8 6,3 IIIc 28,9 41,3 IV 13,4 12,8 FİGO Evrelemesi Evre I Overlerde sınırlı büyüme Ia-Tek over, kapsül intakt,asit (-) Ib-İki over, kapsül intakt,asit (-) Ic- Bir veya her iki over yüzeyde tm(+) veya kapsül rüptüre,asit (+),(+) peritoneal yıkama Evre II Pelvik yayılımlı bir veya iki overde büyüme IIa-Uterus ve/veya tuba yayılım ve/veya met IIb-Diğer pelvik dokulara büyüme IIc-İki over yüzeyinde tm veya rüptüre kapsül veya asit(+) veya (+) peritoneal yıkama FİGO Evrelemesi Evre III Bir veya iki overde tm ve peritoneal yayılım ve/veya LAP.Yüzeyel KC ,İB veya omentum yayılım IIIa-Tm pelvise sınırlı, lenf nod(-), histolojik abdominoperitoneal yüzey yayılımı(+) IIIb-Tm<2 cm., periton yayılım(-),lenf nod(-) IIIc-Tm>2 cm.,abdominal yayılım(+),lenf nod(+) Evre IV Tek veya iki overde büyüme, uzak met. Plevral efüzyon, parenkimal KC met. Over Tümörlerinin Dağılımı Histolojik tip Epitelyal Germ hücreli Stromal Metastatik % 86 6 4 3 Epitelyal over tümörleri Histolojik tip Seröz Musinöz Endometrioid Clear cell Miks Undiferansiye Brenner % 53.5 15.1 18.6 7 2.3 3.5 nadir Robboy SJ Pathology Second ed.1988 Epidemiyoloji Kadınlardaki kanserlerin % 4’ü 50 yaş üzeri • Kuzey Amerika, İskandinavya, Kuzey Avrupa yüksek • Afrika, Çin, Japonya düşük Yaşam boyu risk 1/70, (% 1.4) Yıllık insidans 17/100 000 Yıllık mortalite 7.6/100 000 Risk Faktörleri Beslenme • • • • • • • Yağlı gıda Kahve Az lifli gıda Düşük A vitamini Talk Asbestos Radyasyon Çevresel faktörler • Talk • Asbestos • Radyasyon Risk Faktörleri Üreme • Erken menarj • Geç menapoz • Nulliparite Viral • Kabakulak • Rubella Familyal • Aile anamnezi • BRCA1,BRCA2 mutasyonu • DNA mismatch onarım gen mutasyonu Laktasyon İnfertilite ilaçları • >12 siklus klomifen ile 2-3 kat artmış risk • Bu olgularda tümörlerin çoğunluğu LMP (Borderline) tümörler Çeşitli Risk Faktörleri ile Yaşamboyu Over Kanserine Yakalanma Riskleri Risk Faktörü Aile öyküsü yok Over kanserli 1.derece Bir Akraba Over kanserli 1.derece İki Akraba Meme kanserli 1.derece İki Akraba Kendinde meme kanseri BRCA mutasyonu taşıyıcısı HNPCC Yaşamboyu Over Kanseri riski % 1.4 % 3.5-7 % 15 % 3.5-7 % 3.5 % 16-27 % 3.5-5 Herediter Risk Faktörleri Ailevi Öykü Yaşam boyu risk % Risk faktörü yok 1.5 1 derece yakını 5 2 birinci derece yakını 7 Herediter ovaer kanser sendromu Bilinen BRCA1 or BRCA2 mutasyonu 40 35-65 Herediter Over Kanseri Over kanserlerinin % 90’ı sporadik Tüm epitelyal over kanserlerinin % 10’u herediter kökenli Otozomal dominant geçişli- Birden fazla generasyonda bir çok aile üyesi etkilenir. Herediter over kanserlerinin %90’ı BRCA gen mutasyonları ile ilişkili/%3 HNPCC sendromu? Olguların % 60’ı BRCA1 ve %30’uBRCA2 ile ilişkilendirilebilir. Günümüzde ortak kanı BRCA1 gen mutasyonu taşıyıcıları % 40-50 yaşamboyu over kanseri riski taşır BRCA2 gen mutasyonu taşıyıcıları % 20-30 yaşamboyu over kanseri riski taşır Azaltan Faktörler Oral kontraseptifler Tüp ligasyonu Profilaktik ooferektomi Oral Kontraseptifler Genel populasyonda, OC kullanımı over kanseri riskini düşürür ~% 40 OC kullanımı en az 5 yıl olduğunda yaklaşık % 50 over kanseri riski azalır. Ancak ovulatuvar siklus oranları yalnız % 15 azalır. Nullipar bir kadının 5 yıl OC kullanımı over kanseri riskini multipar bir kadına eşitler. Pozitif aile öyküsü olan bir kadının 10 yıl OC kullanımı over kanseri riskini öyküde risk faktörü olmayan bir hastanın altına indirir. Gross ve Schelesselman,Obstet Gynecol,1994 Risk azalması kullanılan süre ile bağlantılı olarak son kullanımdan 10 yıl sonrasına kadar devam ediyor görünümdedir. Rozenberg et al,JAMA,1982 Profilaktik Ooforektomi Over kanseri, yüksek mortalite hızı, etkin taramanın olmaması, koruyucu önlemde profilaktik ooforektomiyi gündeme getirmiştir. BSO, BRCA mutasyon taşıyıcılarında hem meme hem de over kanseri riskini azaltır. Aile öyküsünde over kanseri olan 35 yaş üstü kadınlarda PO önerilmektedir. Jinekolojik ya da kolorektal cerrahi uygulanan 40 yaş üzeri kadınlara rutin BSO toplumda Over Ca insidansında %5 azalmaya yol açar. BRCA Taşıyıcıları Prospektif çalışma 170 BRCA taşıyıcısı Ortalama 2 yıl takip BSO yapılanlarda, Over Peritoneal Meme kanseri insidansı anlamlı olarak azalmıştır. Kauff et al, N Eng J Med 2002;346:1609-15. Tarama Hastalık belirtisi olmayan bir toplumda, belirli bir hastalık ya da durumun tanısının konulabilmesi için düzenli aralıklarla sistematik olarak uygulanan tıbbı bir işlemdir. AMAÇ: Preklinik Evrede Erken Tanı Erken tanı Konservatif cerrahi şansı Sağkalım artışı Over Kanserinde Tarama Tarama protokollleri genellikle 50 yaş üzeri olgulara önerilmektedir. Ailevi risk taşıyanlarda 25 yaş sonrası taramaya başlanması önerilmektedir. 1995 yılında NIH ailesinde 2 ya da daha fazla akrabasında kanser olan olgulara 35 yaş üzerinde yıllık TvUsg ve Ca125 takibi önermiştir. Temel Tarama İşlemleri Tek tetkik • TV/US ile görüntüleme • Serum tümör belirteçleri Tek belirteç Belirteç panelleri • Genetik testler Ardışık tarama stratejileri Kombine tarama stratejileri Diğer Yöntemler Dopler 3D Ultrasonografi Bilgisayarlı Tomografi MRI PET CT USG Bilateralite(Var/Yok) Morfolojik Durum • Duvar Yapısı(İnce/Kalın) • Septasyon(Var veya ince/kalın) • Papiller yapı(Var veya ince/kalın) • Solid alan(Var/Yok) • Ekojenite(Kistik/solid) • Kistin büyüklüğü Tümör Belirteçleri Alfa-1 antitripsin BHCG CA 15-3 CA 19-9 CA 50 CA 54-61 CA 72 CA 125 CA 195 Katepsin L Karsinoembriyonik antijen Seruloplazmin CRP CYFRA21-1 Dianon marker 70/K Galaktozil transferaz HE4 HER-2/neu İnsan sütü yağ globül proteini İnsan sütü globül 2 ILIL-2 reseptö reseptörü ILIL-6 ILIL-8 ILIL-10 Inhibin KallekreinKallekrein-6 KallekreinKallekrein-10 Kipid iliş ilişkili sialik asit Lisofosfatidik asit Matriks metaloproteinaz 2 MCSF Mezotelin MusinMusin-benzeri karsinom antijeni Osteopontin Over serum antijeni OVX1 P110epidermal bü büyüme faktö faktörü resptö resptörü Plasental alkali fosfataz Prostasin Sialil TN Solubl fAS ligand Tetranektin Tümör nekrozis faktö faktör reseptö reseptörü Üriner gonadotropin peptid CA 125 Over kanserinin değerlendirilmesinde kullanılan en yaygın tümör belirtecidir. Yüksek molekül ağırlıklı bir glikoproteindir (musin). İlk olarak Bast ve ark tarafından, 1981’de fare monoklonal antikorları kullanılarak belirlenmiştir (OC 125). Bu antikorlar immünohistokimyasal özelliklerine göre iki ana grupta değerlendiriliyor • OC 125 benzeri antikorlar • M 11 benzeri antikorlar Beraberinde ayrı bir grup olarak OV 197 antikorları CA 125 Epitelyal over kanserlerinin % 80’inde, ileri evre over kanserlerinin % 90’unda yüksek bulunur. Evre I over kanserlerinin % 50’sinde yüksektir. Postmenopozal kadınlarda yükselmesi daha anlamlı 35 U/ml üzeri değerlerin yanlış pozitifliği premenopozda % 8.8’ken postmenopozda % 0.7’dir. Yüksek CA125 Jinekolojik nedenler Gastrointestinal/ Hepatik • Endometriosis • Akut pankreatit • Fibroidler • Kolit • Hemorajik over kisti • Kronik aktif hepatit • Menstruasyon • Siroz • Akut pelvik inflamatuvar hastalık • Divertikülit • İlk trimester gebelik Yüksek CA125 Nedeni bilinmeyen Malign hastalıklar • Perikardit • Mesane kanseri • Poliarteritis nodosa (PAN) • Meme kanseri • Renal Hastalık (kreatinin > 2) • Endometrium kanseri • Sjögren sendromu • Akciğer kanseri • SLE • Non-Hodgkin lenfoma • Tbc • Over kanseri • Kolon kanseri • Pankreas kanseri Bimanuel Muayene Mutlaka gerekir. Ancak erken evrede genellikle tanı konulamaz. İleri evrede kitlesel bulgu olarak ortaya çıkar. Semptomlar Uzun süre görülmez Batında ağrı ve distansiyon Bası semptomları (Sık idrara çıkma, konstipasyon, şişkinlik) Adet düzensizliği Bulantı,kusma Asit Torsiyon Zayıflama(facies ovarica) Tanı Koymada Yararlanılan Görüntüleme Yöntemleri Ultrasonografi (US) Manyetik Rezonans Görüntüleme (MRG) Bilgisayarlı Tomografi (BT) PET-BT Tanı LAPARATOMİ LAPAROSKOPİ Yayılma Yolları Direkt yayılma Peritoneal disseminasyon Lenfatik Yayılma Hematojen Yayılma Son 50 yılda tarama ve tanı metodlarındaki gelişmelere rağmen olguların 2/3’ü ileri evrede teşhis edilmektedir. Yine bu süre içerisindeki cerrahi ve kemoterapideki gelişmeler tüm evrelerde sürviyi ancak %30’lardan %50’lere çıkartmıştır. Borderline Over Tümörü Epitelial over tümörlerinin % 10-15’i Ortalama yaş : 30 - 45 Çoğunluğu evre I Metastaz yapabilir Rekürensler nadir Kemoterapi tedavide etkili değildir Yaygın metastazların bulunduğu hastalarda bile uzun dönem sağkalım söz konusudur Borderline Over Tm -Tanı Overin kendisinde konur Frozen ile borderline rapor edilen hastaların %20’sinde nihai patoloji invaziv over kanseri şeklinde değişmektedir Musinöz tümörler daha da sorunlu Peritoneal Yüzeylerin Karsinomatozisi Aynı embriyonel kaynak Over tümörü gibi davranır Yaygın peritoneal ve abdominal implantlar Kemoterapiye cevabı iyidir OVER KANSERİ Erken evre Evre I (Ia Ib Ic) Lokal (Evre II) İleri evre diğerleri (Evre III-IV) FIGO (Cerrahi Patolojik evreleme) Erken evre epitelial over tümörlerinde hasta fertilitesi korunması gerekirse evre 1A’da konservatif cerrahi yapılabilir. Ancak düşük riskli olmalıdır. Düşük riskli evre 1B ve1C tartışmalıdır. İleri evrede yapılacak cerrahi DEBULKİNG veya SİTOREDÜKTİF cerrahidir. OVER KANSERLERİNDE KONSERVATİF TEDAVİ EVRE Ia GRADE I PERİTON SİTOLOJİSİ NEGATİF OMENTUM BİYOPSİSİ NEGATİF DİĞER OVER BİYOPSİSİ NEGATİF LENF NODLARI NEGATİF SIK ARALARLA KESİN TAKİP YAPILABİLMELİ GENÇ VE GEBE KALMAK İSTEYEN KADIN BATIN İÇİ GÖRÜNÜM TAMAMEN NORMAL OLMALI ADEZYON OLMAMALI EVRE OVER KANSERLERİNDE CERRAHİ TEDAVİ MİDLİNE İNSİZYON DİKKATLİ PERİTONEAL EXPLORASYON SİTOLOJİ İÇİN ABDOMİNAL YIKAMA (asit,pelvis diafragma altı,parakolik bölgeler) TAH-BSO VEYA ORGAN KORUYUCU CERRAHİ OMENTEKTOMİ ADEZYONLARDAN VEYA ŞÜPHELİ ALANLARDAN BİYOPSİ BİLATERAL PELVİK PARAAORTİK NOD ÖRNEKLEMESİ ERKEN EVRE OVER TÜMÖRLERİNDE RELAPAROTOMİ SONUÇLARI EVRE Ia Ib Ic IIa IIb IIc n 37 10 2 4 38 9 UPSTAGED 6(%6) 3(%3) 0(-) 4(%100) 15(%39) 3(%33) YOUNG,JAMA 1983 ERKEN EVRE OVER KANSERLERİNDE GİZLİ METASTAZ YERLERİ VE ORANLARI YER PERİTONEAL SİTOLOJİ DİAFRAGMA OMENTUM ABDOMİNAL PERİTON PELVİK PERİTON PELVİK NODLAR PARAAORTİK NODLAR SIKLIK(%) 20 7.5 7 10 10 9 12 SOPER,OBSTET GYNECOL 1994 Erken Evre Prognostik Faktörler Yüksek Grade Clear Cell Kapsül yırtımış Asit Batın sıvısı pozitif Operasyon öncesi rüptür Yapışıklık-Tümor ploidisi CERRRAHİ SONRASI TÜMÖR TEKRARLAMALARI İÇİN YÜKSEK RİSKLİ ERKEN EVRE OVER KANSERLERİ 1-EVRE IC VE II TÜMÖRLER 2-GRADE III TÜMÖRLER 3-YAYGIN ASİT VARLIĞI 4-YAYGIN ADEZYON VARLIĞI PRIMER SİTOREDUKSİYON SINIFLAMASI Tip I : uterus,adneks ve omentum. Tip II : TipI+ pelvik periton, pelvik ve paraaortik lenf nod diseksiyon Tip III:Tip I + Tip II + ince barsak,kolon ve parsiyel mesane rezeksiyonu Tip IV: Tip I+II+III ince barsak,kolon iki tarafı,total mesane ve diafragmanın rezeksiyonu Tip V: Tip I+II+ III+IV+dalak,pankreas kuyruğu rezeksiyonu J.Ledermann, W.J.Hoskins, B.Kaye, B.Vergote Sitoredüksiyon Yazar, yıl n Optimal rezidüel hastalık (%) Rezidüel hastalık yok (%) Optimal için cut-off (cm) Değişik cerrahlar tarafından cerrahi yapılmış grup (Genel jinekolog ve genel cerrahlar dahil) Neijt, 1987 191 49 11 2 65 54 14 1,5 Bertelsen, 1990 360 25 8 1 Marsoni, 1990 914 27 - 2 Potter, 1991 163 46 27 1 Eisenkop, 1992 263 54 12 1 Del Campo, 1994 91 27 8 2 Venesmaa, 1994 264 36 - 2 Baker, 1994 136 40 - 1 Makar, 1995 455 27 10 2 Junor, 1999 768 27 - 2 Olaitan, 2001 281 55 - 2 Toplam 3951 34 (25-55) 12 (8-27) Chen, 1985 47 98 - 1,5 Heintz, 1986 70 70 4 1,5 Michel, 1997 152 91 30 2 Eisenkop, 1998 163 99 85 1 Vergote, 2000 112 89 43 1,5 Eisenkop, 2003 408 96 86 1 Toplam 952 93 (70-99) 65 (4-86) Heintz, 1988 Jinekolojik Onkologlar tarafından cerrahi yapılmış grup Sitoreduksiyon ne zaman uygulanmalı? Başlangıçta Arada (Interval debulking) Sekonder sitoredüksiyon Sitoredüktif Amaç Fizyolojik fayda (tümor küçülmesi) Tümör perfüzyonu(Kötü damarlanma kemoterapik ajanların suboptimal konsantrasyonları) İmmunolojik faktörler. SİTOREDÜKTİF CERRAHİ TÜM TÜMÖR DOKUSUNU ÇIKARTMAK YA DA 1 CM DEN AZ OLACAK ŞEKİLDE TÜMÖR DOKUSU BIRAKMAKTIR. İleri evre over kanseri şüphesi Morbidite, performans durumu ve Hastalık yayılımı primer cerrahiye İzin veriyor mu? Hayır Evet Histolojik / sitolojik tanı Primer sitoredüktif cerrahi Optimal Suboptimal Platin bazlı ve taksanla neoadjuvan kemoterapi 2-4 siklus kemoterapi sonrası Cevabın değerlendirilmesi Platin bazlı ve taksanla kemoterapi Cevap veya stabil hastalık İnterval sitoredüksiyon Ek kemoterapi Progresif hastalık Alternatif kemoterapi Palyatif tedavi Suboptimal cerrahi nedenleri ¾ ¾ ¾ ¾ Rezeke edilemeyen üst abdominal metastazlar ( % 85 ) İleri yaş veya medikal sorunlar (% 11 ) Stabil olmayan intraoperatif fizyoloji ( %2 ) Rezeke edilemeyen pelvik hastalık ( %2 ) ( Eisenkop 2001 ) ¾ ¾ Cerrahi Deneyim ? Biolojik agresif tümör ? İlerlemiş evrelerde prognozu etkileyenler Yaş Histoloji, Grade ve Asit SLL bulguları KT Tümor genişliği Residüal Tümör Primer sitoredüksiyon derecesine göre kemoterapiye komplet patolojik yanıt oranları Yazar Yıl n Mikroskopik residüel hastalık % Optimal Sitoredüksiyon % Suboptimal Sitoredüksiyon % Cohen 1983 67 73 35 34 Podratz 1984 118 82 44 39 Douplat 1986 51 85 73 19 Free 1987 89 75 36 9 Charmichael 1987 146 62 30 25 Bertelsen 1988 150 67 56 29 Sonnendecker 1988 24 - 69 38 Ayhan 1991 49 92 61 15 Katsoulis 1997 115 - 76 45 809 70 52 31 Toplam Genel sağkalım (ay)(median) Optimal Yazar, yıl Hoskins, 1994 Baker, 1994 Del Campo, 1994 Makar, 1995 Le, 1997 Michel, 1997 Eisenkop, 2003 Toplam Suboptimal Cut-off (cm) n OS n OS 1 343 40 294 22 1 55 57 81 32 2 25 >38 66 22 2 123 56 332 18 2 105 >60 191 18 2 138 >30 14 14 1 392 72 16 19 1181 50 994 20 İleri Over kanserinde Lenfadenektominin Yeri Benedetti Panici P, J Natl Cancer Inst, 2005 1991-2003 arası Evre IIIB-C,IV 452 olgu 228 olguda lenfadenektomi Yapılmamış sadece bulky lenf nodlar çıkarılmış 224 olguda Tam pelvik ve paraarotik lenfadenektomi yapılmış 195 olgu analiz için uygun 189 olgu analiz için uygun 5 yıılık PFS % 31.2 Median PFS 29.4 ay 5 yıllık survi % 48.5 Median survi 58.7 ay 5 yıılık PFS % 21.6 Median PFS 22.4 ay 5 yıllık survi % 47 Median survi 56.3 ay *Sistematik lenfadenektomi PFS uzatmasına karşın, genel surviyi etkilememektedir Neoadjuvant KT Seçilmiş olgular Histolojik Tanı (Open L/S) 3 siklus KT Sitoredüksiyon 3 siklus KT Park et al, Schwartz et al, ... EORTC-GCG 55865 GOG 152 425 550 319 (%75) 424 (%77) Cisplatin / siklofosfamid Cisplatin / paklitaksel Evre IV %21 %6* WHO performans durumu 2 %17 %7 < 5 cm %36 %56 > 5 cm %64 %44 %10 %5 Erken ölüm %3 %3 Cerrahiye uygun olmayan %6 %4 Kayıtlı Randomize edilmiş Kemoterapi Primer sitoredüktif cerrahiden sonra rezidüel hastalık 3 siklus kemoterapi sonrası Progresif hastalık Optimal interval sitoredüksiyon %64 Genel cevap oranı İnterval sitoredüksiyon %84 İnterval sitoredüksiyon yok %70 Komplet klinik cevap İnterval sitoredüksiyon %70 İnterval sitoredüksiyon yok %35 Median genel sağkalım İnterval sitoredüksiyon 26,4 ay optimal 31,2 ay suboptimal 18,6 ay İnterval sitoredüksiyon yok 35,7 ay 19,2 ay 36,2 ay İnterval sitoredüksiyon 14,5 ay 12,5 ay İnterval sitoredüksiyon yok 11,5 ay 12,7 ay Median hastalıksız sağkalım Kemoterapi Sitoredüktif cerrahi sonrası verilmelidir. Kabul gören tedavi süresi altı kürdür. Bazı olgularda üç kür sonrası cerrahi ve sonrasında da yine üç kür (interval) devam eder. Bazı olgulardada altı kür kemoterapi sonrası cerrahi yapılabilir. Kemoterapi Cisplatin veya Karboplatin +Paclitaksel ana tedavidir. Cisplatin+ Cyclophospamid veya PAC (cisplatin+ cyclophospamid+doksoru-bisin olabilir. İntraperitoneal kemoterapi dışında radyoterapi,ımmunoterapi, hormonoterapi yapılabilir. Takip Muayene Marker Görüntüleme PRİMER CERRAHİ SONRASI REKÜRRENS Kemoterapinin etkinliği Primer kemoterapinin tipi ve süresi Rekürrenssiz aralık Tümörün yayılımı Görüntüleme yöntemleri Second Look Laparatomi Second Look Laparoskopi Sekonder Sitoredüksiyon Second line kemoterapi SEKONDER SİTOREDÜKSİYON TANIM: Primer cerrahi sonrası persiste eden ya da rekürrens olan pelvik ya da abdominal tümörün cerrahi olarak çıkartılması SEKONDER SİTOREDÜKSİYON İÇİN KONDİSYONLAR İyi performans durumu Ekstraabdominal metastazların yokluğu (lenf, deri ve kas dışında ) İntraparenkimal multiple karaciğer metastazının yokluğu?? Etkili bir ikincil kemoterapi seçeneğinin bulunması SEKONDER SİTOREDÜKSİYON SIRASINDA YAPILABİLECEK CERRAHİ İŞEMLER Peritoneal implantların ortadan kaldırılması Kolon rezeksiyonu (çıkan,inen,transvers) İleal rezeksiyon Parsiyel gastrik rezeksiyon Residü omentum rezeksiyonu Hartmann işlemi Kolostomi İleoileostomi İleoileal by-pass SEKONDER SİTOREDÜKSİYON SIRASINDA YAPILABİLECEK CERRAHİ İŞEMLER Pelvik tümöral kitlenin eksizyonu Parsiyel sistektomi Safra kesesinin rezeksiyonu Diaframatik rezeksiyon Splenektomi Parsiyel hepatik rezeksiyon Pankreas kuyruğu rezeksiyonu Abdominal duvar rezeksiyonu Retroperitoneal lenf nodu disseksiyonu