Mikrotubuller ve
Ara çaplı (IF) filamanlar
İstanbul Tıp Fakültesi
Tıbbi Biyoloji AD
Prof. Dr. Filiz Aydın
Doç. Dr. Çiğdem
KEKİK ÇINAR
A
ARA ÇAPLI FİLAMANLAR
B
C
MİKROTUBULLER
AKTİN FİLAMANLAR
Hücre İskeletinin Temel Elemanları
MİKROFİLAMANLAR
(7 nm)
• Aktin (F ve G)
MİKROTUBULLER
(25 nm)
• Tubulin (alfa, beta, gamma)
ARAFİLAMANLAR (IF)
(10nm)
•Keratinler
•Nörofilaminler
•Vimentin
•Desmin
•GFAP
•Laminler
•Nestin
•Periferin
Mikrotubuller
a - tubulin
Tubulin
b - tubulin
Birbiri ile çok benzer 55kd’luk iki polipeptidden (αtubulin ve β-tubulin) oluşan bir dimerdir.
Heterodimer olmak üzere birleşir ve mikrotubul
oluşturur.
GTP enerjisinden faydalanılır.
Pek çok mikrotubul ilişkili protein vardır
(MAP’lar).
Serbest
tubulin
dimeri
a - tubulin
b - tubulin
a-Tubulin hidrolize olmayan
bir GTP’ye sahiptir. GTP
bağlama bölgesi α-β ara
yüzünde olduğu için GTP
hidroliz olmaz.
b-Tubulin GTP veya GDP’ye
sahip olabilir.
GTP ve Mg2+
varlığında,
370C’de
polimerize olabilirler.
Mikrotubul yapısı
13 protoflamanın dairesel
düzenlenmesi ile oluşur.
Mikrotubul oluşumu üç aşamada gerçekleşir
Çekirdeklenme fazı:
Tubulin alt birimlerinin oligomerik yapılar halinde
toplanması
Polimerizasyon (uzama) fazı:
Mikrotubul yapısının serbest uçlarına yeni alt birimlerin
eklenmesi
Plato (denge) fazı:
Polimerizasyon ve depolimerizasyonun dengelenmesi
Alfa
protofilaman
mikrotubul
25nm
Beta
Polarizasyon [(+) ve (-) uç] gösterir.
Eksi
uç
Artı
uç
Bir tubulin molekülünün ortalama yaşam süresi 20
saatten fazla iken bir mikrotubul yarılanma zamanı 10
dakikadan azdır.
GTP, β tubuline bağlanır. Büyüme sırasında (+) uca hızlı bir
şekilde eklenir.
Protofilamentin
+ ucunda β-tubulin,
- ucunda ise α-tubulin
vardır.
Mikrotubul hareketleri
Eksi uç
Eksi uç
Eksi uç
Eksi uç
Artı uç
Artı uç
Artı uç
Artı uç
Uzayan mikrotubul GTP β–tubulin, depolimerize olan GDP β–tubulin
bağlıdır. Uzayan mikrotubul ucu küt, depolimerize olan ise koç
boynuzu şeklindedir.
Mikrotubul ucu boşta ise yıkılma frekansı fazla, bir yapı yada
organele bağlı ise frekans azalır yada yoktur.
Mikrotubul polimerizasyon-depolimerizasyon dengesi:
GTP, Ca+2, PH 6,8
Tubulin
heterodimerleri
mikrotubuller
düşük ısı, yüksek PH, kolşisin.
Sentrozom (Mikrotubul organize edici bölge –MTOC)
Mikrotubul oluşumundan sorumludur.
Sentriol
Perisentriolar
materyal
mikrotubul
Perisentriol materyal nedir?
Sentrozom matriksi olarak isimlendirilir.
Mikrotubullerin çekirdeklenme yeridir.
Mikrotubul yapısı ile ilgili spesifik proteinler içerir.
γ tubulin
MAP
Tau
Perisentriolar materyaldeki -tubulin halka kompleksi (-TURC),
mikrotübül yapım yeridir. – uçları ile MTOC’da + uçları ile hücre
zarına uzarlar.
lockwasher
shape
cap
-tubulin ring complex
MAP
Mikrotübül kenarları boyunca bağlanır, mikrotübül yapılarının
dağılmalarına karşı kararlı hale getirir.
Yüksek molekül ağırlıklı proteinler (MAP)
MW: 200.000- 3000.000
MAP’lar, in vitro mikrotubul polimerizasyonunun nukleasyon
adımını hızlandırır.
Mikrotubule bağlanan kısım,
Mikrotubul’ü hücrenin diğer
komponentlerine bağlayan
kısım
Tau
Sinir hücrelerinin aksonlarında Mikrotubul yapısı tau proteinleri
ile stabilize edilmektedir
Akson boyunca mikrotubul yapısının düzgün olarak korunması
sinirsel uyarım için önemlidir.
Küçük molekül ağırlıklı proteinler
MW: 40.000- 60.000
Tau geninde meydana gelen mutasyon iletim bozukluğuna,
Alzhemier ve Parkinson hastalıklarına neden olur
Mikrotubul ile ilişkili proteinler (MAP )
TİP 1
MAP 1B → Dendrit - Akson
MAP 1A → Dendrit - Akson
MAP 2a →Dendrit
MAP 2b →Dendrit
TİP II
MAP 2c → Embriyonik dendritler
MAP 4 → Nöron dışı hücreler
Tau → Dendrit-Akson da bulunurlar
Catastrophin
Mikrotübülün artı ucuna eklenirler ve tübülin dimerlerinin
ayrılmasını sağlarlar. Bunlar GTP hidrolizini aktive edebilir yada
kıvrık protoflament biçimini indükleyebilirler.
Stathmin: Mikrotübül destabilize eden bir proteindir. Tubulin
heterodimerlere bağlanır, böylece serbest
miktarlarını
azaltarak polimerizasyonu engeller.
Katanin: Mikrotubülleri ayırır. Stabilize edici GTP cap’ı olmayan
yeni artı uca ve sentrozomda -ring complexes tarafından
stabilize olmayan eksi uçları ayırır.
Mitotik ağın oluşumuna katılan mikrotubuller
antimitotik ilaçlara duyarlıdır.
Antimitotiklerin iki farklı etkisi görülür;
1. Tubulin moleküllerinin polimerizasyonuna engel
olurlar (Kolşisin Vinblastin Vinkristin Kolsemid)
2. Mikrotubulleri stabilize edeler (Taksol)
İlaçlar
Kolşisin: Tubulin dimerlerine bağlanıp polimerize olmasını önler.
Mikrotubuller yıkılır. Hücre metafazda kalır. GUT tedavisinde
kullanılır.
Taxol: Mikrotubullere bağlanır ve depolimerizasyonu engeller.
Hücre bölünmesini inhibe eder. Meme ve over Ca tedavisinde
kullanılır.
Nocadazole; Mikrotubul depolimerizasyona yol açar.
Vinblastin, vincristin; Mikrotubul depolimerizasyonuna yol açar.
Kolşemid, kolşisin tubulin dimerlerine bağlanarak polimerizasyonlarını inhibe
Kolşemid
ve kolşisin tubulin dimerlerine bağlanarak
eder ve plus uca eklenmesini engeller
polimerizasyonlarını , dolayısı ile (+) uca
eklenmelerini baskılar
Mikrotbuller antimitotik ajanlara karşı duyarlıdır
Etki şekli
Taksol
Mikrotubullere bağlanarak sabitler
Kolşisin, kolşemid
Altbirimlere bağlanarak polimerizasyonu engeller
Vinblastin , vinkristin
Altbirimlere bağlanarak depolimerizasyona neden olur
Nocodazol
Altbirimlere bağlanarak polimerizasyonu engeller
Mikrotubul özelleşmeleri
Sentrozom
Sitoplazmik mikrotubullerin organizasyonunu sağlar
Sentriyoller
Flagella ve Sil yapısı içerisindeki mikrotubulleri
organize eder
Silya/Flgella (kamçı)
Mikrotubuller kompleks yapılar halinde düzenlenir.
Ökaryotik flagellum ve silya yapısı ‘9+2’ formülü ile
karakterize edilir.
Mitoz mekiği-Mikrotubul yapısındadır.
Mikrotubul üzerindeki hareket iki yönlüdür.
1. Mikrotubulun (+) ucuna doğru (sentrozomdan uzağa)
KİNESİN’ler
2. Mikrotubulun (-) ucuna doğru (sentrozoma doğru)
DİNEİN’ler
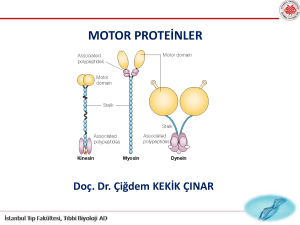
Kinesin motor proteini
İki ağır ve iki hafif zincirden oluşur
Ağır zincirler molekülün globuler
yapıdaki baş kısmını oluşturur
Hafif zincirler fibriller yapıdaki kuyruk
kısmını
meydana getirir
İki baş kısmı mikrotubule bağlanır
Baş kısım ATPaz motor görevi görür
Kuyruk kısmı kargoya bağlanır
Dinein motor proteini
Sitozolik ve aksonemal olmak üzere iki gruba
ayrılırlar
Sitozolik dineinler
• organel hareketi
• mitoz hareketinden sorumludur.
Hafif-İntermediate- 2,3 ağır zincir’den meydana gelir
İki baş kısmı vardır
(+) uç
(-) uç
Ağır
zincir
Hafif zincir
10nm
kinesin
dinein
25nm
Aksonemal dinein
Sil ve flagella yapısında bulunur
Sitoplazmik dineinden daha komplekstir
Dinein molekülünün motor kısmı B tubule
Kuyruk kısmı ise A tubulune bağlanır.
mikrotubul
Dinein
Motor protein
-ATPaz
Mikrotubule bağlı motor moleküller
Aksonemal dinein
* Flagellumda yer alan mikrotubullerin kayma
hareketleri,
* Mikrotubullerin (-) ucuna doğru taşınması
Sitoplazmik dinein
* Mikrotubullerin (-) ucuna doğru partikül ve
veziküllerin taşınması
Kinesin
* Mikrotubullerin (+) ucuna doğru partikül ve
veziküllerin taşınması
Dinamin
* Endositoz hareketi de içeren bir mikrotubulun
diğeri üzerinde kayma hareketi
Mikrotubül hastalıkları
ALZHEİMER
Erken bunama, afazi, başlangıçtan 4 yıl sonra agnozi, ileri derecede
gerçekle ilişkinin kesilmesi, kimlik yitirme, bellek rahatsızlıkları
(tipik) ve günlük yaşamda uygulamaya yönelik rahatsızlıkdır.
İlk belirtiden ortalama 10 yıl sonra ölüm gerçekleşir.
Avrupada her yıl yeni 100 000 alzheimer vakası görülmektedir.
Kesin tedavi yoktur.
1907 yılında Alois ALZHEİMER tarafından tanımlanmıştır.
Tau birikimi
PARKİNSON
1897 yılında James PARKINSON tarafından
tanımlanmıştır.
Progressive
nörodejeneratif
hastalıktır.
Dopamin üreten nöronların kaybı sonucu olur.
Parkin geninde mutasyon => Mikrotubul
depolimerizasyonu => vezikül transportunun
bozulması,
Dopamin
sitozole
salınır,
Mitokondri hasarı => serbest radikal oluşumu
Musküler rijidite, titreme ilk belirtilerdir.
Son dönemlerde kademeli bunama oluşur.
AMYOTROPHIC LATERAL SCLEROSIS
Erişkin nörodejeneratif hastalığıdır.
3–5 yılda progressif motor nöron
kaybı olur.
Pek çok sebebi vardır.
SOD1 mutasyonu tau’nun anormal
fosforilasyonuna neden olur.
Dendritlerde de MAP2 azalmış=>
ekstremite zayıflığı
İntermediate Filamanlar
(10nm)
Protein yapılı, elastik ve dayanıklı filaman yapısıdır.
Strese karşı mekanik güç ve direnç sağlarlar. Mikrotubul ve
mikrofilamentlerden daha elastik ve esnektirler.
Tüm ökaryotlarda bulunmaz (Fungus ve bitkide bulunmaz).
Hücre-hücre ve hücre-matriksi ile ilişki kurarak destek sağlarlar.
Farklı hücre tiplerinde farklı boyut, çap ve yapıdadırlar.
Demetler halinde veya ağ şeklinde bulunurlar. Farklı alt birimleri
vardır.
Çok düşük tuz konsantrasyonu, denature edici ajanların (üre)
yüksek konsantrasyonları Ara Çaptaki Filamentlerin çözünmesine
neden olur.
Polariteleri yoktur.
Motor proteinleri yoktur.
Nükleotide bağlanmaz.
Kararlıdırlar.
Epitel hücreler, kas hücreleri ve sinir aksonlarında bol miktarda
bulunur.
Çekirdek zarının altında bulunur.
Heterojen bir gruptur.
Hücre transportuna katılmaz.
İnsan genomunda 5 alt aileden 70 gen tarafından kodlanır.
a-helikal domain
Amino termal uç
karboksi termainal uç
Keratinler
Vimentin
Nörofilaman
proteinleri
Nüklear
laminler
İntermediate filamanlar; baş (amino uç), kuyruk (karboksil uç), gövde (orta
bölge)’den oluşur.
Intermediate Filamanlar
İnsanlarda 70 değişik gen tarafından
kodlanmaktadır.
Alfa-helikal gövde kısmı yaklaşık olarak 310 aa.
rezidüsünden ibarettir.
C ve N ucundaki non-helikal kısımları farklı yapı ve
özellik gösterir.
Ara çaplı filamanlar daha az dinamiktir.
Yavaş toplanır ve dağılırlar.
Baş
domainin
fosforilasyonu,
depolimerizasyonuna neden olur.
filamanların
Filamanların organizasyonu çeşitli IFAP (intermediate
filaments associated proteins) aracılığı ile sağlanır.
Polimerizasyon/depolimerizasyon farklıdır
İki monomer sarmalleşerek
Dimerleri,
İki Dimer bir araya gelerek
Tetramerleri,
İki Tetramer bir araya gelerek
Protofibrilleri,
Dört ayrı protofibril bir araya
gelerek
Silindir yapılı IF (ara çaplı filaman)
yapısını meydana getirir.
Mikrotubul ve
mikroflamanlardan
farklı olarak
hücreye hareketlilik
kazandırmazlar.
AÇF’ler bir kafes gibi bir araya gelerek DNA’nın korunmasını,
sitozolde güçlü kablolar gibi yapılar oluşturarak epitel hücrelerinin
bir arada kalmasını, nöronlarda uzun ve güçlü aksonların
oluşumunu veya saç ve tırnak gibi yapıların oluşumunu sağlarlar.
Yani hücreye mekanik destek sağlarlar.
IFAP’lar İF’leri nüklear membran, mikrotubul ve
mikrofilamanlar arasında bağlantıyı sağlarlar.
Hücrelerde bağlantı bölgelerinin yapılarına katılırlar.
IF protein
Polipeptid sayısı
Doku dağılımı
Tip I
Asetik keratinler
≥
15
Epitel
Tip II
Bazik Keratinler
≥
15
Epitel
Tip III
Desmin
Glial fibriller asetik proteinler
Vimentin
Periferin
1
1
1
1
İskelet kası,kalp kası ve düz kas
Glial hücreler ve astrositler
Çeşitli mezankimal hücreler
Nöronlar
Tip IV
NF-L
NF-M
NF-H
İnterneksin
1
1
1
1
Medulla spinalis, optik sinirlerde
nestin
1
Gelişen nöron ve kas hücrelerinde
Tip V
Lamin A
Lamin B
Lamin C
1
1
1
Gelişen sentral sinir sistemi
Nöro-epitelyal kök hücreler
Tüm hücreler(nüklear laminler)
Çok sayıda alt tipi
bulunmakta olup
Sitoplazmik plaklar
dezmozom ve
hemidezmozom
yapısına katılırlar
Akson ve dentritlerde
Nüklear laminler
Diğer
Ara
çaplı
filaman
yapılarından farklıdır:
Merkezi bölge uzun
Nüklear
lokalizasyon
sinyaline sahip
İki yönlü bir tabaka şeklinde
düzenlenir
Dinamik bir yapıya sahip
Nukleus iç zarına bitişik laminler iki sıra halinde sıralanırlar
Kromatin ipler telomerleri vasıtasıyla lamin tabakaya bağlanırlar.
Böylece kromatin ağı nukleusta belli bir düzen içinde bulunur.
Oluşturdukları ağ çok dinamik olup mitoz bölünme başlangıcında
dağılır ve mitoz sonunda yeniden oluşur. Bu dağılıp yeniden
oluşma özel serin rezidülerin fosforilasyonu (dağılma) ve
defosforilasyonu (birleşme) ile gerçekleşir.
Ara çaplı filaman (IF) yapısının önemi?
Hastalıkla ilişkisi;
Lamin-A gen mutasyonu
Emery-Dreifuss musküler distrofisi
Dilate kardiyomyopatiler
Progeria
Lamin a ve emerin mutasyonları,
iskelet ve kas hücreleri kadar
yağ, kemik ve nöronal dokuyu
da etkiler (laminopati).
Epidermis derinin
en dıştaki
tabakasıdır.
Esas olarak
"Keratinosit" adı
verilen hücrelerden
oluşur.
Epidermolysis bullosa simplex
Tip 7 kollajene karşı gelişmiş otoantikarların neden olduğu,
travmaya maruz kalan deri ve mukoza bölgelerinde subepidermal
bül oluşumu ile seyreden kronik otoimmün bir hastalıktır.
Mekanik dirence karşı
hücreler birbirleri ile
ilişkilerini ve
bağlantılarını korur,doku
bütünlüğü sağlanır
normal
Genlerde
meydana
gelen
mutasyon
sonucu
keratin
filamanların basınca karşı direnci
düşer. Küçük bir sıkışma mutant
hücrelerde kopmalara neden olur
(epidermolysis bullosa simplex).
Etkilenen doku su toplar.
mutant
IF proteinleri
Teşhis
Sitokeratinler
Epitalyal orjinli farklılaşmamış tümörler,
karsinomlar adenokarsinomlar
Glial fibriller asitik proteinler
Bazı glial tümörler
Vimentin
Bağ dokusu tümörleri
Desmin
Kas tümörleri
Ani Harabeleri, KARS
Teşekkürler...