Moleküler Biyoloji
(2011-2012)
Doç. Dr. Ercan ARICAN
Moleküler Biyoloji ve Genetik Bölümü
DNA YAPISI VE ANALİZİ
Genlerde, bir sonraki kuşağa aktarıldığında soyun biçimini ve
özelliklerini etkileyen bilgiye GENETİK BİLGİ denir.
1944’e kadar, kromozomlardaki hangi bileşenin genleri ve genetik
materyali oluşturduğu açık değildi. 1944 yılında nukleik asitin (DNA)
kalıtıma ait bilgiyi taşıdığı kanıtlanmıştır.
James Watson ve Francis Crick’in DNA’nın ikili sarmal yapısıyla ilgili
hipotezlerini ortaya çıkaran öncü çalışmaları, 1953’te Nobel Ödülünü
almıştır.
Genetik Materyal Dört Özellik Göstermelidir…
•Kendini eşleme (replikasyon)
•Bilgi depolama
•Bilgiyi ifade etme
•Mutasyonla çeşitlenme (varyasyon)
Genetik materyalin “replikasyonu” bütün canlı organizmaların temel bir
özelliğidir ve hücre döngüsünün bir bölümünde yer alır.
“Depolama” özelliği, bir organizmanın tüm kalıtsal özelliklerinin
toplandığı genetik bilgi olarak düşünülebilir. Ancak depolanan bilginin
tamamı ifade edilir yada edilmez.
Hücrelerin çoğu DNA’nın tamamına sahip olduğu halde belirli bir noktada
bu genetik potansiyelinin bir bölümünü ifade ederler.
Bakteriler belirli çevre koşulları karşısında birçok geni faaliyete geçirir.
Omurgalılarda deri hücrelerinde melanin geni aktiftir ama hemoglobin
genleri hiçbir zaman ifade edilmezler.
Depolanan bilginin “ifadesi” karmaşık bir işlemdir ve hücrede bilgi
akışının temelini oluşturur.
İlk işlem, DNA’nın üç tip RNA molekülü; mRNA, tRNA ve rRNA
oluşturmak üzere transkripsiyonu (okuma) ile başlar. Bunların içinden
sadece mRNA’nın proteine translasyonu yapılır.
Translasyon (çeviri), rRNA içeren ribozomlarda tRNA’nın da katılımıyla
gerçekleşir. tRNA, mRNA’daki kimyasal bilgiyi, proteinleri oluşturan
amino asitlere çevirerek adaptör rolü oynarlar.
Bu işlemler “moleküler genetiğin santral dogmasını” oluşturur. “DNA’dan
RNA, RNA’dan protein sentezidir.
Genetik materyal aynı zamanda, mutasyonlar yoluyla organizmalar
arasında ortaya çıkan yeni “çeşitliliğin” de kaynağıdır.
Mutasyon eşey hücrelerinde olursa, gelecek kuşaklara aktarılır ve zamanla
populasyon içerisinde yayılır. Kromozomların içinde ve kromozomlar
arasında yer alan yeniden düzenlenmeleri (rekombinasyon) de kapsayan
genetik çeşitlilik evrimin ham maddesidir.
1944’e kadar yapılan gözlemler, genetik materyalin protein olduğunu
düşündürmüştür.
Bu inanç, üç faktörden kaynaklanmıştır.
•Proteinler hücrelerde bol olarak bulunmaktadır (%50)
•1900’lerin başından ortalarına kadar nukleik asitlerin kimyasal yapıları
ile ilgili olarak kabul edilmiş olan öngörüdür.
DNA ilk olarak 1868 yılında İsviçreli kimyacı Friedric Miescher tarafından
çalışılmıştır. Miescher sitoplazmadan “nuklein” adını verdiği asidik bir
maddeyi izole etmiştir.
1910’larda Phoebus A. Levene, nukleotidlerin nukleik asitlerdeki kimyasal
yerleşimini açıklamak için “tetranukleotid hipotezini” önermiştir.
Son derece basit dört nukleotid birimi DNA’da devamlı
tekrarlanmaktadır.
Dört nukleotidin oldukça değişen oranlarda bulunduğunu gösterdiği halde
Levene, bu oranın 1:1:1:1 olduğunu varsaymıştır.
Genetikçiler, genetik materyalden beklenen büyük miktarda kimyasal
farklılığı bu yapının sağlayamayacağı görüşündeydi.
Buna karşın proteinler 20 değişik amino asit içeriyordu ve farklılığın
temelini oluşturabilirdi.
•Üçüncü faktör, genetiğin en aktif araştırma alanları ile ilgilidir. 1940’tan
önce genetikçilerin çoğu aktarım (transmisyon) genetiği ve mutasyon
çalışmaları ile uğraşmıştır.
1940’lardan sonra, Erwin Chargaff’ın çalışmaları, Levene’nin hipotezinin
doğru olmadığının farkına varılmasına yol açmıştır. Chargaff, bir çok
organizma için 1:1:1:1 oranının doğru olmadığını göstermiştir.
DNA’nın genetik materyal olduğu yönündeki kanıt ilk defa bakteri ve
bakteriyofajlarla yapılan çalışmalar sırasında elde edilmiştir.
Oswald Avery, Colin MacLeod ve Maclyn McCarty’nin bakterilerde
“transformasyon prensibi”nin kimyasal doğası ile ilgili olarak 1944’te
yayınlanan makalesi, DNA’nın genetik materyal olarak kabul edilmesinde
ilk adım olmuştur.
Transformasyon Çalışmaları
1927’de İngiliz Sağlık Bakanlığı’nda sağlık memuru olarak görev yapan
Frederic Griffith tarafından başlatılmıştır.
Griffith Diplococcus pneumonieae nin değişik suşlarını kullanarak
deneyler yapmıştır.
Bazı omurgalılarda zatürreye neden olan hastalık oluşturan (virülant)
suşlardı, bir kısmı da hastalık oluşturmayan (antivirülant) suşlardı.
Virülans etki bakterilerin sahip oldukları polisakkarit kapsül yapıları ile
ilgiliydi.
Virulant suşlarda kapsül bulunurken, avirulant suşlar kapsülsüzdü.
Kapsülsüz bakteriler, hayvanın dolaşım sistemindeki fagositik hücreler
tarafından hızla alınıp parçalanıyordu.
Polisakkarit kılıflı virulant bakteri kolayca hücre içine alınmadığı için
çoğalıp zatürreye neden oluyordu.
Diplococcus’un her bir suşu serotipler olarak adlandırılan düzinelerce
değişik tipten biri olabilir.
Griffith, genetik materyalle ilgili yeni kavramlara yol açan deneylerinde
tip II ve III’ü kullanmıştır.
Griffith yalnız canlı virulant hücrelerin sıçanda zatürre oluşturabileceğini
yapılan çalışmalardan biliyordu. Isıyla etkisiz hale getirilen virulant
bakteriler sıçana verildiğinde avirulant bakteriler gibi zatürre
oluşturmuyordu.
Griffith bu deneyde canlı IIR (avirulant) hücrelerde ısı ile etkisiz hale
getirilen IIIS (virulant) hücreleri karıştırarak sıçana verdi. İki hücre tipi
tek başına verildiğinde sıçanı öldürmediğine göre, Griffith her iki hücrenin
birlikte verilmesinin sıçanı öldürmemesini bekliyordu.
Ancak, beş gün sonra çift enjeksiyon yapılan bütün sıçanlar öldü. Ölü
sıçanların kan analizlerinde fazla miktarda canlı IIIS tipi (virulant)
bulunduğu saptandı.
Avirulant ölen sıçanların kanında bulunan IIIS bakteriler, polisakkarit
kapsül açısından, ısı ile öldürülmüş hücrelerden elde edilen IIIS suşuna
benziyordu. Yalnız canlı, IIR bakterilerin verildiği kontrol sıçan canlıydı
ve zatürre olmamıştı.
Bu bulgu, ısı ile öldürülmüş IIIS fraksiyonu ortamda yok iken, avirulant
IIR hücrelerinin, virulant IIIS hücrelerine dönüşmüş olma (mutasyon)
ihtimalini ortadan kaldırıyordu.
Bunun yerine canlı IIR ve ısı ile öldürülmüş IIIS hücreleri arasında bir tip
etkileşime gereksinim vardı.
Griffith ısı ile öldürülmüş IIIS bakterilerinin bir biçimde, canlı avirulent
IIR hücrelerinin virulant IIIS’lere dönüşümünden sorumlu olduğu
sonucuna ulaştı.
Bu olayı TRANSFORMASYON olarak adlandırarak her ne kadar kapsül
tek başına zatürreye neden olmuyorsa da transformasyonu gerçekleştiren
ana maddenin polisakkarit kapsülün bir kısmı ya da kapsül sentezinde rol
alan bir bileşik olabileceğini önerdi.
1931’de Rockefeller Enstitüsünden Henry Dowson transformasyonun in
vitro cereyan edebileceğini gösterdi.
1933’e gelindiğinde Lionel J. Alloway, S hücrelerinin kaba özütlerini ve
canlı R hücrelerini kullanarak in vitro bir sistem geliştirdi.
1944’te Avery, MacLeod ve McCarty on yıllık bir çalışma sonucunda
bugün moleküler genetik alanında klasik sayılan makalelerini yayınladılar.
Transformasyon yapan maddeyi saf olarak elde ettiklerini ve
transformasyondan sorumlu molekülün DNA olduğunu bidirdiler.
DNA’nın genetik materyal olduğunu destekleyen ikinci önemli bulgu,
Escherichia coli bakterisinin, konakçısı olduğu viruslardan biri olan T2
bakteriyofaj ile enfeksiyonu çalışmalarından elde edilmiştir.
1952’de Alfred Hershey ve Martha Chase faj proteini ve nukleik asitinin
bakteri hücresi ile beraber üreme işlemindeki bağımsız işlevini açıkça
ortaya koymuştur.
RNA bazı virüslerde genetik materyal olarak görev yapmaktadır.
1956’da tütün mozaik virüsünden (TMV) saflaştırılan RNA, tütün
yapraklarına bulaştırıldığında virüsün neden olduğu karakteristik
lezyonlar yapraklarda görülmüştür.
1965 ve 1966’da Norman R. Pace ve Sol Spiegelman, QB fajından RNA’nın
ayrıştırılıp in vitro olarak replike olabileceğini göstermişlerdir.
Replikasyon RNA replikaz denilen bir enzime bağlıdır.
Retrovirüslerin replikasyonları olağan dışıdır. Konakçı hücreyi enfekte
ettikten sonra RNA’ları tamamlayıcı DNA molekülünün sentezi için kalıp
görevi üstlenir.
Revers (ters) transkripsiyon olarak bilinen bu işlemi, revers transkriptaz
denilen RNA-bağımlı DNA polimeraz enzimi yönlendirir. Sentezlenen bu
geçiş DNA’sı viral genetik materyali temsil eder ve konakçının genomuna
katılabilir.
Polio virüsü ve AIDS hastalığına neden olan insan kazanılmış bağışıklık
eksikliği virüsü (human immunodeficiency virus: HIV) retrovirüslere
örnektir.
DNA’nın yapısını kavramak için nukleik asit kimyasını bilmek gerekir.
Nukleotidler: bütün nukleik asit moleküllerinin yapıtaşlarıdır.
3 bileşeni vardır.:
1. Azotlu baz
2. Pentoz şekeri (5-karbonlu şeker)
3. Fosfat grubu
Azotlu bazlar iki çeşittir:
1. Dokuz atomlu, iki halkalı purinler
2. Altı atomlu tek halka içeren pirimidinler
Nukleik asitlerde yaygın olarak 2 tip purin ve 3 tip pirimidin bulunur.
Purinler: Adenin ve guanin (A ve G)
Pirimidinler: Sitozin timin ve urasil (S, T ve U)
DNA ve RNA’da ortak olarak A, C ve G bulunur; T bazı yalnız DNA’da, U
bazı ise yalnız RNA’da vardır.
Nukleik asite adını veren taşıdığı pentoz şekeridir. Ribonukleik asitlerde
(RNA) riboz, deoksiribonukleik asitlerde (DNA) deoksiriboz bulunur.
Deoksiribozda C-2’ pozisyonunda hidroksil gurubu yoktur. C-2’
pozisyonundaki hidroksil gurubunun varlığı RNA’yı DNA’dan ayırır.
Azutlu baz + pentoz şekeri = Nukleozit
Nukleozit Difosfatlar ve Trifosfatlar
Nukleotidler nukleozit monofosfat (NMP) olarak da tanımlanırlar. Bir
veya iki fosfat ilavesi ile sırasıyla; nukleozit difosfatlar (NDP) ve
nukleozit trifosfatlar (NTP) oluşur.
Trifosfat formu çok önemlidir, çünkü hücrede nukleik asit sentezinde öncü
molekül olarak rol alır.
Hücrede ATP’nin ADP ve inorganik fosfata (Pi), GTP’nin de GDP ve
inorganik fosfata hidrolizi ile fazla miktarda enerji açığa çıkar.
Sonuç olarak, ATP ve GTP genetik işlemler de dahil birçok hücre
faaliyetinde kullanılır.
Polinukleotidler
İki mononukleotid arasında kurulan bağ yapısında, iki şekere bağlı fosfat
grubu yer alır. Oluşan bağ fosfodiester bağıdır. Fosforik asit her iki
taraftaki alkol grubu ile ester bağı yapmıştır.
Aynı bağ RNA’da da bulunmaktadır. Her iki yapıda da bir C-5’ ucu ve bir
C-3’ ucu vardır. İki nukleotit birleştiğinde bir dinukleotit, üç nukleotit
birleştiğinde bir trinukleotit oluşturur.
20 ya da daha az sayıda nukleotit içeren zincire oligonukleotit denir. Daha
uzunları polinukleotit olarak adlandırılır.
Yapıları açık formüllerle çizmek zaman alıcı ve karmaşık olduğu için kısa
çizim yöntemi geliştirilmiştir.
Dikey olan çizgiler pentoz şekeri temsil eder, azotlu bazlar tepede, C-1’
konumundadır. Ortasında P olan verev çizgi, bir şekerin C-3’ atomu ile
komşu şekerin C-5’ atomuna bağlıdır ve bu bağ fosfodiester bağını
temsil eder.
DNA’da dört bazın mutlaka eş molar miktarlarda bulunması gerekmediği
gösterilmiştir. Ayrıca, DNA’nın molekül ağırlığının 106-109 dalton
arasında olduğu bulunmuştur.
Bu değer, tetranukleotit olamayacak kadar büyüktür. Bugün gerçek olan,
DNA’nın çok uzun bir polinukleotit zincirine sahip olduğudur.
Uzun polinukleotit zincir yapısı, DNA’nın molekül ağırlığının ve en önemli
özelliği olan büyük bir genetik bilgiyi depolayabilme kapasitesini
açıklamaktadır.
Sadece 1000 nukleotit içeren bir polinukleotit için, her birinin dizilimi
diğerinden farklı olan 41000 değişik yapı oluşturulabilir.
DNA’nın işlevini kavramanın anahtarı DNA’nın yapısında saklıdır.
1953’de iki genç araştırıcı, James Watson ve Francis Crick, DNA’nın
yapısının ikili sarmal şeklinde olduğunu önermiştir (Nature, 302-303).
Watson ve Crick’in önerilerini geliştirilmesi için kritik olan bulgular,
başlıca iki kaynaktan gelmektedir. Hidroliz edilmiş DNA örneğinin bazı
kompozisyon analizi ve DNA’nın X-ışını kırınımı çalışmaları.
1949 ve 1953 arası, Erwin Chargaff ve arkadaşları, birçok organizmadan
elde edilen DNA örneklerinden dört bazı ayırmak için kromatografik
yöntemleri kullanmıştır.
1. Herhangi bir türde, DNA’daki adenin bazlarının miktarı, timin
bazlarının miktarı ile orantılıdır. Guanin bazlarının miktarı ise sitozin
bazlarının miktarı ile orantılıdır.
2. Purinlerin (A+G) toplamı pirimidinlerin (C+T) toplamına eşittir.
3. C+G yüzdesinin, A+T yüzdesine eşit olması gerekmez. İki değer
arasındaki oran türlere göre büyük değişiklikler gösterir.
Bu sonuçlar, DNA molekülünün baz kompozisyonunun kesin profilini
göstermektedir.
X-Işını Kırınımı Analizi
DNA zincirleri X-ışını bombardımanına tutulduğunda molekülün atomik
yapısına göre ışınlar saçılır. Saçılım profili fotoğraf filmi üzerinde
lekeler halinde belirir ve özellikle moleküldeki düzenli yapılar ve genel
görünüm ortaya çıkar.
1938’de William Astbury, bu tekniği DNA üzerinde denemiş ve 1947’de
Astbury DNA’da 3.4 Å aralıklarla tekrarlayan düzenli bir yapı
saptamıştır.
1950-53 arası, Rosalind Franklin daha saf DNA örneklerinden daha
gelişmiş X-ışını verileri elde etmiştir.
Rosalind’in çalışmasıda Astbury’nin gördüğü 3.4 Å’luk tekrarlayan
yapıların varlığını doğrulamış ve DNA’nın bir çeşit sarmal yapıda
bulunduğunu ileri sürmüştür.
Watson-Crick Modeli
Watson ve Crick 1953’de DNA’nın yapısını aydınlatmışladır.
Bu modelin özellikleri:
1. İki uzun polinukleotit zinciri, bir merkez eksen etrafında kıvrılarak,
sağ-el ikili sarmal yapısını oluşturur.
2. İki zincir birbirine zıt konumludur, yani iki zincirin C-5’ ucundan C-3’
ucuna doğru olan yönleri birbirine göre tersdir.
3. Her iki zincirin bazları düzlemsel yapıdadır ve dizilimleri eksene dik,
bazlar arasında 3.4 Å (0.34 nm) mesafe olacak şekilde birbiri ardına
dizilir ve sarmalın içinde yer alır.
4. Karşı zincirdeki azotlu bazlar, hidrojen bağları ile bağlanarak birbirleri
ile eşleşirler, DNA’da sadece A=T ve G=C eşleşmesi mümkündür.
5. Sarmalın her bir tam dönümü 34 Å (3.4 nm)’dir. Böylece DNA’nın
herbir dönümünde 10 baz yer alır.
6. Molekülün herhangi bir bölümünde eksen üzerinde sıra ile daha geniş
olan büyük (majör) oluklar ve daha dar olan küçük (minör) oluklar yer
alır.
7. Sarmalın çapı 20 Å (2 nm)’dur.
Baz eşleşmesi; modelin genetik açıdan en önemli özelliğidir.
Zincirin biri 5’ ucundan 3’ yönüne uzanırken, diğeri 3’ ucundan 5’ yönüne
uzanır.
Watson ve Crick’in önerdiği modelin anahtarı özgül baz eşleşmesidir.
Chargaff’a göre A’nın miktarı T’ye, G’ninki de C’ye eşittir.
A=T ve G=C baz eşleşmesi, tamamlayıcılığı (complemantarity) kavramının
temelidir.
• Neden başka baz eşleşmesi olası değildir?
Watson ve Crick A=G ve C=T baz eşleşmesi olasılığını kabul
etmemişlerdir. Çünkü bunlar purin-purin ve pirimidin-pirimidin
arasındaki eşleşmelerdir.
Bu tip bir eşleşmede sarmalın çapı bazı kısımlarda büyük yada 20 Å’dan
küçük olacaktır.
• Hidrojen bağının önemi nedir ve bu bağ sarmalı dayanıklı kılacak
kadar kuvvetli midir?
Hidrojen bağı, kovalent bağ ile bağlı bir hidrojen atomu ile çiftleşmemiş
bir elektron içeren diğer bir atom arasındaki çok zayıf bir elektrostatik
çekimdir.
İkili sarmaldaki bazların konumuna göre A, T ile iki H bağı, G, S ile üç H
bağı yapar. Tek başına iki yada üç H bağı çok zayıftır, ancak bunların
iki bin yada üç bin tanesi arka arkaya geldiğinde sarmala büyük bir
dayanıklılık sağlar.
Hassas bir ölçümde, DNA’da bir dönüşte Watson ve Crick’in önerdiği gibi
10 değil 10.4 bç bulunduğu gösterilmiştir.
Klasik modelde her bir baz çifti sarmal eksen etrafında yanındaki baz
çiftine göre 36°° dönüş yaparken yeni ölçümler bunun 34.6°° olduğunu
göstermiştir.
Sonuçta, her 360°° dönüşte 10 bazdan biraz fazla baz yer almaktadır.
Yazarlar 1953’deki yayınlarından 2 ay sonra Nature’da yaptıkları yayında
DNA için özgül bir replikayon modeli – semikonservatif modeli (yarı
koruyucu) önermişlerdir.
Bu ikinci yayında da iki yeni kavram bulunmaktadır:
Genetik bilginin DNA’nın baz dizisinde depolandığı ve bazlardaki
değişikliğin mutasyona ya da genetik değişikliğe yol açtığıdır.
DNA’nın farklı formları bulunur
Rosalind Franklin’in X-ışını kırınımı çalışmaları yaptığı DNA’nın B
formuna dayanmaktaydı.
Bu form düşük tuz derişiminin olduğu sulu ortamda bulunan formdur ve
biyolojik olarak önemli olduğuna inanılan yapıdır
A-DNA yüksek tuz ya da dehidrasyon koşullarında baskın olan yapıdır.
A-DNA, B-DNA’ya göre daha sıkı yapıdadır. Çapı 23 Å olan sarmalın tam
bir dönümünde 11 bç yer alır.
A-DNA’da sağ el sarmalıdır ancak bazların yönelişleri bir miktar farklıdır.
A-DNA’nın biyolojik koşullarda bulunabilmesi şüpheli görünmektedir.
Laboratuvar koşullarında incelendiğinde DNA sarmalının sağ el sarmalı
gösteren 3 formu daha bulunmuştur. C, D- ve E-DNA.
C-DNA, A- ve B-DNA’nın izolasyon koşullarında gözlenenden daha da
fazla dehidrasyon koşullarında izolasyon yapıldığında görülür.
Samalın tam bir dönüşünde 9.3 baz yer alır dolayısıyla daha sıkıdır. Çapı
19 Å’dur.
Diğer iki form olan D- ve E-DNA baz içeriğinde guanin bulunmayan
DNA’ların aldığı formdur. Sarmalın tam bir dönüşünde daha az saıda
bç bulunmakta olup sırasıyla 8 ve 7.5’dir.
Z-DNA olarak adlandırılan DNA’nın bir başka formu da 1979’da
keşfedilmiştir. Sadece C-G bç içeren sentetik DNA oligonukleotitleri
incelenirken bulunmuştur.
Sol el sarmalı özelliğindedir. Çapı 18 Å’dur. Her bir dönüşte 12 bç yer alır
ve zikzak konfigürasyonuna sahiptir.
B-DNA’da bulunan büyük oluk Z-DNA’da neredeyse kaybolmuştur.
Jean-François Allemand ve arkadaşlarının yaptığı son çalışmalar DNA
yapay bir şekilde uzatılırsa P-DNA denilen yeni ilginç bir form daha
olabileceğini göstermektedir.
P-DNA daha uzun, daha incedir ve B-DNA’da yüzeyde bulunan fosfat
grupları iç kısımda yer aldığı için oldukça ilginç bir yapıdadır.
P-DNA’da her bir dönüşte 2.62 baz yer alır.
RNA’nın yapısı kimyasal olarak DNA’ya benzer, ancak RNA tek
zincirlidir.
RNA’da deoksiriboz yerine riboz şekeri, azotlu baz timin yerine urasil
bulunur.
RNA çoğunlukla tek zincirli olduğu düşünülmektedir. RNA molekülleri
sentezlendikten sonra bazen kendi üzerine katlanarak ikili sarmal
bölgeler oluşturur.
Genetik materyali RNA olan bazı hayvan virüslerinde RNA ikili sarmal
olarak bulunur.
Genetik bilginin ifadesinde en az üç hücresel RNA molekülü işlevseldir:
Ribozomal RNA (rRNA)
Haberci RNA (mRNA)
Taşıyıcı RNA (tRNA)
Bu moleküller DNA’nın bir zincirinin tamamlayıcı (eşlenik) kopyası olarak
transkripsiyon sonucunda sentezlenir.
RNA’ların içinde en büyük olanı genelde rRNA’dır ve genellikle hücrede
bulunan RNA’ların %80’ini oluşturur.
mRNA molekülleri DNA’daki genetik bilgiyi translasyonun meydana
geldiği ribozomlara taşır.
RNA tiplerinin en küçüğü olan tRNA translasyon sırasında amino asitleri
ribozoma taşır.
Nukleik Asitlerin Denatürasyonu ve Renatürasyonu
İkili sarmal DNA’nın denatürasyonu sonucu H-bağları kopar, çiftli yapı
bozulur ve zincirler birbirinden ayrılır. Ancak kovalent bağlar kırılmaz.
Isı ya da kimyasal yolla uyarılabilen zincirlerin ayrılması sırasında
DNA’nın akışkanlığı azalır, UV absorbsiyonu artar.
Isı sonucu oluşan denatürasyon bazen erime (melting) denir. Isıtılan DNA
çözeltisinin UV absorbsiyonundaki artışı, hiperkromik kayma olarak
adlandırılır ve ölçümü çok kolaydır.
G≡C baz çifti, A=T’ye göre bir fazla H bağı içerdiğinden, ısıya karşı daha
dayanıklıdır. Bu nedenle, A=T’ye göre daha fazla G≡C çifti içeren
DNA’ların tamamen denatüre olması için yüksek sıcaklıklar gereklidir.
Eğer erime sırasında, DNA’nın 260 nm’deki absorbsiyonu izlenir ve
sıcaklığa karşı grafiğe geçilirse, bir erime profili elde edilir. Bu profilin
ya da eğrinin orta noktasına erime sıcaklığı (Tm) denir ve DNA
zincirinin %50’sinin açılmış ya da denatüre olduğu noktayı gösterir.
Isı ile denatüre edilen DNA yavaşça soğutulursa tamamlayıcı zincirler
arasındaki rastgele çarpışmalar sonucu zincirler tekrar bir araya gelir.
DNA Replikasyonu ve Rekombinasyonu
İnsan genomunu oluşturan 23 kromozomda 3x109 (3 milyar) baz çiftinin
yer aldığı bilinmektedir. Bu kromozomların DNA’larının hatasız olarak
iki katına çıkartılması için son derece doğru bir mekanizma işlemelidir.
Milyonda bir (10-6) hata oranı bile her bir replikasyon döngüsünde 3000
hata demektir ve bu da çok büyük bir rakamdır.
Yarı-saklı (semikonservatif) replikasyon olarak bilinen Watson-Crick
modeli virüslerde, prokaryotlarda ve ökaryotlarda yapılan çalışmalarla
deneysel olarak da desteklenmiştir.
DNA, yarı-saklı (semikonservatif) replikasyon modeli ile kendini işler
Azotlu bazların yerleşiminden dolayı DNA ikili sarmalının her bir
zincirinin tamamlayıcı zincir sentezi için kalıp oluşturabileceğini
Watson ve Crick açık olarak kanıtlamışlardır.
Eğer T varsa karşısına A çekecektir. G varsa karşısına C çekecektir. Her iki
kalıp boyunca bu nukleotidler kovalent bağlarla polinukleotit
oluşturduğu taktirde sonuçta birbirine özdeş iki DNA zinciri
oluşturacaktır.
Kopyalanan her bir DNA molekülünde bir “yeni” bir “eski” zincir
bulunacağından bu tip bir çoğalma yarı-saklı (semikonservatif)
replikasyon olarak tanımlanır.
DNA kopyalanması için, atasal zincirlerin kalıp olarak görev görmesine
dayanan iki yol daha düşünülmektedir.
Saklı (konservatif) replikasyon tamamlayıcı polinukleotit zincirleri daha
önce anlatıldığı gibi sentezlenir, ancak burada iki yeni zincir bir araya
gelir ve atasal zincirler tekrar birleşir.
Parçalı (dispersif) replikasyon atasal zincirler kopyalama esnasında kırılır
ve kırılan DNA parçaları iki yeni çift sarmal içinde dağılır. Böylece
herbir zincirde hem eski, hem de yeni DNA bulunur.
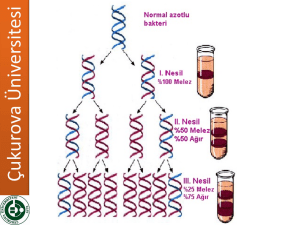
Meselson-Stahl Deneyi
1958’de Marthew Meselson ve Franklin Stahl, bakteri hücrelerinin yeni
DNA moleküllerini yarı-saklı replikasyon ile sentezlediklerine dair
kuvvetli kanıtlar ortaya koyan deney sonuçlarını yayınlamışlardır.
Azot kaynağı olarak sadece 15NH4Cl (amonyum klorür) içeren ortamda
E. coli hücrelerini birçok nesil boyunca üretmişlerdir.
Doğal izotopu olan 14N’e göre bir fazla nötron içerir. 15N daha dayanıklıdır.
15N içeren daha yoğun DNA yoğunluk gradient santrifügasyonunda
daha alt kısımlarda yer alır.
Meselson ve Stahl deneyinde, bir çok nesil sonra E. coli hücrelerinde
DNA’daki azotlu bazlar da dahil olmak üzere tüm azot taşıyan
moleküller 15N içermiş olur.
Daha sonra hücreler yalnız 14NH4Cl içeren ortama aktarılır. Bu ortamda
replikasyon sonucu sentezlenen DNA’lar azotun “hafif” izotopunu taşır.
Daha sonra hücreler yalnız 14NH4Cl içeren ortama aktarılır. Bu ortamda
replikasyon sonucu sentezlenen DNA’lar azotun “hafif” izotopunu taşır.
Ökaryotlarda Yarı-Saklı (Semikonservatif) Replikasyon
J. Herbert Taylor , Philip Woods ve Walter Hughes 1957’de Meselson ve
Stahl’ın çalışmasının yayınlanmasından bir yıl önce ökaryotlarda da
replikasyonun yarı-saklı mekanizma ile olduğunu gösteren kanıtı
sunmuşlardır.
Vicia faba (bakla) bitkisinin kök uçlarını deneylerinde kullanmışlar ve
DNA’yı, DNA’nın radyoaktif öncülerinden olan 3H-timidin ile
işaretleyerek ve otoradyografisini alarak replikasyonu izlemeyi
başarmışlardır.
İşaretli izotop ortamında birinci replikasyon döngüsü sonucu kardeş
kromatidlerin ikisi de rayoaktivite taşımaktadır, yani her bir
kromatitde bir “yeni” sentezlenen radyoaktif işaretli DNA zinciri ve bir
de işaretsiz “eski” zincir bulunmaktadır.
Replikasyon Orijinleri, Çatalları ve Birimleri
Yarı-saklı replikasyon DNA’nın kopyalandığı genel replikasyon modelidir.
Kromozom üzerinde DNA’nın replikasyonu nereden başlar?
Tek bir orijin mi vardır yoksa sentez birden fazla noktadan mı başlar?
Başlangıç noktası rastgele bir yerde mi bulunur yoksa kromozomda özgül
bir bölgede mi yer alır?
Replikasyon başladıktan sonra tek bir yönde mi yoksa orijinden
başlayarak her iki yönde mi ilerler?
Başka bir deyişle replikasyon tek yönlü müdür yoksa çift yönlü müdür?
Kromozom üzerinde replikasyonun olduğu noktada sarmala ait zincirlerin
açılmasıyla ortaya çıkan yapıya replikasyon çatalı adı verilir.
Bu çatal önce sentezin orijin noktasında meydana gelir ve replikasyon
devam ettikçe ilerler.
Replikasyon çift yönlü ise orijinden itibaren zıt yöne doğru ilerleyen iki
replikasyon çatalı oluşacaktır.
Bir orijinden bir replikasyon başladıktan sonra replike olan DNA’nın
uzunluğunun bir birim olduğunu belirtmek için kullanılan terim
replikon terimidir.
John Cairns, E. coli’de replikasyonun bir orijinden başladığını
göstermiştir.
oriC olarak adlandırılan bu özgül bölgenin konumu E. coli kromozomu
üzerinde haritalanmıştır.
Bakteriyofaj ve bakterilerde DNA sentezi bir noktadan başladığı için,
kromozomun tümü bir replikondur. Tek bir halkasal kromozoma sahip
olan bakterilerde bir orijinin bulunması karakteristiktir.
Başka araştırıcılar tarafından ortaya konan çalışmaların sonucuna göre,
replikasyon iki yönlüdür ve oriC’nin her iki yönünde hareket eder.
Bakterilerdeki DNA sentezinde diğer enzimlerin yanı sıra 3 polimeraz
görev alır.
DNA Polimeraz I: 1957’de Arthur Kornberg ve arkadaşları E. coli’den
in vitro sistemde DNA sentezini yönlendiren bir enzim ayrıştırmışlardır.
Bu enzim DNA polimeraz I olarak bilinmektedir.
Kornberg DNA polimeraz I’in varlığında in vitro DNA sentezi için başlıca
iki gereksinim olduğunu saptamıştır:
1. Dört tip deoksiribonukleozit trifosfat
(dATP, dCTP, dGTP, dTTP=dNTP)
2. DNA kalıbı
Reaksiyonda 4 dNTP’den herhangi birinin bulunmaması durumunda
ölçülebilir bir sentez meydana gelmemiştir.
Kalıp DNA ilave edilmezse DNA sentezi gerçekleşmekte ancak büyük
oranda azalmaktadır.
Uzayan DNA zincirine her bir nukleotitin katılım şekli
DNA polimeraz I’in özgüllüğüne bağlıdır.
Öncü dNTP’de, d-ribozun 5’-C’una üç adet fosfat grubu bağlıdır. Sentez
esnasında uçtaki iki fosfat grubu koparken 5’-C’a bağlı olan fosfat
grubu ilave edileceği d-ribozun 3’-OH’ına kovalent bağla bağlanır.
Böylece zincir uzaması, uzayan zincirin 3’ ucuna her seferinde bir
nukleotit ilavesi ile 5’-3’ yönünde devam eder.
DNA sentezi devam ettikçe her basamakta açığa çıkan yeni 3’-OH grubu,
DNA sentezi ilerlerken sonraki nukleotitin zincire eklenmesini sağlar.
DNA Polimeraz II ve III
Peter DeLucia ve John Cairns, DNA polimeraz I aktivitesine sahip
olmayan bir mutant E. coli suşu bulmuştur. İşlevsel enzime sahip
olmayan bu mutatnt suş DNA’sını kopyalayıp üremeyi başarmış ancak
hücreler DNA “onarım” yeteneği bakımından oldukça yetersiz
kalmıştır.
1. E. coli’de, in vivo DNA replikasyonu yapabilen başka bie enzim
bulunmalıdır.
2. DNA polimeraz I’in in vivo koşullarda ikincil bir işlevi olabilir. DNA
polimeraz I’in DNA sentezinin doğru yapılmasından sorumlu olduğu,
ancak tamamlayıcı zinciri sentezleyen gerçek enzim olmayabileceği
düşünülmüştür.
Bu üç enzimin hiçbiri bir kalıptan DNA sentezini başlatamaz, ancak üçü de
primer adı verilen (RNA), var olan bir DNA zincirini kalıp boyunca
uzatabilir.
DNA polimeraz enzimlerinin hepsi molekül ağırlığı 100.000 dalton olan
büyük protein kompleksleridir.
Her üçünün de 3’-5’ eksonukleaz aktivitesi bulunur.
Bu özellik, enzimlerin polimerizasyonu tek yönde gerçekleştirme, bir an
duraksayıp geri dönerek ilave edilen nukleotidleri çıkarabilme
kapasitelerini ifade etmektedir.
DNA polimeraz I, 5’-3’ eksonukleaz aktivitesi de gösterir. Bu sayede enzim,
sentezin başladığı uçtan itibaren nukleotidleri kesebilir ve sonra sentez
yönünde işlemine devam edebilir.
Bu nedenle DNA polimeraz I, RNA primerini de ortamdan uzaklaştırabilir.
Hücrede DNA polimeraz I, DNA polimeraz III’e göre daha fazla miktarda
bulunur ve daha dayanıklıdır.
Polimeraz I, primeri uzaklaştırır ve primerler uzaklaştıkça doğal olarak
oluşan boşluklarda DNA sentezleyerek bu bölgeleri doldurur.
Eksonukleaz aktivitesi ile, bu işlem esnasında oluşabilecek hataları da
onarabilir.
Polimeraz II, UV gibi dış etmenler sonucu hasar gören DNA’nın
onarımında rol alır. Enzim replikasyon çatalındaki DNA sentezi
bozulduğunda aktive olan bir gen tarafından şifrelenmektedir.
Replikasyonda gerekli olan ve polimerizasyondan sorumlu asıl enzim
olarak Polimeraz III görülmektedir.
Enzimin 3’-5’ eksonukleaz aktivitesi, sentez sırasında hata onarımı işlevini
görmesini sağlamaktadır.
DNA polimeraz III’ün holoenzim olarak adlandırılan aktif formu,
10 farklı polipeptit zincirinden meydana gelmiş bir dimerdir.
Molekül ağırlığı 600.000 daltondan fazladır. Molekül ağırlığı 140.000
dalton olan en büyük alt birim olan α, ε, θ (alfa, epsilon ve teta) alt
birimleri ile beraber holoenzimin polimerizasyon aktivitesi gösteren
“çekirdek” (core) enzim kısmını oluşturur.
Kalıp zincirin nukleotit polimerizasyonundan α alt birimi sorumludur.
Çekirdek enzimin ε alt birimi, 3’ – 5’ eksonukleaz aktivitesi gösterir.
Beş alt birimin (γγ, δ, δ’, x, ψ) oluşturduğu ikinci grup, γ (gama) kompleks
olarak adlandırılan bölgeyi oluşturur.
Bu γ kompleksi, replikasyon çatalında enzimin kalıba “oturtulmasında”
rol alır.
Enzimin işlev görmesi için ATP enerjisi gereklidir.
β Alt birimi, polimerizasyon sırasında çekirdek enzimin kalıptan
kopmasını sağlar.
Son olarak, τ (pi) alt birimi, iki çekirdek polimerazın replikasyon çatalında
bir arada tutunmasını sağlar.
Holoenzim ve diğer çeşitli proteinler, replikasyon çatalında neredeyse
ribozom kadar büyük olan replizom olarak bilinen bir kompleks
oluşturur.
DNA replikasyonu sırasında birçok karmaşık olayın çözülmesi gerekir.
Bakteri ve virüslerde replikasyon yarı-saklı ve bir replikonda çift yönlü
hareket eder.
Sentezin, DNA polimeraz III’ün denetimi altında 5’ den 3’ üne doğru iki
replikasyon çatalı oluşturarak gerçekleştiği bilinmektedir.
Bu replikasyon çatalları sentezin başladığı noktadan iki zıt yöne doğru
hareket etmektedir.
1. Sarmalın yer yer açılması ve her iki zincirde sentezin devam etmesi için
bu “açık” konfigürasyonun dayanıklı olmasını sağlayan bir
mekanizmanın olması gerekir.
2. Sarmalın açılması ve zincirin daha aşağı kısımlarda tekrar sarılması
sonucu ortaya çıkan gerilimi azaltmak için de bir mekanizma
bulunmalıdır.
3. DNA polimeraz III’ün polimerizasyonu yönlendirebilmesi için bir çeşit
primer sentezlenmelidir. Gerçekten bir primer vardır, ancak primerin
DNA değil RNA olması şaşırtıcıdır.
4. RNA primeri sentezlendikten sonra DNA polimeraz III, atasal
molekülün her iki zincirinin tamamlayıcısı olan DNA zincirini
sentezlemeye başlar. Replikasyon çatalının ilerleme yönünde olan
kesintisiz sentez, iki zincirin birbirine antiparalel olduğu için ancak
zincirlerden birinde gerçekleşebilir. Diğer zincirdeki sentez zıt yönde ve
kesintilidir.
5. Replikasyonun tamamlanmasından önce RNA primerlerinin
uzaklaştırılması gerekir. Oluşan geçici boşlukların bulunduğu yerler,
kalıp DNA eşlenikliği ile doldurulmalıdır.
6. Boşlukları doldurmak için yeni sentezlenen DNA, yanındaki DNA zinciri
ile birleştirilmelidir.
7. Kopyalama sırasında DNA polimerazlar eşlenik bazları doğru biçimde
yerleştirmektedir, ancak hata olma olasılığı da vardır. Bazen
sentezlenen zincire yanlış bazlar ilave edilebilir. Sentez işleminin bir
parçası olan bir hata okuma mekanizması (proofreading) DNA sentezi
sırasında oluşan hataları düzeltir.
DNA sarmalı açılmalıdır
Bakteri ve virüslerin halkasal kromozomlarında, DNA sentezinin başladığı
bir orijin noktası bulunur. Bu bölge E. coli kromozomunda çok iyi
çalışılmıştır.
Replikasyon orijini olan oriC, 9 ve 13 bazdan oluşan (9mer ve 13mer
olarak adlandırılır) tekrar dizilerinin bulunduğu 245 baz çifti içerir.
DnaA denen özgül bir protein ilk basamakta sarmalın açılmasından
sorumludur. DnaA proteininin bazı alt birimleri birçok 9mer dizisine
bağlanır. Bu bağlanma, sarmalın daha fazla açılmasında ve
kararlılığında rol alan DnaB ve DnaC proteinlerinin bağlanmasını
kolaylaştırır.
H bağlarını kırıp ikili sarmalı denatüre etmek için normalde ATP hidrolizi
ile sağlanan enerjiye gereksinim duyan bu tip proteinler helikazlar
olarak adlandırılır.
Tek zincire bağlanan proteinler (single-stranded binding proteins, SSBP)
olarak bilinen diğer bazı proteinler bu konformasyonu daha da kararlı
kılarlar.
Sarmalın açılması devam ettikçe, replikasyon çatalının önünde oluşan
sarılma gerilimi çoğu kez üstün kıvrılma (super coiling) meydana
getirir.
Halkasal moleküllerde üstün kıvrılmalar, DNA’daki ek bükülmeler ve
dönüşler sonucu oluşturulur. Bu durum aynen bir lastiğin uzatılıp, bir
ucundan büküldüğünde ortaya çıkan sarmal yapıya benzer.
DNA topoizomerazlar olarak adlandırılan geniş bir enzim ailesinin üyesi
olan DNA giraz enzimi, bu tip üstün kıvrılmaları gevşetir. Giraz enzimi
tek zincirde ya da her iki zincirde “kırıklar” oluşturur, aynı zamanda
üstün kıvrılma oluşumu sırasında meydana gelen bükülmeleri ve
düğümleri “açma” hareketleri de katalizler.
Oluşan kırıklar sonra tekrar birleştirilir. Bu çeşit replikasyonlarda ATP
hidrolizinden açığa çıkan enerji kullanılır.
DNA polimeraz kompleksi ve diğer ilgili enzimler hep birlikte, molekülü
DNA sentezine katılacak şekilde düzenlerler ve hepsi replizomun bir
parçasını oluştururlar.
DNA sentezinin başlaması için RNA primerine gereksinim vardır.
Sarmalın küçük bir bölümü açıldıktan sonra sentez başlayabilir. DNA
polimeraz III’ün polinukleotit zincirini uzatması için, serbest 3’-OH
gurubu olan bir primer gereklidir.
Önce, kalıp DNA üzerinden DNA’ya eşlenik olan kısa bir RNA parçası
sentezlenir. RNA sentezi, primaz denilen RNA polimerazın bir çeşidi
tarafından sentezlenir.
Primazın sentezi başlatması için serbest 3’ ucu gerekmemektedir. DNA
polimeraz III işte bu kısa RNA parçasına 5’-deoksiribonukleotitleri
eklemeye başlayarak DNA sentezini başlatır.
Daha sonraki bir aşamada, RNA primeri uzaklaştırılmalı ve yerini DNA’ya
bırakmalıdır. Bu reaksiyon DNA polimeraz I tarafından katalizlenir.
RNA primerinin oluşumu, virüsler bakteriler ve çeşitli ökaryotik
organizmalarda tanımlanan, evrensel bir işlemdir.
Antiparalel zincirde DNA sentezi kesintili ve kesintisiz olarak gerçekleşir
DNA polimeraz III, DNA sentezini yalnız 5’-3’ yönünde gerçekleştirebilir.
Sentez, replikasyon çatalı boyunca ve çatalı açarak zincirin birinde bir
yönde, diğerinde zıt yönde aynı anda gerçekleşir.
Replikasyon çatalı açıldıkça ve aşağı doğru hareket ettikçe, sadece bir
zincir sürekli DNA sentezi için kalıp olarak kullanılabilir. Bu zincire
kesintisiz DNA zinciri (leading DNA strand) denir.
Kesintili DNA zinciri (lagging DNA strand) olarak adlandırılan diğer
zincirde, sentez için birçok başlangıç noktası gereklidir ve sonuç olarak
bu zincirde kesintili DNA sentezi yapılır.
Kesintili DNA sentezini destekleyen kanıtlar, Reiji Okazaki, Tuneko
Okazaki ve ark. tarafından elde edilmiştir.
E. coli’de bakteriyofaj DNA’sının replikasyonu sırasında yeni sentezlenen
DNA’nın bir kısmının, kalıp zincire H bağlarıyla tutunan 1000-2000
nukleotitlik küçük parçalar halinde bulunduğunu göstermişlerdir.
RNA primeri bu şekildeki her bir parçanın bir kısmını oluşturmaktadır.
Okazaki parçaları (fragmanlar) olarak adlandırılan bu parçacıklar,
sentez devam ettikçe, molekül ağırlığı gittikçe artan daha uzun DNA
zincirlerine dönüşmektedir.
Kesintili DNA sentezinde, RNA primerini uzaklaştıracak ve Okazaki
fragmanlarını birleştirecek enzimlere gereksinim vardır.
Bilindiği gibi, primerin uzaklaştırılması ve eksik nukleotitlerin yerine
konulmasında DNA polimeraz I enzimi sorumludur.
Fragmanları birleştirme işi ise DNA Ligaz enzimine aittir. DNA ligaz,
fosfodiester bağının oluşumunu katalizleyerek kesintili sentezlenen
zincirler arasındaki boşluğu kapatır.
Sentez kesintili ve kesintisiz zincirlerde aynı anda yapılır
Bu iki zincir aynı replikasyon çatalında aynı anda mı kopyalanır, yoksa bu
işlemler enzimin iki ayrı kopyasını içeren farklı olaylar mıdır?
Kesintili zincir bir ilmek oluşturduğu taktirde, her iki zincirde birden
dimetrik enzimin yönlendirdiği nukleotit polimerizasyonu gerçekleşir.
100-200 baz çiftinin sentezinden sonra enzimin kesintili kol üzerindeki
monomeri sentezi tamamlamış bir Okazaki fragmanına rastlar ve o
noktada zinciri terk eder.
Hemen arkasından kesintili kalıp zincirde yeni bir ilmek oluşur ve işlem
tekrarlanır. İşlem oluşumu kalıbın yönünü değiştirir ancak, kesintili
zincirde sentezin 5’-3’ olan gerçek yönünü etkilemez.
Holoenzimin replikasyon çatalında sentezi kolaylaştıran diğer bir önemli
özelliğide, enzimin β alt biriminin yeni oluşan DNA sarmalını saran
kıskaç-benzeri dimer yapısıdır.
Bu β alt birim kıskacı, çekirdek enzimin (nukleotitlerin ilavesini
katalizleyen α, ε ve θ alt birimleri) polimerizasyon süresince kalıptan
ayrılmasını engeller.
Replikasyon çatalı açılırken, holoenzimin tümü ana sarmal boyunca
hareket ettiği için β alt birim dimerine kaygan kıskaç denir.
Hata okuma (proofreading) ve düzeltme DNA replikasyonunun ayrılmaz
parçasıdır.
DNA replikasyonunun temeli, her nukleotiti tamamen kalıp zincirin
eşleniği olan yeni bir zincirin sentezlenmesidir.
DNA polimeraz, sentezi çok doğru yaptığı halde kusursuz değildir ve
zaman zaman eşlenik olmayan bir nukleotit hatalı olarak zincire
girebilir.
Bu tip hataları gidermek için polimeraz I ve III, 3’ – 5’ eksonukleaz
aktivitesi göstererek yanlış eşleşen nukleotiti saptar ve yapıdan çıkarır
(3’-5’ yönünde).
Yanlış eşleşmiş nukleotit çıkartıldıktan sonra sentez 3’-5’ yönünde yeniden
devam eder.
Eksonukleaz hata okuması (exonuclease proofreading) denen bu işlem
sentezin doğruluğunu arttırır.
Holoenzim yapısındaki DNA polimeraz III’ün ε alt birimi, hata onarım
basamağına doğrudan katılır.
DNA replikasyonu uygun bir model ile açıklanabilir
İlerleyen çatalda helikaz enzimi ikili sarmalı açar. Sarmal açılınca, tekrar
sarmal oluşmasını engellemek için, açılan zincire tek zincir yapılarına
özgül olarak bağlanan proteinler bağlanır.
İlerleyen replikasyon çatalında, DNA giraz oluşan üstün kıvrılmaların
yarattığı gerilimi azaltma işlevi görür.
Polimeraz dimerinin çekirdeğini oluşturan her bir monomer, kalıp
zincirlerden birine β-alt birimlerinin oluşturduğu kaygan kıskaç
yardımıyla bağlanır.
Sentez, kesintisiz zincirde sürekli olarak gerçekleştirilirken, kesintili zincir
sentezin her iki zincirde de aynı anda devam etmesini sağlamak için
“ilmek” oluşturmalıdır.
Kesintili zincirdeki replikasyonda, RNA primerinin yerini DNA’nın alması
için DNA polimeraz I ve Okazaki parçalarının birleşmesi için de DNA
ligaz işlevi gereklidir.
Replikasyon çeşitli genler tarafından kontrol edilir.
Ligaz eksikliği ya da hata okuma-eksikliği gibi pekçok mutasyon,
kopyalamanın bazı safhalarını engeller ya da ciddi ölçüde bozar.
Genetik analizlerde, genellikle bir koşulda kendini gösteren ancak başka
bir şekilde gözlenmeyen koşullu mutasyonlar (kondisyonel
mutasyonlar) kullanılır.
E. coli’de polimeraz I, II ve III’ün alt birimleri, çeşitli genler tarafından
şifrelenir.
Ökaryotik DNA sentezi prokaryotik DNA sentezine benzer ancak daha
karmaşıktır.
Bakteri ve ökaryotlarda DNA ikili sarmalı replikasyon orijininde
açılarak iki replikasyon çatalı meydana gelir ve DNA polimerazın
yönlendirdiği sentez, kesintisiz zincirde ve kesintili zincirde çift
yönlü olarak devam eder.
Ökaryotik polimerazların DNA sentezi için bakteriyel sistemlerde
olduğu gibi;
4 tip deoksiribonuklezit trifosfat
Bir kalıp
Bir primer’e ihtiyacı vardır.
Ancak ökaryotik hücrelerde, hücre başına düşen DNA miktarı daha
fazla olduğu için ve bu DNA proteinlerle kompleks yapmış
durumda bulunduğu için, bakterilerin karşılaşmadığı sorunlarla
yüz yüze gelir.
Çoklu Replikasyon Orijini
Prokaryotik ve ökaryotik DNA replikasyonu arasındaki en belirgin
fark, E. coli kromozomunda bir replikasyon orijini bulunurken,
ökaryotik kromozomda birçok replikasyon orijini bulunmasıdır.
Birden fazla replikasyon orijininin bulunması;
1. Ökaryotlarda, bakterilere göre daha fazla DNA vardır
2. Ökaryotik DNA polimerazın saniyede 50 nukleotit olan sentez hızı,
bakteriyel polimeraza göre 20 kat daha yavaştır.
Bu koşullarda, tek bir orijinden başlayan tipik bir ökaryotik
replikasyonu ancak bir ayda tamamlanabilecektir.
Mayadan elde edilen replikasyon orijinlerine, özerk replike olan
diziler (Autonomously replicating sequences, ARS) denir.
ARS’ler sentezin etkin olarak başlamasına katkı sağlayan diğer kısa
dizilerin yanında yerleşim gösteren 11 bç’lik birimlerden
oluşmuştur.
Polimerazın bu kadar büyük DNA arasından ARS dizilerini nasıl
bulduğu ilişkin açıklama; S fazından önce başlayan bir
mekanizmanın bulunmasıdır.
Hücre döngüsünün G1 fazı sırasında bütün ARS dizilerine bazı
protein grupları bağlanır ve orijin tanıma kompleksi (origin
recognition complex, ORC) meydana gelir.
ARS dizilerinde yada ORC proteinlerini şifreleyen genlerde her hangi
bir mutasyon olursa, DNA sentezinin başlaması gerçekleşmez.
Bu tanıma kompleksleri G1 fazında oluştuğu ve S fazından önce sentez
başlamadığı için, sentezin gerçek başlama sinyalinde yer alan daha
başka proteinler de bulunmalıdır.
Bu proteinlerin en önemlileri, özgül kinazlardır.
Kinazlar, hücre döngüsünün ayrılmaz bir parçası olan fosforilasyonun
kilit enzimleridir.
ORC’ye bağlandıklarında, DNA polimerazın bağlanmasına açık olan
bir ön replikasyon kompleksi (pre-RC) oluşur.
Kinazlar aktive olduklarında, sadece başlama kompleksini
tamamlamış olmazlar, aynı zamanda DNA sentezinin tetiğinide
çekerler ve her replikasyonda DNA sentezi tamamlana kadar tekrar
ön-RC oluşmasını engellerler.
Bu mekanizma önemlidir, çünkü kopyalanması tamamlanan DNA
parçasını, kopyalanmamış DNA’dan ayırt eder.
Böylece kopyala işlemi düzenli ve etkin biçimde sürdürülür.
Ökaryotik DNA polimerazlar
Enzimin toplam olarak 6 formu saflaştırılıp çalışılmıştır.
Polimerazın DNA’ya bağlanabilmesi için, önce sarmalın topolojisinin
değişmesi gerekir.
Orijin bölgesinde sentezin başlaması tetiklenince, ikili sarmal A=T
zengin bir bölgeden açılarak helikaz enziminin girişini sağlar.
Helikaz, DNA sarmalını daha da açarak ilerler.
Polimerazın sentezi başlatmasından önce, DNA ile kompleks yapmış
olan histon proteinlerinin uzaklaştırılması yada modifikasyonu
gerekir.
DNA sentezi ilerledikçe, histonlar yeni sentezlenen dublekslerle bir
araya gelerek, karakteristik nukleozom yapısını yeniden oluşturur.
Ökaryotlarda, hücre döngüsünün S fazında yeni histon proteinlerinin
sentezi, DNA sentezi ile birlikte gerçekleştirilir.
DNA polimerazlardan üçü (α
α, δ ve ε) ökaryotik hücrelerde çekirdek
DNA’sının replikasyonu için gereklidir.
Diğer ikisinin (β
β ve ζ) (beta ve zeta) DNA tamirinde rol aldığı
düşünülmektedir.
Altıncısı ise (γγ) mitokondri DNA’sının sentezinde yer alır. Polimeraz γ,
her ne kadar çekirdek genleri tarafından sentezlense de replikasyon
işlevi bu organelle sınırlıdır.
Çekirdek DNA’sının sentezinin başlatılmasında, polimeraz α ana
enzim olarak görülmektedir.
Enzimin 4 alt biriminden ikisi, kesintili ve kesintisiz zincir üzerinde
RNA primerinin sentezlenmesinden sorumlu olan primaz olarak
işlev görür.
Diğer bir alt birim, eşlenik deoksiribonukleotitleri RNA primerine
takarak primeri uzatır.
Böylece, DNA sentezinin ilk evresi başlamıştır. RNA primerine kısa bir
DNA dizisi eklendikten sonra, polimeraz değişimi olarak bilinen
işlem gerçekleşir.
Polimeraz α kalıptan ayrılır, onun yerini pol. δ alır. Bu form, “yüksek
işlevselliğe” ve hata düzeltme işlevini yapabilmesini sağlayan 3’-5’
eksonukleaz aktivitesine sahiptir.
Ayrıca pol. α’ya göre sentez hızını 100 kez arttırır. Pol. δ’nın
yönlendirdiği DNA sentezi devam ederken, zincir uzar ve hata
onarımı yapılır.
Üçüncü enzim formu olan pol. ε, pol. δ ile aynı özellikleri taşır, ancak
değişik hücre koşullarda çalıştığı var sayılmaktadır.
Mayada, pol. ε aktivitesini engelleyen mutasyonların ölümcül olması,
enzim işlevinin kopyalama sırasında gerekli olduğuna işaret
etmektedir.
Ökaryotlarda çok fazla replikon olduğu için bakterilere göre çok daha
fazla DNA polimeraz molekülü bulunur.
Ökaryotlarda, bakteriye göre daha fazla sayıda daha küçük replikon
bulunması, ökaryotlardaki daha yavaş sentez hızının yaratabileceği
sorunları ortadan kaldırır.
Doğrusal kromozomların uçlarının replikasyonu sorunludur.
Prokaryotik ve ökaryotik DNA sentezi arasındaki fark,
kromozomların yapısı ile ilgilidir.
Bakteri ve fajların çoğunda bulunan kapalı halkasal kromozomların
tersine, ökaryotlardaki kromozomlar doğrusaldır.
Replikasyon sırasında kromozomun telomerik bölgesinin bir parçası
olan doğrusal kromozom “uçlarında” özel bir sorunla karşılaşır.
Kesintisiz zincirdeki sentez normal olarak kromozom ucuna kadar
devam ederken, kesintili zincirde, RNA primeri uzaklaştığında
sorun ortaya çıkar.
Kesintili sentez sırasında oluşan 3’-OH grubuna nukleotit ilavesi
yapılarak yeni oluşan boşluklar doldurulmalıdır.
Ancak burası kromozomun ucu olduğu için, 3’-OH grubunu
sağlayacak kalıp zincir yoktur.
Dolayısıyla, her sentezin sonunda kromozom, teorik olarak, RNA
primerinin boyu kadar kısalacaktır.
Telomeraz olarak adlandırılan enzimin bulunması, daha karmaşık
yapıdaki organizmaların bu problemi nasıl çözdüğünün
anlaşılmasına olanak sağlamıştır.
Tetrahymena’da telomerlerin çoğu 5’-TTGGGG-3’ dizisi ile sonlanır.
Telomeraz, her replikasyon sonrası telomerin kısalmasını önlemek
için, TTGGGG tekrar dizilerini yine aynı diziyi içeren kromozom
ucuna ilave etmektedir.
DNA’nın ucunda TTGGGG dizisi bulunmasa da enzim yinede bu
diziyi kromozomun ucuna eklemektedir.
O halde, TTGGGG, ne bir sinyal nede telomerazın işlev görmesi için
gereklidir.
Enzim, yapısında katalitik aktivitesi için gerekli olan kısa bir RNA
parçası bulunduran çok özgün yapıda ribonukleoproteindir.
Telomerik DNA dizilerinin evrim sürecinde çok sıkı korunmuş diziler
olması, telomerlerin işlevlerinin oldukça kritik olduğunu gösterir.
Telomerin boyunun kısalmasıyla hücre yaşlanmasının moleküler
mekanizması arasında bir bağlantı olduğu bilinmektedir.
Ökaryotlarda, somatik hücrelerin çoğunda telomeraz aslında aktif
değildir ve bu nedenle, her hücre bölünmesi sonucu kromozomların
telomerleri kısalır.
Birçok bölünmeden sonra telomerde ciddi aşınmalar olur ve hücre
daha fazla bölünme kapasitesini yitirir. Diğer yandan kanser
hücrelerinde telomeraz aktivitesi korunmuştur, bu hücreler
ölümsüzdür.
DNA rekombinasyonu, replikasyonda olduğu gibi özgül enzimler
tarafından gerçekleştirilir.
Önemli oranda DNA dizi homolojisi içeren iki kromozom boyunca
eşdeğer pozisyonlardaki genetik değiş-tokuşa, genel yada
homolog rekombinasyon denir.
Homolog rekombinasyon, belirli ortak özelliklere sahip çeşitli
modellerle açıklanmaya çalışılmıştır.
Robin Holliday ve Harold L.K. Whitehouse’un 1964’de, bağımsız
olarak ortaya koyduğu modellere dayanmaktadır.
Değiş-tokuşun kusursuz olması DNA zincirleri arasındaki eşleniğe
bağlıdır.
Bütün modellerin temelinde genetik rekombinasyonu
gerçekleştirebilmek için bir dizi enzimatik işlemler yer alır.
Süreç, iki eşleşmiş DNA dubleksi yada homologları ile başlar. Her bir
çiftte, aynı pozisyonda endonukleaz aracılığı tek zincirde kırık
oluşur (a).
Zincirlerin kesim sonucu ortaya çıkan uçları yer değiştirir ve
arkasından diğer dubleksin tamamlayıcı ipliği ile eşleşir (b).
Boşta kalan uçlar ligaz ile birleştirilerek heterodubleks DNA
molekülleri adı verilen hibrit çiftler oluşturulur (c).
Değiş-tokuş sonucu çapraz köprü yapısı ortaya çıkar. Çapraz
köprünün pozisyonu, dallanma (branch) göçü olarak adlandırılan
işlemle kromozom boyunca hareket eder (d).
Bu hareket, fermuarın açılıp kapanmasına benzer biçimde, her bir
dubleksin yer değiştiren zincirinin eşlenik bazları arasındaki
H bağlarının kırılıp tekrar birleşmesiyle gerçekleşir.
Bu hareket sonucu her iki homolog üzerindeki heterodubleks DNA’nın
uzunluğu artar.
Dubleksler ayrıldığında (f), ve alttaki kısım 180° döndüğünde (g), ki
formu (chi form) denilen düzlemsel bir ara yapı oluşur ve
karakteristik Holliday yapısı ortaya çıkar.
Daha önce değiş-tokuşta yer almamış karşı homologlardaki iki zincir
endonukleazla kırılırsa (h), ve tekrar birleşme olursa (i),
rekombinant dubleksler meydana gelir.
Gen konversiyonu (dönüşümü), DNA’nın rekombinasyonu sonucu
ortaya çıkar.
Başlangıçta, Carl Lindegren’in mayada ve Mary Mitchell’in
Neurospora’da saptadığı gen dönüşümü iki yakın bağlantılı gen
arasındaki karşılıklı olmayan (nonresiprokal) genetik değiş-tokuş
olarak adlandırılır.
Örneğin, her biri değişik mutasyon taşıyan iki Neurospora suşunu
çaprazlarsak (a+ X +b), genler arasındaki karşılıklı (resprokal)
rekombinasyonla ++ ve ab genotipleri taşıyan spor çiftleri oluşur.
Bunun aksine, tek taraflı değiş-tokuşta bu çiftlerden yalnız biri
meydana gelir.
Bu olayların sıklığı öngörülen mutasyon hızına göre daha yüksektir ve
dolayısıyla mutasyondan kaynaklandığı söylenemez.
Bunlar, gen konversiyonu olarak isimlendirilir, çünkü, genetik değiştokuşun olduğu yerde bir allel bir şekilde başka bir allele
“dönüşmüştür”.