Slayt 1 - WordPress.com
advertisement

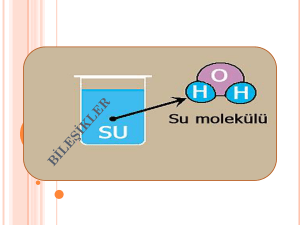
ATOM ve YAPISI Maddelerin gözle görülmeyen (bölünmeyen) en parçasına atom denir. Atom kendinden başka hiçbir fiziksel ya da kimyasal metotlarla kendinden farklı atomlara dönüşemezler. Atomda (+) yüklü protonlar,(-) yüklü elektronlar ve yüksüz nötronlar bulunur. Atom çekirdek ve elektron olmak üzere iki temel parçacıktan oluşur Atomun merkezini oluşturur. Hacim olarak çok küçük(1/10000) olmasına karşın tüm ağırlığın(1/1840) toplandığı kısımdır. Protonlar:Bir element için proton sayısı sabittir. Elementin tümünü ve tüm özellikleri belirleyen protondur.Proton sayısı değiştiğinde elementin türü ve tüm özelliği değişir.”p” harfiyle gösterilir. Elektron:”e” harfiyle gösterilir. Çekirdek çevresinde ,belirli yörüngelerde bulunurlar. Elektronlar bağımsız yörüngelerde bulunamazlar. Pozitif(+) ya da negatif(-) elektrik yüküyle yüklenmiş atom veya atom gruplarına iyon denir. İki tür iyon vardır; Pozitif iyon: Nötr atomdan elektron uzaklaştırılması sonucu oluşmuştur Negatif iyon: Nötr atoma elektron ilavesi sonucu oluşur. İZOTOP ATOM Proton sayıları aynı ,nötron sayıları farklı atomlara izotop atomlar denir. İzotop atomların kimyasal özellikleri aynı,fiziksel özellikleri farklıdır. Yanda gördüğümüz gibi iki atom var, ve bunların nötron sayıları(22,18) farklı ama proton sayıları(20,20) aynıdır. Bu nedenle yandaki iki atom izotop atomlardır. ELEMENTLERİN SINIFLANDIRILMASI Elementler kendilerinden başka daha saf maddelere ayrışamazlar. Kısaca içerisinde bir cins atom bulunduran maddelere element denir. Doğada 115 tane element bulunur. Bu elementleri üç grupta inceleriz. Bunlar metaller,ametaller ve yarı metaller(soy gazlar)dır. 1) Metaller: Elementlerin çoğunluğu metal şeklinde bulunurlar. Sanayi ve teknolojinin ham maddesidir. Isı ve elektriği ileten ve dövülerek işlenebilen (biçimlendirilen) ,genellikle katı halde bulunan parlak cisimlere metal denir. Altın,gümüş,demir vb. Metallerin özellikleri şunlardır; _Doğal ortam şartlarında ,cıva hariç hepsi katıdır. _Tel ve levha haline gelirler _Elektriği ve ısıyı iletirler. _Parlak renklidirler 2) Ametaller: Isı ve elektriği iletmeyen,dövülerek işlenemeyen katı, sıvı ve gaz halinde bulunan maddelerdir. Azot, oksijen,klor,karbon vb. Ametaller doğada 20 tanedir. Ametallerin özellikleri şunlardır: _Doğal ortam şartlarında gaz halinde bulunurlar. _Genellikle mat renklidirler. _Grafit hariç ısı ve elektriği iletmez. _Canlıların yapısında bol bulunurlar. 3)-Yarı metaller(soy gazlar): Bazı özellikleriyle metallere ,bazı özellikleriyle de ametallere benzerler. Bu elementlere geçiş elementleri de denir. Arsenik, antimont ,germanyum ,silisyum, polonyum ,tellür vb. BİLEŞİKLER İki ya da daha fazla elementin kendi özelliklerini kaybederek belirli oranlarda ve kimyasal tepkimeler sonucu oluşturdukları saf maddelere bileşik denir Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik oluştururlar. Elementler doğada genelde saf halde değil de bileşikler halinde bulunurlar. Bileşiklerin Oluşması : Elementler bileşik oluştururken, elementi oluşturan aynı cins element atomları arasındaki kimyasal bağlar kopar ve element atomları birbirinden ayrılır. Birbirinden ayrılan element atomları, farklı cins element atomları ile yeni kimyasal bağlar oluşturarak bir araya gelir ve bunun sonucunda da bileşikler meydana gelir. Bu nedenle bileşikler oluşurken farklı element atomları kimyasal bağlar sayesinde bir araya gelir ve yeni maddeler oluşur. Bileşiklerin Bazı Özellikleri : 1-) Bileşikler, kendini oluşturan elementlerin özelliklerini göstermezler ve kendini oluşturan elementlerden tamamen farklı fiziksel ve kimyasal özelliklere yani kimliklere sahiptir. 2-) Bileşiği oluşturan elementler kendi özelliklerini yani kimliklerini kaybederler. 3-) Bileşiği oluşturan elementler belirli oranlarda birleşirler. 4-) Bileşiği oluşturan element atomları arasında kimyasal bağlar bulunur. 5-) Bileşikler oluşurken enerji alışverişi olur. 6-) Bileşikler, kimyasal değişmeler sonucu (tepkimelerle) oluşur ve kimyasal yollarla ayrılırlar. 7-) Bileşikler en az iki farklı elementten yani atomdan oluşurlar. Bileşik Çeşitleri : Bileşikler moleküler yapılı bileşikler ve moleküler yapılı olmayan bileşikler olarak iki grupta incelenirler. a) Moleküler Yapılı Bileşikler : Bileşikler, farklı cins element atomlarından oluşan moleküllerden oluşmuşsa böyle bileşiklere moleküler yapılı bileşikler denir. • Moleküler yapılı bileşikler moleküllerden oluşur. • Bileşiklerdeki molekülleri oluşturan atomlar arasında kovalent bağ bulunur. Bileşiğin İsmi Bileğin Formülü Bileşik Molekülünü Oluşturan Atomlar Su H2O 1 Su molekülü; 2 H, 1 O atomundan oluşur. Amonyak NH3 (KÖK) 1 Amonyak molekülü; 1 N, 3 H atomundan oluşur. Karbon Di Oksit CO2 1 Karbon Di Oksit molekülü; 1 C, 2 O atomundan oluşur. Kükürt Di Oksit SO2 1 Kükürt Di Oksit molekülü; 1 S, 2 O atomundan oluşur. Hidrojen Klorür HCl 1 Hidrojen Klorür molekülü; 1 H, 1 Cl atomundan oluşur. Hidrojen Florür HF 1 Hidrojen Florür molekülü; 1 H, 1 F atomundan oluşur. Azot Di Oksit NO2 1 Azot Di Oksit molekülü; 1 N, 2 O atomundan oluşur. Karbon Mono Oksit CO 1 Karbon Mono Oksit molekülü; 1 C, 1 O atomundan oluşur. Kükürt Mono Oksit SO 1 Kükürt Mono Oksit molekülü; 1 S, 1 O atomundan oluşur. Azot Mono Oksit NO 1 Azot Mono Oksit molekülü; 1 N, 1 O atomundan oluşur. Basit Şeker (Glikoz) C6H12O6 1 Basit Şeker molekülü; 6 C, 12 H, 6 O atomundan oluşur. Amonyum NH4 (KÖK) 1 Amonyum molekülü; 1 N, 4 H atomundan oluşur. Fosfat PO4 (KÖK) 1 Fosfat molekülü; 1 P, 4 O atomundan oluşur. Sülfat SO4 (KÖK) 1 Sülfat molekülü; 1 S, 4 O atomundan oluşur. Nitrat NO3 (KÖK) 1 Nitrat molekülü; 1 N, 3 O atomundan oluşur. Hidroksit OH 1 Hidroksit molekülü; 1 O, 1 H atomundan oluşur. Karbonat CO3 (KÖK) 1 Karbonat molekülü; 1 C, 3 O atomundan oluşur. Hidrojen Sülfat H2SO4 1 Hidrojen Sülfat molekülü; 2 H, 1 S, 4 O atomundan oluşur. (KÖK) b) Moleküler Yapılı Olmayan Bileşikler : Bileşikler, moleküllerden oluşmayıp bileşiği oluşturan farklı cins element atomları bir yığın oluşturacak şekilde bir araya gelmişse böyle bileşiklere moleküler yapılı olmayan bileşikler denir. • Moleküler yapılı olmayan bileşiklerdeki iyonlar düzenli bir yığın oluştururlar. • Moleküler yapılı olmayan bileşikler sonsuz örgü tipi bileşiklerdir • Moleküler yapılı olmayan bileşiklerdeki iyonlar düzenli bir örgü oluştururlar. • Moleküler yapılı olmayan bileşikleri oluşturan zıt yüklü iyonlar arasında iyonik bağ bulunur. (İyon sayısı yığının büyüklüğüne göre değişir). Bileşiğin İsmi Bileğin Formülü Bileşiği Oluşturan İyonlar Kalsiyum Oksit CaO Ca+2 ve O–2 İyonları Sodyum İyodür NaI Na+1 ve I–1 İyonları Sodyum Klorür NaCl Na+1 ve Cl–1 İyonları Alüminyum Klorür AlCl3 Al+3 ve Cl–1 İyonları Kalsiyum Florür CaF2 Ca+2 ve F–1 İyonları Alüminyum Sülfür Al2S3 Al+3 ve S–2 İyonları Bakır (I) Klorür CuCl Bakır (II) Klorür CuCl2 Demir (II) Bromür FeBr2 Demir (III) Bromür FeBr3 Gümüş Nitrat AgNO3 Kalsiyum Karbonat CaCO3 Çinko Sülfat ZnSO4 Alüminyum Sülfat Al2(SO4)3 Sodyum Sülfat Na2SO4 Sodyum Karbonat Na2CO3 Bakır Sülfat Klorat (*) Kromat (*) Bi Kromat (*) CuSO4 ClO3 (KÖK) CrO4 (KÖK) Cr2O7 (KÖK)