4.Kimyasal Ba*lar
advertisement

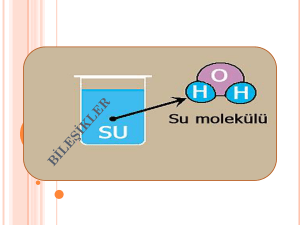
4.Kimyasal Bağlar Kimyasal Bağlar Aynı ya da farklı cins atomları bir arada tutan kuvvetlere kimyasal bağlar denir. Pek çok madde farklı element atomlarının birleşmesiyle meydana gelmiştir. İyonik bağ • (+) ve (–) yüklü taneciklerin (iyonların) elektriksel çekim kuvvetinden doğan bağa iyonik bağ denir. İyonik bağ yapan atomlardan elektron veren (+) yüklü, elektron alan (–) yüklü iyon olur. • Yemek tuzu, sodyum ve klor atomlarının iyonik bağ yapmasıyla oluşur. Atom numarası 11 olan sodyum (Na) atomu, atom numarası 17 olan klor (Cl) atomuna elektron vererek iyonik bağ oluşturur. Kovalent bağ • İki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. • Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. • Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır. • Kovalent bağ, söz konusu atomların dış yörüngelerinin dolması ile meydana gelir. Bu tür bağlar, moleküller arası hidrojen bağından daima daha güçlü, iyonik bağdan ise ya aynı güçte ya da daha güçlüdür. • Bazı inorganik maddelerin hidrojen(H), amonyak(NH3),klor(Cl), su(H2O) ve azot(N) molekülleri ile tüm organik maddelerin molekülleri kovalent bağ ile bir arada tutulmaktadır. • Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. • Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir. • Hidrojen bağı, bir molekülde oksijen, azot veya flor gibi elektronegatif bir atoma bağlı hidrojenin kısmi artı yükle yüklenmesi sonucu, başka veya aynı moleküldeki elektonegatif atom ile yaptığı kuvvetli bağdır. • Van der waals kuvvetinden güçlü olmasına karşın, tipik hidrojen bağı iyonik bağ ve kovalent bağdan daha güçsüzdür. Proteinler ve nükleik asitler gibi makromoleküller içinde, aynı molekülün iki parçası arasında var olabilir. • Hidrojen bağı ismi, bağın bir hidrojen atomunu kapsamasından gelir. Genelde bağ, hidrojenin flor, oksijen ve azot gibi elektronegatifliği yüksek atomlarla yapmış olduğu kuvvetli bir etkileşim türüdür.(Sadece F,O,N ile H atomu arasında oluşabilir) • Eğer hidrojen bağı atomu iki atom arasında ortak kullanılıyor ise meydana gelen iki molekül arasındaki zayıf bir bağdır. • Hidrojen bağları genellikle oksijen ve azot gibi negatif elektrik yüklü atomlarla diğer bir negatif yüklü atomlara kovalent olarak bağlanmış hidrojen atomları arasında oluşan bağlardır. • Dipol dipol etkileşmesinin kimyadaki en bariz örneğini teşkil eder. Metalik Bağ • Metalik bağa metallerde, örneğin çinkoda rastlanır • Metalik bağ, esas olarak metaller arasındaki, bir ya da daha çok atomubir arada tutan bir kimyasal bağ türüdür. , • Metal atomlarının latisindeki serbest elektronların yer değiştirmiş olarak paylaşılması esasına dayanır. Dolayısıyla metalik bağlar ergimiş tuzlarla karşılaştırılabilir. Diğer görece kuvvetli bağlardan iyonik bağ,kovalent bağ biridir. • Metalik bağ polar değildir ve bağlanma etkileşimi içerisindeki atomlar arasında ya hiç (saf elementel metaller) elektronegatiflik farkı yoktur, ya da çok az (alaşımlar) elektronegatiflik farkı vardır. • Bu etkileşim içindeki elektronlar metalin kristal yapısı boyunca yer değiştirirler. Metalik bağ, metalin dayanımı, dövülebilirliği, süneklik, ısı iletkenliği, elektrik iletkenliği ve parlaklığı gibi pek çok özelliğinin nedenidir. • Metalik bağ, metal atomları veya iyonlar ile yer değiştirmiş elektronlar arasındaki elektrostatik çekimdir. Bu nedenle, atomların veya tabakaların birbiri üzerinde kayması ile dövülebilirlik ve süneklik gibi karakteristik özellikler ortaya çıkar. • Metal atomlarının en az bir valans elektronu vardır ve bu elektronu ne bir komşu atomla paylaşır ne de iyon oluşturmak üzere verirler. • Bunun yerine, metal atomlarının dış enerji seviyeleri üst üste biner ve bu anlamda kovalent bağa benzerlik gösterirler 5. Bileşikler ve Formülleri Bileşikler : Günümüzde bilinen 117 element olmasına rağmen (92 tanesi doğada bulunur) bu elementler farklı sayıda ve şekilde birleşerek ve etkileşerek farklı kimyasal özelliklere sahip milyonlarca yani madde yani bileşik oluştururlar. Elementler doğada genelde saf halde değil de bileşikler halinde bulunurlar. • İki ya da daha fazla farklı element atomunun kendi özelliklerini kaybedip belirli oranlarda bir araya gelerek kimyasal bağ oluşturması sonucu meydana gelen yeni ve saf maddelere bileşik denir. • Bu nedenle elementlerin bileşikleri oluşturması kimyasal değişmedir. Örnek bileşikler Bileşiklerin Özellikleri 1- Bileşikler, kendini oluşturan elementlerin özelliklerini göstermezler ve kendini oluşturan elementlerden tamamen farklı fiziksel ve kimyasal özelliklere yani kimliklere sahiptir. 2- Bileşiği oluşturan elementler kendi özelliklerini yani kimliklerini kaybederler. 3- Bileşiği oluşturan elementler belirli oranlarda birleşirler. 4- Bileşiği oluşturan element atomları arasında kimyasal bağlar bulunur. 5- Bileşikler oluşurken enerji alışverişi olur. 6- Bileşikler, kimyasal değişmeler sonucu (tepkimelerle) oluşur ve kimyasal yollarla ayrılırlar. 7- Bileşikler en az iki farklı elementten yani atomdan oluşurlar. 8- Bileşiklerin belirli erime, kaynama, donma ve yoğunlaşma sıcaklıkları vardır. 9- Bileşiklerin öz kütleleri sabittir. 10- Bileşikler formüllerle gösterilirler. 11- Bileşikler saf ve homojen maddelerdir. 12- Bileşikler, moleküler yapılı bileşikler ve moleküler yapılı olmayan bileşikler olarak iki çeşittir. 13- (Bileşiklerin en küçük yapı birimleri moleküllerdir). Bileşik Çeşitleri a) Moleküler Yapılı Bileşikler Bileşikler, farklı cins element atomlarından oluşan moleküllerden oluşmuşsa böyle bileşiklere moleküler yapılı bileşikler denir. • Moleküler yapılı bileşikler moleküllerden oluşur. • Bileşiklerdeki molekülleri oluşturan atomlar arasında kovalent bağ bulunur. b) Moleküler Yapılı Olmayan Bileşikler Bileşikler, moleküllerden oluşmayıp bileşiği oluşturan farklı cins element atomları bir yığın oluşturacak şekilde bir araya gelmişse böyle bileşiklere moleküler yapılı olmayan bileşikler denir. • Moleküler yapılı olmayan bileşiklerdeki iyonlar düzenli bir yığın oluştururlar. • Moleküler yapılı olmayan bileşikler sonsuz örgü tipi bileşiklerdir • Moleküler yapılı olmayan bileşiklerdeki iyonlar düzenli bir örgü oluştururlar. • Moleküler yapılı olmayan bileşikleri oluşturan zıt yüklü iyonlar arasında iyonik bağ bulunur. (İyon sayısı yığının büyüklüğüne göre değişir). 6.Karışımlar • Çözelti: Homojen karışımlara çözelti denir • Homojen karşım: karışımı oluşturan maddelerin karışımın her tarafına eşit olarak dağılmasıyla oluşan karışımdır. • Heterojen karışım: karışımı oluşturan maddelerin karışımın her tarafına eşit olarak dağılmamasıyla oluşan karışımdır. • Çözücü: karşımı oluşturan maddelerden miktarı çok olana denir. Çözünen: karışımı oluşturan maddelerden miktarı az olana denir. • Seyreltik: bir çözeltide çözünen madde miktarı, diğer bir çözeltide bulunan çözünen madde miktarından daha az ise seyreltik denir. • Derişik: bir çözeltide çözünen madde miktarı diğer bir çözeltide bulunan çözünen madde miktarından daha fazla ise derişik denir. İki ve ya da daha fazla maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla karışımlar oluşur. Karışımı oluşturan maddeler, karışımın her tarafına eşit olarak dağılmışsa bu tür karışımlar homojen karışımlardır. Homojen karışımlar çözelti olarak adlandırılır. • Örneğin; çay içine şeker attığımızda, şeker çay içinde çözünür. Şeker karışımın her tarafında eşit oranda bulunduğundan bu karışım homojen karışımdır Çözünme hızına etki eden faktörler • Bir çözünmenin daha hızlı gerçekleşmesi için neler yapmamız gerekir? • Küp şeker mi yoksa toz şeker mi su dolu bardakta daha hızlı çözünür? • Su dolu bir bardağa bir küp şeker attığımızda, şeker su içinde çözünmeye başlar. Eğer küp şekeri parçalayıp toz halinde su içine atarsak çözünme çok daha hızlı gerçekleşir. Suyun sıcaklığı arttırıldığında çözünme hızı da artar. • Çözeltiler içerdikleri çözünen madde miktarlarına göre seyreltik ve derişik olarak ayrılabilirler. Bir çözeltide çözünen madde miktarı, diğer çözeltide bulunan çözünen madde miktarından daha az ise seyreltik, fazla ise derişiktir. FUAT ÖZDEMİR FEN BİLGİSİ ÖĞRETMENLİĞİ 2.SINIF 091852058












![C Elementi [Slayt]](http://s1.studylibtr.com/store/data/000924935_1-effe9d67aa73b7116686c4c63d62e23f-300x300.png)






