Slayt 1 - WordPress.com
advertisement

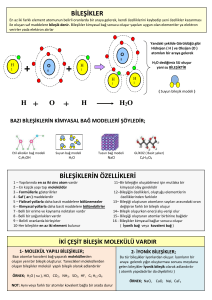
Bileşikler ve formülleri Farklı element atomları uygum şartlarda bir araya geldiğinde yeni maddeler oluşur. Bu yeni maddeleri oluşturan atomlar arasında kimyasal bağ bulunmaktadır. Farklı elementlere ait atomların belirli oranlarda bir araya gelerek bağ yapmasıyla oluşan yeni ve saf maddeye bileşik denir. Bileşikler, kendilerini oluşturan elementlerden tamamen farklı fiziksel ve kimyasal özelliklere sahiptir. Örneğin;yemek tuzu kendi oluşturan sodyum ve klor elementlerinden tamamen farklı özelliktedir. Sodyum elementi sadece sodyum atomlarından oluşur. Su Yeni madde oluştuğunda, oluşan bileşikler moleküler yapıda olabilecekleri gibi, moleküler yapıda olmayabilirde. Bileşikler moleküllerden oluşmuşsa bu moleküllerdeki atomlar arasında kovalent bağ vardır. Örneğin;su, su moleküllerinden oluşmaktadır ve suyu oluşmaktadır ve suyu oluşturan hidrojen ve oksijen atomları arasında kovalent bağ vardır. Suda olduğu gibi bileşikler moleküllerden meydana geliyorsa bu tür bileşikler molekül yapılı bileşik olarak adlandırılır Moleküler yapıda olmayan bileşikleri oluşturan atomlar arsında iyonik bağ vardır. Bu tür bileşikler iyonik yapılı bileşikler olarak adlandırılır. Örneğin;kalsiyum oksit bileşiğinde kalsiyum ve oksijen iyonları arasında,sodyum iyodür bileşiğinde iyot ve sodyum iyonları arasında iyonik bağ bulunmaktadır. İyonik bağ yapması sonucunda oluşa bileşikler, iyonik bileşik adlandırılır. CaO NaI OKSİJEN ATOMU KARBON ATOMU Karışımlar Karışım, birden çok maddenin kimyasal bağ oluşturmadan bir arada bulunmasıyla meydana gelir. Karışımlar yeni ve saf madde değildir. Bu sebeple karışımların belirli bir kimyasal formülü yoktur. • Karışımlar görünümlerine göre ikiye ayrılır. Örneğin; tebeşir tozu ile suyu karıştırdığımızda tebeşir karışımın her tarafında aynı miktarda bulunmaz. Tebeşir tozu karışımın üst tarafında daha çok diğer kısımlarda ise daha az miktarlarda bulunur. • Karışımı oluşturan maddeler karışımın her tarafına eşit miktarlarda dağılmıyorsa bu tür karışımlara heterojen karışım denir. Adi karışımlar bir tür heterojen karışımdır. Toz şeker Su Karışımı oluşturan maddeler karışımın her tarafına eşit olarak dağılmışsa bu tür karışımlar homojen karışımlardır. Çözeltiler homojen karışımlardır. Örneğin;bir şeker ile suyu karıştırdığımızda şeker ile su karışımının her tarafında eşit oranda bulunur. • Çıplak gözle bakıldığında homojen gibi görünen bazı karışımların,mikroskopla bakıldığında heterojen olduğu gözlenir. Örneğin;mineral ve vitamin gibi besinler içeren süt çıplak gözle bakıldığında homojen gibi görünür. Mikroskopta incelendiği zaman ise yağ zerreciklerinin belirli kısımlarında daha fazla bulunduğu görülür ve sütün heterojen olduğu anlaşılır. Süt Soluduğumuz hava, içerisinde bazı canlıların yaşadığı sular, içtiğimiz meşrubatlar, diş dolgusunda kullanılan amalgamlar, kullandığımız metal paralar hepsi birer çözeltidir. Bu çözeltileri oluşturan maddelerden miktarı çok olan çözücü,az olan da çözünendir. Fakat sulu çözeltilerde suyun miktarı az bile olsa su çözücü olarak kabul edilir. Örneğin;bir bardak suya bir kaşık şeker eklenerek hazırlanan çözeltide su çözücü,şeker ise çözünen maddedir. Çözeltiler fiziksel hallerine bağlı olarak katı,sıvı veya gaz halde bulunur. Biz bu konumuzda sadece sıvı halde bulunan çözeltileri inceleyeceğiz. Örneğin;soda ve gazoz gibi içecekler,gazın sudaki;tuzlu su,katının sudaki;kolonya ise alkolün sudaki çözeltisidir. • Çözelti oluşurken çözücü ve çözünen maddeler arasında bir etkileşim olur. Çözünen maddelerin tanecikleri çözücü ile etkileşerek birbirinden ayrılır ve çözücünün her tarafına dağılır. Bu dağılma sırasında çözücünün tanecikleri çözünenin taneciklerinin etrafını sarar. Böylece çözücü ve çözünen maddeler en küçük birimlerine kadar ayrılır. • Çözünme, çözücü ve çözünen maddelerin birbiri içinde iyonlarına veya moleküllerine ayrılmasıdır. • Çözelti oluştururken çözünen maddenin çözücüde daha hızlı çözünmesi için sıcaklığı arttırabilir veya çözünen maddenin tane boyutunu küçültebiliriz. • Çözelti oluştururken sıcaklığı arttırmak çözücü ve çözünen maddenin taneciklerinin çarpışmasını hızlandıracaktır. Bu durumda çözücünün tanecikleri çözünenin taneciklerini daha hızlı kuşatacak ve çözünme daha kısa sürede gerçekleşecektir. • Aynı şekilde çözünen maddeleri ufalayarak tane boyutunu küçülttüğümüzde,çözücünün taneciklerinin daha çok çözünen madde tanecikleriyle temas etmesi sağlanmış olacaktır. TEKRAR YAPMAYI UNUTMAYALIM!!!