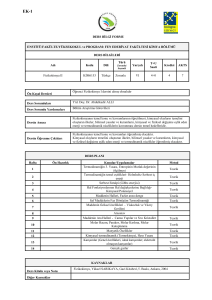
TEMEL TERMODİNAMİK
EŞİTLİKLER
• İÇ ENERJİ(U)
• ENTALPİ(H)
• HELMZ-HOLZ SERBEST
ENERJİSİ(A)
• GIBBS SERBEST ENERJİSİ(G)
dU = TdS-PdV
A = U-TS
G = U+PV-TS = H-TS
U 2 U1 qP P(V2 V1 )
(U 2 PV2 ) (U1 PV1 ) qP
H H 2 H1 qP
( A2 A1 ) (U 2 U1 ) (T2 S 2 T1S1 )
(U 2 U1 ) q w
( A2 A1 ) q w (T2 S 2 T1S1 )
q T (S 2 S1 )
( A2 A1 ) w
( A2 A1 ) TS irr w
( A2 A1 ) TS iir 0
dA TdS iir 0
dA 0
A U TS
p
p
nv ( eq ,T ) kT
(V VS ( atT1 ) )
nv ( eq ,T2 ) kT
(V VS ( atT2 ) )
3166
n p(atm)
16.01
T
A TS irr
(G2 G1 ) ( H 2 H1 ) (T2 S 2 T1S1 ) (U 2 U1 ) ( P2V2 P1V1 ) (T2 S 2 T1 S1 )
(U 2 U1 ) q w
(G2 G1 ) q w ( P2V2 P1V1 ) (T2 S 2 T1S1 )
(G2 G1 ) q w P(V2 V1 ) T (S 2 S1 )
w w P(V2 V1 )
'
(G2 G1 ) q w T ( S 2 S1 )
'
q T (S 2 S1 )
w (G2 G1 )
'
w (G 2 G1 ) TS irr 0
'
dG 0
H U PV ~ dH TdS VdP
A U TS ~ dA SdT PdV
G H TS ~ dG SdT VdP
KİMYASAL REAKSİYONLARIN ENERJİ
DÖNÜŞÜMÜNE ETKİSİ
dG
dG
dG
dG
dG
dT
dP
dni
dn j etc.
dT P ,ni ,n j
dP T ,ni ,n j
dni T , P ,n j ,nk
dn j T , P ,ni ,nk
dG SdT VdP
dG
S
dT P , ni , n j
dG
V
dP P , ni , n j
dG
dG SdT VdP
dni
i 1 dni T , P , n
j
i k
dG
dni
i 1 dni T , P , n
j
i k
dG
dni T , P ,n j
k
dG SdT VdP i dni
1
dU
dU TdS PdV
1 dni
k
dni
S ,V ,n j
dH
dH TdS VdP
dni
1 dni S , P , n
j
k
dA
dA SdT PdV
dni
1 dni T ,V , n
j
k
dG
dU
dH
dA
i
dni T , P ,n j
dni S ,V ,n j dni S , P ,n j dni T ,V ,n j
dU TdS PdV i dni
dU TdS PdV i dni
dH TdS VdP i dni
dA SdT PdV i dni
dG SdT VdP i dni
dU q w
q TdS
w PdV i dni
dS
dP
dV T dT V
dS
dV
dP T
dT P
S S (T ,V )
dS
dS
dS
dT
dV
dT V
dV T
TdS qv dU ncv dT
dS
nCv / T
dT V
ncv
dP
dT
dV
T
dT
V
nR
dP
V
dT V
ncv
nR
dS
dT
dV
T
V
T2
V2
S 2 S1 ncv ln
nR
ln
T
V
1
1
dS
dU TdS PdV
dU
dV
dU
dV
dS
T
P
T
dV T
dP
T
P
T
dT V
dH
dP
dH
dP
dS
T
V
T
dP T
dV
V
T
dP T
x x( y, z )
dx
dx
dx dy dz
dz y
dy z
dU
dH
T
dS V ,comp dS P ;comp
dU
dA
P
dV S ,comp
dV T ,comp
dH
dG
V
dP S ,comp dP T ,comp
dA
dG
S
dT V ,comp
dT P ,comp
Z Z ( x, y )
dZ
dZ
dxi
dZ
dx
dy
dy x
y
dZ Ldx Mdy
d dZ
dL
dy dx y x dy x
d dZ
dM
dx dy x y dx y
d dZ
d dZ
d 2Z
dy dx y x dx dy x y dxdy
dL
dM
dy x dx y
dT
dP
dV S
dS V
dT
dV
dP S
dS P
dS
dP
dV T
dT V
dS
dV
dP T
dT P
S S (T , V )
dS
dS
dT
TdS q v
dS
dT
dV
V
dV T
dU nc v dT
nc v
dS
T
dT V
S S (T , V )
dS
dS
dS
dT
dV
dT V
dV T
TdS q v dU ncv dT
ncv
dS
T
dT V
ncv
dP
dS
dT
dV
T
dT V
nR
dP
V
dT V
ncv
nR
dS
dT
dV
T
V
dx
dx
dy dy dz dz
y
z
dx dy
dx
dy dz dz
x
y
z
dx dy dz
dy dz dx 1
x
y
z
G H TS
dG
S
dT P
dG
S
dT P
dG
G H T
dT
GdT HdT TdG
TdG GdT
HdT
2
2
T
T
d (G / T )
H
2
dT
T
d ( G / T )
H
2
dT
T
A U TS
dA
U T
dT V
d(A/T)
U
2
dT
T
d ( A / T )
U
2
dT
T
KISMİ MOLAR TERMODİNAMİK BÜYÜKLÜKLER
Kısmi molar değeri, molar değerin sabit sıcaklık ve sabit
basınçta kütleye (mol sayısına) göre kısmi türevidir. Başka bir
şekilde, bu değerin sabit sıcaklık ve basınçta eklenen bileşen
kütlesiyle değişiminin ölçüsüdür. Bu tanım genelde çözelti
çalışmalarında kullanılır. Kolay ölçülebilen değerin
gösteriminde “a” malzemesinin kısmi molar hacmi çözelti
V
içinde gösterilir.
V (
)
a
na
T , P , ni , nj..
Va (
V
) T , P ,ni,nj..
na
Kısmi molar hacm “V”, ‘a’ malzemesi kütlesi grafiğinin
eğimidir. Burada kısmi molar hacmini ‘a’ malzemesinin
molar hacmi olarak düşünebiliriz çünkü bu değer çözeltinin
hacminin ‘a’ malzemesi eklenmesiyle artımının değeridir.
V
eğim=(V/na)T,p,ni,nj
Sabit sıcaklık ve basın
Şekil .2 (a) çözeltiye eklenen mol miktarının fonksiyonu olarak çözelti hacmi
V
Sabit sıcaklık ve basınç
na
Şekil .2 (b) Saf “ a “ nın içinde na nın fonksiyonu olarak “a” nın hacmi
DENGE
İki durum arasında sistemi değiştirecek tersinir bir iş yoksa, bu iki
durum dengededir. Eğer Wçevre 12 =0 ise bu iki durum dengededir.
Eğer iki durum arasında kinetik ve potansiyel enerji farklılıkları
yoksa: Wçevre = G2 - G1 olup, “i” iki durum içinde de sabit basınç
altında bulunuyorsa, Gi,1 = Gi,2 veya i,1 = i,2 şeklindedir.
Sabit basınç altındaki kapalı bir sistemde ise: (G/ni) =(G/ni)
T,V,njni,durum1 ve T,V,njni,durum2 veya i,1 = i,2 şeklindedir.
Saf madde içindeki birinci sıra geçişi (G’den türemiş olanlardan
birinin devamsız olması halinde), basınç ve sıcaklık çizgilerinin eğimi 2
faz (Clapeyron denklemi) arasında şu şekildedir:
(dP/dT) = (1/∆V).(∆H/T)
∆V geçiş içindeki molar hacim değişimi, ∆H ise geçiş içindeki molar
entalpi değişimidir. Yoğunlaşmış fazın buharlaşması ideal gaza göre
şöyledir: d(lnP) = (∆H/RT2)dT veya lnP= - ∆H/RT2 +Sabit .
MADDENİN GENLEŞMESİ
Maddenin hacimsel ısıl genleşme katsayısı, v
aşağıdaki gibi tanımlanabilir:
v (1/V).(V/T) P
Maddenin izotermal sıkışırlığı, T:
T - (1/V).(V/P) T
ÖLÇÜLEBİLİR ÖZELLİK İLİŞKİLERİ
Sistemin ölçülebilir özellikleri açısından kesin kısmi türevleri
tanımlayan genel formüller için de kısmi türevlerin gelişmesi
yardımcı olur. Örnek olarak aşağıdaki şekilde belirleyebiliriz.
Hacimsel termal genleşmenin katsayısı
1 V
V T P
İzotermal sıkıştırılabilirlik, K
1 V
V P T
İZOTERM BASINÇ – SICAKLIK (ENTROPİ EŞİTLİĞİ)
Kapalı sistemdeki adyabatik ve tersinir değişim için basınç sıcaklık
bağıntısı açıklanmıştı. Aynı eşitlik bu bölümdeki metodları kullanarak
elde edilebilir. Adyabatik ve tersinir işlemde, kapalı sistemde T nin ve
P nin değişimini sabit entropide veren matematiksel tanım (T/P)S
dir.
(T/P)S = - T/ CP (S/ P)T
-(S/P)T = (V/T)P , olduğundan
(T/P)S = + T/CP(V/T)P
İdeal gaz için (PV=RT) , (V/T)P = R/P
(T/P)S = (T/CP)(R/P)
1 ve durumları için integre edersek , Cp yi sabit kabul ederek:
T2/T1 = (P2/P1)R/Cp
.
Basınç değişikliği ile ilişkili olarak sıcaklıktaki değişim
oldukça önemlidir. Örnek olarak bir iki atomlu ideal gazı 1
atmosferden 10 atmosfere sıkıştıracak olursak sıcaklık
değişimi:
T2/T1 =(10/1) 0,082 /3,5 = 1.93
273 Kelvin deki ve 1 atmosfer basınçlı bir gaz izoterm bir
sıkıştırma sonucu 10 atmosferde 527 K sıcaklığa ulaşacaktır.
Bu değişim katıda daha uygun bir değişimdir.
KATILARIN İZOTERM SIKIŞTIRILMASI
Katıların izoterm sıkıştırılmasını , adyabatik ve tersinir
basınç veya gerilim değişiminden dolayı, katı sıcaklığındaki
değişimi hesaplama amacıyla bütün hallerde (katı – gaz –
sıvı) için;
(T/P)S = T/CP(V/T)
Katı durumda (V/T)P tanımı hacimsel ısıl katsayı V ile
ifade edilir. İzoterm katılar için V lineer ısıl katsayı I nın üç
katı olacaktır.
(T/P)S = TVV/CP = TV3/CP
Sabit entropide
dT/T = 3V/CP dP
, V ve CP nin basınçtan bağımsız olduğunu varsayarak
integralini alırsak;
ln T2/T1 = 3V / CP (P2 - P1)
Bakırın basıncının 1 atmosferden 10 atmosfere değişiminde:
ln T2/T1 = 3(7,09. 10-9)(16,7.10-6) / 30 . 9(1,013.105)
X çok küçük olduğunda ln(1+X) =X olduğunu kabul ederek,
T/T = 10.76 . 10-6 , 300K de T = 3.23X10-3 K dir.
Gazların aksine adyabatik ve tersinir sıkıştırmada katıların
sıcaklığı basınçtan bağımsızdır.
TERMOELASTİK ETKİ
Adyabatik durumda tersinir (elastik) deformasyona dayalı
katıdaki sıcaklık değişimine termoelastik etki denir. Üç
eksenli gerilme hali düşünüldüğünde her eksende eşit
gerilim vardır denir. Kuvvet tek yönde uygulandığında ,
termoelastik etki çok eksenli gerilim altında da
araştırılabilir. Çok eksenli durumda termoelastik etki
ölçümü çok ilginçtir, çünkü sıcaklık değişim yönü (pozitif
veya negatif) bütün katılar için aynı değildir. Genleşmiş
kauçuk örnek olarak alınırsa sıcaklık değişim yönü
metallerden farklıdır. Termoelastikliğin geldiği yeri görmek
için esas özellik bağıntısını çok eksenli kuvvetler ve
uzunluk değişimi için terimler ekleyerek kullanabiliriz.
dU = TdS – PdV + fdl
Burada f çok eksenli kuvveti , dl ise lineer boyuttaki değişimi
gösterir . PdV ve fdl terimlerinin işaretleri değişiktir çünkü
basınç sıkıştırıcı olduğu durumda pozitiftir buna karşın fdl
terimi çok eksenli kuvvet katıya uygulandığı zaman ve
gerilim olduğu zaman pozitif olur.
Böylece G fonksiyonu şöyle tanımlanır:
G = -SdT +PV - TS
ve dG tanımı;
dU = -SdT + PdV + fdl
Eksen kuvveti fl uzunluğunda kesit alanı F olan silindire
uygulanırsa sıcaklık değişimi şu şekilde tanımlanabilir. Eğer
deformasyonun sabit hacimde olduğunu düşünürsek P-V
terimleri ortadan kalkıp tanım şu şekle gelebilir.
(T/f) = - T (S/f )T / nCf
burda n gergin mol sayısı , Cf ise sabit kuvvetteki ısı
kapasitesidir. Çapraz diferansiyel sabit hacimde uygulanırsa :
(S/l)T = (f /T)l
Zincir kuralını uygularsak elde edeceğimiz bağıntı:
(S/f)T (f/l)T = + (l/T)f (f/l)
değerlerinde gerekli değişiklikleri yaparsak ;
(T/f)S = - Tll / nCf
Katı deformasyonu için uygulanan kuvvetleri incelerken birim
alandaki kuvvet terimini kullanmak daha yararlıdır.
= f /F
f = a
(f/) = F
Eşitliuin her tarafını çarparsak bize şu eşitliği verir:
(T/f)S (f/)A = - TFl / nCf = - TVl /nCf
burada F ve I nın sonucu hacim ve V/n nin sonucu molar
hacimdir. Cf terimi burda yerimi C terimine bırakır.
(T/)S= - TVl /CP
sıcaklıktaki değişimin (T) çok az olduğunu kabul edersek,
T = - (TV / C )
Demirin gerilme durumundaki değişime , 10000 psi yada
6,9.107 N/m2 basınçta bakalım:
molekül ağırlığı = 55,85 g/mol
yoğunluk
= 7.87 g/cm3
V = 7,10 cm3/mol = 7,10.10-6 m3/mol
I
= 11,8 .
CP
= 25,1 J/molK
Sıcaklık
= 300K
T
= - 0.07K
iki karşılaştırmaya ulaşılabilir.
Birincisi, demir gibi bir metal adyabatik ve tersinir gerilimde
bulunduğunda oluşan sıcaklık değişimi negatiftir. İkincisi,
gerilimdeki adyabatik ve tersinir değişimin oluşturduğu
sıcaklık değişimi metallerde azdır. Elastik malzemeler için
gerilimle sıcaklık değişimi metallerdeki değişimden farklıdır.
Kauçuk için sıcaklık değişimine bağlı genleşme başta
bir düşüş gösterir sonra epeyce yükselir.
Bu fiziksel olay sonuca aykırılık göstermez.
Bunu şöyle açıklayabiliriz; kauçuğun ısıl genleşme
katsayısı genleşme durumu olduğunda negatif olur.
Metallerin tersinir genleşmeleri %1 in altındadır.
Kauçuk ise çok büyük yüzdelerde tersinir genleşebilir.
Genleşme durumunda (%20-30 gibi), kauçuk ısıtıldığı
zaman büzüşecektir.
Negatif ısıl genleşme katsayısı artan gerilimle pozitif
ısı değişimi değeri gösterecektir.
Elastomerlerde ısı değişimi büyük , tersinir ve
adyabatik (100%) genleşmelere neden olur.
SIKIŞTIRILABİLİRLİK
Termodinamik eşitliklerde az da olsa kullanılan katıların
fiziksel özelliklerinden biri izotermik sıkıştırmadır. Yani
hacmin basınçla sabit sıcaklıkta değişimi ölçüsüdür. Şöyle
tanımlanır:
T = -1/V (V/P)T
Şekil.3 : Elastik Şekil Değiştirme
Katılar ,metal ve seramik gibi, elastik gerilmeye uğradıklarında
genleşme değişimi şekil.3 deki gibi lineer olur. Gerilimin ,,
genleşmeye oranı elastiklik modülü E , bazen de Young modülü
olarak tanımlanır.
E = /
Uygulanan kuvvetin yönünde oluşan eksenel
değişmeye ek olarak , katılar uygulanan kuvvete dik
yönde eksen değiştirirler. Örnek olarak bir katıya x
yönünde gerilim uygulanıyorsa katı x yönünde
genleşip y ve z yönünde kısalır. Değişimdeki bu oran
Poisson oranı olarak adlandırılır. X yönünde bir
gerilim x uygulandığında , x yönündeki genleşme x
= x /E olacaktır. Y yönündeki eksenel değişim ise y
= -x /E olur.
Eğer x = y = z ise buna gerilim basıncı denir,
basınçta ve gerilimde kabul edilen işaretler farklıdır.
Sıkıştırılmış durumda basınç pozitif fakat ters olarak
gerilim ise gerilim halinde pozitif değer alır.
P = - X
ayrıca
X + Y + Z = 3 l/l = V/V
Bunun yanında;
T = - 1/V (V/P)T = 3(1-2)/E
Buradan izotermal sıkıştırabilirlik çok kolay biçimde
ölçülebilen fiziksel özellikler olarak E ve den
hesaplanabilir. Örnek olarak demirin sıkıştırılabilirliği:
T= 3(1-2[0,3]) / 196.109
T = 1,2 . 10-9 atm
MANYETİK ETKİ
Mekanik bir işin (P-V veya f-l ) yapıldığını ve malzemenin
manyetik alan içinde olduğunu düşünelim. Burada yapılan iş
malzemenin manyetik akısına göre değişim gösterecektir. W
= + H dB dV
B =manyetik indüksiyon, H=manyetik alan ve V= hacim dir.
Yaptığımız analiz için manyetik alandaki malzemenin
izotropik olduğunu düşünelim. Böylece bütün vektörel ürünler
ve vektör işaretleri ortadan kalkacaktır. Isı akışı olmadığını
varsayarsak:
dU = W + VHdB
Manyetik indüksiyon tanımından;
B = 0 (H+M)
Burada 0 =boş alanın geçirgenliği, M= hacim başına
manyetik moment terimleri eşitlersek;
dU’ = 0VHdH +0VHdM
Molar bazda;
dU’ = 0VHdH +0VHdM
dU’ eşitliğinin ilk terimi manyetik alan şiddetini vakumlu
ortamda değiştirmek için gerekli enerjidir. İkinci terim ise
malzemenin manyetikliğini değiştirmek için gerekli enerjidir.
Çünkü biz malzemenin termodinamiği ile ilgileniyoruz. dU’
yu şöyle tanımlaya biliriz
dU’ =0VHdM
dU’ =TdS + 0VHdM + Vd
Entalpi tanımı da manyetik ve mekanik etki altında şöyle tanımlanabilir;
H’= U’ - 0VHdM + Vd
buradan
dH’ =TdS - 0VMdH – Vd
Maxwell eşitliğinin sıcaklık , basınç ve hacim dışında
kullanımına bir örnek olabilir. Örneğin manyetostriktiflik
numune boyutu üzerinde manyetik alan değişiminin etkisidir.
Maxwell bağıntısını son iki terimine uygularsak
(V/H)S, = 0(M/)S,H
V nin işlemde değişmez olduğunu kabul edersek
( / h) S, = 0(M/)S,H
Manyetostriktif büzülme :
= ( / h) S, Dh
Manyetikliğin manyetik alana bölümü bize etkilenirliği
verir:
= M/H
değişimleri yaparsak ;
d = 0 (/)H,S H dH
/ oranının sabit olduğunu düşünürsek
= (/) H2 / 2
Bu manyetik etki malzemenin manyetik ve elastik özellikleri
arasındaki ilişkiyi, malzemenin boyunun manyetik alan etkisi
ile değişimini açıklar. Buradaki bağıntılar ferromanyetik
malzemeler için doğrudur (mıknatıslık doygunluğunun
altındaki çok küçük H değerlerinde). Bir malzeme mıknatıslık
doygunluğuna ulaştığında bütün özellikleri hızalanır. Bu
değerin altında manyetik alan değişimi etkisi çok düşüktür.
Manyetik alan değişiminin başka bir etkisi malzemenin
sıcaklığının değişen manyetik alanla değişmesidir. Bu genelde
çok düşük sıcaklıklarda kullanılır. Fiziksel olarak bu manyetik
mıknatıslanmama olarak adlandırılır ve paramanyetik
bileşenler seçilerek, mutlak sıfıra ulaşmakta kullanılır.
Adyabatik mıknatıslanmama tekniği ile malzeme sıvı helyum
banyosuna konarak çok düşük sıcaklıklarda soğutulabilir.
Daha sonra numune yüksek manyetik alana konarak
sıcaklığını sabit tutan termal enerji dağıtılır.
Manyetik alan adyabatik ortamda kaldırılırsa numune helyum
banyosunda olduğundan çok daha düşük sıcaklıklara soğur. Bu
işlemi termodinamik terimlerle incelemek için numunenin
entropisini sıcaklığın ve manyetik alanın fonksiyonu olarak
gösteririz.
S = S(T , H)
dS = (S/T)H dT + (S/H)T dH
Bu eşitliğin ilk terimi sabit manyetik alandaki ısı kapasitesiyle
ilişkilidir.
;
dG = -SdT - 0VMdH
(S/H)T = 0V(M/T)H
Buradan
dS = CH /T dT + 0V (M/T)H
Curie Kanunu’nu takip eden paramanyetik tuz için =k/T (k sabittir)
M = kH/T
(M/T)H = - kH/T2
Eşitlik şu hale gelir;
dS = CH/T dT - 0Vk / T2
dQ değerinde ısı eklendiğinde veya çıkarıldığında tersinir
işlemde bunun TdS olduğunu hatırlayalım ve bunu eşitliği
şu şekilde de gösterelim.
TdS = CHdT - 0Vk / THdH
Adyabatik mıknatıslanmamada ilk adım manyetik alanı
sıfırdan H değerine sabit sıcaklıkta (T1) çıkartmaktır. Termal
enerji, sıcaklık entropi değişimiyle çarpılırken kaldırılır.
Q = T1 (S1 – S0) = (- 0Vk / T1)(H2/2)
Adyabatik mıknatıslanmamanın ikinci adımı, malzeme termal
olarak yalıtılır ve manyetik alan sıfıra getirilir. Sıfırda entropi
değişimi sıfırdır, çünkü ısı transferi olmamıştır ve değişim
tersinirdir.
CHdT = 0Vk/T HdH
CHTdT = 0Vk HdH
CHTdT = 0Vk H2/2
Eşitlikğin sol tarafı integre edilmez çünkü CH kuvvetli bir
fonksiyondur. Bu teknik kullanılarak 10-5 Kelvin değerlerine
ulaşılabilir