9.11.2015
Atom
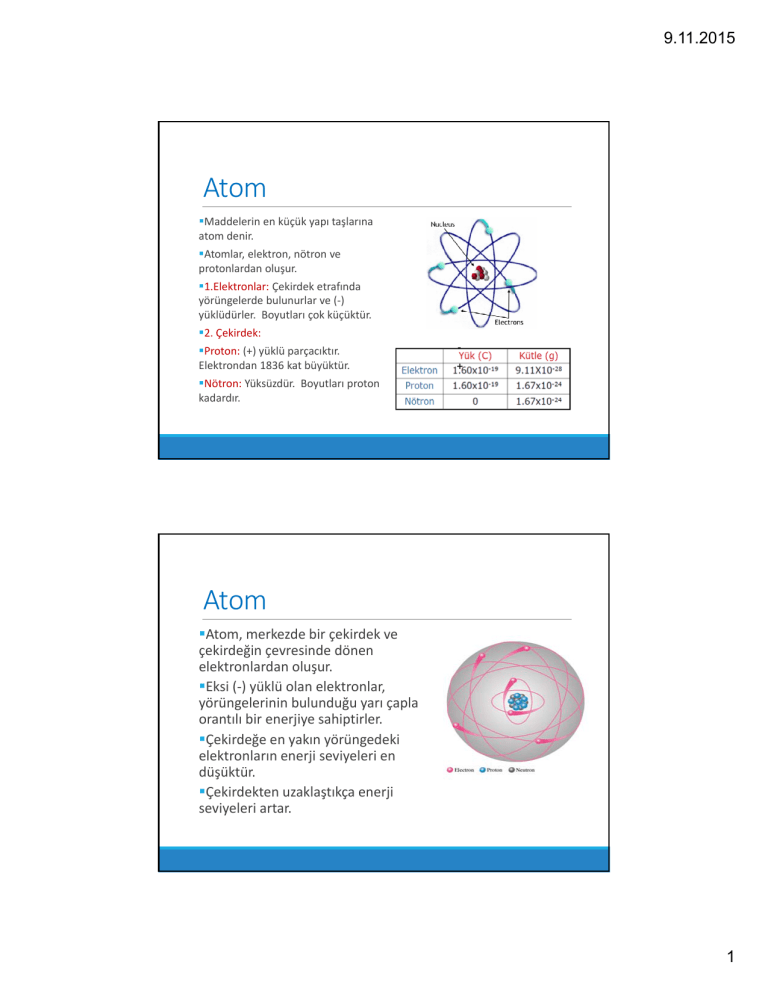
Maddelerin en küçük yapı taşlarına atom denir. Atomlar, elektron, nötron ve protonlardan oluşur. 1.Elektronlar: Çekirdek etrafında yörüngelerde bulunurlar ve (‐) yüklüdürler. Boyutları çok küçüktür.
2. Çekirdek:
Proton: (+) yüklü parçacıktır. Elektrondan 1836 kat büyüktür. +
Nötron: Yüksüzdür. Boyutları proton kadardır. Atom
Atom, merkezde bir çekirdek ve çekirdeğin çevresinde dönen elektronlardan oluşur. Eksi (‐) yüklü olan elektronlar, yörüngelerinin bulunduğu yarı çapla orantılı bir enerjiye sahiptirler.
Çekirdeğe en yakın yörüngedeki elektronların enerji seviyeleri en düşüktür. Çekirdekten uzaklaştıkça enerji seviyeleri artar.
1
9.11.2015
Atom
Nötronların elektriksel ve kimyasal etkileşimlerde işlevi yoktur.
Atomdaki elektronlar K, L, M, N, O, P, Q kabuklarında dağılmıştırlar. Sırasıyla en içteki
kabukta en fazla 2, ikinci kabukta en fazla 8, üçüncü kabukta en fazla 18, dördüncü kabukta
en fazla 32 elektron bulunur. Örneğin, elektrik iletiminde sıklıkla kullanılan 29 elektrona
sahip bakır atomun 29. elektron tek başına dönmektedir.
29 elektronlu Cu
11 elektronlu Na
Atom
Elektronlar, bulundukları yörüngeye göre belirli bir enerji düzeyine sahiptirler.
Elektronlara sahip olduğu enerjinin üzerinde bir enerji uygulanırsa, elektron bir üst yörüngeye geçer.
Bir maddenin elektriksel olaylarının oluştuğu son kabukta bulunan elektronlarına valans elektronları denir.
Valans elektronu uygulanan bir enerji ile serbest hale geçerek atomu terk eder ve söz konusu madde iletken olur.
29 elektronlu Cu
2
9.11.2015
Enerji‐Band Diyagramları
Bilindiği gibi elektronlar, atom çekirdeği etrafında belirli yörüngeler boyunca sürekli dönmektedir. Bu hareket, dünyanın güneş etrafında dönüşüne benzetilir.
Hareket halindeki elektron, iki kuvvetin etkisi ile yörüngesinde kalmaktadır:
1. Çekirdeğin çekme kuvveti
2. Dönme hareketi ile oluşan merkezkaç kuvveti
Enerji‐Band Diyagramları
Hareket halinde olması nedeniyle her yörünge üzerindeki elektronlar belirli bir enerjiye sahiptir.
Eğer herhangi bir yolla elektronlara, sahip olduğu enerjinin üzerinde bir enerji uygulanırsa, elektron bir üst yörüngeye geçer.
Valans elektrona uygulanan enerji ile de elektron atomu terk eder.
Valans elektronun serbest hale geçmesi, o maddenin iletkenlik kazanması demektir.
3
9.11.2015
Enerji‐Band Diyagramları
Valans elektronlarına enerji veren etkenler:
1) Elektriksel etki
2) Isı etkisi
3) Işık etkisi
4) Elektronlar kanalıyla yapılan bombardıman etkisi
5) Manyetik etki
Ancak, valans elektronları serbest hale geçirecek enerji seviyeleri madde yapısına göre şöyle değişmektedir:
İletkenler için düşük seviyeli bir enerji yeterlidir.
Yarı iletkenlerde oldukça fazla enerji gereklidir.
Yalıtkanlar için çok büyük enerji verilmelidir.
Enerji‐Band Diyagramları
a) Yalıtkan
b) Yarıiletken
c) İletken
Bant-enerji diyagramları
4
9.11.2015
Elektrik Yükü
Atomdaki proton ve elektron sayıları eşit olduğundan , atomun tümü elektriksel olarak nötrdür.
Nötr: proton sayısı = elektron sayısı
İyon: proton sayısı ≠ elektron sayısı
+ yüklü iyon: Dış etkilerle atomun son yörüngesinde bulunan elektronun biri alınırsa elektriksel denge bozularak atom, artı yüklü iyon durumuna geçer. ‐ yüklü iyon: Dengedeki bir atomun son yörüngesine bir elektron girecek olursa atom eksi yüklü iyon durumuna geçer.
Elektrik Yükü
5
9.11.2015
Elektrik Yükü
Elektrik Yükü
6
9.11.2015
Elektrik Yükü
Atomlar Arası Bağlar
Madde içerisindeki atomlar kimyasal bağlar sayesinde bir arada tutularak düzenli bir geometri oluştururlar. Sertlik, elektriksel, ısısal, iletkenlik, v.b. özellikler kimyasal bağlara göre şekillenmektedir.
7
9.11.2015
Atomlar Arası Bağlar
Atomlar Arası Bağlar
Metaller ile ametaller arasında metallerin elektron vermesi ametallerin elektron almasıyla oluşan bağlardır.
Metaller elektron vererek (+) değerlik, ametaller elektron alarak (–) değerlik alırlar. Bu şekilde oluşan (+) ve (–) yükler birbirini büyük bir kuvvetle çekerler. Bu çekim iyonik bağın oluşumuna sebep olur. Onun için iyonik bağlı bileşikleri ayrıştırmak zordur.
8
9.11.2015
Atomlar Arası Bağlar
Atomlar Arası Bağlar
Elektron aktarımıyla oluşan bileşiklerde, kaybedilen ve kazanılan elektron sayıları eşit olmalıdır.
İyonik katılar belirli bir kristal yapı oluştururlar.
İyonik bağlı bileşikler oda sıcaklığında katı halde bulunurlar.
İyonik bileşikler katı halde elektriği iletmez. Sıvı halde ve çözeltileri elektriği iletir.
9
9.11.2015
Atomlar Arası Bağlar
İki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Atomlar Arası Bağlar
Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (‐) yüklü bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır.
Kovalent bağ, söz konusu atomların dış yörüngelerinin dolması ile meydana gelir.
10
9.11.2015
Atomlar Arası Bağlar
Atomlar Arası Bağlar
11
9.11.2015
Atomlar Arası Bağlar
Örnek: Na, Cu gibi metaller metalik bağlar oluștururlar.
Atomlar Arası Bağlar
Metalik bağ iyi elektrik
iletkenliği sağlar. Uygulanan
bir voltaj (gerilim) etkisi
altında, valans elektronları
hareket eder, devre
tamamlanırsa akıma neden
olur.
12
9.11.2015
Atomlar Arası Bağlar
Atomlar Arası Bağlar
13
9.11.2015
Atomlar Arası Bağlar
Atomlar Arası Bağlar
14
9.11.2015
Atomların Yapı Türleri ve Bohr
Atom Modeli 1. Atomik Yapı Türleri
Kristal (Metalik) Yapı
Amorf Yapı
Bileşik Yapı
Kolloidal Yapı
Seramik Yapı
2. Bohr Atom Modeli
Atomların Yapı Türleri
15
9.11.2015
Atomların Yapı Türleri
Atomların Yapı Türleri
Amorf cisimlerde moleküllerin birbirlerine göre konumları sabit olmakla birlikte geometrik yapıları herhangi bir matematik kuralı ile açıklanamaz. Amorf katılar farklı doğrultu ve yönlerde, ayrıca farklı uzaklıklarda bulunan atomlardan oluşmuştur.
Gazlar, sıvılar, camlar ve plastiklerin büyük bir çoğunluğu amorf yapıya sahiptir.
16
9.11.2015
Atomların Yapı Türleri
Atomların Yapı Türleri
17
9.11.2015
Atomların Yapı Türleri
Atomların Yapı Türleri
18
9.11.2015
Atomların Yapı Türleri
Atomların Yapı Türleri
19
9.11.2015
Atomların Yapı Türleri
Atomların Yapı Türleri
20
9.11.2015
Atomların Yapı Türleri
Katların Fiziksel Yapıları
Kristallerde ise moleküller arası uzaklıklar ve uzaklıkları belirten açıların katı madde içinde sabit olduğu görülür.
X ışınları ve başka yöntemler kullanılarak yapılan araştırmalar, metallerin ve yarıiletkenlerin pek çoğunun kristal yapılı oldukları gözlenmiştir.
21
9.11.2015
Kristal Yapılar
Kristal yapılar da kendi içerisinde birçok farklı şekilde bulunurlar. Bunlardan bazıları:
Basit Kübik Kristaller (BKK) (Simple Cubic Cyrstals): Her bir köşesinde bir atom bulunduran kübik yapıdır. “a”
ile gösterilen boyut kafes sabitini (lattice constant) tanımlar. Bu yapılara örnek olarak Polonium gösterilebilir.
Kristal Yapılar
Gövde Merkezli Kübik Krsitaller (GMK) (Body‐
Centered Cubic Cyrstals):
Bir GMK kristali, köşe atomlarına ek olarak, kübik yapının ortasında da bir atom bulunduran kristal yapısıdır. Bu özelliği gösteren yapılara örnek olarak Sodyum, Molybdenum, Tungsten gösterilebilir.
22
9.11.2015
Kristal Yapılar
Yüzey Merkezli Kübik Kristal Yapılar (YMK) (Face‐Centered
Cubic Cyrstals): 8 köşe atomuna ek olarak 6 adet yüzey atomu da bulunduran yapıdır. Bir çok element bu kristal formda bulunur. Alüminyum, Bakır, Altın, Gümüş, Nikel, Platinyum
v.b.
Kristal Yapılar
Elmas Yapı (Diamond Structure): Silikon ve
Germanyum gibi yarı iletken yapılarda
görülür. İki YMK’nın birbirine geçmesiyle
oluşur.
23
9.11.2015
Kristal Yapılar
Çinko Sülfür Yapısı (Zinc Blende Structure):
Bir başka yarıiletken yapı olan GaAs (Galyum Arsenide) bu özelliği gösterir. Ayrıca GalyumFosfat, ÇinkoSülfat ve KadmiyumSülfat da bu yapıdadır.
Bohr Atom Modeli
1913 yılında Neils Bohr, hidrojen atomunun spektrum çizgilerini ve Planck'ın kuantum kuramını kullanarak Bohr kuramını ileri sürdü.
Pozitif yüklü bir çekirdek ve negatif yüklü elektronlardan oluşan en basit atom modelinde, elektronların toplam yükünün çekirdek yüküne denk olduğu kabul edilirse, atom elektriksel olarak nötr durumda olduğu düşünülebilir.
Bohr atom modeline göre
hidrojen atomu.
24
9.11.2015
Bohr Atom Modeli
Örneğin her bir atomunda tek bir elektron bulunduran hidrojene bir bakalım. Şekilden de görülebileceği üzere çekirdek ve elektron arasında iki kuvvet meydana gelmektedir.
1. Çekim kuvveti
2. Merkezkaç kuvveti
Bohr atom modeline göre
hidrojen atomu.
Bohr Atom Modeli
Bu kuvvetlerden ilki Coulomb’un ortaya koyduğu çekim kuvvetidir. Coulomb Yasası: Elektrik yüklü iki parçacık arasındaki kuvvetin büyüklüğü, yüklerin çarpımı ile doğru, yüklerin arasındaki uzaklığın karesiyle ters orantılıdır şeklinde ifade edilir.
Burada q = elektronik yük;
= boşluğun geçirgenlik katsayısını
r = Yüklü parçacıkların arasındaki uzaklığı göstermektedir.
25
9.11.2015
Bohr Atom Modeli
Sabit bir yörünge bu kuvvetlerin birbirlerini dengelemeleri sonucu ortaya çıkar.
Elektronun potansiyel enerjisi:
Elektronun kinetik enerjisi:
Elektronun toplam enerjisi:
Bohr Atom Modeli
Elektronun çekirdeğe ne kadar yakınlaşırsa üzerindeki enerji miktarının o kadar azalır.
Çekirdeğe en yakın elektron kararlıdır, ışık yaymaz. 26
9.11.2015
Bohr Atom Modeli
Bir elektron yüksek enerji düzeyinden daha düşük enerji düzeyine geçtiğinde, seviyeler arasındaki enerji farkına eşit bir ışık yayınlar. Burada bağıntısı geçerlidir. h= Planck sabiti, v= yayımlanan enerjinin frekansı, hv= foton enerjisi ifade eder. Bohr Atom Modeli
Elektron'a yeterli enerji verilirse elektron bulunduğu enerji seviyesinden daha yüksek enerji seviyesine sıçrar. Atom bu durumda kararsızdır. Kararlı hale gelmek için elektron tekrar eski enerji seviyesine dönerken almış olduğu enerji seviyesini eşit enerjide bir Foton (ışın taneciği) fırlatır. Atom bu şekilde ışıma yapar.
27
9.11.2015
Bohr Atom Modeli
Bohr’a göre sabit bir yörünge, elektronun açısal momentumunun durumuna göre belirlenebilir.
Burada n sabit bir sayıyı ifade eder ve ≥1’dir. Elektronun toplam enerjisinin r ve v’den sadeleştirilmiş hali:
Böylece açısal momentum ayrık enerji seviyeleri oluşturmaktadır. Farklı enerji seviyeleri arasındaki geçişler sırasında yayımlanan foton frekansları böylece belirlenebilmektedir.
Bohr Atom Modeli
Bohr varsayımları (postulatları) şöyle özetlenebilir:
1.
Bir atomdaki elektronlar çekirdekten belli uzaklıktaki yörüngelerde hareket eder ve bu yörüngelerdeki açısal momentumu h/2π'nin
tam katlarıdır. Her kararlı hâlin sabit bir enerjisi vardır.
2.
Her hangi bir kararlı enerji seviyesinde elektron dairesel bir yörüngede (orbitalde) hareket eder. Bu yörüngelere enerji düzeyleri veya kabukları denir.
28
9.11.2015
Bohr Atom Modeli
Bohr varsayımları (postulatları) şöyle özetlenebilir:
3.Elektron kararlı hâllerden birinde bulunurken atom ışık (radyasyon) yayınlamaz. 4.Elektron hareketinin mümkün olduğu kararlı seviyeler, K, L, M, N, O gibi harflerle veya en düşük enerji düzeyi 1 olmak üzere, her enerji düzeyi + bir tam sayı ile belirlenir ve genel olarak "n" ile gösterilir, (n: 1,2,3 ...¥)
Bugünkü bilgilerimize göre; Bohr kuramının, elektronların dairesel yörüngelerde hareket ettikleri ifadesi yanlıştır.
29