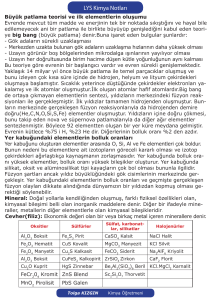
Periyodik Cetvel
Atomun yapısı hakkında bilgilerin artması, elementlerin bazı özelliklerinin periyodik (devirli) oluşu,
elementleri bir tablo altında toplama fikrini oluşturmuştur.
1869 yılında Dimitry Mendeleyev ve Mayer elementlerin atom ağırlıklarına göre tablo yapmışlar fakat sonraki
yıllarda, periyodik özelliklerin atom ağırlığına değil, atom numarasının artışına göre olduğu saptanarak bugünkü
periyodik tablo düzenlenmiştir.
Elementler, atom numaralarına göre değişirken, periyodik olarak özelliklerin değiştiği ve benzer özelliklerine
sahip elementlerin alt alta düştüğü gözlenir.
Periyodik cetveldeki yatay sıralara periyot, düşey sıralara grup denir. Bugün için mevcut bulunan elementlerin
oluşturduğu cetvelde 7 periyot ile, 8 sıralı A grupları ve 2A ile 3A arasında 10 sıradan oluşan 8 tane B grubu
bulunmaktadır. Ayrıca cetvelin altında 6. ve 7. periyotların devamı olan Lantanid ve Aktinidler sırası ilave
edilmiştir.
1 A Grubu:
Alkali metaller grubu denir.
Hidrojen hariç hepsi de metaldir.
Kararlı bileşiklerinde +1 değerlikli olurlar.
Soygazlardan sonra gelen gruptur.
2 A Grubu:
Toprak alkali metaller grubu denir.
Kararlı bileşiklerinde +2 değerlikli olurlar.
Elektron dizilişleri ns2 ile biter.
B Grupları:
10 sıradan oluşan 8 tane B grubu bulunur.
Geçiş metalleri gruplarıdır.
Değerlik elektronları s ve d orbitallerinde bulunur.
d orbitallerinin doluş sırasına göre, 3B grubundan başlar, 2B grubunda biter
3 A Grubu:
P orbitallerinin dolmaya başladığı ilk gruptur. Bu gruptan sonra 8A grubuna kadar ametalik özellikler
gözlenir.13Al amfoter özellik gösterir.
7 A Grubu:
Halojenler grubu denir.
Soygazlardan önceki gruptur.
Elektron dizilişleri np5 ile biter.
Kararlı bileşiklerinde –1 ve +7 değerlikleri alabilir.
F2, Cl2, Br2, I2 gibi iki atomlu moleküler elementlerdie.
Hidrojenli bileşiklerinin sulu çözeltisi asit özelliği gösterir.
8 A Grubu:
Soygazlar grubu denir.
Değerlik orbitalleri tam doludur.
Kimyasal bileşik yapmaya yatkın değildirler.
Oda koşullarında hepsi de gazdır.
Erime ve kaynama noktaları çok düşüktür.
Periyodik özellikleri grup ve periyotlara göre genelleştirirsek, aşağıdaki biçimde özetleyebiliriz:
Gruplarda yukarıdan aşağıya inildikçe:
- Atom numarası artar.
- Atom çapı artar.
- İyonlaşma enerjisi azalır.
- Elektronegatiflik azalır.
- Elektron ilgisi azalır.
- Değerlik elektron sayısı değişmez.
- Kimyasal özellikler benzerlik gösterir.
- Metalik özellikler artar.
Periyotlarda soldan sağa gidildikçe:
– Atom numarası artar.
– Atom çapı küçülür.
– İyonlaşma enerjisi artar.
– Elektron ilgisi ve elektronegatiflik artar.
– Değerlik elektron sayısı artar.
– Metalik özellik azalır.
1 A Grubu Elementlerin Kimyasal Özellikleri:
Hidrojen (H):
Hidrojen; etkinleştirilmiş biçimleri dışında, soğukta pek etkin değildir. Buna karşın, sıcakta ya da katalizörler
eşliğinde pek çok tepkimeye girer. Bir değerli bir element olması nedeniyle çok belirgin elektropozitif bir özellik
taşır. Orta kuvvette bir indirgendir: alkali metal oksitler (Al2O3) gibi çok kararlı bileşikleri indirgeyemez.
Bununla birlikte NiO, CuO, vb. gibi pek çok metal oksidi indirger. Bu yolla katalizör olarak kullanılabilen çok
ufaltılmış metaller elde edilir.
Hidrojen, alkali ve toprak alkali metallerde olduğu gibi, ametallerin çoğuyla da doğrudan birleşir. Halojenlerin
dördüyle de tepkimeye girerek hidrasitleri verir: flordan iyoda doğru gidildikçe hem tepkime hızında, hem de
açığa çıkan ısı miktarında bir azalma görülür. Oksijenle, kızıl derecede ya da düşük sıcaklıkta bir katalizör
eşliğinde (platin köpüğü) bileşerek su verir. Mavi bir alevle yanar, oksijenle karışımı oksihidrojen hamlacında
kullanılır. Kükürtle 250oC’a doğru birlerşir. Azotla yüksek basınçta ve katalizör eşliğinde birleşerek amonyak
elde edilmesini sağlar.
Hidrojen, özellikle oksijen ve klora karşı büyük ilgi gösterir ve bu maddeleri bileşiklerinden uzaklaştırır.
Kükürt, azot, arsenik oksitlerinden ametali açığa çıkarır, kurşun ve bakır gibi değerli metallerin oksitlerini
indirger. Demir ve demire yakın metallerin oksitleriyle tersinir tepkimeler verir.
Hidrojen, ayrıca karbonmonoksidi de indirger; işlemin gerçekleştirildiği koşullara uygun olarak değişik
ürünler oluşturur.
Katalikit hidrojenlenme tepkimeleri arasında taşkömürü yağlarının ya da taşkömürünün doğrudan kensisinin
hidrojenlenmesinin yanı sıra doymamış organik bileşiklere hidrojenin bağlanması da sayılabilir. Özellikle bu son
tepkimeden sıvı yağların sertleştirilmesinde yararlanılır. İndirgenecek madde, hidrojenin elde edildiği aynı
ortama konulduğunda indirgeme koşulları daha uygun bir hale gelir. Bu sırada doğan hidrojen atom durumunda
olduğundan büyük bir olasılıkla çok daha etkilidir. Aynı şekilde hidrojen üretiminde kullanılan hidroklorik asit
ve çinko karışımına sülfit asidi katıldığında, hidrojen sülfür (H 2S) oluşur.
Elektrik arkına hidrojen üflendiğinde olağanüstü indirgen özellikler taşıyan bir gaz elde edilir: buna
Langmuir’in atomsal hidrojeni denir. Atomsal hidrojen, tüm oksitleri indirger ve soğukta ametallerin çoğuyla
birleşir.
Hidrojenin, alkali ya da toprak alkali metaller üzerine etkimesi sonucu, iyonsal ya da tuz durumunda hidrürler
elde edilir. Bunlar kristalleşmiş tuzlardır. Alkali hidrürler, bor ya da aliminyumla LiAIH 4 gibi çift hidrürleri
oluşturur. Bu bileşikten, organik kimyada özel olarak polar çiftle bağların hidrojenlenmesinde yararlanılır.
Hidrojen, geçiş metalleriyle çoğu kez stokiyometrik olmayan aradurum bileşikleri oluşturur. Bu bileşiklerde
hidrojen atomları, kristal örgüde atomlar arasındaki boşluklara yerleşir. Demir (Fe), nikel (Ni) ve özellikle
paladyum (Pd) gibi kimi metaller, önemli miktarda hidrojen soğurur. Böylece oluşan metal hidrürler, daha çok
katalikit özellikleri nedeniyle kullanılır. Hidrojenle çalışan uzay araçlarında yakıt olarak kullanılan hidrojenin
depolanması konusunda kimi metal hidrürler üzerinde araştırmalar sürdürülmektedir.
Lityum (Li):
Lityum, alkali metallerin ilkidir. Hidroksidi olan litya 1817’de Arfvedson tarafından bulunmuş, metal olarak
Davy tarafından elektroliz yoluyla elde edilmiştir. Lityum, beyaz bir katıdır. Bileşikleri, alevi kırmızıya boyar.
Lityumun kimyası, temel olarak iyonsaldır: elektronegatif elementlerle birleşerek lityum klorür (LiCl) gibi
kristalleşmiş iyonsal katıları oluşturur; suda çözünebilen bu katılar, su molekülleriyle kuşatılmış Li + katyonları
verir. Lityum oksijende yanarak Li2O ile Li2O2 gibi oksitleri, hidrojenle kızıl derecede hidrürü (LiH), azotla oda
sıcaklığının hemen üzerinde nitrürü (Li3N) meydana getirir. Soğukta suyla tepkimeye girerek litya (LiOH) ile
hidrojeni verir. Renksiz olan tuzları, magnezyum tuzlarına benzer, ama formülleri bakımından bunlardan
farklıdır, çünkü lityum bir değerlidir. Lityum, tıpki magnezyum gibi C 2H5Li formülünde ortak değerlikli
organometal bileşikleri verebilir; bu maddelerden organik kimyada birleşim etkeni olarak yararlanılır.
Lityum doğada silikatlar (lepidolit, spodumen) ya da fosfatlar (ambligonit, trifilit) biçiminde bulunur. En
önemli cevheri, bir lityum-potasyum alüminosilikat olan lepidolittir. Lepidolitten lityum klorüre (LiCl) geçilir,
lityum klorürden de elektroliz yoluyla metal üretilir. Tuzlarını elde edebilmek için öncelikle suda çözünmeyen
karbonat olarak çökeltilir.
Lityum, döteryumla birlikte Tokamak türü bir nükleer füzyon reaktöründe kullanılan gerekli iki temel
malzemeden biridir.
Sodyum (Na):
Sodyum 1807’de sodyum hidroksitin elektrolizi sonunda Davy tarafından bulundu.Dövülerek
yassılaştırılabilen yumuşak bir metaldir; kırılma yüzeyi ilk anda gümüş beyazlığındadır, ancak havada hızla
yükseltgenerek kararır; bu nedenle vazelin yağı içinde saklanır.
Sodyum kimyasal bakımdan, özellikle düşük elektrot geriliminden (- 2,17V) kaynaklanan yüksek tepkinliğiyle
tanınır. Soğukta suyu indirgeyerek sodyum hidroksit ve hidrojen verir. Birinci iyonlaşma geriliminin düşük
olması, Na+ katyonunun çok kolay oluştuğunu gösterir. Nitekim elektronegatif elementlerde şiddetle birleşerek
suda çözünen ve solvatlanmış Na+ iyonunu serbest bırakan NaCl gibi iyonsal bileşikler verir. Bununla birlikte
sodyum, ortak değerlikli bağlar oluşturabilir: örneğin sodyum buharındaki Na 2 molekülleri, organometal
bileşikleri.
Sodyumun sertliğinin düşük olması, ayrıca ergime ve kaynama sıcaklıklarının pek yüksek olmaması, metalin
ağ yapısı içinde güçlü bir kohezyonun bulunmadığını gösterir; bu ağ yapı içinde her atom, yalnız bir elektron
verir.
Sodyum, cıva içinde çözünerek tanımlanmış çeşitli bileşikler içerebilen bir amalgam meydana getirir. Ayrıca
sıvı amonyakta çözünerek mavimsi bir çözelti oluşturur; bu çözeltide sodyum metali, solvatlanmış iyon ve
elektronlar olarak ayrışmış durumda bulunur. Bu çözelti, yüksek indirgen özellikler taşıdığından organik
kimyada çeşitli birleşimlerde kullanılır.
Sodyum günümüzde kalsiyum klorür ile sodyum klorürden oluşan ve yaklaşık 580 oC’ta ergiyen ikili bir
karışımın elektroliziyle üretilir. Oysa alüminyum üretiminde kullanıldığı dönemde, sodyum karbonatın kömürle
indirgenmesi ya da sodyum hidroksitin elektrolizi yoluyla elde edilirdi.
Potasyum (K):
Potasyum bileşikleri temel olarak iyonsaldır: elektronegatif elementlerle şiddetle birleşerek çözelti halinde
solvatlanmış K+ katyonu ceren KCl gibi iyonsal katılar oluşturur.
Potasyum, oksijen içinde yanarak pek çok oksit verir. Potasyum oksit (K 2O), suda çözündüğünde bazik
hidroksit (KOH), yani potasyum hidroksit meydana getirir.
Potasyum klorür (KCl), susuzken 768oC’ta eriyen renksiz küpler biçiminde kristalleşir.Tuzlu bataklık
sularından, yosun külünden, carnalitten (KCl, MgCl2, 6H2O) ya da silvinitten bölümsel çözündürme yoluyla elde
edilir. Potasyum klorür, öteki potasyum bileşiklerinin hazırlanmasında kullanılır.
Potasyum bromür (KBr) ve potasyum iyodür (Kl), çok çözünen renksiz kübik kristaller biçiminde bulunur. Bu
tuzlardan tıpta ve fotoğrafçılıkta kullanılır.
Potasyum klorat (KClO3), patlayıcıların bileşimine girer ve kibrit yapımında kullanılır.
Potasyum sülfat (K2SO4), yosun külü ile şekerpancarı tuzlarından çıkarılır; ayrıca sülfürik asidin potasyum
klorür üzerine etkimesiyle de hazırlanılır. Tarımda gübre olarak kullanılır. Potasyumun ayrıca ısıtıldığında
potasyum pirosülfat’a (K2S2O7) dönüşen bir hidrojen sülfatı (KHSO4) vardır.
Potasyum nitrat (KNO3), aynı zamanda güherçile olarak da adlandırılır.
Silis ve potas karışımları ısıtıldığında, çeşitli potasyum silikatlar ve bu arada özellikle metasilikat (K2SiO3)
elde edilir. Bunların çakıl taşı çözeltisi denen sulu çözeltileri, yapılarda kullanılan gevrek kalker taşlarını
sertleştirmeye yarar.
Potasyum Tuzlarının Özellikleri: Derişik çözeltide çöken sarı renkli potasyum kloroplatinat (K 2[PtCl6]),
potasyum fluorosilikat (K2[SiF6]), potasyum perklorat ve potasyum pikrat dışında potasyum tuzlarının çoğu suda
çözünür. Bir Bunsen beki alevine tutulduklarında alevin rengini mora dönüştürürler.
Rubidyum (Rb):
Rubidyum atom numarası 37, atom kütlesi Rb=85,4678 olan kimyasal bir elementtir.Rubidyum 1,53
yoğunluğunda, 38,9oC’ta eriyen beyaz bir katıdır. Kuru havada bile hızla yükseltgenir, suyu şiddetle ayrıştırır ve
bu sırada meydana gelen hidrojen tutuşur. Hemen hepsi suda çözünebilen tuzları renksizdir. Rubidyum kimi
maden sularında, şekerpancarı ve tütün küllerinde, lepidolit, trifilin vb.’de bulunur; erimiş durumdaki klorürü
vakum altında kalsiyumla tepkimeye sokularak element durumunda kolayca elde edilebilir.
Sezyum (Cs):
Bunsen ile Kirchoff’un 1861’de tayf çözümlemesi yardımıyla rubidyumla aynı anda buldukları sezyum, tüm
doğal elementlerin en elektropozitif olan, uçuk sarı renkte, yumuşak bir metaldir. Kolayca yükseltgenir, soğukta
suyu ayrıştırarak hidrojen ve yakıcı bir hidroksit olan sezini (CsOH, sezyum hidroksit) verir. Tuzları potasyum
tuzlarıyla eşyapılıdır. Kimi maden sularında, lepidolitte, trifilinde, Elbe adasında çıkarılan polusitte az miktarda
bulunur. Sezyum, eritilmiş klorürün vakum altında kalsiyumla ayrıştırılması ve elde edilen ham metalin
damıtılması yoluyla hazırlanabilir. Kimi fotosellerin yapımında kullanılır.
Fransiyum (Fr):
Atom kütlesi 223 olan fransiyum, doğada bulunmasına karşın dönemli sınıflandırmada eksik olan son
elementti. 1939’da, Paris Radyum Enstitüsü’nde Marguerite Perey tarafından bulundu. Aktinyumdan ayrılan
fransiyum, radyoaktif bir elementtir. Alkali metallerin özelliklerini taşır ve tüm kimyasal elementlerin en
elektropozitifidir.
2 A Grubu Elementlerin Kimyasal Özellikleri:
Berilyum (Be):
Vauquelin, berilyum oksidi 1789 yılında Limoges zümrüdünde buldu. Tuzlarının şekeri andıran tadı nedeniyle
bu okside glusinyum adını verdi; bu ad Fransa’da birkaç yıl öncesine değin kullanılıyordu.
Berilyum, fiziksel özellikleri bakımından magnezyuma benzer. Bileşikleri ortak değerlik bağlarından oluşur ve
bu nedenle iyon yapılı toprak alkalilerden ayrılır. Berilyum, ister arı metal olarak, isterse alaşım halinde
kullanılsın, havada yeterince yansızdır. Atmosfer korozyonuna karşı ince bir oksit katmanıyla korunur. Oksijene
olan ilgisine rağmen, ancak 900oC’ın üzerinde belirgin biçimde yükseltgenir.
Magnezyum (Mg):
Magnezyum, 1808’de önce Davy, daha sonra da 1829’da Bussy tarafından katışıklı olarak elde edildi.
Magnezyum, gümüş beyazlığında, yassılaşabilen bir katıdır; ama tokluğunun zayıf olması nedeniyle pek fazla
sünek değildir. Kuru havadan etkilenmemesine karşın; nemli havada yükseltgenir. İnce şerit, tel ya da toz
halindeyken, 300oC’ın üzerindeki sıcaklıklarda parlak bir alevle yanarak magnezyayı (MgO) verir. Kütle
durumunda, tutuşma sıcaklığının üzerine çıkar. Kızıl derecede azot ve halojenlerle bileşir; kaynama
sıcaklığındaki suyu ayrıştırır, oksitlerin çoğunu indirger, asitleri bozundurur.
Magnezyumun kimyası, genel olarak bu metalin indirgen niteliğine dayanır; uranyum fluorürden (UF 4)
uranyum üretiminde, özellikle bu metalden yararlanılır.
Kalsiyum (Ca):
1808’de, ilk kez Davy tarafından elde edilen kalsiyum, bıçakla kesilebilecek kadar yumuşak, beyaz bir
metaldir. Kesik yeri, parlaklığı bakımından ilk anda kurşununkini andırır, anca havada yükseltgenmesi nedeniyle
yavaş yavaş kaybolur.
Kalsiyum doğada serbest olarak bulunmaz, ama bileşikleri oldukça yaygın ve önemlidir. En bol bulunan
bileşiği kalsiyum karbonattır (CaCO3). Kalsiyum karbonat, doğada az ya da çok arı türleri biçiminde bulunur.
Kalsiyum bileşikleri arasında özellikle alçı taşını oluşturan hidratlı oluşturan hidratlı sülfatı (CaSO4, 2H2O) ile
Kuzey Afrika’da çok geniş yataklar halinde bulunan ve kemiklerdeki anorganik bileşenlerden biri olan kalsiyum
fosfatı [Ca3(PO4)2] saymak gerekir.
Çözeltide iki değerli iyon olarak bulunur ve fluorürü çözünmez. Çok parlak, beyaz bir alevle yanarak
sönmemiş kireci (CaO) verir; halojenlerle kolayca birleşir; hidrojenle tepkimeye girerek kalsiyum hidrürü
(CaH2), azotla nitrürü (Ca3N2) oluşturur. Soğukta suyu ayrıştırarak hidrojen ve sönmüş kireci [Ca(OH) 2]
meydana getirir.
Stronsiyum (Sr):
Stronsiyum atom numarası 38, atom kütlesi Sr=87,62 olan bir elementtir. 1790’da Strontian’daki (İskoçya) bir
kurşun madeni ocağından getirilen bir mineral içinde Crawford tarafından bulundu, 1808’de Davy tarafından tek
başına elde edildi. Toprakta karbonat (stronsianit) ve sülfat (selestin) mineralleri durumunda bulunur. Deniz
suyunda ve kimi maden sularında eser miktarda rastlanır.
Stronsiyum beyaz bir metaldir; havayla temas eder etmez yükseltgenerek anında kararır. 769 oC’ta ergiyen, çok
çabuk yükseltgenen, 2,5 yoğunluğunda bir katıdır. Soğukta suyu ayrıştırır; ametallerin çoğuyla birleşir, asitlerle
tuz oluşturur ve bu tuzlarda iki değerli olarak bulunur.
Baryumunkilere benzeyen tuzları alevi kırmızıya boyar; bu bakımdan havai fişek yapımından kullanılır.
Hidroksidi [Sr(OH)2], şekerle çözünmez bir bileşik oluşturarak, şekeri melastan ayırır. Stronsiyum, baryum
karbonatla birlikte düzenleyici bir rol oynadığı vakum tiplerinin oksitli katotlarının yapımında kullanılır.