Uploaded by
common.user14862
Faz Diyagramları: Malzeme Bilimi Sunumu

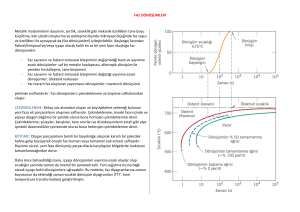
FAZ DİYAGRAMLARI • Öğrenim Amaçları • Malzeme özelliklerinin çoğu görmüş oldukları termomekanik işlemlerin sonucu olarak oluşan iç yapılarına bağlıdır. Faz ve faz diyagramlarına ait bilgiler özellikle döküm-katılaşma ve ısıl işlemlerin tasarımı ve kontrolü açısından önemlidir. • Faz diyagramları çoğunlukla kararlı ve dengeli durumlar için geçerli olmasına rağmen, bunların bize sağladığı bilgiler kararsız yapıları kavrayabilme açısından yararlıdır. • Mühendislik uygulamalarında dengesiz ve kararsız yapıların sunduğu performans ve özellikler, genellikle kararlı yapılarınkine göre daha fazla tercih edilmektedir. En iyi örnek «çökelme sertleşmesi» olacaktır. Faz kavramı • Kristal yapılı malzemelerin iç yapılarında homojen ve belirli özellikler gösteren bölgelere faz (phase) adı verilir. • Fazlar; bu atom düzenlerinden ve toplam iç yapıda bu fazların oluşturdukları tanelerden meydana gelir. Sıvı çözelti (a) Suyun 3 hali; gaz, sıvı, ve katı. Herbiri bir fazdır. (b) Su ve alkol; tam çözünme. (c) Tuz ve su; sınırlı çözünme. (d) Su ve yağ; Hiç çözünmeme. Katı çözelti • Sıvı çözeltide olduğu gibi, katı durumda da bir elementin atomları diğer bir elementin kafes yapısı içerisinde uygun bir yer bulup yerleşmesi ile katı çözelti meydana gelir. • Uygun yerler arayer veya yeralan (ikame) olabilir. • Hume-rothery kuralı gerçekleşmişse tam ve sınırsız bir çözünme (karışma) sağlanabilir. • Hume – Rothery prensipleri, metal atomlarının birbiri içinde sınırsız katı eriyebilirlik oluşturması için gerekli şartlardır. Yani birbiri içinde sınırsız çözünebilen metal atomlar bu şartları sağlamalıdır. Hume – Rothery kuralları • Metal atomlarının yarıçapları farkı %15 den büyük olmamalıdır • Aynı kristal kafes yapısına sahip olmalıdır. • Atomlar aynı valans elektron sayısına sahip olmalıdır. Farklı valansa sahip olanlar bileşik oluşturabilir. • Metal atomları aynı elektronegativiteye sahip olmalıdır. Bir kristal içine yabancı atomlar gösterildiği gibi sızmışsa fakat bu atomların miktarı bir faz dönüşümü yaratamayacak kadar düşükse yani, kristal yapı, simetrisini aynen muhafaza ediyorsa oluşan bu karışıma Katı Çözelti diyoruz. • Eğer bir kristal yapı içerisinde çok az sayıda yabancı atom varsa ve ana fazın kristal yapısını değiştirmeyecek kadar düşük bir miktardaysa oluşan bu katı fazdaki karışıma katı çözelti adını veriyoruz ve içeri sızan bu yabancı atomlara çözünen atom adını veriyoruz. (a)Sıvı Cu ve Ni, tam çözünür. (b)Katı Cu ve Ni kristal yapıda rastgele yerlere yerleşmek suretiyle tam katı çözelti oluşturur. Katı Çözelti 2.Faz (c)Cu ve Zn alaşımları sınırlı çözünmeden dolayı % 30 dan fazla Zn çözemez, ikinci faz bölgeleri oluşturur. Mikroyapıda fazlar Mikroyapıda Fazlar niçin oluşur? Neden atomlar her noktada homojen karışım oluşturamazlar? • Tanelerin nasıl oluştuğundan kısaca bahsedelim. Bunun için bir pota içerisinde yeralan sıvı bir metal düşünelim. Çünkü taneler kristalleşme sürecinde meydana geliyorlar. • Bu kristalleşme aynı anda başka yerlerde de başlamaktadır. Bunların hepsinin yönelimlerinin farklı farklı olduğunu gözlemliyoruz ve büyüye büyüye biraraya geldiklerini görüyoruz. Bu büyüyen kristal parçacıklarına malzeme biliminde «tane» adını veriyoruz. Bu büyüyen taneler arasında oluşan bölgelere de tane sınırı adını veriyoruz. • Bir elemente diğer bir element karıştırılacak olursa, daima toplam iç enerji mimimum olacak şekilde yeni atom düzenleri meydana gelir. Sistemde enerji • Fazlar: İç enerjinin min olmasını sağlayacak şekilde oluşurlar. • Bir sistemde enerji durumu: sıcaklık, kimyasal bileşim, basınç gibi değişkenler ile belirlenir. • Eğer basınç sabit ise (atmosferik basınç) sistemin enerjisi kimyasal bileşim ve sıcaklık tarafından belirlenir. Faz diagramları • Kimyasal bileşim ve sıcaklığa bağlı olarak belirli şartlarda hangi fazların stabil olduğu faz diagramları ile belirlenir. Tek Bileşenli Faz Diyagramları Mg Ergime Sıcaklığı=651 C Kaynama Sıcaklığı= 1090 C Böylelikle yemekler normal bir tencerede ısıtıldığında suyun kaynama noktası olan 100 dereceye gelindiğinde, su bu derecede kaynar ve tüm su kaynayana kadar bu sıcaklık sabit kalır ve yemek de bu sıcaklıkta pişer. Düdüklü tencerede ise buhar dışarı kaçamadığından tencerenin içindeki basınç gittikçe artar, dolayısıyla su 100 derecede kaynamaz, tenceredeki sıcaklık 125 °C (257 °F) dereceye kadar çıkar. Böylece pişirilmesi istenen besinlerin ısısı suyun kaynama derecesinden çok daha yükseğe çıkmasına rağmen yüksek sıcaklık yiyeceğe süratle nüfuz ettiğinden,vitamin ve mineraller tahribata uğramadan daha çabuk pişmesi sağlanır. Hava basıncı artarsa, ağzı açık kaptaki sıvının kaynaması zorlaşır. Hava basıncının azalması ise kaynamayı kolaylaştırır. Dolayısıyla sıvı daha düşük sıcaklıkta kaynar. Deniz düzeyinde 100 °C de kaynayan saf su, Ankara’da 96 °C de, Erzurum’da ise 94 °C de kaynar. Yeryüzünden yükseldikçe; Yerçekimi ve atmosferdeki gazların miktarı azalır. Bunlara bağlı olarak basınç düşer. Yükselti ile basınç ters orantılıdır. Aynı maddenin değişik kristal biçimlerine allotrop denir; allotrop sözcüğü değişik biçim anlamında Yunanca iki sözcükten gelir. Elmas ve grafit, karbonun allotroplarıdır. Elmasta her karbon atomu, dört başka karbon atomuna bağlanarak üç boyutlu katı bir yapı oluşturur; grafitte ise karbon atomları, üst üste yığılmış geniş, yassı levhalar oluşturacak biçimde, iki boyutlu düzlemde birbirlerine bağlanmıştır. Bu levhalar birbirlerinin üzerinden kolayca kayar; grafitin iyi bir yağlayıcı olma özelliği de bundan kaynaklanır. Grafitin kâğıt üzerinde iz bırakmasının nedeni de, bu ince atom levhalarının grafitten ayrılarak kağıdın üzerinde birikmesidir. Karbonun bazı allotropları: a) elmas; b) grafit; c) altıgen elmas; d-f) fullerenler (C60, C540, C70); g) amorf karbon; h) karbon nanotüp. 1 kelvin = -272.15 degrees Celsius 1 Kbar= 986,92 Atm İki Bileşenli Faz Diyagramları Basınç sabit, sıcaklık ve kimyasal kompozisyon değişken Çözünme durumuna göre • Tam çözünme: Bir elementin diğeri içerisinde sınırsız çözünebilmesi. • Hiç çözünmeme: Bir elementin diğeri içinde hiç çözünememesi. • Sınırlı çözünme: Bir elementin diğeri içerisinde kısıtlı çözünebilmesi. a) b) c) Tam Çözünme ✓ ÇEKİRDEKLENME Likidüs Sıcaklık ✓ BÜYÜME Solidüs S, Sıvı TB Sıvı Tamamen sıvı faz Sıvı % 90 Sıvı + % 10 S+ % 60 Sıvı + % 40 TA % 10 Sıvı + % 90 , Katı %B X Tamamen katı faz. : %x oranında B elementi içerir. %63B %37A Ötektik Yapı • Ötektik reaksiyon; sıvı fazın ani olarak iki ayrı katı faza dönüşmesi reaksiyonudur. Ötektik reaksiyon: Sıvı Soğuma (Katı) + (Katı) Ötektik nokta Ötektik noktadan uzaklaştıkça, ötektik reaksiyon, dönüşüm öncesi varolan sıvı faz kadar gerçekleşir. Ötektik Sıcaklık • Katılaşma sırasında çekirdeklenme bir çok noktadan başlar, • Bu çekirdekler tabaka şeklinde büyürler • Birbirlerine temas etmeleri ile ince ve tabakalı yapı meydana gelir, • Çekirdeklenme ne kadar çok noktadan meydana gelmişse yapı o kadar ince tabakalı (veya küçük taneli) olacaktır. “A” kristal taneleri (Açık renk) “B” kristal taneleri (Koyu renk) Ötektik dönüşüm Hiç Çözünmeme Ötektik alaşım 2.Alaşım 1.Alaşım S TA 1• • 2• Ötektik Sıcaklık •1 A+S 3• 4• 1 •3 •4 2• 5• 3• X1 A+B 1 Sıvı X2 Ötektik Bileşim Sıvı Sıvı A 2 2 3 Sıvı A 3 3 •5 X3 A Kristalleri (Açık renk) B Kristalleri (Koyu renk) 1 2 4 %B 1 2 S+B • TB 3.Alaşım Proötektik A 5 Ötektik Yapı Ötektik A Ötektik B Sıvı Sıvı B 4 5 Ötektik A Ötektik B Proötektik B Ötektik A Ötektik B Sınırlı Çözünme • Alaşım sistemlerinin çoğunda görülür. • B elementi A nın içerisinde sınırlı olarak çözünebilir. Oda sıcaklığında X1 kadar, sıcaklık arttıkça (ötektik sıcaklıkta) X2 kadar çözünebilir. • Aynı şekilde A elementi B içerisinde sınırlı miktarda çözünebilir. • Oda sıcaklığında X3 kadar, sıcaklık arttıkça (ötektik sıcaklıkta) X4 kadar çözünebilir. • (Sıcaklıkla ısıl aktivasyon artar ve boşluk miktarı artar). fazı: Katı Çözelti • Çözeltiye giremeyen yabancı atomlar kendilerinin çoğunlukta olduğu yeni atom düzeni (faz) oluştururlar. • A nın çoğunlukta olduğu katı çözelti fazını oluşturur, • B nin çoğunlukta olduğu katı çözelti fazını oluşturur. • Fiziksel ve kimyasal özellikleri farklı olan iki katı faz ve aynı yapıda birarada bulunabilir. fazı: 2.Faz ve Katı çözelti Ötektik Bileşim Ötektik altı bileşim (hypo) Xö Ötektik üstü bileşim (hyper) Lehim: Genel olarak lehim, % 30-40 Pb, % 60-70 Sn içerir. Plastik derece istenen lehimlerde kalay % 40ın altında, kurşun % 60ın üzerindedir. Erime noktası 183oCdır. Milyatağı alaşımları: Makinenin hareketli ve sabit bölümleri arasında bağlantı sağlayan ve hareketli bölüme destek olarak kullanılan bu malzemeler kurşun, kalay ve bakır esaslı alaşımlardır. Ör. PbSn10. Çökelmeyle sertleşebilir alaşımlarından olan Al-Cu-Mg alaşımları ( % 2,84,8 Cu ve %0,4-1,8 Mg), yüksek dayanımları nedeniyle taşıt ve uçak yapımında kullanılırlar. Al-Mg alaşımları. Esas alaşım elementi magnezyumdur. Magnezyum oranı arttıkça sertlik ve mukavemet artar fakat süneklik azalır. Ötektoid Reaksiyon • Soğuma sırasında bir katı fazdan iki ayrı katı fazın oluşması reaksiyonudur. Ötektoid reaksiyon: (Katı) Soğuma (Katı) + (Katı) Recently, Ti-Pt binary alloys have been developed, and these alloys were expected to become promising candidates for dental applications due to alloying with non-toxic elements, better grindability, and better mechanical compatibility with bone tissue than cp-Ti and Ti-6Al-4V alloys. Cu–Ti alloys are now receiving a great deal of attention as ultra-high strength conductive materials for applications such as conductive springs, interconnections etc. essentially displacing the conventional Cu–Be alloy series Peritektik Reaksiyon Peritektik reaksiyon: Sıvı + (Katı) Soğuma (Katı) Peritektoid reaksiyon: (Katı) + (Katı) Soğuma (Katı) Ötektik Peritektik Monotektik Ötektoid Peritektoid Örnek (c)2003 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning ™ is a trademark used herein under license. Aşağıda verilen faz diyagramında bulunan 3 adet farklı faz reaksiyonlarını tespit ediniz. 1150oC, 920oC, 750oC, 450oC ve 300oC lerde yatay çizgiler vardır Örnek1 100 gr Pb-%10 Sn alaşımı için; (a)100oC’de Sn nin Pb içerisinde max çözünürlüğünü bulunuz, (b) Pb nin Sn içerisinde max çözünürlüğünü bulunuz, (a) 100oC (Sn) nin (Pb) içerisinde çözünürlüğü % 5. (b) Pb nin Sn içerisinde max çözünürlüğünü ötektik sıcaklık olan 183oC de gerçekleşir: Bu değer % 97.5. Tötektik:183oC 97.5% Sn 2.5% Pb 5% Çelik üretiminde tandişe döküldükten sonra 8 nozuldan çıkarak kütük üretim prosesi sırasında tandişteki sıvı çeliğin yarısı dökülmeden nozullar tıkanmakta ve dökümü zorlaştırmaktadır. Firma bu zorluğu aşmak için metalik Ca kullanmıştır. Nedenini faz diyagramına bakarak yorumlayınız. Çelik temizliği kaynaklı nozul tıkanmalarının çelikte bulunan ergime derecesi çok yüksek alümina inklüzyonlarının nozul çeperinde birikmesi sonucu oluşmaktadır. Potassium acetate Dengesiz soğuma • Katı içerisinde difüzyon için zamanın yetersiz olması segregasyonlu bir yapı oluşturur. • Dengesiz solidüs çizgisinin gerçek yeri ve son dengesiz solidüs sıcaklığı soğuma hızına bağlıdır. Yüksek soğutma hızı, dengede daha büyük sapmalara neden olur. Dengesiz soğuma Demir-Karbon Sistemi • Tüm ikili alaşım sistemleri içinde en önemli yeri demir-karbon alaşım sistemi tutmaktadır. Teknolojik açıdan önemli yere sahip olan tüm toplumlar, esas olarak demir-karbon alaşımı olan dökme demir ve çelikleri ana yapısal malzeme olarak kullanmışlardır. Fe/C ve Fe/Fe3C Faz diyagramı • Sementit; demir karbon faz diyagramında metallerarası bir bileşiktir. • Pratikte Fe-C diagramında sementite kadar olan bölge önemlidir. • Sementit; % 6.67 C konsantrasyonuna sahiptir. • Daha önceki alaşım diyagramlarından farklı olarak katı fazda, yatay eksen karbon oranı % 0-100’e kadar değil de, % 0-6,67 kadar olan aralığı gösterilir. Bu diyagram, katılaşma aralığı, sıvı ve sıvı - katı ve ötektik ve ötektoit gibi bölgeleri göstermektedir. • % 6,67 C bulunduğu durumda yapı, % 100 sementitdir( Fe3C veya demir-karbür). Karbon oranının % 4,5 daha alan demir-karbon alaşımının teknolojik önemi yoktur. • Demir-karbon denge diyagramından görüldüğü gibi sıcaklığa bağlı olarak yapıların değiştiği görülmektedir. • % 0-2 veya 1,7 ye kadar karbon ihtiva eden demir-karbon alaşımına çelik, % 2 den daha fazla karbon ihtiva eden demir karbon alaşımına ise dökme demir denir. a) Stabil Sistem (Fe-C Diyagramı): • Alaşımdaki tüm karbon miktarı yapı içerisinde grafit şeklindedir. • Bu iç yapı yavaş soğutma ile elde edilir. Silisyum miktarı iç yapının ferrit+grafit şeklinde olmasını kolaylaştırır. • Bu tip yapı stabil sistem yada stabil katılaşma olarak adlandırılır. b) Metastabil sistem (Fe-Fe3C diyagramı): • Alaşımın ihtiva ettiği bütün karbon miktarı, kimyasal olarak demir karbür şeklinde bağlanmıştır ve sementit şeklinde yapıda yer alır. • Bu iç yapı hızlı soğutma ile oluşur ve manganez oranı ile oluşumu kolaylaşır. • Sementit kristali yüksek sıcaklıkta parçalanmış ferrit ve grafit taneciklerine (temper grafiti) dönüşebileceği için bu tip katılaşmaya metastasbil (kararsız dengeli) sistem denir. • Demir karbon alaşımları bu sebepten ötürü birbirinden farklı eğrilere sahip iki ayrı denge diyagramından oluşur. • Aralarındaki fark çok düşük olduğundan, genellikle her ikisi de aynı diyagram üzerinde gösterilir. A3 + Acm +Fe3C A1 +Fe3C • Çelik; %2 ye kadar C içeren demir alaşımına verilen isimdir. • Otektoit çelik; % 0.8 C içeren çeliğe ötektoit çelik adı verilir. • Bu kompozisyonun altındaki çeliklere ötektoit altı çelikler (C oranı < % 0.8 %), bu bileşimden daha fazla C içeren çeliklere ötektoid üstü çelikler (C oranı > % 0.8) adı verilir. • C oranının %2 yi geçmesi durumunda malzeme artık çelik olarak değil, dökme demir (cast iron) olarak adlandırılır. • Perlit: Ötektoit reaksiyon sonrası -Fe ve Fe3C tarafından oluşturulan özel yapıya verilen isimdir. • Ötektoit yapı hakkında daha ayrıntılı bilgi geçen derste verilmişti. • C miktarı % 0.8 iken (ötektoit çelik) %100 perlitik yapı elde edilir. • C miktarı sıfıra doğru azaldıkça, perlit azalır, ferrit (-Fe) artar. • C miktarı %0.8 in üzerinde arttıkça, perlit miktarı azalır, sementit miktarı artar. (ferrit) taneleri (Açık renk) Sementit taneleri (Koyu renk) I II I III 5 III 1 2 1 2 3 4 +Fe3C 3 5 Perlit + 12 3 4 II Otektoit Bileşim Perlit Sementit Perlit Faz Dönüşümleri • Şu ana kadar yavaş soğuma hızlarında elde edilebilecek iç yapılar görüldü. • Gerçek uygulamalarda soğuma hızlarının kontrolü ile farklı iç yapılar elde etmek mümkündür. • Bu sayede mikro yapı ve mekanik özellikler ayarlanabilir. • Isıl İşlemler: Malzemelerin iç yapılarını ve bunlara bağlı olarak özelliklerini ayarlamak amacıyla yapılan kontrollü ısıtma ve soğutma işlemleridir. • Şu ana kadar incelenen faz diyagramları yavaş soğumada dengede olan fazlara göre hazırlanmıştır. • Isıl İşlemler, malzemelerin zamana bağlı faz dönüşümlerinin bilinmesi ile uygulanabilirlik kazanır. Zaman-Sıcaklık Dönüşüm diagramları Sınır: Dönüşümün tamamlanması • Birbiri içerisinde hiç çözünmeyen elementler için faz diagramı. • Faz diagramında TA nın altındaki sıcaklıklarda A katısının oluşacağı bilinebilir. • Fakat dönüşüm süreleri bilinemez. • Soğuma hızlarına bağlı olarak ne tür katıların oluşacağı Zaman-Sıcaklık Dönüşüm (ZSD) (TTT-Time Temperature Transformation) diagramları ile verilir Çekirdeklenme/Büyüme • Yüksek sıcaklıklarda ve düşük sıcaklıklarda dönüşüm süreleri düşük. Yani yavaş • Hızlı dönüşümün gerçekleştiği bir sıcaklık aralığı mevcut (Burun bölgesi) • Belli sıcaklığın altında dönüşüm gerçekleşmez. Sıvı • Katı oluşumu 2 aşamada olur. Katı Çekirdeklenme – Çekirdeklenme (nucleation) – Büyüme (Growth) Büyüme • Çekirdeklenmede: atomlar bir araya gelerek çekirdekleri oluştururlar. Daha sonra belli bir boyutun (kritik çap) üzerinde olan çekirdekler büyürler. Diğerleri çözünür yok olur. • Dönüşüm hızı belirli bir sıcaklık aralığında (burun bölgesinde) en yüksek değerler alır. • Dönüşümün tamamlanması için gereken süre, dönüşüm hızıyla ters orantılıdır. Dolayısıyla sıcaklık-zaman eğrisi sıcaklık- hız eğrisine benzer karakterde fakat tam ters şekilde olacaktır. Büyüme hızı Toplam dönüşüm hızı Çekirdeklenme hızı Hız Zaman Dönüşüm hızı eğrisinin zamana göre düzenlenmiş hali • Dönüşüm başlaması ve tamamlanması, belli bir zaman aralığında gerçekleşecektir. • Bu nedenle dönüşüm; dönüşüm başlangıcını ve sona ermesini ifade eden iki çizgini arasında gerçekleşir %50 Dönüşüm Dönüşüm miktarları Dönüşüm başlangıcı Hiç Dönüşüm Olmamış bölge %100 Dönüşüm Zaman, t(sn)-logaritmik skala T Ostenit Dengesiz ostenit T Kaba perlit İnce Perlit Sertlik Üst Beynit Alt Beynit Reaksiyon Başlamamış Sürüyor t (logaritmik skala) Tamamlanmış Faz dönüşümleri Faz dönüşümlerini ikiye ayrılır: 1.Yayınmalı dönüşümler: 2.Yayınmasız dönüşümler: Faz dönüşümleri 1. Yayınmalı dönüşümler: Atomlar, en kararlı halin (min.enerji) gerektirdiği fazları oluşturmada yeterli süreye sahiptirler. Bu fazlar, faz diyagramlarında yer alan fazlardır. a) Kaba perlit (coarse pearlite) b) İnce perlit (fine pearlite) c) Üst beynit (upper bainite) d) Alt beynit (lower bainite) 2. Yayınmasız dönüşümler: Atomlar düşük enerjili kararlı fazları oluşturacak yeterli sürelere sahip değillerdir. Bu nedenle faz diyagramlarında rastlanmayan yarı kararlı veya kararsız fazlar oluştururlar. * Martenzit Ötektoid Çelik T + +Fe3C Kaba perlit +P İnce Perlit +B Üst Beynit Alt Beynit Reaksiyon Başlamamış Sürüyor t (logaritmik skala) Tamamlanmış Perlit Dengesiz ostenit Ostenit Yayınmalı dönüşüm 1: Perlit Kaba Perlit (coarse pearlite): – Tabakalar (lameller) halinde dizilmiş iri ve Fe3C fazlarından oluşur. – Nispeten yumuşaktır. – Yüksek dönüşüm sıcaklıklarında oluşmaktadır, dolayısıyla çekirdeklenmesi yavaş, büyümesi ise hızlı olarak gerçekleşir. (Ferrit) Fe3C Yayınmalı dönüşüm 1: Perlit İnce Perlit (fine pearlite): – İnce ve Fe3C tabakalarının (lamellerin) istiflenmesi ile oluşan yapıdır. – Daha serttir. – Düşük sıcaklıklarda dönüşüm sonucu oluşur (çekirdeklenme hızı yüksek). Kaba yapıta göre daha serttir. (Ferrit) Açık renk Fe3C Yayınmalı dönüşüm 2: Beynit Üst Beynit (Upper bainite): – Ferrit matris içinde dağılmış sementit tanelerinden ibarettir. – Düşük dönüşüm sıcaklıklarında oluştuğundan tabakalı yapı oluşturulamaz. – Perlitle aynı kimyasal bileşime sahip fakat daha serttir. (Ferrit) Matris Fe3C Yayınmalı dönüşüm 2: Beynit Alt Beynit (lower bainite): –Dönüşüm sıcaklıkları daha da düşüktür. Böylece büyüme imkanı bulamamış ve ferrit içine dağılmış çok ince ve sık dağılımlı sementit taneleri oluşur. –Ancak elektron mikroskopunda görülebilir. Çok daha sert bir yapıdır. (Ferrit) Açık renk Fe3C Koyu tanecikler Yayınmasız dönüşüm: Martenzit Kararlı fazların oluşması için gereken yayınmanın olmaması durumlarında dönüşüm kararsız olarak gerçekleşir. Bu değişim yayınmasız olmasından dolayı zamandan bağımsızdır ve iki yatay çizgi şeklinde gösterilir. Soğumanın kritik bir hızın üzerinde olması durumunda ostenit faz martenzit faza dönüşür. İğnemsi yapı (Optik mikroskopta Martenzit • Demir allotropik bir metaldir ve farklı sıcaklıklarda farklı yapılar gösterir. • Ostenit ferritten çok daha fazla C’u çözebilir. • Yavaş soğutma sırasında ostenit ferrite dönüşürken, C difüzyon ile sementit (Fe3C) fazını oluşturur. • Fakat hızlı soğumada C, yayınma (difüzyon) için zaman bulamaz ve ferrit içerisinde hapis olur. • Yayınamayan C atomları hacim merkezli kübik yapıyı gererek hacim merkezli tetragonal yapıya dönüşmesine sebep olur. • Bu yapıya martenzit adı verilir. • Çok serttir ve iğnemsi bir görünüşe sahiptir. -Fe:2.86 Å. -Fe: 3.56 Å. -Fe:2.96 Å. Acm A3 + +Fe3C A1 +Fe3C “Critical Cooling rate”. Kritik Soğuma Hızı Özet Ostenit Ostenit Ostenit Yavaş Soğuma Yayınmalı İzotermal Dönüşüm Yayınmalı Çok hızlı Soğuma Yayınmasız Çeliklerin mekanik Pertlit (+Fe3C) özellikleri iç yapılarıyla doğrudan alakalıdır. – Ferrit – Kaba Perlit Beynit (+Fe3C) – İnce Perlit Sertlik – Üst beynit – Alt beynit Martenzit (tekfaz) – Martenzit Ötektoit Çelik T + Ostenit +Fe3C Kaba perlit Dengesiz ostenit İnce Perlit Üst Beynit Alt Beynit Ms Mf Martenzit t (logaritmik skala) +Fe3C Ötektoit altı çelik T Ostenit Dengesiz ostenit + Kaba perlit İnce Perlit Üst Beynit Alt Beynit Martenzit t (logaritmik skala) +Fe3C +Fe3C Ötektoit üstü çelik T Ostenit Dengesiz ostenit + +Fe3C Kaba perlit İnce Perlit Üst Beynit Alt Beynit Ms Mf Martenzit t (logaritmik skala) +Fe3C ZSD diyagramaları üzerinde iki ayrı soğutma yöntemi ve bunları temsil eden eğriler uygulanarak dönüşüm gerçekleştirilebilir. 1. Sürekli soğuma ile dönüşüm (Continuous cooling curve) 2. İzotermal soğuma ile dönüşüm (isothermal curve) TTT Diagrams Sürekli soğutma eğrisi boyunca dönüşüm İzotermal eğri boyunca dönüşüm İzotermal dönüşüm için Sürekli soğuma için eğri İzotermal dönüşüm için ZSD eğrisi, özellikle yüksek sıcaklıklarda bir miktar sola doğru kayar. Bunun nedeni sürekli soğumada ısıl aktivasyon azalan sıcaklıkla sürekli azalacak olmasıdır. Bu durum atom hareketlerinin yavaşlaması ve dönüş için gereken sürenin artmasıyla sonuçlanır. Öte yandan yüksek sıcaklıklarda ki izotermal dönüşüm de dönüşüm sırasında ısıl aktivasyon sürekli etkin kalacaktır. Soru: Yapılar nedir T t (logaritmik skala) Ostenit T T Kaba perlit t (logaritmik skala) Ostenit Kaba perlit t (logaritmik skala) Kırmızı çizgi; çeliği ostenit sıcaklıktan 600oC ye hızla soğutulduğunu, bu sıcaklıkta 102 s tutulduğunu ve daha sonra oda sıcaklığına soğutulduğunu göstermektedir. Perlit başlangıç ve bitiş çizgileri kesildiği için çelik %100 perlitik bir yapıya sahip olacaktır. Ödev 1 cevap Ödev 2 cevap