2. KATI CİSİMLERİN İÇ YAPISI
İnşaat Mühendisliğinde, cisimlerin yükler altındaki davranışını saptayabilmek
çok önemlidir. Yapının tasarımı, boyutlandırma ve kesin hesapları açısından
malzemenin "mekanik özelliklerini" bilmek gereklidir.
Malzemenin mekanik özellikleri cismin iç yapısına bağlı olduğundan önce
bunun incelenmesi gerekir. Ayrıca, metallerin korozyonu gibi malzeme
açısından önemli olayları atom yapısına dayanmadan açıklamak
olanaksızdır. Bu nedenle bu bölümde, bir yapı mühendisinin hatırlaması
gereken kimya bilgilerini özetlemekte yarar vardır.
2.1. Atom Yapısı
Atomlar, çevrelerinde negatif yüklü elektronların devinimler yaptığı pozitif
yüklü proton ve yüksüz nötronlardan oluşur. Nötronu olmayan atom, yalnız
hidrojen atomudur. Bir atom çekirdeğinde, elektron sayısı kadar proton
vardır. Elektronlar, çekirdek kütlesi yanında çok küçüktür (1/1850 oranında)
ve bu değer kütle hesabında göz önüne alınmaz.
Atomun en önemli özelliği, çeşitli bağ kuvvetlerinin meydana gelmesine yol
açan elektron sayısıdır. Atom numarası da elektron sayısına eşittir.
Örneğin, atom numarası 92 olan uranyumun 92 elektronu vardır. Buna göre,
uranyum atomunun çekirdeğinde 92 proton ve 146 nötron vardır. Böylece
uranyumun kütle ağırlığı 238 olur.
Malzemelerin özellikleri iç yapıya büyük ölçüde bağlıdır. Uygulanan bir işlem
sonucu özelliklerde meydana gelen değişmelerin nedeni ancak iç yapı göz
önüne alınarak açıklanabilir. îç yapılar atomlar arası bağ kuvvetleri etkisinde
üç boyutlu uzayda dizilmeleri sonucu oluşur. Atomlar arası bağların
oluşmasında ana etken elektron yapılarıdır. Özellikle en dış yörüngede
bulunan valans elektronları cisimlerin mekanik, fiziksel ve kimyasal
özelliklerini belirlerler. Bir cismin kimyasal bileşimi aynı kaldığı halde atomsal
diziliş biçimi değişirse özellikler önemli ölçüde etkilenir.
Örneğin %0,8 karbonlu çelik 800 °C ta ısıtıldıktan sonra 1 günde 1 saatte ve
1 saniyede olmak üzere üç ayrı hızda soğutulacak olursa, mukavemetler
yaklaşık 1/2/3 oranında farklı değerler alır. Bunun nedeni, üç farklı soğuma
hızında atomların üç değişik biçimde dizilmesi, dolayısıyla üç değişik iç yapı
oluşmasıdır. Mikroskopla incelendiğinde bu farklar açık bir şekilde görülebilir.
Atomların bir araya gelerek dizilişlerinde oldukça basit kurallar geçerlidir. Bu
kurallar bilindikten sonra büyük kütlelerin yapısını tanımak olundukça
kolaydır. Atomsal diziliş genellikle üç aşamada ele alınır: a) iki atom arasında
ilişkiler, b) Bir atoma onu çevreleyen komşular arasında ilişkiler, c) Üç boyutlu
uzak mesafeli dizilişler.
Elektronlar çekirdeği içine alan ve çekirdekten belirli uzaklıklarda bulunan
değişik yörüngeler üzerinde hareket ederler. Her yörüngede belirli sayıda
elektron bulunur ve bu yörüngelere içten dışa doğru, K, L, M, N, O ve P
adları verilir. İç yörüngelerde sırasıyla 2, 8,18 ve 32 elektron bulunur. En etkin
elektronlar dış yörüngedekilerdir.
Elektronlar atom çekirdeği çevresinde belirli yörüngeler üzerinde sürekli
hareket halindedirler ve belirli enerji düzeyine sahiptirler. Elektronlar çekirdek
etrafına yerleşirken önce en düşük enerji düzeyini doldururlar, sayıları arttıkça
sırası ile daha dıştaki enerji düzeylerini işgal ederler. Bir enerji düzeyinde en
fazla iki elektron bulunur ve bunların eksenleri etrafında dönme yönleri zıttır. Bir
atomun çevresindeki olası enerji düzeylerinin değerleri ve ardışık sırası
kuvantum mekaniği kurallarına göre belirir. Bir enerji düzeyinde bulunan bir
elektrona yeterli enerji verilirse, boş bir üst enerji düzeyine atlayabilir. Örneğin
E1 enerji düzeyinde kararlı hareket yapan bir elektronu E düzeyine yükseltmek
için verilmesi gereken enerji ΔE=E2 - Eı kadardır. Ancak E2 düzeyinde
elektron kararsız olduğundan burada sürekli kalamaz, tekrar Eı taban düzeyine
iner ve inerken aldığı ΔE enerjisini elektromanyetik radyasyon halinde çevreye
yayar. Çevreye yayılan radyasyon dalgasının Frekansı v ΔE enerjisi ile
orantılıdır.
2.2. Atom Bağları
Cisimlerin en küçük yapı birimi olan atomları,'atomlar arası bağ kuvvetleri bir
arada tutar. Bu bağ kuvvetleri cismin mukavemetinin esasını oluşturur. Ayrıca
elektriksel ve ısıl özellikleri belirler. Genellikle atomlar arası bağ kuvvetli ise
şekil değiştirme direnci büyük, ergime sıcaklığı yüksek ve ısıl genleşme
düşük olur.
Atom bağları zayıf (fiziksel) veya kuvvetli (kimyasal) olabilir. Kimyasal
bağlar üç şekilde olur.
a) İyonsal Bağlar - Atomların elektron alış verişi ile gerçekleşir. Tuz
molekülünün bağ şekli buna iyi bir örnektir (Şekil 2.1). İyon örgüsü sonsuz
sayıdaki Na+ ve CI" iyonlarının boşlukta küp teşkil edecek şekilde
dizilmelerinden oluşmuştur, örgüdeki her bir CI" anyonu 6 Na+ katyonu ile, her
bir Na+ katyonu 6 CI" anyonu ile sarılmıştır. Ancak bu alışveriş böyle basit
atomlar arasında olabileceği gibi, komplekslerle de olabilir, örneğin Ca++ ile
CO3" kompleksinin birleşiminden CaC03 oluşur. İyonsal bağlar küresel
nitelikte olduğundan yönsüzdür.
Şekil 2.1. NaCl de iyonsal yapı oluşumu
b) Kovalan Bağlar - Ametaller, moleküllerindeki ikişer atom birbirlerine
elektron çifti ya da çiftleri ile bağlı olup; moleküldeki her bir atom kısmen
ortaklanmış elektron çiftleri ile oktetler (sekizli elektron sistemleri)
oluştururlar. Bu şekilde oluşan bağlara kovalan bağlar denir. Örneğin, 2 Cl
atomu en dış yörüngelerindeki 7 elektrondan birini ortaklaşa kullanarak
sekizli elektron sistemi oluşturup klor molekülünü meydana getirirler (Şekil
2.2). Bu şekilde oluşan bağlar yönlüdür.
Şekil 2.2. Klor Molekülü
c) Metalik Bağlar - Metallerin çoğunun dış yörüngelerinde pek az
elektron vardır. Metal atomları en dış elektronlarını verip katyon olurlar.
Serbest elektronlar ise anyon görevi yapıp, bir elektron bulutu içinde
atomlar arasında hareket ederler. Anyon durumundaki elektronlar ile
katyon halindeki metal iyonları arasında oluşan elektrostatik kuvvet, kristal
yapılı metalleri oluştur. Valans elektron sayısı arttıkça bağ enerjisi,
dolayısıyla ergime sıcaklığı da artar. Örneğin, 1 valans elektronlu Na'un
ergime sıcaklığı 98 OC, 2 valans elektronlu Cu'ın 851 °C ve 3 valans
elektronlu Fe'in 1535 °C dir. Metallerde aynı veya benzer tür atomlar
oldukça sık ve düzenli biçimde dizildiklerinden tümü kristal yapılıdır.
Şekil 2.3. Metalsel bağ oluşumu.
Fiziksel Bağlar - Bazı atomların en dış yörüngesi elektronlarla dolu olabilir. Bu
tip atomlar ancak Van der Waals kuvvetleri adı verilen zayıf bağlarla bağlanabilir.
Sıcaklığın sıfırın altında çok düşük bir değer alması ve atomların titreşimlerinin
azalması sonucu bu bağlar oluşabilir.
Van der VVaals kuvvetlerinin büyük bir kısmı moleküllerin elektriksel dipolu sonucu
oluşur. Elektriksel dipol, iki atomun bir araya gelmesinden oluşan molekülde, pozitif
ve negatif elektrik yüklerinin ağırlık merkezlerinin farklı konumlarda olmasından
doğar. Bu olaya moleküllerin polarizasyonu denir. Fiziksel bağlantılar özellikle
plastik malzemelerde önem taşır.
2.3. Atomsal Yapı Türleri
Yapı Malzemelerinde beş tip atomsal yapıya rastlanır.
2.3.1. Metalik (Kristal) Yapı
Metallerin normal mikroskop ile gözlenemeyen yapısı X ışınlan, elektron ışınları ve
elektron mikroskobu aracılığıyla daha iyi belirlenmiştir. Bu yöntemler metalik ve
metalik olmayan kristallerin birim hücrelerden oluştuğunu kanıtlamıştır. Birim hücre,
üç boyutlu atomların belirli düzende dizildiği ve tüm kristali oluşturan en küçük
öğedir. Birim hücrelerin her doğrultuda birbirleri ile birleşerek yayılması sonucunda
tüm kristal oluşur. Katı metalik cisimlerde bu birleşme bir düzen içerisinde oluşur. Bu
düzenli yapıya kristal yapı denir.
Kristal yapılı malzemeler, düzgün yapıları nedeniyle homojen, dolu, özgül ağırlıkları
ve mekanik özelikleri yüksek; serbest elektronlarının hareketi nedeniyle de ısı,
elektrik ve sesi iyi ileten malzemelerdir.
Bir kristal birim hücresi, bir atomunu merkez almak ve diğer komşu atomların
buna göre konumlarını, yayılış uzaklıkları ve açıları ile belirtmek suretiyle
tanımlanabilir (Şekil 2.4)
Şekil 2.4 Kristal Birim Hücresi
Doğada 7 adet kristal tipi vardır. X,Y,Z eksenlerindeki uzunluklarını a,b,c ve
bunların birbirleriyle olan açılarını göstererek elemanter hücre türleri (kristal
tipleri) Tablo 2.1'de görüldüğü gibi özetlenebilir:
Kristal doğrultular Miller indisleri ile tanımlanır. Miller indislerini bulmak için
orijinden bu doğrultuya paralel ve bir sonraki köşeye kadar uzanan
doğrultu vektörü çizilir. Vektörün eksenle üzerindeki izdüşümlerinin kafes sabiti
cinsinden boyutsuz değerleri parantez içinde yazılır ve aralarında virgül
bulunmaz. Örneğin, (110) doğrultu vektörünün bileşenlerinin z eksenine dik
olduğunu gösterir.
Sırasına bakılmaksızın sayıları aynı olan düzlemler aynı aileye aittir. Kübik
sistemlerde aynı mutlak Miller indislerine sahip düzlemler eşdeğer düzlemler
olup, aynı ailedendir.
Yapı Malzemesi olarak kullanılan metallerin kristal yapıları daha çok kübik ve
hekzagonai sisteme uymaktadır. Kübik sistemin 2 özel şekli vardır (Şekil
2.4, 2.5).
Hekzagonal sistemin sık rastlanan özel bir hali vardır. Bu sistemde birim
kristal hücresinin orta kesitinde 3 atom yer almıştır. Yoğun hekzagonal
sistem olarak adlandırılan bu sisteme en iyi örnekler çinko, kuvars, beril,
kalsit ve mangandır (Şekil 2.6).
örnek: Çinko, kuvars, kalsit ve mangan
Şekil 2.6. Yoğun Hekzagonal Sistem
Tipik bir metal kristali 1018 birim hücresinin düzgün bir blok şeklinde
düzenlenmesinden oluşabilir. Kusursuz bir kristal yapının herhangi iki
hücresinin karşılıklı yüzleri Şekil 2.7-a'da görüldüğü gibi her iki hücre için
de ortak olur.
7
Isı ve basıncın etkisiyle bazı cisimlerin kristal yapılarında değişimler
olabilir. Örneğin, demirin 0 - 910°C de hacim merkezli kübik kristal yapısı var
iken, 910°C - 1400°C arasında kristal yapısı yüzey merkezli kübik olur. Bu
tip kristal yapı değişimine allotropik değişim denir.
Metalik malzemelerin çoğu küçük kristal kümeciklerinden oluştuğundan
polikristal adını alırlar. Bu kristal kümeciklerinin kristal yapısı da kendi içinde
düzenlidir. Kristal kümeciklerinin ayrımını, bunların birim hücrelerinin
değişik yönlerde dizilişinden anlayabiliriz (Şekil 2.7-b). Birleşen kristal
kümecikleri arasında tane sınırı adı verilen atomik bir boşluk vardır. Bu
bölgede belirli bir düzensizlik görülür. İnce yapılı bir metalik cismin kristal
kümecikleri daha küçük yapılıdır. Bu nedenle kaba tane yapılı kristale kıyasla
daha çok tane sınırı bulunmaktadır.
2.3.1.1.
Metalik Kristal Bağları
Metalik birim hücreler atomların karakteristik dizilişi ile tanımlanırsa da
aslında bu düzen iyonların dizilişidir. Katı metalik cisimlerde atomlar,
değerlik elektronları ile çevrilmiş iyonlar olarak bulunur. Metalik kristal bağlar
bu iyonları birim hücredeki konumunda tutan kuvvetlerdir. İyonların dizilişi, ilgili
bütün kuvvetlerin denge konumu ile sağlanır. Pozitif elektrik yükleri bir iyon
8
çifti arasında itme kuvveti yaratır. Benzer şekilde negatif yüklü elektronlar
elektron bulutu içinde elektronların düzgün dağılımını sağlar.
Bu konuya elastik ve plastik davranış kavramlarının açıklanması
sırasında tekrar değinilecektir.
İyonların birim hücrelerdeki konumu sabit değildir. İyonlar sıcaklığa bağlı
termal (ısısal) titreşim yaparlar. Ancak, mutlak sıfır derecesi olan -273
°C'de tamamen hareketsizdirler (Kelvin Teorisi). Sıcaklığın artışı ile titreşim
artar ve iyon hacmi genişler. Erime sıcaklıklarında iyon hareketleri bağ
kuvvetlerini kırabilecek boyutlara erişir ve katı cisim sıvı hale dönüşür.
2.3.1.2.
Anizotropi
Tekil kristal kümeciklerinin (monokristal) özellikleri kristal eksenlerine göre
farklılıklar gösterir. Monokristallerin yönlere göre farklı davranış
göstermesi nedeniyle; mekanik, fiziksel, kimyasal özellikleri, dış etkilerin,
uygulama doğrultusuna bağlı olarak, farklı değerler alabilir, özelliklerin
yönlere göre farklılık göstermesine anizotropi denir.
Anizotropi kristal yapı içindeki iyonların dizilişindeki yönlere göre
farklılıklardan oluşur. Düzgün blok halindeki bir kristal kümesinin davranışı,
aynı konumda bulunan aynı büyüklükteki bir kristalin davranışına benzer
(Şekil 2.7-a). Ancak bir çok metalik malzeme, değişik yönlerde polikristal adı
verilen kristal kümeciklerinden oluşmuştur. Monokristallerin rasgele dağılımı
nedeniyle değişik yönlerdeki çok sayıda karakteristiğin ortalaması polikristalin
karakteristiğini belirler. Bu ortalama, tane sınırının olumsuz etkisi nedeniyle
değişik yönlerin karakteristiklerinin bileşkesi değildir.
Polikristal malzemelerin kristal kümeciklerinin dizilimini metalürjik
yöntemler ile kontrol edebilmek olanaklıdır. Örneğin, transformatör ve elektrik
motor parçaları yapımında kullanılan tabaka çeliklerin kristal kümeciklerinin
birim hücrelerinin paralel hale getirilmesine çalışılır.
Metal tabakalarından kap, tabak, vb. şekillerde gereçler yapılmak
istenirse böyle bir yönlendirilmeden kaçınılır.
9
2.3.1.3. Metalik Yapı Kontrolü ve Bozuklukları
Bir metalik malzemenin yapısı gerekli kesme, parlatma gibi hazırlıklar
yapıldıktan sonra mikroskobik olarak incelenebilir. Bu çalışmalar şu
açılardan çok yararlıdır:
1) Metalik göçmelerin nedenini açıklayabilirler,
2) Metalin geçmişini öğrenerek uygun fabrikasyon işlemini ortaya çıkarırlar,
3) Isıl işlemlerin yeterlilik derecesini saptarlar,
4) Alaşımların geliştirilmesine yardımcı olabilirler,
5) Metal bileşenleri ve özellikleri kestirilebilir.
Kristallerin içinde değişik boyutta yabancı atomlar bulunabilir, bazı kafes
köşeleri boş (eksik atom), bazı atomlar yerinden kaymış ve bazı kristal
düzlemleri yarım olabilir. Bunlardan başka cisim tek yerine çok
kristallerden oluşabilir.
Yukarıda sözü edilen tüm etkenler ve çok kristalli cisimlerde sınır
bölgeleri kütlenin düzenli yapısını bozar ve kusurlu hale getirirler. Bu
kusurların biçimi, boyutu ve miktarı toplam kütleye göre çok az da olsa
özellikleri büyük ölçüde etkirler. (iletkenlik gibi). Metallerin plastik şekil
değiştirmesi, mukavemeti ve iletkenlikleri büyük ölçüde kristal yapı
kusurlarına bağlıdır, malzemelerin gerçek davranışını açıklayabilmek için
bu kusurları yakından tanımak gerekir. Kristal kusurları noktasal, çizgisel
ve yüzeysel olmak üzere üç türe ayrılırlar. Kusur birkaç eksik veya yer
değiştirmiş atomdan oluşursa noktasal kusur denir. Bunların mekanik
özelliklere önemsizdir. Eğer kusur kristalde boydan boya bir çizgi
boyunca uzanıyorsa buna çizgisel kusur (dislokasyon) denir. Bu tür kusur
özellikle metallerin mekanik özelliklerini büyük ölçüde etkiler. Diğer
sonuncu kusur iki boyutlu olup kristallerin yüzeyleri ve çok kristalli
yapılarda kristal bireyleri (tane) arasındaki tane sınırlarıdır.
Bu muayeneler özellikle metalürji bilimi için çok gereklidir.
Metalik kristal kümelerindeki iyon dizilişlerinin düzgün olduğu tanımlanmış ise
de, aslında az da olsa bazı kusurlara rastlanabilir. Bu kusurlar şöylece
sıralanabilir:
1) Tane sınırı bölgeleri bozuklukları,
2) Yabancı iyonların varlığı,
3) Mikroskobik yapı kontrolü işlemleri (kesme, parlatma) sonucu
meydana gelen bozukluklar,
10
4) Fazla sıcaklık nedeniyle ortaya çjkan bazı iyonların konum
bozuklukları,
5) Dislokasyonlar (Bazı iyon sıra ve düzlemlerinin yanlış yerlerde
bulunabilmesi),
6) Mozaik yapı çarpıklıkları.
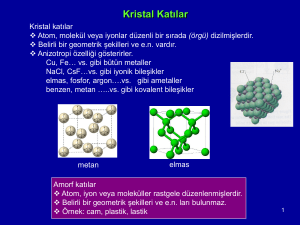
2.3.2. Amorf Yapı
Eğer bir cismin atomlarının dizilişinde rasgele bir düzensizlik var ise bu
yapıya amorf yapı adı verilir. Sıvılar, bazı cisimler örneğin cam, amorf
yapılıdır. Amorf yapılı cisimleri oluşturan atom ve moleküller belirli bir
düzende dizilmemişlerdir. Bu nedenle bazen yüksek dayanımlara sahip
olabilirler. Buna karşılık, plastik deformasyon özelliklerine çoğunlukla sahip
değillerdir.
2.3.3. Bileşik Yapı
Bileşik yapı çok küçük kristal parçalarının gelişigüzel bir yığınından
ibarettir. Yığını tek kitle haline getiren bir bağlayıcı vardır: Bileşik yapıya en
iyi örnekler ahşap ve bir ölçüde çeliktir. Çelikte, cismin çok küçük parçaları
kristal yapı görünümde olmasına karşın, aynı cisim kaba bir bütün olarak
göz önüne alındığında şekilsizdir. Ahşap ise ince kristal liflerin reçineli bir
madde ile yapışmasından oluşmuştur.
Bileşik yapılı cisimler yönlere göre özellikleri değişmeyen, izotrop (örneğin
çelik) veya değişen, anizotrop (örneğin ahşap) yapıda olabilirler. Bileşik
yapılı cisimlerde, mikroskobik iç yapı hatalarına rastlanabilir. Bu kusurlar
kristalin adı verilen küçük kristaller arasındaki bağlayıcı maddede görülen
boşluk, aralık gibi gevşek noktalardır. Tam kristal yapılı cisimlerde de
özellikle serbest yüzeylerinde yukarıda anlatılan benzer kusurlar, kılcal
süreksizlikler vardır. Bu tip yüzey bozuklukları cismin dayanımlarını
şaşılacak derecede düşürebilir.
2.3.4. Kolloidal Yapı
Kolloidal yapıda çok küçük elemanlar halinde bazı cisimler, birbirlerinden ayrı
olarak, ayrı faz veya aynı faz halinde bulunan başka bir cisim içinde
dağılmıştır, örneğin, dumanın içinde oldukça küçük çaplı yanmamış kömür
zerreciklerinin bulunması veya bir sıvının diğer bir sıvı içinde yayılması bu
tip yapılardır. Yol malzemelerinden bitümlü emülsiyonlar bu yapıdadır.
11
2.3.5. Seramik Yapı
Seramikler, metaller ve polimerlerle birlikte en geniş malzeme
gruplarından birini oluştururlar. Seramikler bir metal veya iki metal ile bir
ametal atomun belirli steokimetrik oranlarda birleşmesiyle oluşurlar.
Yalnızca pişmiş toprak malzemeyi temsil etmezler.
Seramiklerde metal olmayan atom çoğunlukla oksijendir. Seramiklerde
metaller katyon, ametaller ise anyon oluşumuna neden olurlar. Böylece
seramiklerde iyonsal bağlar oldukça yaygındır. Ancak seramiklerde
kovalan bağlara, kristal yapıya, hatta amorf yapıya da rastlanır.
Seramikler çeşitli şekillerde gruplandırılabilirler. örneğin, yapılarına göre
şu şekilde sınıflandırılabilirler:
- Kristal seramikler - Tek fazlı (Örneğin MgO) veya çok fazlı
(Örneğin MgO-AI203) seramikler.
- Amorf seramikler - (Doğal veya yapay inorganik camlar.)
- Cam bağlı seramikler - (Kristalleri camsı bir matrisle bağlanmış
seramikler-pişmiş toprak mamuller.) - Çimentolar - (Kristal veya amorf kısımlardan oluşabilen bağlayıcı
maddeler.)
Ayrıca bunlar işlevlerine göre de sınıflandırabilirler. örneğin, pişmiş kil
mamuller, çimentolar, kayalar, vb Cisimler iç yapı açısından çok
karmaşık ve birbirlerinden çok farklıdırlar. Bu nedenle, bugün için
malzemelerin çeşitli mekanik özelliklerinin teorik yollardan, atom fiziği
ilkelerinden elde edilebilmesinin çok zor olduğu söylenebilir. Ayrıca
mühendislik açısından da fazla yararı yoktur. Bu gibi özellikleri örneğin,
malzemelerin dayanım sınırlarını ancak deneysel yöntemlerle
saptayabiliriz. Bu nedenle bugün için malzeme biliminde cismin yük
altında iç yapısında doğan fizik olaylarını incelemek yerine, bunun
makroskobik ve ölçülebilir kaba verileriyle yetinilip, cismin
fenomenolojik (olgusal) özellikleri göz önüne alınır.
2. 4. Moleküller
Atomlar çoğunlukla komşuları ile bağ kurarak daha düşük enerjili,
dolayısıyla kararlı halde bulunurlar; pek azı, asal gazlar gibi, bireysel
haldedir. Moleküller kuvvetli kovalan bağlarla bağlı atom
gruplarından oluşur, ancak moleküller arası bağ zayıf türdendir.Basit
moleküller aynı tür atomları (H2, F, O2, N2 gibi) veya birden azla tür
12
atomları (HF, H20, CO2, CH4 gibi) içerirler. Moleküllerde atomlar 8
valans elektronla (H hariç) çevrilmiştir, elektron yapıları asal gazlardakine benzer, bu nedenle çoğunlukla gaz halinde, pek azı sıvı
halinde bulunur. Moleküllerde atom sayısı arttıkça boyutu büyür,
yanal zayıf bağ oluşma olasılığı artar, boyut büyüdükçe gazdan sıvı,
sıvıdan katı hale geçebilirler. Kovalan bağlar bir doğrultuda uzanırsa
zincir şeklinde yapı (lineer polimerler), iki boyutta uzanırsa tabakalı
yapı (grafit gibi) ve üç boyutta uzayda yapılırsa uzay ağı türü
moleküller yapı (bakalit gibi) oluşur.
2.5. Fazlar
Bir malzemede iç yapı yönünden farklı olan kısımlara faz denir. Her
faz atomların homojen olarak dizilmeleri sonucu oluşan belirli bir
yapıya sahiptir. Bu malzeme içinde mevcut değişik tür fazların
kimyasal bileşimi aynı olur veya olmayabilir, fakat değişik yapıları
dolayısıyla fiziksel özellikleri farklıdır, örnek olarak su ve buz
karışımı gösterilebilir. Bu karışımda su ve buz kimyasal yönden aynı
olduğu halde yapıları ve özellikleri tamamen değişiktir. Bu şekilde
birden fazla tür faz içeren sistemlere çok fazlı sistemler denir. Bir
cisim sıvı halden katı hale geçerken faz dönüşümü oluşur. Farklı
bileşimde olan cisimler sıvı halde kolayca birbirleri içinde atomlar
veya moleküller mertebesinde karışarak eriyik meydana getirirler.
2.6. Katı Eriyikler
Endüstride metalleri birbirleri ile karıştırarak alaşım üretme işlemi
sıvı halde yapılır. Arı bir A metali katılaşınca çok kristalli bir yapı
oluşur, bu yapıdaki her tane birbirine özdeştir, yalnız kristal
doğrultuları rasgele dağılmıştır. A metaline sıvı halde B metali
katılarak elde edilen eriyik katılaşmadan sonrada karışımını korursa
tek fazlı bir eriyik oluşur. Endüstriyel metaller çoğunlukla birden
fazla tür eleman içerirler, pek azı arı halde kullanılır. Arı metallerin
yüksek iletkenlik korozyona dayanıklılık gibi bazı üstün özellikleri
varsa da genellikle yumuşak, mukavemetleri düşük ve pahalıdırlar,
örneğin arı bakır yüksek elektriksel iletkenliği nedeni ile iletken tel,
yüksek korozyon mukavemeti nedeni ile de çatı kaplama malzemesi
olarak kullanılan, bununla beraber yumuşak, mukavemeti düşüktür.
Bakıra %40 kadar çinko katılarak elde edilecek pirinç alaşım çok
daha sert ve mukavemetlidir, aynı zamanda daha ucuzdur.
Metallere katkı elemanları ergimiş halde katılır. Değişik tür atomlar
sıvı halde kolayca karışarak homojen sıvı eriyik oluştururlar.
Katılaşma sırasında yabancı elemanlar kafes yapıda varlığını
13
korursa katı eriyik elde edilir. Bu işleme alaşımlandırma, elde edilen
metale alaşım ve katkı elemanına alaşım elemanı denir. Ayrıca
kafes yapıya sahip ana eleman eriten, içinde dağılmış halde
bulunan eleman eriyen sistem adını alır. Eriyen atomlar eritenin
yerini alırsa yer alan katı eriyiği, kafes boşlukları arasına yerleşirse
ara yer katı eriyiği oluşur. Her iki halde de farklı çaplı atomlar kafes
yapıya girince çevrelerinde gerilme alanı doğar, dolayısıyla enerji
artar. Enerjideki bu artış, mekanik ve elektriksel özellikleri büyük
ölçüde etkiler.
14