A. ATOMUN YAPISI VE
ELEKTRİK YÜKLERİ
Maddenin tüm fiziksel ve kimyasal
özellikleri, en küçük yapı taşı olan
atomun elektronik yapısı ile ilgilidir.
• Maddenin elektrik yüklü olduğu çok
eskiden beri bilinmektedir.
• Süs eşyası yapımında kullanılan
kehribar taşı ,( ağaç reçinesinin
fosilleşmesiyle oluşmuştur) ipek
yada yünlü kumaşa sürtüldüğünde
çok küçük cisimleri çekmesi ile
elektriklenme çok eskiden
gözlemlenmişti.
• Plastik tarak saça sürtüldüğünde
elektriklenir.Saça ve suya
yaklaştırıldığında çeker.
• Yün kazağımızı çıkarırken oluşan
kıvılcım elektrik yükünün bir yerden
bir yere hareket ettiğini gösterir.
• Maddenin elektrikle yüklü hale
gelmesi , maddede elektrik
yüklerinin olduğunun ve
bunların hareket ettiğinin bir
kanıtıdır.
• Bu hareket eden yükün türü
nedir?
ATOM VE ELEKTRİK
• Atomlarda hareketli olan parçacıklar
sadece negatif elektrik yükleridir.
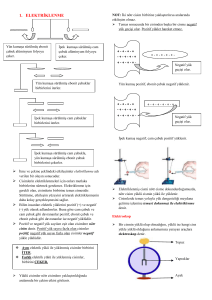
• ELEKTRİKLENME ÇEŞİTLERİ
1. SÜRTÜNME İLE ELEKTRİKLENME
• Ebonit çubuk yün kumaşa sürtüldüğünde
ebonitin (-) , yün kumaşın (+) yüklendiği
görülür. Cam çubuk ipek kumaşa
sürtüldüğünde camın (+), ipek kumaşın ise
(-) yüklendiği görülür. Sürtünme ile
elektriklenme yalnızca bazı yalıtkan
maddeler arasında gözlenebilir.
2. ETKİ İLE ELEKTRİKLENME
Yüklü bir cisme bir başka iletken
cisim yaklaştırıldığında aynı tür
yükler birbirini itip, zıt yükler
birbirini çekeceği için cisimlerin
üzerinde bir yük hareketi
oluşacaktır..
3. DOKUNMA İLE
ELEKTRİKLENME
Yüklü bir cisim nötr veya yüklü bir
başka iletken cisme
dokundurulduğunda aralarında
yük alışverişi olur • Bir süre
sonra yükler dengelenerek yük
alışverişi durur.
• Cisimlerdeki yük varlığını ve
türünü anlamamıza yarayan
alete elektroskop denir.
Elektroskop yüklendiğinde
yaprakları açılır ve yüksüz
olduğunda yaprakları kapalı
durumda olur.
Metaller gibi elektriği ileten
maddelere iletken madde denir,
iletkenlerde elektronlar
serbestçe hareket edebilir.
• Periyodik cetvelde 1A grubu ( H
hariç), 2A grubu, 3A grubu ve
tüm B grubu elementleri
metaldir.
• Elektriği ileten sulu çözeltilere
de elektrolit denir.
• Asitlerin, bazların, tuzların sulu
çözeltileri elektrik akımını iletir.
• Sulu çözeltilerde elektrik
akımını ileten iyonlardır.
ŞİMŞEK, YILDIRIM ve GÖK
GÜRÜLTÜSÜ
Bulutlar hareket ederken birbirlerine
ve hava moleküllerine sürtünürler.
Sürtünme sonucu üzerlerinde
elektriklenme oluşur. Yer yüzünün
buluta yakın olan kısımları da zıt
cinste elektriklenebilir. Bu sebeple
bulut ile yeryüzü arasında zaman
zaman elektriksel boşalma olur.Bu
olaya yıldırım denir.
• Yüksek binaları, kuleleri
yıldırımdan korumak için
yıldırımlık yapılır. Yıldırımlık
(paratoner), toprağa bağlı sivri
uçlu bir metal çubuktur. Bu uca
düşen yıldırımdaki elektrik,
iletken bir kablo yardımıyla
toprağa aktarılır. Böylece
paratoner yardımıyla yıldırımın
tehlikelerinden korunuruz.
Bulutlarda biriken elektrik yalnız
yer yüzüne değil, bulutun bir
noktasından diğer bir noktasına
da boşalabilir. Bu olaya şimşek
denir.
Gerek şimşek, gerekse yıldırım,
ışık ile birlikte şiddetli bir ses
meydana getirir. Bu sese gök
gürültüsü denir. Işık, sesten çok
daha hızlı yayılır. Şimşeklerin
çaktığı bir havada ilk önce
parlak ışığı görür sonrada gök
gürültüsünü duyarız.
Örneğin; gök gürültüsünün
şimşekten bir saniye sonra
duyulması yıldırımın 350 metre
uzakta oluştuğunu bize gösterir.
Elektrikte yük hareketi negatif
elektrik yüklerinin hareketiyle
gerçekleşir. Pozitif yükler
hareketsizdir.
Bir atomda pozitif yükler ile
negatif yükler birbirine eşit ise
buna nötr (yüksüz) atom denir.
• Eğer nötr bir atom elektron
kaybetmiş ise pozitif yükler
çoğunlukta olacağı için bu
atoma pozitif yüklü atom (iyon)
denir.
Eğer nötr atom elektron kazanmış
ise bu atoma negatif yüklü atom
(iyon) denir.
Yükler arasındaki bu kuvvete
.
Coulomb
kuvveti denir.
Aynı tür yükler birbirini iter, zıt
yükler birbirini çeker
UYARI
I . Aynı cins elektrik yükleri ile yüklü
cisimler birbirlerini İTERLER.
+
+
-
-
UYARI
II. Zıt yükler birbirlerini ÇEKER.
+
• Elektriklenme atom alışverişi ile
olmaz.Olsaydı iki maddenin de
yapısının değişmesi gerekirdi.
• Cam çubuk, ebonit çubuk,
plastik çubuk, tarak sürtülürken
herhangi bir değişikliğe
uğramamıştır.
ETKİNLİK 1: Plastik çubuk ve
cam çubuktaki elektriklenme
• ETKİNLİK 1 : Sürtme ile elektriklenme ve atomik yapı
• AMAÇ: Atomun elektrikli bir yapıya sahip olduğunu
belirlemek.
• ARAÇ VE GEREÇLER:
• plastik cetvel (plastik çubuk, tarak) 2 adet
• cam çubuk (cam deney tüpü)
2 adet
• döküm ayak
1 adet
• ikili bağlama parçası
1 adet
• demir çubuk (50 cm)
1 adet
• yalıtılmış çubuk
1 adet
• yünlü kumaş parçası
1 adet
• ipekli kumaş parçası
1 adet
• iplik
• ETKİNLİĞİN YAPILIŞI
• A) Etkinlik düzeneğini kurunuz.
• B) İple astığınız plastik cetvele kumaş parçasını
sürtün.
• C) Diğer plastik cetvele de yün kumaş parçasını
sürtünüz.
• Şimdi bu cetveli iple asılı cetvele yaklaştırınız.
• D) İpteki plastik cetveli çıkarınız.
• Yerine cam çubuğu bağlayınız.
• E) Cam çubukları ipek kumaşa sürterek
elektriklenmelerini sağlayınız.
• F) Cam çubuğu asılı cam çubuğa yaklaştırınız.
• İki Cam çubuk birbirini itiyor mu?
• SONUÇ:
• 1. Sürtme ile elektriklenmiş iki cetvel birbirini
itmektedir.
• 2. Elektriklenmiş iki cam çubuk birbirini itmektedir.
• 3. Cam çubuk ve plastik cetvel birbirini
çekmektedir.
• Buradan şöyle bir sonuca varılabilir.
• Benzer deneyler yapıldığında elektriklenmeler
farklıdır.
• Cam çubuk ve plastik cetvelde olduğu gibi.
• Cam çubuğun yükü artı (+), plastik çubuğun yükü
eksi (-) kabul edilir.
• Bu, tabiatta iki farklı tür yükün olduğunu gösterir.
• Atomun çekirdeğinde bulunan protonlar,
elektriklenme sırasında yer değiştirmez.
• Elektriklenmede, elektronlar yer değiştirir.
• Mesela: plastik çubuğun elektriklenmesini
atom modeline göre açıklayabiliriz.
• Başlangıçta plastik çubuk yüksüz idi.
• Proton sayısı elektron sayısına eşit
durumdaydı
• Böylece; plastik çubukta elektron
fazlalığı, yün kumaşta ise elektron
eksikliği vardır.
• Plastik çubuk(-), yün kumaşta(+)
yüklü olur
• Yani bir maddedeki elektronlar
başka bir maddeye geçebilmektedir.
• Elektron veren atom (+) yüklü,
elektron alan atom (-) yüklü hale
gelmektedir.
• Bu olay atomun elektrikli yapıda
olduğunu gösterir.
• Sürtme ile elektriklenme
sırasında protonlar yer
değiştirmez.
• Protonlar sabit kalarak sadece
elektronlar yer değiştirir.
• Eğer elimizdeki kazağı sönük bir
floresan lambaya yaklaştırırsak
lambanın hafifçe parladığını da
görürüz. Yünlü bir eşyaya
sürülmüş ebonit çubuk kağıt
parçacıklarını çeker. Bunun
nedeninin ebonit çubuk
üzerindeki elektrik yükleridir
ETKİNLİK 2:
YÜKLÜCİSİMLERİN ELEKTROSKOBA
ETKİSİNİN İNCELENMESİ
• ETKİNLİK AMACI: Yüklü cisimlerin
elektroskop üzerindeki etkisini incelemek.
• KULLANILAN ARAÇ VE GEREÇLER:
• 1-elektrostatik takım
• 2-elektroskop
• HAZIRLIK SORUSU:
• 1-Bir cismin yüklü olup olmadığını nasıl
anlarsınız? Araştırınız.
• 2-Yüklü bir elektroskopun yükünü nasıl
boşaltabiliriz?Tartışınız.
• El TEORİK BİLGİ :
Bir cismin yüklü olup olmadığını yüklü
ise yükünün, cinsini bulmak için
kullanılmaya yarayan araca “Elektroskop”
denir. elektroskop yüksüzken metal
yapraklar kapalıdır. ( - ) yükle yüklenmiş bir
elektroskopun topuzuna parmağımızla
dokunursak, negatif yükler vücudumuz
üzerinden toprağa akar, elektroskop nötr
hale gelir ve yaprakları tamamen kapanır.
(+) yüklü elektroskopta; negatif yükler
topraktan elektroskopa geçer ve yapraklar
yine kapanır. Bu olaya “elektroskobun
boşalması” denir.
• ETKİNLİĞİN YAPILIŞI:
• 1. Yüklü bir cismi nötr bir elektroskoba
yaklaştırırsak, topuz yaklaştırılan cismin
yükünün zıttı ile, yapraklar ise aynı yükle
yüklenirler.
• Yapraklar açılır.
• 2. Yüklü bir cismi nötr bir
elektroskopa dokundurursak
topuz ve yaprak aynı yükle
yüklenir.
• Yapraklar açılır.
• 3. Yüklü bir cismi zıt yüklü bir
elektroskoba yaklaştırırsak,
elektroskobun ve yüklü cismin yük
miktarına bağlı
olmak şartıyla;
• a)Yapraklar biraz
kapanabilir.(Elektroskop yükü çoksa)
• b)Yapraklar tamamen
kapanabilir.(Yükler eşitse)
• c)Yapraklar önce kapanıp sonra
açılabilir.(Cismin yükü çoksa)
• 4. Yüklü bir cismi aynı yüklü bir
elektroskoba yaklaştırırsak
yapraklar biraz daha açılır.
• Eğer dokundurulursa ;
• a)Yapraklar biraz açılır. (cismin
yükü fazla ise)
• b)Yaprakta değişme olmaz.
(yükler eşit ise)
• c)Yapraklar biraz
kapanır.(Elektroskobun yük
fazla)
• 5. Yüklü bir cismi zıt yüklü bir elektroskopa
dokundurursak, yük miktarlarına bağlı
olmak şartıyla üç durum gözlenir:
• a)Yapraklar biraz
kapanabilir.(Elektroskopun Yükü fazla ise)
• b)Yapraklar tamamen kapanabilir. (Yükler
eşitse)
• c)Yapraklar önce kapanıp sonra zıt
yüklenerek açılabilir.(Cismin yükü fazla ise)
ETKİNLKİ 3:YÜKLÜ BİR EBONİT
ÇUBUĞUN SUYU ÇEKTİĞİNİN
GÖZLENMESİ
• ETKİNLİĞİN AMACI: Elektrikle
yüklenmiş yalıtkan maddelerde
bulunan elektronların, uygun
ortamda bir başka maddeye
aktığını görmek.
• HAZIRLIK SORUSU:
• Yüklü bir ebonit çubuk çeşmeden
akan suya yaklaştırılırsa suyun
akışını etkiler mi? Tartışınız.
• KULLANILAN ARAÇ VE
GEREÇLER:
• Döküm ayak, statif çubuk,
bağlama parçası, şişe tutturucu,
kısa cam boru, tek delikli tıpa,
geniş beherglas, tabanı kesik
şişe, ebonit çubuk, yün parçası,
su
• TEORİK BİLGİ:
• Yünlü kumaş parçasına sürtülerek
negatif ( - ) yükle yüklenen ebonit
çubuk, çeşmeden ip şeklinde çok
ince akan suya yaklaştırılırsa suyu
kendine doğru çeker. Çünkü bir
iletkene (metal, su .. ) yaklaştırılan
yüklü bir cismin etkisiyle, yüklerin
ayrılmasına “etkiyle elektriklenme”
denir.
• Yaklaştırılan cisimdeki yüklerin
etkisiyle iletkendeki aynı cins
yüklerin itildiği, zıt yüklerin
birbirini çektiği görülür.
•
•
Etki ile elektriklenmede yüklü
cisimle nötr cisim birbirlerine
dokunmadığından aralarında
elektron alış verişi olmaz. Yalnız nötr
cismin elektronları yer değişir. Yüklü
cisim uzaklaştırılırsa elektronlar
tekrar eski yerlerine dönerler. Bu
şekilde cisim tekrar nötr hale gelir.
• ETKİNLİĞİN YAPILIŞI:
• 1-Statif çubuğa bağlama
parçası takıp, bu parçaya şişe
tutturucusunu takınız.
• 2-Cam boruyu lastik tıpaya
geçiriniz ve
şişenin ağzına
sıkıca kapayarak şekildeki
düzeneği hazırlayınız.
• 3-Beherglasa su koyunuz. Cam
borunun ağzını kapatarak şişeye su
doldurunuz.
• 4-Ebonit çubuğu yüne sürterek
elektrikle yükleyiniz.
• 5-Parmağınızı cam borudan çekiniz
ve akan suya yüklediğiniz ebonit
çubuğu yaklaştırınız. Çubuğun suyu
çektiğini gözleyiniz. Çubuğu ters
tarafta tutarak deneyi tekrarlayınız.
• ETKİNLİĞİN SONUCU:
• Yüklü bir cisim bir iletkene
yaklaştırıldığında yüklerin
ayrılmasına neden olur. Bu olaya
“elektrostatik indüksiyon”
(etkiyle elektriklenme ) denir.
FARADAYIN ELEKTROLİZ
DENEYLERİ
• Aslında maddenin elektriksel
yapısına ilişkin ilk kanıtlar 1834
yılında M. Faraday tarafından
ortaya konmuştur.
• Faraday, elektriğin maddeler
üzerindeki etkisini inceleyerek
elektroliz deneylerini
gerçekleştirmiştir.
• Elektroliz deneylerinde bir
elementin çeşitli bileşiklerinin
sulu çözeltilerine elektrik akımı
uygulamış ve ve elektrotlarda
elementler elde etmiştir.
• Faraday kimyasal bileşiklerin
sulu çözeltilerinden elektrik
akımı geçirerek kimyasal yapıda
değişiklik sağlandığını
göstermiş ve maddenin
elektriksel yapısı hakkında ip
uçları elde etmiştir.
• Faraday katotta elementi saf
olrak elede etmiş ,ve katotta
belirli bir miktar madde elde
etmek için bir elektrik yükü
yada bu yükün basit katları
kadar elektrik yükü
taşıyabileceğini farketmiştir.
• Faraday elektrik yüklerinin
parçacıklar halinde taşındığını ,
elektriğin tanecikli yapıda
olduğunu göstermiştir.Faraday ,
atomların elektrik yüklerini
taşıdığını ve bu taneciklerin
atomda olduğunu belirtmiştir.
• Elektrikle kimyasal değişme
ilişkisi , İngiliz fizikçisi ve
kimyacısı Michael Faraday
(1830) tarafından bulunmuştur.
Bugün hala kullanılan elektroliz,
elektrolit, elektrot, anot ve
katot, Faraday'ın ortaya attığı
terimlerdir.
ELEKTROLİZDE KULLANILAN TERİMLER
• Elektroliz: Bir bileşiği kendisini
oluşturan elementlere ayırmak
için elektrik enerjisinden
yararlanarak yapılan kimyasal
bir ayrıştırma işlemidir.
• Elektrolit : Elektrik akımını ileten,
elektrolize uğrayan sıvıdır.
İyonlardan oluşur. (İyonik bağlı
bileşiklerin katıları halde elektrik
akımını iletmediği, sıvı halde veya
sulu çözeltilerinin ilettiği
unutulmamalıdır.)
• Elektrot : Elektrik akımını ileten
çubuk. Elektrolit ile tepkime vermesi
gerekir. Genellikle soy metaller ( Cu,
Ag, Pt, Au ) kullanılır.
• Katot :
• Katyonların ((+) yüklü iyonların) gittiği ver.
• İndirgenmenin ( elektron almanın ) olduğu
yer.
• (-) yüklü çubuk.
• Anot :
• Anyonların (-) yüklü iyonların gittiği yer.
• Yükseltgenmenin ( elektron vermenin )
olduğu yer.
• (+) yüklü çubuk.
FARADAY’IN 1.KANUNU
• Elektrolizde biriken madde
miktarı elektrik yükü miktarı ile
doğru orantılıdır.
• Devreden geçen elektrik yükü
doğrudan bilinemeyeceği için
ampermetre ile ölçülür.
• Akım Şiddeti ( I) : Bir elektrik
devresinden birim zamanda ( 1
saniyede ) geçen elektrik yükü
miktarına akım şiddeti denir.
Akım şiddeti birimi Amper dir.
Amper = Coulomb / Saniye dir.
• Devreden geçen ,
• elektrik yükü Q (Coulomb)
akım şiddeti
I (amper)
• Zaman
t ( saniye)
• Elektrik yükü miktarı Q= I. t
• Örnek : Bir elektrik devresinde 50
saniye süre ile 150C yük geçerse
akım şiddeti kaç amper olur?
• Çözüm :
t = 50 s
q=150C
I= q /t = 150 / 50 = 3 Amper
olur.
I =?
• Devereden 1 Amperlik elektrik akımı
1 saniye süre ile geçerse 1 kulonluk
( C) elektrik yükü elde edilir.
• 96500kulonluk elektrik yüküne 1
Faraday denir.Bu sırada devrede 1
mol elektron kullanılır.
• Elektrik yük birimi olan coulomb (C) ,
•
• Gümüş nitrat çözeltisinin
elektrolizinde , katotta 1,118 mg
metalik gümüş birikmesine
neden olan elektrik yükü
miktarına denir.
96500 coulomb= 1 Faraday = 1 mol elektron
FARADAY’IN 2. KANUNU
• Devreden 1 Faraday’lık akım
geçtiğinde elektrotlarda 1 eşdeğer
gram madde toplanır.
• Elektrotlarda biriken madde miktarı
•
•
m= Q.MA
96500. Td.
• MA : Mol kütlesi
• Td: Atomun aldığı yada verdiği
elektron sayısı
• Q:Elektrik yükü
• m:Elektrotlarda açığa çıkan
madde miktarı
• Elektroliz deneylerinden
yararlanan İngiliz kimyacı
Humphry Davy , bileşikleri
ayrıştırmak için elektrik akımı
kullanarak potasyum, sodyum,
kalsiyum, stronsiyum ve baryum
elementlerini saf olarak
bileşiklerinden ayırarak elde
etmiştir.
ELEKTROLİZLE
KAPLAMACILIK
• Bir metalin üzeri başka bir
metalle kaplanır.
• Kaplanacak metal katottur.
• Elektrolit olarak , kaplamada
kullanılacak metalin tuzu
kullanılır.
• Anot ise kaplamada kullanılan
metaldir
Bakır bileziği altınla kaplama
• Anot
: Altın plaka
• Katot
: Bakır bilezik
• Elektrolit : Altının suda çözünen
bir tuzu
• Anotta çözünen altın plaka ,
katotta bakır bileziğin üstünde
toplanarak, bileziği kaplar.
SUYUN ELEKTRİK AKIMININ
ETKİSİYLE ELEMENTLERİNE
AYRILMASININ GÖZLENMESİ
• ETKİNLİK AMACI: Bileşikleri
(su) elektrik enerjisi ile
ayrıştırarak başka saf
maddeler elde etmek.
• HAZIRLIK SORULARI:
• 1-Farklı yükler birbirini çekerler
yargısı elektrotta gerçekleşen
olaylar için söylenebilir mi?
Araştırınız.
• 2-Suyu oluşturan gazlardan
oksijen gazı hangi elektrotta
toplanmasını beklersiniz?
• 3-Suyun elektrolizinde oluşan
hidrojen ve oksijen gazları
arasındaki yaklaşık oran nedir?
Araştırınız.
• 4-Saf su ile elektroliz olayını
gerçekleştirmek mümkün
müdür?
TEORİK BİLGİ
•
•
Bir bileşiğin elektrik
yardımıyla bileşenlerine
ayrılma olayına “elektroliz”
denir. Herhangi bir bileşiğin
elektrolizinde bileşiğin
anyonu anottan, katyonu ise
katottan açığa çıkar.
• Elektroliz düzeneğinde pozitif ve
negatif kutupların her ikisine
birden “elektrot” denir. Güç
kaynağının pozitif kutbuna
bağlanan elektrot “anot” ,
negatif kutbuna bağlanan ise”
“katottur”. İki kutup arasında
elektrik taşınmasını sağlayan
iletken çözeltiye “elektrolit”
denir.
• Suyun elektrolizinde katotta ( - )
“hidrojen, anotta( + ) ise oksijen
gazı toplanır. Deney sırasında
bir süre sonra tüplerde
toplanan hidrojen gazı hacim
olarak oksijen gazının iki katı
olur.
• Yapılan deneyde yaklaşık olarak
1 coulomb’luk yükün devreden
geçmesi halinde yaklaşık olarak
0,12 cm3 hidrojen, 0,06 cm3
oksijen gazının açığa
çıktığı görülmüştür.
ETKİNLİK DÜZENEĞİ
ETKİNLİĞİN YAPILIŞI
• 1-Bir beherglas içerisine 500 ml
su koyunuz. İçine az miktar
sülfirik asit veya 30 gr kadar
çamaşır sodası (Na2CO3)
koyarak çözeltinizi hazırlayınız.
• 2-İki deney tüpünü de
hazırladığınız çözeltiyle ağzına
kadar doldurunuz. Sonra hava
almayacak şekilde parmağınızla
kapatarak ters çeviriniz ve
beherglas içerisindeki çözeltiye
daldırınız. Tüpleri Bunzen
kıskacıyla sabitleyiniz.
• 3-Elektrotların uçlarını şekilde
görüldüğü gibi tüplerin içlerine
yerleştiriniz. Krokodilleri
elektrotlara bağlayarak, diğer
uçlarını güç kaynağının doğru
akım çıkışına bağlayınız.
• 4-Tüplerdeki gaz birikmesi sona
erdikten sonra yine hava
almayacak şekilde sudan
çıkarınız. Tüplere kibrit alevi
yaklaştırdığınızda patlayarak
yanan gaz hidrojen (yanıcı gaz),
alevi daha parlak yakan gaz ise
oksijen (yakıcı gaz) gazıdır.
ETKİNLİĞİN SONUCU
• Suyun elektrolizinde; ( - ) kutba
bağlı olan tüpte iki hacim
hidrojen , ( + ) kutba bağlı olan
tüpte bir hacim oksijen gazı
toplanır.
ELEKTRONUN KEŞFİ
CROOKS TÜPÜ
• 1870 ‘de İngiliz Fizikçi Williams
Crooks , Vakumlu tüp
geliştirmiştir.Bu vakumlu tüp
içerisinde gazların elektrikle
etkileşimi sonucu ortaya çıkan
davranışlarını incelemiştir.
• Crooks tüpleri olarak bilinen bu
tüpler televizyon tüplerinin
yapılmasında öncü olmuştur.
• Crooks tüpünde elektrotlar
arasına yüksek gerilim
uygulandığında tüpün cam
çeperinde sarı- yeşil floresan
ışık yansıması meydana
gelir.Tüpün ortasına bir nesne
yerleştirildiğinde ise tüpün
sonunda bir gölge oluşmaktaydı.
• Crooks gölgenin oluşmasında
bazı ışınların etkili olabileceğini
belirtmiştir.Bu ışınlara daha
sonraları katot ışını adı
verilmiştir.
• Katot Işını:Katottan anota
hareket eden ışınlara katot
ışınları denir.Katot ışınları
doğrusal yol boyunca hareket
eden negatif taneciklerdir.katot
ışınları hızla hareket eden (-)
yüklü taneciklerdir.
• Crooks , buradan katot
ışınlarının doğrusal hareket
ettiği sonucuna varmıştır.
ELEKTRONUN KEŞFİ
STONEY
• 1891 yılında ise J. J. Stoney
elektriğin taneciklerden ibaret
olduğunu ve bu taneciklerin
atomun yapısında da
bulunduğunu önermiş ve 1891
yılında bunları elektronlar
olarak isimlendirmiştir.
• John Stoney’e göre bu negatif
elektrik yükleri ( elektronlar)
her maddede farklı miktarda
bulunmaktadır.
• Maddenin nötr olması için bu
negatif yüklere eş sayıda pozitif
yük bulunması gerekir.
• 1897 yılında Joseph John
Thomson havası alınmış
tüplerde katot ışınlarına
manyetik alan ve elektriksel
alan uygulayarak davranışlarını
incelemiştir.
• Thomson elektriksel alan
uygulanan katot ışınlarının
negatif kutup tarafından
itildiğini ve pozitif kutba doğru
çekildiğini belirlemiştir.
• Aynı cins elektrik yükleri
birbirini itmesi ve zıt yüklü
elektrikli yüklerinin birbirini
çekmesinden dolayı katot
ışınlarının negatif elektrik
yükleri olduğunu belirlemiştir.
• Thomson deneyini farklı metal
ve gazlarla tekrarladığında ,
katot ışınlarının davranışlarında
bir değişiklik olmadığını
belirleyerek,
• Katot ışınlarının maddenin
cinsine bağlı olmadığının
sonucuna varmıştır.
ELEKTRONUN KÜTLESİ VE
YÜKÜNÜN BULUNMASI
• Thomsan atom modelinde (-) ve
(+) yüklerden bahsetmiştir.
• Elektriksel ve manyetik
alanların şiddetinden
yararlanarak , elektron için
1897 yılında
• Yük
, e_ oranını bulmuştur.
• Kütle
m
• Yük
Kütle
e_ oranını
m
-11
1,7588.10
-1
C.kg olarak buldu.
• İngiliz fizikçi Thomson ,Gazların
elektrik iletkenliği üzerine
yaptığı çalışmalardan dolayı
Nobel Fizik ödülü almıştır.
MİLLİKAN’IN YAĞ
DAMLASI DENEYİ
• Elektronun yükü ilk defa 1908
yılında Robert Andrews Millikan
tarafından ölçülmüştür.
• Elektrik yükünü Millikan yağ
damlası deneyi ile ölçmüştür.
• Millikan yağ damlası
düzeneğinde ,yüklü levhalar
arasına yağ damlacıklarını
küçük bir delikten göndermiş ve
yağ damlaları ,aşağıya doğru
inerken X ışınları göndermiştir.
• Yağ damlacıkları bu X ışınları
tutarak negatif yüklenmiştir.
• Üst plaka ( + )
• Alt plaka ( - )
• Negatif yüklü yağ
damlacıklarının aşağıya doğru
düşmemesini sağlayarak , üst
plaka tarafından çekilmesini
sağlayarak , yukarı hareketi ile
damlacığın davranışlarını,
düşme hızını , mikroskopta
gözlemleyerek bulmuştur.
• Millikan yağ damlacığının
yükünü , elektronun yükünü,
-19
• -1,6.10
Coulomb olarak
bulmuştur
• Millikan elektronun yükünü
bulduktan sonra , Thomson’un
e/m değerinden faydalanarak
elektronun kütlesini de
hesaplamıştır.
Elektronun Kütlesi
-31
Yük__=
yük
kütle
-28
9,21096.10 kg =9,21096.10
Olarak hesaplamıştır.
gr
• Millikan’dan önce bilim adamları
su damlacıklarını kullanmışlardı.
• Kullanılan yağ damlacığının
düşük buhar basıncına sahip
olanını tercih eden Millikan yağ
damlacığının , ışık kaynağının
etkisiyle buharlaşmasını
önleyerek , deney boyunca yağ
damlacığının kütlesinin sabit
kalmasını sağlamıştır.
ATOMDA ELEKTRONUN YÜKÜ İLE
POZİTİF YÜKLER ARASINDAKİ İLİŞKİ
• Nötr bir atomdan bir veya daha
çok elektron koparıldığında
geriye kalan tanecik , koparılan
elektronların toplamına eşit
miktarda pozitif yük kazanır.
• Elektron kaybeden atom (+) yük
kazanır.
• Crooks tüpünde , katot ışınları tüpün
içindeki gaz atomlarından
elektronların ayrılmasına neden
olduğundan pozitif yüklü iyonlar
oluşmuştu.
• Bu iyonları ilk araştıran Alman bilim
adamı Goldştayn ‘dır. Bu iyonlara
pozitif iyonlar yada kanal ışınları adı
verilmiştir.
• Thomson elektronun kütlesini ,
• Pozitif iyonların kütlesinin
1/ 1836 ‘sı olarak hesaplamıştır.
• Elektrik yükü
• Pozitif elektrik yükü
• Negatif elektrik yükü
kütlesi
1
1/1836
• Rutherford 1918 yılında pozitif
yüklü alfa taneciklerini azot,
flor, sodyum, alüminyum, fosfor
ve bor elementlerine
gönderdiğinde hepsinin H+
iyonuna eşit pozitif tanecikler
saçtığını gözlemiştir.
• Rutherford , bütün elementlerin
atomlarında elektronun yüküne
eşit fakat zıt yüklü taneciklerin ,
protonların bulunduğunu
belirlemiştir.
• Aşağıda verilen özelliklerden
hangisi katot ve kanal ışınları
için yanlıştır?
•
•
•
•
A) Yüklü taneciklerden oluşma
B) Doğrusal hareket etme
C) Elektrik alanda saparlar
D) Kullanılan gaz değiştiğinde
içerdiği taneciğin değişmesi
• E) Ekranda iz , gölge oluşturma
• Çözüm: Katot ışınları negatif
yüklü elektronlardır.Kullanılan
maddenin cinsine bağlı
değildir.Doğrusal hareket
ederler.Ekran üzerinde iz
bırakırlar.
• Kanal ışınları ise pozitif
iyonlardır.Doğrusal hareket
ederler.Kullanılan gazın iyonu
içerirler.Katot ışınları maddenin
cinsine bağlı değilken kanal
ışınları bağlıdır. D şıkkı yanlıştır.
ATOM NUMARASI VE
ÇEKİRDEK YÜKÜ
• Nötr bir atomda pozitif yük
sayısı , negatif yük sayısına
eşittir.Yani elektron ve proton
sayıları aynıdır.
• Atomdaki proton sayısı o
elementin çekirdek yükü ve
proton sayısı olarak adlandırılır.
• Atom numarası Z ile gösterilir.
ATOMUN PROTON SAYILARININ
BELİRLENMESİ
• İngiliz kimyacı Henry Moseley ,
1912 yılında X ışınlarını
kullanarak, değişik elementlerin
farklı X ışınları spektrumunu
elde etmiştir.
• Spektrumları incelediğinde her
elementin sadece birkaç
karekteristik spektral çizgi
içeren X ışınları spektrumu
olduğunu görmüştür.
• Moseley, elementlerin atom
numaralarını doğru bir şekilde
belirlemiştir.
• Moseley, elementlerin özelliklerinin
atom kütlelerinden değil, atom
numaralarına bağlı olduğunu
deneysel olarak belirlemiştir.
• Bu sonuç, atom kütlelerine göre
sıralanarak oluşturulan
Mendeleyev’in elementler
tablosunu değiştirerek
günümüzde kullanılan
elementlerin atom numaralarına
göre sıralandığı Periyodik tablo
oluşturulmuştur.
• HENRY MOSELEY
• Moseley atom numaraları 13 ile 79
arasında olan 38 elementin X-ışınları
spektrumunu inceledi.Her elemen
için o elemente karşılık gelen
karakteristik spektrum çizgisini
kullanan Moseley , elementin atom
numarası ile çizgi frekansının kare
kökü arasında doğrusal bir ilişki
olduğunu
• buldu.Başka bir değişle
elementler atom numarası
artışına göre dizildiğinde
spektrum çizgisi frekansının
karekökü bir elementten
diğerine gittikçe sabit bir
miktarda artar.
• Henri Moseley elementlerin
spektrumlarını incelediğinde Ca
ve Ti elementleri arasında bir
uyumsuzluk olduğunu gördü.Bu
iki element arasında başka bir
element bulunması gerektiğini
belirterek Sc elementinin
keşfedilmesini sağlamıştır.
• Bundan dolayı Moseley X-ışınları
spektrumuna dayanarak
elementlerin doğru atom
numaralarını tahmin
edebildi.Böylece atom ağırlıkları
komşu atomlarınkine uygun
düşmeyen K,Ni ve I un
sınıflandırılması problemi de
çözümlenmiş oldu.
• Diğer taraftan Moseley Ce den Lu e
kadar olan seride 14 element
bulunması ve bu elementlerin ve bu
elementlerin periyodik çizelgede
Lantan’dan sonra gelmeleri
gerektiğini bildirdi.Moseley’in
diagramları ayrıca 79 numaralı
elementten önce henüz o zamana
kadar bulunmamış 4 elementin var
olması gerektiğini de gösterdi.
• Nihayet Moseley’in
çalışmalarına dayanarak
periyodik yasa
• “Elementlerin fiziksel ve
kimyasal özellikleri atom
numarasının periyodik
fonksiyonudur” şeklinde tekrar
tanımlandı.
• Moseley ayrıca, atomda bir
elementten diğerine gidildikçe
artan temel bir nicelik
bulunduğunu ifade ederek bu
niceliğin ancak merkezdeki artı
yüklü çekirdeğin yüklü
olabileceğini belirtti.
• Moseley,Atom numarası ile
proton sayısının aynı olduğunu
belirterek bu yükün çekirdek
yükü olduğunu belirtmiştir.
• Henry Moseley:
• Periyodik Sistemin, elementlerin fiziksel
ve kimyasal özelliklerinin atom
numarasının periyodik bir sonucu olduğunu
belirtmiştir.
• Periyodik cetvelde aynı gruptaki
elementlerin fiziksel ve kimyasal özellikleri
birbirine benze özellikler
göstermektedirler.
Periodik Tablo 1911
Kütle numarası
K.N.
X
Atom numarası
Z
Moseley’in Ölümü: 10 Aug
1915
Moseley’s death:10 Aug 1915
1915 (8 Ağustos, 05:00) Baldwin kuvvetleri Conk Bayrı’nın kuzey
bölümüne hücum edecektir. Bir süre sonra Birlikler Çiftlik (Farm)
denilen bölgede sıkışırlar. Ne ileri ne geri gidilebilmektedir.
Baldwin Q tepesine ulaşma amacı için açık olan sol taraftan
hücuma karar verir. Ancak hücum başarısızdır. Çiftlik alanını
tutmaya çalışırlar.
(9 Ağustos) Baldwin’in birliği hala Çiftlik’tedir.(Baldwin’s unit is in
the Farm)
(10 Ağustos) Türkler karşı atağa geçerler. Conk Bayırı’ndan Çiftlik
(Ağıl Dere)’ye akarlar. Gögüs göğüse bir savaş olur. İngiliz Kuv.
Kom. Sir Hamilton’un daha sonraki tasvirine göre ‘bu kadar
umutsuz bir savaş tanımlanamaz. Muhteşem döğüşen Türkler,
Allah’ın adını tekrarlayarak dalga dalga geliyorlardı.
Adamlarımız bu akışa kahramanca tüm gücleri ile karşı
koydular. Hiçbir fedakarlıktan kaçınmadılar. Dayandıkları
yerlerde öldüler.’ Baldwin ve tüm adamları ve bu arada
haberleşme subayı HM, yaşayan İngiliz bilimci gençlerinin en
gelecek vaat edeni, de bu savaşta yaşamını yitirdi.
(Moseley’s death)
Aynı gün, bir başka mermi de, Türk Birlikleri Komutanı Alb. Mustafa
Kemal’in cep saatine çarparak onun yaşamını kurtaracak, bu
tesadüf ise Türk ulusunun tüm kaderini değiştirecektir.
• İngiliz fizikçi ve kimyacı
Moseley 1915’te Çanakkale
Savaşında ölmüştü ve orda
yatıyordu!...
• Atatürk’ün dediği gibi, artık
düşmanımız değil, dostumuz,
hatta bizim de fizikçimiz
sayılırdı..
TÜBİTAK BİLİM TEKNİK, Haziran 2002
(my article on H.M. TBT, June 2002
Doğadaki en küçük elektrik yükü
elektronun ve protonun yüküdür.
Bunlar birbirine değer olarak
eşit fakat işaret olarak zıttır.
Elektron ve protonun yükü çok
küçük olduğu için yük birim
olarak coulomb (C) kullanılır.
Atom,maddenin en küçük yapı taşıdır.
Elektron ( e - )
Yörünge
Proton ( p +)
+p
0n
Çekirdek
Nötron (n 0 )
Atomun Yapısı
• Kütle numarası
27
3+
iyon yükü
X
Atom numarası
13
10
elektron sayısı
NÖTRONUN KEŞFİ
• Atomun kütlesi , protonların
kütlelerinin toplamından
büyüktür.Bu büyüklük ya iki katı
kadar yada daha fazla büyüktür.
• Protonların kütlesinin yarısı
kadar yada daha fazla olan
tanecik nedir?
• 1920 yılında Rutherford
çekirdekte yüksüz taneciklerin
olabileceği fikrini ileri
sürmüştür.
• 1932 yılında İngiliz fizikçi James
Chadvich , çekirdek reaksiyonları
üzerinde yaptığı çalışmalar
sonrasında ,atomun çekirdeğinde
protonlardan başka , kütlesi
protonun kütlesine eşit olan yüksüz
tanecikleri bularak bu taneciklere
yüksüz anlamındaki nötron adını
verdi.
• Atomun çekirdeğinde pozitif
yükleri bir arada tutan nötronu
keşfeden James Chadvch ,1935
yılında bu çalışmasıyla Nobel
Fizik ödülünü almıştır.
• Kütle numarası= Proton sayısı+ nötron sayısı
• K.N. = p + n