1
SIVI ÇÖZELTİLER KONU ANLATIMI-1
ÇÖZELTİ OLUŞUMU
Çözeltilerin bir çok türü vardır. En yaygını, çözücünün sıvı, çözünenin ise katı ya da sıvı olduğu sıvı çözeltilerdir.
Sıvılarda ve katılarda, moleküller, moleküller arası kuvvetlerle bir arada tutulur. Bu kuvvetler aynı zamanda çözeltilerin oluşumunda da
temel rol oynar. Maddelerin birbiri içinde çözünüp çözünmeme durumu tanecik yapıları (polar/ apolar) ile tanecikler arası etkileşimlere
bağlıdır. Bu etkileşimler London kuvvetleri, dipol—dipol etkileşimi, iyon-dipol etkileşimi ve hidrojen bağıdır.
Bir madde (çözünen) başka bir madde (çözücü) içinde çözündüğü zaman, çözünen tanecikleri çözünenin her tarafına dağılır. Çözünen
tanecikler, çözücü molekülleri arasına girer. Bir çözünen taneciğinin bir çözücü molekülünün yerine geçme kolaylığı şu üç tür etkileşimin bağıl
güçlerine bağlıdır. çözücü-çözücü etkileşimiçözünen-çözünen etkileşimi çözücü-çözünen etkileşimi
Polar olmayan kovalent bağlı moleküller arasındaki çekim kuvvetleri yalnızca London kuvvetleridir. London kuvvetleri, çekirdek etrafındaki
elektron bulutunun herhangi bir anda simetrik olmamasından kaynaklanır. Buna anlık dipol denir.
CH4, C6H6, I2, CS2, gibi maddeler örnek verilebilir.
Molekülleri polar olan kovalent bağlı molekülerde ise dipol—dipol etkileşimleri ya da bu etkileşimlerle birlikte hidrojen bağı vardır.
Dipol - dipol etkileşimine sahip olanlara örnek; CHCI3, CH3CI, HCI, H2S verilebilir.
Hidrojen bağı etkileşimine sahip olanlara ise CH3OH, C2H5OH, HF, H2O, CH3COOH gibi örnekler verilebilir.
Apolar ve polar maddeler genellikle birbiriyle karışmazlar. Apolar olan karbon tetraklorür (CCI 4), polar bir madde olan su (H2O) içinde
çözünmez. Su molekülleri arasındaki çekim kuvvetleri, su ve karbon tetraklorür molekülleri arasındaki çekim kuvvetlerinden daha büyüktür. Su
molekülleri karbontetraklorür moleküllerini çekmeyi tercih etmez.
Apolar yapıya sahip CCI4 apolar C6H6 da rahatlıkla çözünür. Aynı şekilde apolar yapıya sahip I2 apolar CCI4 de rahatlıkla çözünür.
Polar moleküllerin su ile karışma isteği çok yüksektir. CH3OH (metanol) su ile her oranda rahatlıkla karışabilir. Metanol polar olmayan
çözücülerde çözünmez.
▲ Genellikle polar maddeler yalnızca polar çözücülerde, apolar maddeler apolar çözücülerde çözünür. Bir başka deyişle benzer benzeri çözer.
Polar sıvı çözücüler, çoğu iyonik ve polar kovalent bileşikler için çözücü özelliğine sahiptir.
En iyi polar çözücülerden biri sudur.
Çözünme sırasında iyonik maddenin iyonları, polar kovalent maddenin ise dipolleri, polar su moleküllerinin dipolleri tarafından elektrostatik
olarak çekilir.
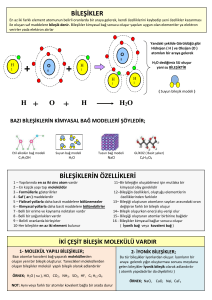
Şekillerden de anlaşılacağı gibi pozitif
iyon veya dipolün pozitif ucu, su
molekülünün negatif ucunu çekerken
negatif iyon veya dipolün negatif ucu ise su
molekülünün pozitif ucu ile çekilir.
Böylelikle iyonik ve polar kristalden
tanecikler (iyon,molekül) uzaklaşarak
çözeltiye aktarılmış olur. Bu iyon-dipol ve
dipol—dipol çekimi oldukça güçlüdür.
NaCI-H2O : İyon-dipol etkileşimi
CH3OH-C6H6 : Dipol-indüklenmiş dipol etkileşimi; çözünmez.
CH3OH-H2O : Didol-dipol etkileşimi, hidrojen bağı
CH4-C6H6 : London kuvvetleri
ÇÖZÜNME ENTALPİSİ
Bir çözelti oluşurken çözücü ve çözünen tanecikleri arasında etkileşim kuvvetleri ortaya çıkacağından enerji değişimi kaçınılmazdır.
Çözünme sürecinin üç ayrı basamakta gerçekleştiğini söylemek mümkündür. Birinci basamak çözücü moleküllerinin ayrılması, moleküller
arası çekim kuvvetlerini yenmek için bir miktar enerji gerekir. Dolayısıyla bu basamak endotermiktir. Alınan ısı ΔH1 ile gösterilsin.
İkinci basamak çözünen moleküllerinin ayrılmasıdır. Bu basamak endotermiktir. Alınan ısı ΔH2 ile gösterilsin.
Üçüncü basamakta çözünen ve çözücü molekülleri karışır. Bu basamak endotermik veya ekzotermik olabilir. Olay sırasındaki ısı değişimi ΔH3
ile gösterilsin.
Çözeltinin entalpi değişimi; ΔH çözelti = ΔH1+ΔH2+ΔH3 tür.
▲ Eğer çözünen ile çözücü etkileşimi, çözünen ve çözücünün kendi tanecikleri arasındaki etkileşimden daha büyük ise çözünme işlemi
ekzotermik olarak gerçekleşir. ΔHçözelti < 0 olur.
▲ Eğer çözünen-çözücü etkileşimi, çözünen ve çözücünün kendi tanecikleri arasındaki etkileşimden daha küçük ise çözünme işlemi
endotermiktir.
ΔHçözelti > 0 olur. NaCI suda çözünürken Na+ ile CF arasındaki çekim kuvvetleri kırılır, bu işlem için harcanan enerji ΔH2 dir. H2O sıvı maddesinde
moleküller birbirinden kopar, bu işlem için harcanan enerji ΔH1 dir. H2O molekülleri, iyonları kristal yapıdan ayırarak çözelti ortamına taşır.
İyon-dipol ekileşimi sırasında ısı açığa çıkar. Açığa çıkan ısı ΔH3 ile gösterilir.
ΔHçözünme = ΔH1 + ΔH2 + ΔH3
Su molekülleri tuz iyonlarını çevirir. Çözünen iyonların su molekülleri tarafından çevrilmesine hidratlaşma (hidratasyon) denir. Çözeltide tüm
iyonlar hidratlaşmış hâldedir.
Eğer su yerine başka bir çözücü tercih edilirse hidratlaşma yerine solvatasyon kelimesi
kullanılır.
Bütün sistemler kararlı hâle gelmek için en düşük enerji seviyesinde bulunmak ve en düzensiz
yapıya ulaşmak ister. Kendiliğinden oluşan (istemli) çözünmelerde genellikle enerji açığa çıkar.
Yani enerji toplamı negatiftir. Bu tür çözünmede sistem enerji vererek enerjisini azaltır.
Genellikle iyonik katıların suda çözünmesi istemlidir.
Bir madde, çözücüde çözündüğünde ortamla ısı alışverişi olur. Bu ısıya çözünme ısısı denir.
Çözeltideki ısı, bazı kimyasal bağların kopması, bazı kimyasal bağların ise oluşması sonucunda
ortaya çıkar.
Bir iyonik tuz (metal tuzu) suda çözünürken ısı alınır veya ısı verilir. Çözünme için gerekli olan
ΔHçözünme=-Kristal enerjisi+Hidratlaşma ısısı
enerji, çözünen maddeyi oluşturan kristalleri bir arada tutan bağ enerjisine eşit miktardadır.
İyonik bir kristalin iyonlarından oluşması sırasında verdiği enerjiye kristal enerjisi denir.
bağıntısına göre hesaplanır
İyonlar hidratlaşırken açığa çıkan enerjiye hidratlaşma ısısı denir.
Hidratlaşma enerjisi, iyonik kristalde iyonları ayırmak için gerekli enerjiden büyükse iyonik
katı suda çözünür.
İyonik katının suda çözünmesi sırasındaki enerji değişimi
https://hasanfirat.com
2
SIVI ÇÖZELTİLER KONU ANLATIMI-1
Kristal enerjisinin mutlak değeri, hidratlaşma ısısının mutlak değerinden küçükse
çözünme ısısı eksi olur, çözünme sırasında ısı verir. Kristal enerjisinin mutlak değeri,
hidratlaşma ısısının mutlak değerinden büyükse çözünme ısısı artı olur, çözünme
süresince ısı alır.
Kendiliğinden oluşan çözünmelerde genellikle ısı açığa çıkar.
Çözünme ısısı sıfır olan çözeltiler ideal çözelti olarak adlandırılır.
Gaz moleküllerini ayırmak için enerji gerekmez. Bu nedenle bir gazın sıvıda
çözünmesi için solvatasyon ısısı yeterli olur.
DERİŞİM BİRİMLERİ
Çözeltilerde çözünmüş olan bir maddenin miktarının ölçüsü derişim olarak adlandırılır.
Derişim yerine konsantrasyon da kullanılabilir.
Farklı alanlarda farklı ihtiyaçlar olduğu için birçok derişim birimleri kullanılmaktadır.
1. Molar derişim (molarite) 2. Molal derişim (molalite) 3. Kütlece yüzde derişim 4. Hacimce yüzde derişim 5. Mol kesri 6 . Milyonda bir
kısım (ppm) ve milyarda bir kısım (ppb)
• Kütlece ve hacimce yüzde derişim ile milyonda bir kısım (ppm) 10. sınıf kimyasında bulunmaktadır. Fakat bu yıl hatırlatma amacıyla örnekler
verilecektir.
Molar Derişim (Molarite)
Bir çözeltinin 1 litresinde çözünmüş olarak bulunan maddenin mol sayısına o maddenin molar derişimi veya molaritesi adı verilir. • Molar
derişim M ile gösterilir.
Bir çözeltinin molaritesi hesaplanırken daima çözeltinin hacmi litre olarak alınır. Molaritenin birimi mol. L-1 dir.
Daha önceden hazırlanmış doygun olmayan bir çözeltiye bir miktar daha madde eklenebilir. Bu da çözeltinin derişimini artırır. Doygun
olmayan çözeltiden bir miktar suyun çökelme olmaksızın buharlaştırılması çözeltinin derişimini artırır. Bir çözeltinin derişimini artırmak için
yapılan işlemlere deriştirme denir.
Bir çözeltideki maddenin derişimini su ekleyerek çözeltinin hacmini artırma veya maddenin bir kısmını çöktürme gibi işlemlerle
küçültülmesine seyreltme denir.
Çözünen maddenin miktarını değiştirmeden çözeltinin hacmi değiştirildiğinde, çözünenin mol sayısı değişmeyeceğinden;
M1.V1 = M2.V2 olur. Çünkü mol sayısı; n = M.V’dir.
Molal Derişim (Molalite)
Bir kilogram çözücü içerisinde çözünmüş olan maddenin mol sayısına molal derişim veya molalite denir.
Molalite 1 kg çözücüde bulunan maddenin mol sayısıdır.
Molal derişim m ile gösterilir.
Kütlece Yüzde Derişim
100 gram çözeltide çözünmüş olan maddenin miktarına kütlece yüzde derişim denir. % C ile gösterilir.
Hacimce Yüzde Derişim
Bir çözeltideki çözünen sıvı hacminin çözeltinin toplam hacmine oranının 1 00 ile çarpılmasına hacimce yüzde derişim denir. % C ile gösterilir.
Sıvıların oluşturduğu çözeltiler için kullanılır.
Sıvılar birbirinde çözündüğünde moleküller arasındaki boşlukları doldurur. Bu nedenle çözeltinin hacmi sıvıların toplam hacminden daha
küçük olur. Problemlerin çözümünde bu hacim azalması genellikle ihmal edilir.
Mol Kesri
Karışımdaki bir çözünenin mol sayısının, tüm bileşenlerin toplam mol sayısına oranına mol kesiri denir. • Mol kesiri X ile gösterilir.
Milyonda Bir Kısım (ppm) ve Milyarda Bir Kısım (ppb)
• ppm ve ppb derişimlerinde bileşenin ve karışımın miktarı aynı birimdendir. Bu nedenle ppm ve ppb'nin birimi 275 yoktur.
https://hasanfirat.com