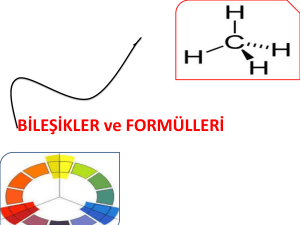
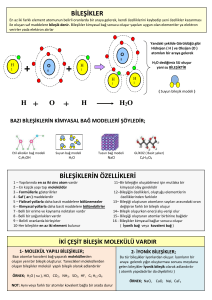
Slayt 1 - WordPress.com
advertisement
advertisement