Konu 13
Katıların Analizi:
Alaşımların nitel analizi
Bir alaşım, metallerin bir karışımıdır. Bazı alaşımlar ise, heterojen karışımlar olup bu alaşımlardaki
metal bileşenlerin kristalleri, bir mikroskopla ve hatta çıplak gözle bile görünür.
Başka bir alaşım tipinde ise, iki veya daha çok metal arasında katı bir çözelti oluşur. Üçüncü bir tipte,
metaller, metal-metal bileşiği oluşturur. Bu alaşımların özellikleri, kullanılan metallerin özelliklerini
içerebildiği gibi, bu özelliklerden çok farklı da olabilir. Bu duruma bir örnek olarak magnezyum
aluminyum alaşımları verilebilir. Hem magnezyum hem de alüminyum oldukça yumuşak ve kolaylıkla
şekil verilebilen metallerdir; ancak magnezyum-alüminyum alaşımları oldukça serttir. Bununla beraber
çoğu alaşımlar, bileşenlerini oluşturan metallerden daha düşük sıcaklıkta erirler; bu durum, bütün
lehimlerin temelini oluşturur.
Nitel analiz şemasında yer alan metallerin hepsi, alaşım oluşturmakta kullanılabilir. Ancak, alkali
metallerden sodyum ve potasyum; toprak alkali metallerden kalsiyum, stronsiyum ve baryum yüksek
kimyasal aktiviteleri nedeniyle, yaygın bulunan alaşımlarda kullanılmazlar. Bir alaşımın analizinde
ortaya çıkan ana sorun, analizde güçlük çıkarabilecek çözünmeyen türler oluşmadan, metalleri
mümkün olabildiğince çözen bir çözücü bulabilmektir.
Hidroklorik asit, hem alaşımlar hem de iyonik bileşikler için pek çok sakıncası olan bir çözücüdür.
Bunlar şu şekilde sıralanabilir:
1. Yükseltgen olmayan bir asit olan hidroklorik asit, gümüş, cıva, arsenik, bizmut, bakır, antimon gibi
pozitif elektrot potansiyeline sahip metalleri çözemez.
2. Hem kalay hem de cıva ısıtma ile ortamdan uzaklaşabilecek uçucu klorürler ( SnCl2 ve HgCl2)
oluştururlar.
3. Numunede arsenik ve antimon bulunduğunda, uçucu arsin (AsH3(g)) ve stilbin (SbH3(g)) oluşur ve
bu elementler ortamdan uzaklaşır. Ancak arsenik, alaşımlarda (özellikle kurşun mermilerde) çok
düşük oranlarda bulunur ve bu nedenle, bir numunenin nitel analizinde genellikle yer almaz.
Sülfürik asit de sıcak ve derişik olmadıkça yükseltgen olmayan bir asittir ki, bu şartlar altında
kullanmak tehlikelidir. Ayrıca, çözücü olarak kullanıldığında, Ag2SO4 ve PbSO4 gibi çözünmeyen
bileşikler oluşturur.
Nitrik asit yükseltgen bir asittir. Bu yüzden, gümüş ve bakırı çözer:
Kral suyu, altını çözme kabiliyetinden dolayı bu şekilde isimlendirilmiş olup üç kısım derişik
hidroklorik asit ile bir kısım nitrik asitin karışımıdır. Kompleks kloro anyonları oluşumu, çözeltideki
serbest metal iyonları derişimini düşürdüğünden ve böylece nitrik asidin yükseltgeme gücünü
artırdığından dolayı, bu karışım oldukça etkindir. Altının kral suyunda çözülmesi buna örnektir:
Kurşun, gümüş, cıva, bizmut, bakır, arsenik ve antimon hidroklorik asitte çözünmez; ancak, kral suyu
oluşturacak şekilde ortama nitrik asit katıldığında, bu metallerin hepsi çözünür. Kurşun ve gümüş,
klorürleri halinde çöker:
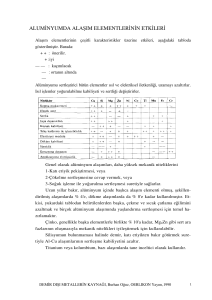
Alaşımların analizi aşağıdaki şemada özetlenmiştir.
Aşağıdaki metalleri içermeyen alaşım numunesi
Na, K, Ca, Sr, Ba, As
Çözünürlük deneyi
Alaşım tamamen aşağıdakilerle reaksiyona girer
6 M HNO3
Katyon
analizi için
çözelti
Ç-1
Kral suyu
Birkaç damla kalıncaya kadar
buharlaştırma
Pb2+, Hg2+,
BiO+, Cu2+,
AsO+, SbO+
Sb2O5
sarı
Kral suyu
Katyonlarını
içermez
SnO2
İşlem 3-1
beyaz
İşlem 2-1
6 M HCl
6 M KOH
K-1
AgCl
beyaz
H2S(sulu)
PbCl2
beyaz
SbS2-
SnS32-
Karbon
+
SiO2
6 M CH3COOH
Sb2S3
turuncu
SnS2
sarı
(mümkün)
H2S(sulu)
12 M HCl
SbCl63-
SnCl62-
Ç-11’e ilave edilir
Karbon
+
metal sülfürler
6 M HNO3
Katyon analizleri için
çözelti
karbon
Ç-1
Çok az
Pb2+
içerir