GENEL KİMYA
MADDE ve SINIFLANDIRILMASI
Kimya Nedir?
Kimya maddeleri ve maddelerin uğradıkları
değişiklikleri inceleyen bilim dalıdır.
Fiziksel evrende yer alan ya da alabilecek
maddelerin temel yapılarını, bileşimlerini,
dönüşümlerini inceleyen ve büyük ölçekli
üretim yöntemlerini de araştıran bir bilim
dalıdır.
2
Kimya günümüzde birçok ana bilim dalına ve bunların alt
dallarına ayrılmıştır. Beş temel anabilim dalı:
ORGANİK KİMYA: C ve onun bileşiklerini inceler.
İNORGANİK KİMYA: Genellikle C ve bileşikleri
dışındaki maddeleri inceler.
ANALİTİK KİMYA: Maddelerin tanınması, analizi,
bileşiminin nicel ve nitel yönden incelenmesiyle
ilgilenir.
FİZİKOKİMYA: Maddelerin enerji ilişkilerini ve hal
değişimlerini inceler.
BİYOKİMYA: Canlıların yapısında gerçekleşen
kimyasal olayları ve bunların sonuç ve etkilerin
inceler.
Bunlara bağlı alt bilim dalları: polimer kimyası, çevre kimyası, petrol
kimyası, korozyon kimyası, termokimya, elektro kimya … ve diğerleri
3
Kimya Tarihi
Kimya bilimi 17. yüzyıldan (Aydınlama
Çağı) itibaren gerçek bir bilim kimliğini
kazanmaya başlamıştır.
Endüstrileşmenin (19. y.y.) başlamasıyla,
endüstrinin ihtiyacı olan yöntemlerin,
maddelerin ve tepkimelerin araştırılması
ve deneyciliğin gelişmesi kimyanın bilime
dönüşmesine katkı sağlamıştır.
4
Kimya Tarihi
17., 18. ve 19. yüzyıllarda yaşamış olan
Toricelli, Boyle-Mariotte, Francis Bacon,
Lavoisier, John Dalton dönemin kimyaya
katkı getiren önemli bilginlerindendir.
John Dalton 1803 yılında yayınladığı
Atom Teorisi kitabi ile bu teorinin
kurucuları arasında yer almıştır.
5
Kimya Tarihi
• 18. yüzyılda yaşamış olan Fransız
kimyager Lavoisier modern kimyanın
kurucusu olarak kabul edilir.
• Newton fizik için neyse, Lavoisier’de
kimya için odur.
•Lavoisier, havanın çeşitli gazlardan
oluştuğunu keşfetmiş, yanma olayını
açıklamış, kimyada kullanılan dili
kolaylaştırmıştır. Bugün kullandığımız
element isimleri ve sembollerini büyük
ölçüde Lavoisier geliştirmiştir.
6
Kimya ve İnsan
Kimya maddenin yapıtaşlarıyla
ilgilendiğinden aslında bütün evrenle
ilgilenir. Yani yeryüzündeki bütün bilim
dallarıyla doğrudan ilişkisi vardır.
Yeryüzünün en gelişmiş ve kompleks varlığı
insanın kimyasal bileşimi:Fosfor 700 g,
Hidrojen 7000 g, Azot 2100 g, Oksijen 45500
g, Klor 105 g, Kükürt 175 g, Karbon 12060 g,
Magnezyum 35 g, Demir 2,8 g, Potasyum 245
g, Kalsiyum 1050 g
7
Ölçme ve Sonuç Bildirme
Kimya deneysel bir bilimdir. Deneyler
yapılarak bir takım ölçüler alınarak bir
sonuca varılır. Deneylerde hatanın en az
olması istenir. Deney hataları; deney
yapanın kendisinden, seçilen yöntemin
uygunluğundan, kullanılan bağıntılardan
ve ölçü aletlerinin durumundan
kaynaklanabilir. Kimyada deneylerin
tekrarlanabilirliği temel esastır.
8
ANLAMLI SAYILAR
Milattan önce 4000 li yıllar ifadesindeki 4000
rakamının doğruluk ve hassasiyeti nedir?
3 gr, 3.0 gr, 3.00 gr aynı mıdır?
40±2 neyi ifade eder?
sayısı kaç basamak?
3.14159265358979323846264338327950288419716939
93751058…………….
9
Anlamlı Rakam Sayısı
Sayılar, kesin sayılar ve ölçme sayıları olarak ikiye
ayrılırlar. Kesin sayılar belirsizliği olmayan sayma sayıları
ve tanım sayılarıdır. Ölçme sayıları ise bir ölçme sonucu
elde edilen ve son hanesinde belirsizlik bulunan sayılardır.
Hiç bir ölçme sonucunda kesin sayılar elde edilemez.
Ölçme sayılarının da son hanesindeki rakamda belirsizlik
vardır. Fakat son hanedeki rakamın önündeki rakamlar
kesin olarak bilinen rakamlardır. Kesin olarak bilinen
rakamlarla belirsizlik olan rakamların tümüne birden anlamlı
rakamlar denir:
25 (belirsizlik 1)
, 2300 (belirsizlik 100)
2300. (belirsizlik 1) , 0.029 (belirsizlik 0.001)
10
ANLAMLI SAYILAR
YUVARLAMA:
Virgülden sonra alınacak hane basamağından
sonra gelen rakamlar 0,1,2,3 ve 4 ise atılır;
Virgülden sonra alınacak hane basamağından
5, 6, 7, 8 ve 9 ise en son kalan rakam bir
artırılır
Örneğin 3.141592 … rakamı virgülden sonra
iki haneli olacaksa 3.14 olur eğer virgülden
sonra üç hane olacaksa 3.142 olur
11
Birim Sistemi
MADDE MİKTARI: Mol
HACİM: Litre, ml, cm
1000 cm3=1000 ml= 1 lt
UZUNLUK:
Metre (ve alt ve üst katları)
Angstrom (Å) = 10-10 m
1 inç= 2.54 cm=25.4 mm
12
Birim Sistemi
SICAKLIK
Celcius (C) (t)
Kelvin (K) (T)
Fahrenhayt ( F)(F)
T= t+273
25 C= 25+273 K= 298 K
13
Birim Sistemi
t oC= 5/9 (F-32)
Örnek: Vücut sıcaklığı yaklaşık 36 oC’dir.
Bunu Fahrenhayta çeviriniz
36 oC = 5/9 (F-32)
F= 96.8 oF
14
Birim Sistemi
BASINÇ
Atm, Bar, Torr, mm-Hg
1 atm= 760 torr=760 mm-Hg
1 bar = 750.062 torr = 0.9869 atm
15
Birim Sistemi
Birim sistemlerinde kullanılan alt ve üst
kat önekleri
ÖNEK
KAT
SEMBOL
mili
10-3 kat
m
kilo
103 kat
k
mikro
10-6 kat
nano
10-9 kat
n
16
Birim Sistemi
Kimyada Kullanılan Bazı Sabitler
R (İdeal Gaz Sabiti)
R=0.082 lt.atm./mol. K
R=1.987 kal./mol. K
R= 8.314 j/mol. K
NA=Avagadro sayısı = 6.02X1023
17
ÇEVİRME FAKTÖRÜ
Matematiksel işlemlerde birimler dikkate
alınmalı ve çevirme faktörleri kullanılarak
anlamlı birimleri ifade eden rakamlar elde
edilmelidir.
İstenen miktar
ve birimi
Verilen miktar
ve birimi
X
Çevirme
f aktörü
18
ÇEVİRME FAKTÖRÜ
Örnek: 36 km/saat kaç m/sn’dir?
?
m
sn
İstenen miktar
ve birimi
36
km
saat
Verilen miktar
ve birimi
X
1000 m
X
1 km
1 saat
10 m/sn
3600 sn
Çevirme
f aktörü
19
Maddenin Yapısı
Madde:
Tanecikli yapıda
Boşluklu yapıda
Hareketli yapıda
20
Maddenin Yapısı
Madde taneciklerden meydana geliyorsa,
tanecikler neden görülemiyor?
1 Damla suda 2x1021 tane su
molekülünün (H2O, suyu oluşturan
tanecikler) bulunması, çıplak gözle
neden maddeyi oluşturan taneciklerin
görülmediğini açıklar.
21
Maddenin Yapısı
Maddedeki tanecikler:
Atomlar
Moleküller
İyonlar
22
Maddenin Yapısı
Demir çubuk, bir şişedeki cıva, bakır kap,
alüminyum çerçeve, tanecikleri atomlar
olan maddelere örnek verilebilir.
Bir kaptaki su (H2O), alkol (C2H5OH),
aseton (C3H6O), çay şekeri (C12H22O11)
ve bir tüpteki oksijen (O2) tanecikleri
moleküller olan maddelere örnek teşkil
eder.
23
Maddenin Yapısı
Tanecikleri iyonlar olan maddelere
örnekler:
Sodyum klorür (yemek tuzu) NaCl
Na+, Cl-
Kalsiyum Karbonat (kireç taşı) CaCO3
Ca2+, CO32 Sodyum karbonat (çamaşır sodası)
Na2CO3
2Na+, CO32
24
Maddenin Yapısı
Maddenin boşluklu
yapısı:
50 mL su ve 50 mL alkol
karıştırıldığı zaman
toplam hacim daima 100
mL den daha az (90-95
mL) olur. Bu durum nasıl
açıklanabilir?
Aynı durum, taneli yapılı
maddeler (nohut-pirinç
vb) içinde düşünülebilir.
25
Maddenin Yapısı
Maddenin Taneciklerinin Hareketliliği
Maddenin taneciklerinin hareketli olduğu,
maddenin gaz hali göz önüne
alındığında daha kolay anlaşılır.
Bir maddenin gaz halindeki tanecikleri
hareketli olmasaydı, evde hangi
yemeklerin piştiği apartman girişinde
anlaşılabilir miydi?
26
Maddenin Halleri
Maddenin bulunma durumlarına
maddenin halleri denir.
Maddenin halleri
Katı
Sıvı
Gaz
Plazma
27
Maddenin Halleri
28
Maddenin Halleri
Su molekülünün üç hali
H2O(k)
H2O(s)
H2O(g)
29
Su molekülünün üç hali
30
Maddenin Halleri
Maddenin Plazma Hali: Elektrikçe nötr
olan; atom, iyon, elektron ve moleküllerin
bir arada bulunduğu karışıma plazma
hali denir.
Daha çok yüksek sıcaklık ve basınçta
plazma hali ile karşılaşılır.
Kibrit alevi, floresan lambadaki ışıldama
maddenin plazma haline örnek verilebilir.
31
Maddenin Halleri
Madde Hallerinin Özellikleri
Hal
Katı(k)
Sıvı(s)
Gaz(g)
Özellik
Kütlesi, hacmi ve şekli belirlidir.
Kütle ve hacim belirlidir.
Şekil değişir ve konulduğu
kabın şeklini alır.
Kütle belirlidir. Konulduğu
kabın hacmini kaplar.
Konulduğu kabın şeklini alır.
32
Maddedeki Hal Değişimleri
Gaz
Yoğunlaşma
Kırağılaşma
Süblimleşme
Buharlaşa
SIVI
Erime
Donma
Katı
33
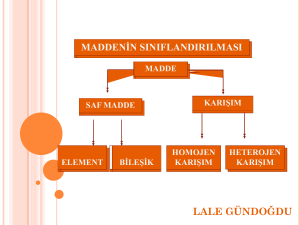
Maddenin Sınıflandırılması
Çevremizde görülen bütün maddeler
aşağıdaki gibi sınıflandırılır.
Madde
Saf maddeler
Elementler
f iziksel yöntemlerle
Karişimlar
ayrilabilir
Bileşikler
Kimyasal yöntemlerle ayrilabilir
Homojen
Karişimlar
Heterojen
Karişimlar
Süspansiyonlar (Kireçli su)
Emülsiyonlar (Yağ+su)
Aerosol (sis)
34
Elementler
Aynı cins atomlardan oluşan maddelere
element denir.
Elementler saf maddelerdir.
Günümüzde 115 civarında element
bilinmektedir. Bunların 88 tanesi doğal,
diğerleri yapay elementlerdir.
35
Bileşikler
Farklı cins element atomlarının bir araya
gelerek oluşturdukları taneciklerden
(moleküller veya iyonlar) meydana gelen
maddelere bileşik denir.
Bileşikler saf maddelerdir.
Bütün saf maddelerin erime ve kaynama
noktaları sabittir.
36
Bileşikler
Bileşik adı
Su
Etil alkol
Aseton
Karbon dioksit
Sodyum klorür
Formülü
H 2O
C2H5OH
C 3H 6O
CO2
NaCl
Sodyum bikarbonat NaHCO3
Bileşik Çeşidi
moleküler
moleküler
moleküler
moleküler
iyonik
iyonik
37
Karışımlar
Bileşimleri belli bir kimyasal formülle
ifade edilemeyen maddelerdir.
Karışımların erime ve kaynama noktaları
sabit değildir.
Tuzlu su, içme suyu, çay, kahve, odun,
toprak, taş ve süt karışımlara örnek
olarak verilebilir.
38
Homojen Karışımlar
Her tarafında aynı özelliğe sahip olan
karışımlara homojen karışım denir.
Alaşımlar ve çözeltiler, homojen
karışımlardır.
Çözelti; çözünen ve çözücü’den oluşup
çeşitli şekillerde elde edilebilirler.
39
Çözeltiler
Çözelti çeşidi
Sıvı-sıvı
Katı-sıvı
Katı-katı
Örnekler
Kolonya
Tuzlu su, şekerli su
Sıvı-gaz
Kolalı içecekler, suda
çözünmüş oksijen
saf hava
Gaz-gaz
Alaşımlar (pirinç, çelik,
lehim vb.)
40
Heterojen Karışımlar
Her tarafında aynı özelliğe sahip
olmayan karışımlara heterojen karışım
denir.
Heterojen karışımlarda iki faz ayrı ayrı
görülür.
41
Heterojen Karışımlar
Sıvı-katı heterojen karışımlara
süspansiyon denir.
Su-kum, su-un, bulut (hava-su buharı
karışımı), ayran birer süspansiyon örneğidir.
Sıvı-sıvı heterojen karışımlara emülsiyon
denir.
Su-zeytin yağı, su-benzin karışımı birer
emülsiyon örneğidir.
42
Aerosol (Heterojen karışım)
Bir sıvının yada bir katının gaz içinde
çözünmesi
Örneğin;
Sıgara dumanı (Gaz içinde katı)
Toz bulutu (Gaz içinde katı)
Sis (Gaz içinde sıvı)
Köpük (Gaz içinde sıvı)
Deodorant (Gaz içinde katı)
43
Karışımların Ayrılması
Çevremizde görülen bir çok madde, saf
maddelerin karışımından oluşmuş
karışımlar olup, bu karışımlar çeşitli
yöntemler kullanılarak bileşenlerine
ayrılabilir.
44
Süspansiyonların Ayrılması
Süspansiyonlarda, katı ve sıvı faz
süzülerek birbirinden kolayca ayrılabilir.
Süzme işleminde, suda dağılmış olan
katı maddenin tanelerinin geçemeyeceği
kadar küçük gözenekleri olan süzgeç
kağıtları kullanılır.
Katı tanecikler, süzgeç kağıdının
üzerinde kalır ve sıvı kısım süzgeç
kağıdından geçer.
45
Çözeltilerin Ayrılması
Katı-sıvı homojen karışımlar,
buharlaştırma yada damıtma
(destilasyon) ile bileşenlerine ayrılır.
Buharlaştırma işleminde, sıvı kısım
buharlaşır ve katı kısım buharlaştırma
kabında kalır.
46
Çözeltilerin Ayrılması
Sıvı-sıvı homojen karışımları
bileşenlerine ayırmanın en uygun yolu,
damıtma (destilasyon) yöntemini
uygulamaktır.
Bu yöntemle, kaynama noktaları
birbirinden farklı, iki yada daha fazla sıvı
birbirinden kolayca ayrılabilir.
47
Çözeltilerin Ayrılması
Katı-sıvı ve sıvı-sıvı karışımları ayırma işleminde
kullanılan basit damıtma (destilasyon)düzeneği
48
Vakum Destilasyonu
Vakumlu Destilasyon
1-Yüksek kaynama noktasına sahip sıvıların destilasyonu
2-Kaynama noktasında bozunan sıvıların destilasyonu
Evaparatör
Döner Buharlaştırıcı
VAKUM
49
Emülsiyonların (birbiri içerisinde
karışmayan sıvıların) Ayrılması
Emülsiyonlar (sıvı-sıvı
heterojen karışımlar) öz kütle
farkından yararlanılarak,
bileşenlerine ayrılırlar.
Bu iş için ayırma hunisi adı
verilen özel bir alet
geliştirilmiştir.
50
Katı Karışımların Ayrılması
Katı karışım; tuz-şeker, kum-tuz, un-tuz
gibi iki bileşenli ise, katının birini çözecek
diğerini çözmeyecek uygun bir çözücü
kullanılarak, katı karışım süspansiyona
dönüştürülür.
Süspansiyon süzülerek bileşenlerden biri
(süzgeç kağıdında kalan) ayrılır.
Süzüntü buharlaştırıldığında, çözücü
buharlaşır ve çözünen katı kapta kalır.
51
Katı Karışımların Ayrılması
Soru: Tuz ve şeker karışımı (katı-katı)
bileşenlerine nasıl ayrılır?
52
Kimyasal Yolla ayrıştırma
Bileşikler kimyasal yolla elementlere yada
farklı yapıdaki bileşiklere dönüştürülebilir.
2 HgO(k)
2 KClO3(k)
2 H2O(s)
Isı
Isı
elektroliz
2 Hg(s) + O2(g)
2 KCl(k) + 3 O2(g)
2 H2(g) +
O2(g)
53
Maddenin Genel Özellikleri
Hacim
Kütle
Eylemsizlik
Hissetme
54
Maddenin Ayırt Edici Özellikleri
1-) Fiziksel Özellikler
2-) Kimyasal Özellikler
55
Maddenin Ayırt Edici Özellikleri
Ayırt Edici Özellik
Katı
Sıvı
Gaz
Özkütle
+
+
+
Erime noktası
+
-
-
Donma noktası
-
+
-
Kaynama noktası
-
+
-
Yoğunlaşma
noktası
-
-
+
Çözünürlük
+
+
+
Genleşme
+
+
-
Esneklik
+
-
-
Elektrik iletkenliği
Metaller için
-
-
56
Maddenin ayırt edici özellikleri
Yalnız öz kütlesi veya yalnız
erime noktası veya yalnız
kaynama noktası bilinen bir
maddenin hangi madde olduğu
anlaşılabilir mi?
57
Maddenin ayırt edici özellikleri
• Nikelin öz kütlesi 8,9 g/cm3’tür. Acaba öz
kütlesi 8,9 g/cm3 olan bir madde nikel
midir?
• Öz kütlesi demirin 7,86 g/cm3 ve gümüşün
10,5 g/cm3 ’tür. Belli bir oran da demir ve
gümüşten karıştırarak öz kütlesi 8,9 g/cm3
olan alaşım hazırlanabilir. Bu durumda öz
kütleleri 8,9 g/cm3 olan madde nikel de
olabilir, demir – gümüş alaşımı da olabilir.
Demek ki, öz kütle yalnız başına tam
anlamıyla ayırt edici olma özelliği
göstermeyebiliyor.
58
Maddenin ayırt edici özelliklerinin
her biri tek başına yeterli mi?
Erime noktası
Kaynama noktası
Yoğunluk
Kırılma indisi
İletkenlik
vb fiziksel özellikler tek başlarına bir
maddeyi teşhis etmek için kullanılamazlar.
Aynı erime noktasına sahip binlerce molekül
vardır.
59
Fiziksel ve Kimyasal Özellikler
Maddenin rengi, kokusu, hacmi, hali,
yoğunluğu, erime noktası ve kaynama noktası
gibi bazen beş duyumuzla doğrudan bazen de
ölçümler yaparak tespit edilen özelliklere
maddenin fiziksel özellikleri denir.
Maddenin enerji etkisiyle yada diğer kimyasal
maddelerle yeni maddeler oluşturabilme
yeteneğine maddenin kimyasal özellikleri
denir.
60
Fiziksel ve Kimyasal Değişmeler
Maddenin taneciklerinin yapısının
değişmediği durumdaki değişmelere
fiziksel değişme denir.
Maddenin hal değiştirmesi bir fiziksel
değişmedir.
Hal değişimi sırasında maddenin
taneciklerinin yapısında bir değişme
olmaz. Sadece, taneciklerin enerjileri ve
bir araya gelme biçimleri değişir.
61
Fiziksel ve Kimyasal Değişmeler
Maddenin taneciklerinin yapısının
değiştiği durumdaki değişmelere
kimyasal değişme denir.
Odunun yanması, dinamit’in ısıtıldığında
patlaması, demirin paslanması birer
kimyasal değişme örnekleridir.
62
Kimyasal Değişme (Reaksiyon)
Kimyasal değişmelere çoğunlukla
“Kimyasal Reaksiyon” denir.
Bir kimyasal reaksiyonda, başlangıçta
alınan maddelere “reaktantlar” veya
reaksiyona girenler denir.
Reaksiyon sonucunda meydana
gelenlere de ürünler denir.
Reaksiyona Girenler (Reaktantlar)
Ürünler
63
Ekzotermik ve Endotermik Reaksiyonlar
Çevreye ısı vererek yürüyen
reaksiyonlara “ekzotermik reaksiyonlar”
denir.
Çevreden ısı alarak yürüyen
reaksiyonlara “endotermik reaksiyonlar”
denir.
64
Ekzotermik ve Endotermik Reaksiyonlar
Yanma reaksiyonları ekzotermik, bozunma
reaksiyonları ise endotermik reaksiyon
çeşitleridir.
CH4(g) + 2O2(g)
kivilcim
CO2(g) + 2H2O(g) + 213 kcal/mol (yanma)
metan
CaCO3(k)
kireçtasi
CaO(k) +
sönmemis
kireç
CO2(g)
(bozunma)
65
Kütlenin Korunumu Kanunu
Kibrit çöpü yandığında kütlesi azalır, neden?
Magnezyum yandığında kütlesi artar, neden?
Mg(k) + 1/2 O2(g)
24 gr
16 gr
MgO(k)
40 gr
Bir Kimyasal reaksiyonda, reaksiyona giren
maddelerin kütleleri toplamı, ürünlerin kütleleri
toplamına eşittir.
66
Sabit Oranlar Yasası
Bir bileşiğin bütün örnekleri aynı bileşime
sahiptir. Yani, bileşenler sabit bir oranda
birleşir.
Örneğin su dünyanın neresinde ve hangi
metotla elde edilirse edilsin sudaki
hidrojen ve oksijenin kütleleri oranı
sabittir (H/O=1/8)
67
Katlı Oranlar Kanunu:
İki element bir biriyle birden fazla bileşik
oluşturuyorsa, bu elementlerden birinin
sabit miktarına karşılık gelen diğer
elementin değişen kütleleri arasında
basit tam sayılarla ifade edilen sabit bir
oran vardır. Bu orana Katlı Oranlar
Kanunu denir.
68
Katlı Oranlar Kanunu:
ÖRNEK:
NO2 : 14 gr N 32 gr O
N2O : 14 gr N 8 gr O
Katlı oranı 4/1
N2O : 14 gr N 8 gr O
N2O3 : 14 gr N 24 gr O
Katlı oranı 1/3
69
Avagadro Kanunu
Aynı şartlarda gazların eşit hacimlerinde
eşit sayıda molekül bulunur.
O oC ve 1 atm basınçta gazların 1.0
molu 22.4 lt hacim kaplar.
Bütün maddelerin 1 molünde 6.02x1023
tane madde taneciği vardır.
70
Birleşen Hacimler Kanunu
Aynı sıcaklık ve basınç altında reaksiyona
giren gazlar ile oluşan gazların hacimleri
arasında basit sayılarla ifade edilebilen
oranlar vardır.
H2 (g)
1 hacim
N2 (g)
1 hacim
+ Cl2 (g)
1 hacim
+ 3 H2 (g)
3 hacim
2 HCl (g)
2 hacim
2 NH3 (g)
2 hacim
Girenlerde oran 1/1
Girenler ve ürünlerde oran 1/2
Girenlerde oran 1/3
Girenler ve ürünlerde oran 1/2 ve 3/2
71