halidir. Tanecikler arasındaki çekim kuvveti en fazladır. Hacimleri ve
advertisement

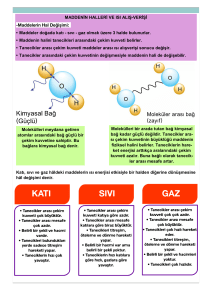
MADDENİN HALLERİ Boşlukta yer kaplayan, kütlesi ve eylemsizliği olan her şey maddedir. Oturduğumuz sıralardan, yediğimiz yiyeceklere ,dev yıldızlardan gezegenlere, kullandığımız basit aletlerden bilgisayarlara,tek hücreli canlılardan karmaşık yapılı canlılara,gözümüzle görebildiğimiz bütün nesnelerden göremediğimiz,atmosferdeki gazlara kadar her şey maddedir. Yani kısaca uzayda yer kaplayan ve kütlesi, hacmi, eylemsizliği olan duyu organlarımızla algılayabildiğimiz her şeye madde denir. Maddenin katı, sıvı, gaz ve plazma olmak üzere dört hali vardır. MADDENİN HALLERİ KATI SIVI GAZ PLAZMA 1. KATI HALİ YEMEK TUZU ( NaCl ) ÇİNKO ( Zn ) GÖZ TAŞI ( CuSO4 ) Belirli bir şekli olan ve bu şeklin ortamlara göre değişmediği hale katı hal denir. Genel Özellikleri : Katı halinde atomlar ve moleküller birbirine oldukça yakındır. Maddenin en düzenli (karalı ) halidir. Tanecikler arasındaki çekim kuvveti en fazladır. Hacimleri ve şekilleri bellidir. Sıkıştırılamazlar. Akışkan değildir. Tanecikler bulundukları yerde titreşim hareketi yaparlar. Fiziksel yollarla diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. 2. SIVI HALİ MEYVE SUYU SU SÜT COLA Maddenin bulundukları kabın şeklini alan haline sıvı hali denir. Genel Özellikleri : Kabın doldurduğu kısmın şeklini ve hacmini alırlar. Belirli bir şekilleri ve hacimleri yoktur. Katılara göre daha düzensizdirler. Akışkandır. Sıvı tanecikleri birbiri üzerinde kayarak hareket ederler. Öteleme hareketi yaparlar. Tanecikler arası boşluk fazladır. Üzerine uygulanan basıncı her yöne aynen iletir. Akmaya karşı direnç gösterirler.Buna viskozite denir. Açık kapta buharlaşırlar. Yüzey gerilimleri vardır.Sıcaklık arttığında hacimleri az da olsa artar.Böylelikle yoğunlukları azalır. Birbirleri içinde çözünebilen iki sıvı karıştırıldığında birbirleri içinde yayılırlar. Sıkıştırılamazlar. 3. GAZ HALİ Boş bir kaba konulan bir madde o kabın her noktasına yayılabiliyorsa bu haline gaz hali denir. GENEL ÖZELLİKLERİ Tanecikler arasında çekim yok denecek kadar azdır. Akışkandır. Tanecikler arasında çok büyük boşluklar vardır.Daima hareket halindedirler. Maddenin en düzensiz halidir. Belirli bir şekilleri ve hacimleri yoktur. Bulundukları kabı doldururlar ve kabın her yerine homojen olarak yayılırlar. Sıkıştırılabilirler. Sonsuz yayılma özelliğine sahiptir. 4. PLAZMA HALİ KUTUP IŞIKLARI Maddenin dördüncü hali plazmada ; İyonlaşmış gaz Elektronlar ve protonlar Yüksüz atomlar ve moleküller Uyarılmış atomlar bulunur. Normal bir gazla plazma arasındaki temel fark, gazların yalnızca elektriksel olarak olarak nötr atom veya moleküllerden oluşmasıdır.. Plazmada ise nötr parçacıkların yanı sıra özgür elektron ve iyonlar da bulunur. Burada özellikle içerisinde bulunan plazma ile maddenin dördüncü hali olan plazma karıştırılmamalıdır. Plazma ortamında plazma titreşimleri ve plazma dalgaları oldukça sık görülür. Normal gazda yalnızca ses dalgaları üretilebilir. GENEL ÖZELLİKLERİ İyi bir iletkendir. Elektriği ve ısıyı iletir. Elektrik ve manyetik alanla etkileşir. Kimyasal reaksiyonları çok hızlıdır. Yüksek sıcaklık ve enerji yoğunluğuna sahiptir. HAL DEĞİŞİM OLAYLARI VE ISI Sıcak bir cisimden soğuk bir cisme aktarılan enerjiye ısı denir,yani ısı sıcaklık farkından ileri gelen enerjidir. Erime ve Donma • ERİME (ERGİME) : Katı maddeler ısıtıldıklarında sıcaklıkları artar ve bir noktaya gelindiğinde hal değiştirerek sıvı hale geçerler. Bu olaya yani maddelerin ergime sıcaklığında katı halden sıvı hale geçmesine erime (ergime) denir. Erimenin olduğu sıcaklığa da erime noktası denir. • DONMA : Bir sıvının katıya dönüşmesine donma denir. Donmanın olduğu sıcaklığa da donma noktası denir. Saf maddeler için , Erime noktası = Donma noktası Buharlaşma ve Yoğuşma • BUHARLAŞMA : Sıvıyı oluşturan tanecikler katılara oranla birbirlerine daha uzak ve yapılarını oluşturan tanecikler arasındaki çekim kuvvetleri daha zayıftır. Sıvıyı buharlaştırmak (gaz hale getirmek) için tanecikleri arasındaki çekim kuvvetlerini yenmek amacıyla enerji vermek gerekir. Yeterli enerji ile tanecikler sıvı yüzeyinden kurtularak gaz haline geçerler. Bu olaya buharlaşma denir. • YOĞUŞMA : Kaynayan suyun üzerine kapak kapattığımızda kapakta su damlacıkları oluşur. Bu su damlacıkları kaynama sırasında oluşan buharının tekrar sıvı hale geçtiğini gösterir. Bir gaz ya da buharın sıvıya dönüşmesine yoğuşma denir. Buhar sıvıya dönüşürken ısı verir. Süblimleşme Maddenin katı halden sıvı hale dönüşmeden gaz hale dönüşmesine süblimleşme denir. Katıdan gaz hale geçerken madde ısı alır. Süblimleşmenin tersine maddenin gaz halden doğrudan katı hale geçmesine geri süblimleşme denir. Su moleküllerinin geri süblimleşmesine kırağılaşma denir. KIRAĞILAŞMA HAL DEĞİŞİM ISISI (L) : Maddenin 1 gramının bir halden başka bir hale geçmesi sırasındaki ısı değişimidir. Hal değişim ısısı madde eriyorsa, erime gizli ısı (Le) , madde buharlaşıyorsa buharlaşma gizli ısısı (Lb) şeklinde ifade edilir. Erime sıcaklığındaki bir mol katının erimesi için gerekli ısı molar erime ısısı, kaynama noktasındaki bir mol sıvının buharlaşması için gerekli ısı molar buharlaşma ısısıdır. KÜTLE (m) : Hal değişimine uğrayan maddenin kütlesidir. Birimi gram (g) ’ dır. ÖZ ISI (c) : Bir maddenin 1 gramının sıcaklığını 1 santigrat derece artırmak için gereken ısı miktarıdır. Birimi joule / gram derece celcius ’ tur . SICAKLIK FARKI : Son sıcaklık ile ilk sıcaklık arasındaki farktır. Sıcaklık birimi celcius ’ tur.