kanser dosyası
advertisement

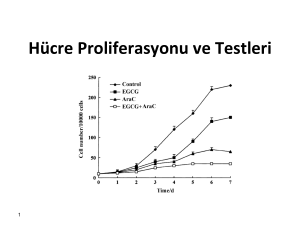
2012 KANSER DOSYASI Kanser konusunda bugüne kadar yaptığımız bazı çalışmaların özetini içermektedir. İçindekiler 1. DENEYSEL KISIM ....................................................................................................................... 2 1.1. Yöntemler ..................................................................................................................................... 2 1.1.1. Tripan (Trypan) sayımı ........................................................................................................... 2 1.1.2. MTT analizi ............................................................................................................................ 2 1.1.3. WST analizi ............................................................................................................................ 2 1.1.4. Caspase-3 aktivite tayini ........................................................................................................ 2 1.2. Deney Grupları ............................................................................................................................. 2 1.2.1. Ön Denemeler ....................................................................................................................... 3 1.2.2. Seri Çalışmalar ....................................................................................................................... 3 1.2.3. Tübitak Tarafından Yapılan Test ............................................................................................ 3 2. SONUÇLAR VE TARTIŞMA .......................................................................................................... 4 2.1. Ön Denemeler .............................................................................................................................. 5 2.2. Seri Çalışmalar .............................................................................................................................. 6 2.2.1. Kontrol Grubu Deneyi............................................................................................................ 6 2.2.2. Kanser Hücre Deneyleri ......................................................................................................... 7 2.2.2.1. PC12: Sıçan böbreküstü bezi feokromositoma (adrenal gland pheochromocytoma) kanser hücreleri ........................................................................................................................... 7 2.2.2.2. C8: İnsan beyin kanser monosit/makrofaj mikroglia...................................................... 7 2.2.2.3. A549: İnsan akciğer karsinoma....................................................................................... 8 2.2.2.4. 293T: İnsan böbrek kanser hücreleri .............................................................................. 9 2.2.2.5. GC-4 SPC: Fare testis kanser hücreleri ......................................................................... 10 2.2.2.6. MDA-231: İnsan meme kanser hücre soyu .................................................................. 10 2.2.3. Mekanizma Tayini................................................................................................................ 12 2.2.3.1. Caspase-3 Aktivite Tayini .............................................................................................. 12 3. SONUÇ ................................................................................................................................... 13 1 1. DENEYSEL KISIM 1.1. Yöntemler Hücre testlerinde canlılık oranı ve metabolik aktivite tayini için Tripan sayımı, MTT analizi ve WST analizleri yapılmıştır. Mekanizma anlamak için ise Caspase-3 aktivite tayini yapılmıştır. 1.1.1. Tripan (Trypan) sayımı 24, 48 ve 72 saat uygulamadan sonra ölü hücreler Tripan boyası ile boyanarak mikroskop altında sayım yapıldı. 1.1.2. MTT analizi 24, 48 ve 72 saat uygulamaları sonucu canlı kalıp metabolik aktivite göstermeye devam eden hücrelerin sayılması için MTT protokolü uygulandı. Analiz, metabolik olarak aktif hücrelerin sarı tetrazolium MTT molekülünün mor formazan kristallerine kesilmesine dayanır. Oluşan formazan kristalleri suda çözdürülüp renkli çözelti oluştururlar. Oluşan rengin şiddeti çok kuyulu tarama spektroskopisinde (scanning multiwell spectrophotometer, ELISA reader) ölçülür. Kristallerin çözünmesi için SDS deterjanını kullanıldı. Sonra, 96 kuyulu plate’ler mikroplate okuyucu tarafından okundu. 1.1.3. WST analizi MTT analizi ile aynı prensipte çalışır. Tek farkı, tetrazolium MTT yerine “WST-1 Cell Viability Reagent” kullanıldı. Kesilme sonucu oluşan kristaller suda çözündüğünden surfactant (SDS) eklenmedi. MTT ve WST analizleri tripan sayımı ile ilişkilendirilmiştir. Tripan sayımında sadece ölü veya sadece yaşayan hücreler görülürken, MTT ve WST analizlerinde metabolik aktivite de analiz edilmektedir. 1.1.4. Caspase-3 aktivite tayini Caspase-3 proteini apoptoza giden hücrelerde aktive olan bir proteindir. Bu nedenle Caspase-3 aktivite tayini ile hücre ölüm mekanizmasının apoptozla olup olmadığı anlaşılır. 293T (İnsan böbrek kanser hücreleri) hücrelerindeki anti-aktif caspase-3 antikorunu kullanarak immünohisto kimyasal yöntemlerle caspase-3 aktivitesine bakıldı. 1.2. Deney Grupları Geliştirdiğimiz molekül B1 ve B2 olarak 2 bileşenden oluşmaktadır. B1 ve B2 bileşenlerinin farklı oranlarda birleşimiyle M, M0, M1 ve M2 moleküllerini tasarladık. Deneylerde kullanılan örnekler aşağıdaki gibidir. Kontrol: Hiçbir bileşen uygulanmayan örneklerdir. B1: B1 bileşeni B2: B2 bileşeni B3: B2 modifikasyonu ile geliştirdiğimiz farklı bir molekül B4: B2 modifikasyonu ile geliştirdiğimiz farklı bir molekül M3: B1 ile B3 molekülü bire bir konjügatı M4: B1 ile B4 molekülü bire bir konjügatı CPT: Kemoterapi ajanı Camptothecin 2 B3 ve B4 molekülleri B2 molekülünün farklı (modifiye) bir türüdür ve B2 molekülünün kimyasal mekanizmasını anlama açısından üretilmiştir. 1.2.1. Ön Denemeler Projenin başlangıcında test ettiğimiz ilk hücre türleridir. Sağlıklı hücre olarak insan lenfosit hücreleri, kanser hücre soyu olarak ise ishikawa uterus kanser hücre soyu denemeleri yapılmıştır. 1.2.2. Seri Çalışmalar Ön denemeler başarılı olduktan sonra gerekli doz ayarlamaları ve hücre çeşitlemelerinin yapıldığı testlerdir. Deneylerde kullanılan hücreler aşağıdaki gibidir. Madin Darby canine kidney (MDCK): Kanser olmayan köpek böbrek epital hücresi. PC12: Sıçan böbreküstü bezi feokromositoma (adrenal gland pheochromocytoma) kanser hücreleri C8: İnsan beyin kanser monosit/makrofaj mikroglia A549: İnsan akciğer karsinoma 293T: İnsan böbrek kanser hücreleri GC-4 SPC: Fare testis kanser hücreleri 1.2.3. Tübitak Tarafından Yapılan Test MDA-231: İnsan meme kanser hücre soyu üzerinde sitotoksisite testi yapılmıştır. Deneyler Tubitak tarafından yapılmıştır. İlgili detaylar Ek-1’de sunulan Tübitak raporunda verilmiştir. 3 2. SONUÇLAR VE TARTIŞMA Her hücre tipi için Tripan ve MTT veya WST analiz sonuçları verilmiştir. MTT ve WST sonuçları mikropipet okuyucu tarafından okunan kuyulardaki absorbans değerleri üzerinden hesaplanmıştır. Her bir zaman noktası için (24, 48 ve 72 saat) deney gruplarındaki değerler kontrol grubuna göre normalleştirilmiştir (oranlanmıştır, normalized). Bu nedenle kontrol grubu ayrı olarak gösterilmeyip her bir zaman noktası için %100 olarak gösterilmiştir. Tripan hücre sayıları her bir zaman noktasında hesaplanmış ve grafik olarak verilmiştir. Ayrıca, aynı zaman noktaları için ölüm yüzdeleri kontrol grubuna göre normalleştirilerek hesaplanmıştır. Bu hesap için aşağıdaki formül kullanılmıştır: (100 x Ölü hücre / toplam hücre)= (her bir grup için ölüm yüzdesi) (Her bir grup için ölüm yüzdesi) – (kontrol grubunun ölüm yüzdesi )= Normalleştirilmiş ölüm yüzdesi Bu nedenle kontrol grubun ölüm yüzdesi %0 olarak alınmıştır. Bazı yaşayan hücre sayısı grafikleri için başlangıç hücre sayıları da grafiklerin üzerinde başlangıç (starting) çizgileri ile gösterilmiştir. Bu çizgi, hücrelerin deneye başlanma saylarını gösterir. MTT, WST ve tripan sayımlarında hücreler deney moleküllerimizle muamele edilmeden önce 24 saat inkübe edilmiştir. Madde uygulama esnasında hücrelerin aktif büyüme periyotunda bulunmasına dikkat edilmiştir. 4 2.1. Ön Denemeler Sağlıklı hücreler olarak inan lenfosit hücreleri (Şekil 2.1), kanser hücreleri olarak ise ishikawa uterus kanser hücreleri (Şekil 2.2) kullanılmıştır. 24, 48 ve 72. Saatlerde canlı hücrelerin sayımı yapılmıştır. Şekil 2.1: Sağlıklı lenfosit hücreleri testi Şekil 2.2: Ishikawa: uterus kanser hücreleri testi Ishikawa hücrelerinde sitotoksik etki görüp, sağlıklı hücrelerde M1 molekülünde sitotoksik etki görmeyince birçok hücre türünde yaptığımız testleri içeren seri çalışmalara başladık. 5 2.2. Seri Çalışmalar 2.2.1. Kontrol Grubu Deneyi Kontrol grubu olarak MDCK (Madine Darby Canine Kidney) hücreleri kullanılmıştır (Şekil 2.3). Şekil 2.3: MDCK: Madine Darby Canine Kidney hücreleri MTT testi Bu hücreler normal hücrelerdir M1 molekülünün ve CPT kemoterapi ilacının normal hücrelere etkisini görüp karşılaştırmak için kullanılmıştır. MTT analizlerinde CPT kemoterapi ilacının normal hücrelerin çoğunu öldürdüğü fakat M1 molekülünün hücreler üzerinde sitotoksik etki göstermediği görülmektedir. Bu çalışmamızda, mekanizmayı anlamak için çeşitli türevlendirmelerde bulunduk. B1 ve B2 bileşenlerini çeşitli oranlarda ve farklı kimyasal bağlarla bağlayıp yaptığımız türevlendirmeleri M ve M0 olarak isimlendirdik. Bu türevlendirmeler bize mekanizma açısından çok önemli bilgiler sağladı ve sonrasında M2 molekülünü tasarlamamızı sağladı. 6 2.2.2. Kanser Hücre Deneyleri 2.2.2.1. PC12: Sıçan böbreküstü bezi feokromositoma (adrenal gland pheochromocytoma) kanser hücreleri 24, 48 ve 72 saat uygulamadan sonra Trypan canlı hücre sayısı ölçülmüştür (Şekil 2.4). Şekil 2.4: PC12: Sıçan böbreküstü bezi feokromositoma (adrenal gland pheochromocytoma) kanser hücreleri M1 molekülü ile yaptığımız çalışmalara, PC12: Sıçan böbreküstü bezi feokromositoma hücreleri ile devam ettik. B2 bileşeni hücre büyümesini baskılamış, 72 saatte ise hafif bir düşüş göstermiştir. CPT molekülü ise 24 saatte önemli bir sitotoksik etki göstermemesine rağmen 48. saatte büyük oranda sitotoksik etki gösterdi. Fakat 72 saatte tekrar canlılık oranı artış gösterdi. M1 molekülünde ise hücre canlılık oranı 48 saatte büyük oranda azalmış, 72 saatte ise tam ölüm sağlanmıştır. Sonuç olarak M1 molekülü B2 bileşeninden ve CPT’den daha yüksek sitotoksik etki göstermiştir. 2.2.2.2. C8: İnsan beyin kanser monosit/makrofaj mikroglia 24, 48 ve 72 saat uygulamadan sonra Tripan canlı hücre sayısı ölçülmüştür (Şekil 2.5). Şekil 2.5: C8: İnsan beyin kanser monosit/makrofaj mikroglia 7 B1 bileşeni 24, 48 ve 72 saatte büyük oranda sitotoksik etki göstermiştir. M1 ve CPT gruplarında ise, tripan sayımları bütün hücrelerin 24. saatte öldüğünü göstermiştir. Sonuç olarak, C8 hücrelerinin test ettiğimiz bütün moleküllere karşı hassas olduğu gözlemlenmiştir. 2.2.2.3. A549: İnsan akciğer karsinoma 24, 48 ve 72 saat uygulamadan sonra Tripan hücre sayımı testi yapılmıştır (Şekil 2.6). Daha sonra çift doz uygulama ile WST analizi de yapılmıştır (Şekil 2.7). Şekil 2.6: A549: İnsan akciğer karsinoma Tripan Sayımı Şekil 2.7: A549: İnsan akciğer karsinoma: Çift doz WST analizi 8 WST ve tripan analizleri M1 molekülünün tek başına B1 ve tek başına B2’ye göre belirgin olarak daha etkili olduğunu göstermiştir. B1 ve B2 moleküllerinin beraber kullanımı (M1), ölüm oranını büyük oranda arttırmıştır. Tripan sayımı M1 molekülü için 72. Saatte tamamiyle ölümü (total death) göstermiştir. Ayrıca sadece bu hücre tipi için çift doz (6 mg/ml) uygulama da denenmiştir. Normal doza göre aynı korelasyon görülmüştür. Fakat canlı hücre sayısı sıfıra yakın seviyeye düşmüştür. Mekanizma anlama açısından türevlendirmelere devam edilmiştir. B3 ve B4 türevlendirmeleri ile birlikte, onların B1 bile olan bileşiklerini temsil eden M3 ve M4 türevlendirmelerinin de sitotoksik etkilerine bakılmıştır. M3 ve M4 moleküllerinin 24, 48 ve 72 saatlerdeki sitotoksik etkileri bize daha sonraki çalışmalarda yol göstererek M2 molekülünü tasarlamamızı sağladı. 2.2.2.4. 293T: İnsan böbrek kanser hücreleri 24, 48 ve 72 saat uygulamadan sonra WST analizi yapılmıştır (Şekil 2.8) . Şekil 2.8: 293T: İnsan böbrek kanser hücreleri WST analizleri M1 molekülünün CPT’ye göre daha fazla sitotoksik etki göstermiştir. B1 bileşeni de CPT’ye göre daha fazla sitotoksik etki göstermiş fakat M1 molekülünün sitotoksik etkisi çok daha fazladır.B2 bileşeni ise hücre proliferasyonunu sağlamıştır. B2 bileşeni hücre proliferasyonunu sağlarken, B1 bileşeni ve M1 molekülünün sitotoksik etki göstermesi çalışma mekanizmasını anlama açısından önemli bilgiler edinmemizi sağlamıştır. 9 2.2.2.5. GC-4 SPC: Fare testis kanser hücreleri 24, 48 ve 72 saat uygulamadan sonra WST analizi yapılmıştır (Şekil 2.9). Şekil 2.9: GC-4 SPC: Fare testis kanser hücreleri WST analizleri M1 ile sadece B1 ve sadece B2 bileşenleri arasında belirgin bir etki farkı olduğunu göstermiştir. M1 molekülü kullanıldığında hücre ölüm oranı büyük oranda artmış, 72. saatte tam ölüm (total death) gözlemlenmiştir. M1 molekülü CPT molekülünden daha fazla sitotoksik etki göstermiştir. 2.2.2.6. MDA-231: İnsan meme kanser hücre soyu Oldukça yayılmacı bir meme kanseri türü olan MDA-231 insan meme kanser hücre soyları üzerinde deneyler yapılmıştır. Bu testte, daha önce kullandığımız M1 molekülü ile birlikte, yeni geliştirmiş olduğumuz M2 bileşiğini de kullandık. Tasarlanan M1 ve M2 moleküllerinin MDA-231 kanser hücre soyları üzerindeki 24, 48 ve 72 saatteki etkileri belirlenmiştir. Elde edilen veriler Ek-1'de bulunan 13.06.2012 tarihli Tübitak Raporu sayfa 5'deki tabloda bulunmaktadır. Bu veriler yine aynı raporda sayfa 5 ve 6 da grafik haline getirilmiştir. Tablo ve grafiklerdeki %1 uyguama oranı 1mg/ml son derişime denk gelmektedir. Bu tablodaki veriler, anlaşılması kolay olması için aşağıdaki grafiklerde gösterilmiştir (Şekil 2.10, Şekil 2.11, Şekil 2.12): 10 Şekil 2.10: M1 ve M2 maddelerinin farklı dozlardaki uygulamaları. Bu tabloda 24 saat uygulama Şekil 2.11: M1 ve M2 maddelerinin farklı dozlardaki uygulamaları. Bu tabloda 48 saat Şekil 2.12: M1 ve M2 maddelerinin farklı dozlardaki uygulamaları. Bu tabloda 72 saat 11 Grafiklerde görüldüğü gibi düşük dozlarda bile 24. ve 48. saatlerde kanser hücreleri sayısında ciddi bir azalma olmuştur. Aşağıda en etkin 3 farklı M1 ve M2 dozlarını içeren ve kanser hücrelerinin sayılarındaki azalmayı yukarıdaki grafiklere göre özetleyen bilgiler verilmiştir. Sayılardaki azalma hiçbir ilaç uygulanmayan kanser hücreleri ile karşılaştırılarak hesaplanmaktadır. 3 numaralı doz uygulama sonuçları 24. saatte, M1 molekülünün 3 numaralı doz miktarında hücre sayısı %64 oranında azalmıştır. M2 molekülünde ise %74 azalmıştır. 48. saatte, M1 molekülünün 3 numaralı doz miktarında hücre sayısı %55 oranında azalmıştır. M2 molekülünde ise %84 azalmıştır. 72. saatte, M1 molekülünün 3 numaralı doz miktarında hücre sayısı %50 oranında azalmıştır. M2 molekülünde ise %85 azalmıştır. 6 numaralı doz uygulama sonuçları 24. saatte, M1 molekülünün 6 numaralı doz miktarında hücre sayısı %86 oranında azalmıştır. M2 molekülünde ise %91 azalmıştır. 48. saatte, M1 molekülünün 6 numaralı doz miktarında hücre sayısı %96 oranında azalmıştır. M2 molekülünde ise %98 azalmıştır. 72. saatte, M1 molekülünün 6 numaralı doz miktarında hücre sayısı %99,4 oranında azalmıştır. M2 molekülünde ise %99,8 azalmıştır. 10 numaralı doz uygulama sonuçları 24. saatte, M1 molekülünün 10 numaralı doz miktarında hücre sayısı %91 oranında azalmıştır. M2 molekülünde ise %95 azalmıştır. 48. saatte, M1 molekülünün 10 numaralı doz miktarında hücre sayısı %98,5 oranında azalmıştır. M2 molekülünde ise %98,7 azalmıştır. 72. saatte, M1 ve M2 moleküllerinin uygulandığı tüm hücreler ölmüştür. 2.2.3. Mekanizma Tayini Kanser hücrelerindeki apoptozu gözlemlemek için Caspase-3 aktivite tayini yapılmıştır. 2.2.3.1. Caspase-3 Aktivite Tayini B1 ve B2 bileşenleri, M1 molekülü ve Camptothecin’in negatif kontrolle karşılaştırmalı olarak 293T (İnsan böbrek kanser hücreleri) üzerinde Caspase-3 aktivite tayini testleri yapılmıştır (Şekil 2.13). Şekil 2.13: 293T: İnsan böbrek kanser hücreleri Caspase-3 aktivite tayini Şekil 2.13’deki fotoğraflar 24. saatte 1,7x optik yakınlaştırma altında çekilmiştir. Caspase-3 aktivitesi B1, M1 ve CPT uygulanmış gruplarda (C-E) gözlenmiş fakat kontrol grubu ve B2 grubunda gözlemlenmemiştir. M1 ve B1 örneklerinde gözlenen Caspase-3 aktivitesi, geliştirdiğimiz moleküllerin apoptoz mekanizmasını da aktifleştirdiğini göstermektedir. 12 3. SONUÇ Deneylerimiz boyunca B1 ve B2 bileşenleri baz olmak üzere birçok molekül tasarladık. İlk çalışmalarımızda en etkili formülasyon olarak M1 molekülünü geliştirdik ve birçok deneyimizi M1 molekülü üzerinden gerçekleştirdik. M1 molekülü, tek başına B1 ve tek başına B2’den çok daha etkili olduğu görülmüştür. M1 molekülü, böbrek, akciğer, testis, beyin, uterus, meme ve böbreküstü bezi kanser tipleri üzerinde öldürücü etkisi göstermektedir. Ayrıca, böbrek kanser hücreleriyle yapılan caspase-3 aktivite tayinlerinde, geliştirdiğimiz M1 molekülünün kanser hücrelerini apoptoz mekanizmasıyla öldürdüğü gözlemlenmiştir. Geliştirdiğimiz moleküllerin en önemli özelliklerinden birisi kanser hücrelerine karşı sitotoksik etki gösterirken kanser tipi olmayan hücreler üzerinde sitotoksik etki göstermemesidir. Yaptığımız denemelerde M1 molekülü kanser tipi olmayan MDCK (ve lenfosit) hücrelerine karşı sitotoksik etki göstermemiş fakat CPT molekülü MDCK hücreleri üzerinde sitotoksik etki göstermiştir. Bu yüzden, tasarladığımız moleküller kemoterapi ilaçlarına göre çok daha üstün özellikler göstermiştir. Geliştirdiğimiz moleküllerin en önemli özelliklerinden bir diğeri ise istediğimiz yönde türevlendirilebilmesidir. Ön ve seri çalışmalarımızdan edindiğimiz tecrübeler üzerine M2 molekülünü tasarladık ve Tübitak’ta yapılan testlerde M1 ve M2 molekülünü birlikte analiz ettirdik. Tübitak’ta yaptırılan test sonuçlarına göre M1 ve M2 molekülleri için elde edilen verilerin çoğunda yüzde canlılık oranları kontrolün (100 rakamının) oldukça altındadır. Özellikle 6 ve 10 numaralı uygulamalarda (6mg/ml ve 10mg/ml) kanser hücrelerinin ölüm oranı %99’lar seviyesindedir. Bir diğer ifadeyle her iki molekül de MDA-231 hücrelerine karşı ölümcül etki göstermekle birlikte M2 molekülü daha etkili olmuştur. Bu etki farkı moleküllerin ne kadar geliştirilebilir olduğunun ispatıdır. Çünkü M2 molekülü M1 molekülünü türevlendirerek üretilmiştir. Aynı şekilde, yapacağımız diğer türevlendirmeler ile etki hızını ve etkili olduğu kanser hücresi türünü değiştirmemiz mümkündür. 13