Alkoller, eterler, aldehit ve ketonlar
advertisement

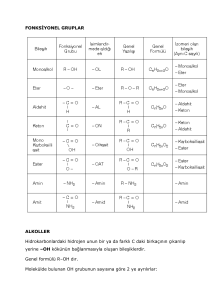
ALİFATİK YAPILI ORGANİK BİLEŞİKLER II Doç.Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2006 1 Alkoller Alkoller, hidroksil (OH) grubu içeren bileşiklerdir. 2 Alkoller, hidroksil grubunun bağlı olduğu karbon atomunun primer (RCH2), sekonder (R2CH), tersiyer (R3C) olmasına göre primer alkoller (RCH2OH), sekonder alkoller (R2CHOH), tersiyer alkoller (R3COH) olarak sınıflandırılırlar. 3 Metanol, etanol ve propanoller suda her oranda çözünürler. Alkol molekülü büyüdükçe çözünme hızla azalır ve C>12’den sonraki 4 alkoller pratik bakımdan suda çözünmezler. Alkoller, moleküldeki hidroksil grubunun sayısına göre monoalkoller, dialkoller (glikoller), trialkoller, polialkoller olarak sınıflanabilirler. Glikoller ve daha fazla sayıda hidroksil grubu içeren alkoller, yüksek değerli alkoller olarak adlandırılırlar. 5 Alkollerin molekülleri arasında hidrojen bağları bulunduğundan kaynama noktaları alkanlarınkinden yüksektir. 6 Alkoller, OH bağı ile, suyun OH bağı gibi asitlik reaksiyonu verirler; oksijen üzerinden proton ayrılır ve yerine başka bir atom veya grup girer. Alkoller sudan yaklaşık 100 kat daha zayıf asittirler. Alkollerin anyonlarına (RO) alkolat veya alkoksit denir. 7 Alkoller, karboksilik asitlerle karboksilat esterlerini (RCOOR) oluştururlar. 8 Primer ve sekonder alkollerin -hidrojenlerinin CH bağının elektronları, uygun yükseltgenlerle alınırlar; böylece primer alkollerden aldehitler, sekonder alkollerden ketonlar meydana gelir. Tersiyer alkoller, normal koşullarda yükseltgenlerden etkilenmezler. 9 Alkollerin dehidrasyonu ile alkenler oluşur. 10 Metanol (CH3OH), ilk kez odunun damıtılma ürününden yalıtılmıştır; endüstride, sentetik reçinelerin üretilmesinde kullanılan formaldehidin sentezi için gereklidir. Metanol, organik çözücülerle kolayca karışır. Metanol, vücuttan çok yavaş atılır; özellikle göz sinirlerine zarar vererek körlüğe neden olabilir. 11 Etanol (C2H5OH), endüstride çözücü olarak, sentezlerde, hekimlikte ve eczacılıkta kullanılır. Alkollü içkileri üretmek için gerekli olan etanol, daha çok şekerli maddelerin veya nişastanın fermantasyonuyla elde edilir; sulu fermantasyon karışımından, birkaç kez damıtılarak ayrılır; bunun konsantrasyonu en çok %96’dır. %100’lük etil alkole mutlak alkol veya absolü alkol denir. Etanol, vücutta sedatif ve narkotik etkilidir; %70-80’lik etil alkol, dıştan kullanıldığında dezenfekte edicidir. 12 Eterler Eterler, genel formülü ROR şeklinde olan bileşiklerdir. Eter molekülünde oksijen üzerinde hidrojen bulunmadığından moleküller arasında hidrojen bağları meydana gelmez; bu nedenle eterlerin kaynama noktaları düşüktür. 13 Dietil eter (C2H5OC2H5), kısaca eter olarak bilinir; pratikte etil alkol+sülfürik asit karışımları ısıtılarak elde edilir; bu nedenle bazen eter sülfürik diye de adlandırılır. Eter, halk arasında lokman ruhu olarak bilinir; çok önceleri az miktarda koklanmak veya suya damlatılıp içilmek suretiyle ferahlatıcı ve rahatlatıcı olarak kullanılmıştır. 1 kısım eter+3kısım alkol karışımı, Hoffman damlası olarak bilinir; kolik tarzında ağrıları dindirmek için kullanılmıştır. 14 Eter buharı çok miktarda solunduğunda bayıltıcı ve anestetik etkilidir. 15 Eter, kimya laboratuvarlarında ekstraksiyon işleminde çok kullanılan bir çözücüdür; önemli sakıncası, kolay yanıcı olmasıdır. 16 Aldehit ve ketonlar Aldehit ve ketonlar, karbonil bileşikleridirler. Açil bileşikleri 17 Aldehitler, primer alkollerin oksitlenmesiyle elde edilirler. 18 Ketonlar, sekonder alkollerin oksitlenmesiyle elde edilirler. 19 Aldehitler ve ketonlar polar olmakla birlikte molekülleri arasında hidrojen bağları meydana gelmez; bu nedenle kaynama noktaları alkollerinkinden daha düşüktür. Aldehitlerin ve ketonların küçük moleküllü olanları suda çözünürler; çünkü su molekülleriyle hidrojen bağları yapabilirler. Molekül büyüdükçe hidrofob etkiden dolayı suda çözünürlükleri azalır. 20 Aldehitler ve ketonlar, reaksiyon yeteneği fazla olan bileşiklerdir; katılma, yükseltgenme, indirgenme, kondensasyon reaksiyonları verebilirler. 21 Triklorasetaldehite (kloral) su katılmasıyla uyku ilacı (hipnotik) olarak kullanılan kloral hidrat Cl3CCH(OH)2 oluşur. 22 Aldehitler ve ketonlara alkol katılmasıyla yarı-asetaller oluşur. Basit şekerlerin pek çoğu başlıca halkalı yarı-asetal yapısında bulunur. 23 Aldehitler ve ketonlar tiyollerle tepkimeye girerek tiyoasetalleri oluştururlar. 24 Aldehitler, güçlü yükseltgenlerle karboksilik asitlere yükseltgenirler. Ketonlar, güçlü yükseltgenlerle normal koşullarda reaksiyon vermezler. 25 Aldehitler yükseltgenirken yükseltgen maddeyi indirgerler. 26 Aldehitlere yükseltgenlerin etkisi, aldehitleri tanıma reaksiyonları bakımından önemlidir. Tollens belirteci, aldehitlerle sıcakta gümüş aynası verir. Fehling belirteci, aldehitlerle sıcakta kiremit kırmızısı Cu2O çökeltisi verir. 27 Farklı indirgenler, aldehitleri primer alkollere indirgerler. Farklı indirgenler, ketonları sekonder alkollere indirgerler. 28 Aldehitlerin ve ketonların önemli bir reaksiyonu, enolleşme reaksiyonudur. 29 Karbonil bileşiklerinin keto ve enol şekilleri, özel tipte yapı izomerleridir. Birbirine dönüşebilen keto ve enol hallerine tautomerler denir ve onların birbirine dönüşümüne tautomerleşme adı verilir. 30 Karbonil bileşiklerinin aldol kondensasyon reaksiyonu da önemlidir. 31 Formaldehit (HCHO), normal şartlarda gaz halde, karakteristik kokulu bir maddedir; endüstride metanolden elde edilir. 32 %40’lık formaldehit çözeltisi, formol veya formalin diye bilinir. Formolde halâ %10-15 metanol bulunur. Formol, kuvvetli bir dezenfeksiyon maddesidir; anatomik dokuların, organların saklanmasında kullanılır. Formaldehit, proteinleri denatüre eder; bu nedenle tahriş edicidir; gaz ve çözelti halinde ellere, yüze ve göze 33 değmesinden sakınılmalıdır. Asetaldehit (CH3CHO), renksiz, kaynama noktası 21oC olan, bayıltıcı kokuda bir maddedir. Asetaldehit, asetik aside yükseltgenebilir veya etanole indirgenebilir. 34 Asetaldehit, sulu asitli ortamda kolaylıkla paraldehit adında halkalı bir trimer verir. Paraldehit özel kokulu bir sıvıdır; bir zamanlar uyku ilacı olarak kullanılmıştır; nefeste kötü bir koku oluşturur. 35 Aseton (CH3COCH3), kaynama noktası 56oC ve kendine has kokusu olan bir sıvıdır. Asetonun organik bileşikleri çözme gücü yüksektir; genellikle çözücü olarak kullanılır. Aseton, su, etanol ve eterle kolayca karışır. Aseton, diabetes mellituslu hastaların vücudunda da patolojik olarak fazla miktarda oluşur; idrarla ve solunumla atılır. 36