Slayt 1
advertisement

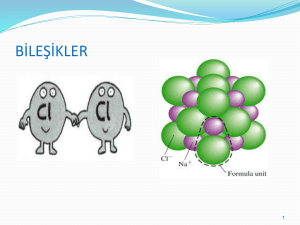
İyon Yükü ve Yükseltgenme Basamağı Elektron alış verişinin tam olduğu varsayılan NaCl gibi bileşikler için iyon yükü tabiri kullanılır. NaCl suda çözündüğünde Na+ ve Cl- iyonlarını ortama salar. Burada sodyumun iyon yükü 1+ ya da yükseltgenme basamağı 1+ tabirleri kullanılır. Ancak SO3 bileşiği suda çözündüğünde S6+ iyonu oluşmaz. Bu yüzden bu tür atomlar için iyon yükü tabiri kullanılmaz. Bu tür maddelerde iyon yükü tabiri yerine, yükseltgenme basamağı tabiri kullanılır. İyon Yükü ve Yükseltgenme Basamağı: Bir atomun kimyasal davranışını değerlik elektron sayısı belirler. Daha önceden de bildiğimiz gibi son katmanlarında 1 elektronu olanlar 1+, 2 elektronu olanlar 2+ yükle yüklenirler. GRUP DEĞERLİK ELEKTRON SAYISI YÜKSELGENME BASAMAĞI 1A 1 1+ 2A 2 2+ 3A 3 3+ 4A 4 4+,4- 5A 5 3-,3+, 5+ 6A 6 2-,4+, 6+ 7A 7 1-,1+, 3+, 5+, 7+, 8A 8 0 Bir Atomda; Ps = Es ise bu atoma yüksüz yani nötr atom denir. Ps<Es ise - yüklü iyon (ANYON) Ps>Es ise + yüklü iyon (KATYON) İyon Yükü ve Yükseltgenme Basamağı: KÖK: Kimyasal tepkimelerde tek bir atom gibi davranan atom gruplarına kök denir. Örnek: NO31- = 4 atomdan oluşur ama kimyasal tepkimelerde X1- iyonu gibi davranır. Örnek: SO42- = 5 atomdan oluşur ama kimyasal tepkimelerde X2- iyonu gibi davranır. Yükseltgenme Basamağı Hesaplamaları: •Elementlerin yükseltgenme basamakları “0” dır •1A grubu elementleri (hidrojen hariç) 1+ dır. •2A grubu elementlerinin yükseltgenme basamağı 2+ dir. •3A da Al un yükseltgenme basamağı 3+ •Hidrojenin yükseltgenme basamağı genellikle 1+ iken, metallerle bileşiklerinde 1- değerini alırlar. •Oksijenin yükseltgenme basamağı genellikle 2- dir. •Bileşiklerde tüm atomların yükseltgenme basamakları toplamı 0 dır. •Köklerde ise atomların yükseltgenme basamağı toplamı kökün yüküne eşittir. NOT : A grubu metallerinin yükseltgenme basamakları sabitken, ametaller ve B grubu metalleri birden fazla yükseltgenme basamağına sahip olabilirler. Yükseltgenme Basamağı Hesaplamaları: ÖRNEK: H2SO4 bileşiğinde S ün yükseltgenme basamağını bulunuz. H2+SxO42- =0 ve 1+x+(-8)=0 ve X=+6 ÖRNEK: K2Cr2O7 bileşiğinde Cr un yükseltgenme basamağını bulunuz. K2+Cr2xO72- ve 2+2x+(-14)=0 ve x=+6 ÖRNEK: CaMnO4 ‘de Mn’nın yükseltgenme basamağını bulunuz. Ca2+MnxO42- ve 2+x+(-8)=0 ve x=+6 ÖRNEK: SO42- ‘de S ‘ün yükseltgenme basamağını bulunuz. 2.ÜNİTE II.BÖLÜM İyonik Bileşiklerin Oluşumu 2.1.1 Değerlik elektron sayısı ve Lewis Yapısı Bir atomun son katmanındaki toplam elektron sayısına değerlik elektron sayısı denir. Değerlik elektronların atomların etrafında noktalar şeklinde gösterilmesine LEWİS yapısı denir. Aşağıdaki tabloda A grupları elementlerinin lewis yapıları gösterilmiştir. (:) çiftleşmiş elektronu, (.)çiftleşmemiş elektronu göstermektedir. Lewis yapıları yazılırken element sembolünün çevresine değerlik elektron sayısı kadar nokta konur. Bu noktalar sembolün dört tarafına önce teker teker yerleştirilir. Eğer dörtten fazla elektronu varsa sekize (oktete) ulaşıncaya kadar noktalar ikişerli olacak şekilde yerleştirilir. 10Ne ) ) 2 8 Ne İyonlarda Bileşik Oluşumu “Kimyasal tepkimelerde, verilen elektron sayısı alınan elektron sayısına eşittir.” Bileşik formülleri bu mantığa göre yazılır. Na F İyonlarda Bileşik Oluşumu ÖRNEK: Mg Cl2 bileşiğinin oluşumu: 12Mg: 2)8)2 ve Magnezyum 2 elektron vererek Mg+2 iyonunu oluşturur. 17Cl: 2)8)7 ve Klor 1 elektron alarak Cl iyonunu oluşturur. Görüldüğü gibi bir Mg atomunun verdiği 2 elektronu, 2 Cl atomu alabildiğinden MgCl2 bileşiği oluşmuş olur. ÖRNEK: MgO bileşiğinin oluşumu: 2+ 12Mg: 2)8)2 ve Magnezyum 2 elektron vererek Mg iyonunu oluşturur. 28O: 2)6 ve Oksijen 2 elektron alarak O iyonunu oluşturur. Görüldüğü gibi bir Mg atomunun verdiği 2 elektronu, 1 tane O’atomu alabildiğinden MgO bileşiği oluşmuş olur. Mg+2 Cl- Mg+2 O-2 MgCl2 MgO 2.1.3 İyonlarda Bileşik Oluşumu (Çaparazlama Kuralı) Katyon ve anyonların yükseltgenme basamakları bulunur. Katyonun değerliğinin anyonun altına yazılması ve anyonun değerliğinin pozitif olarak katyonun altına yazılması ve en sade biçimde sadeleştirilmesiyle oluşacak bileşiğin formülü bulunmuş olur. Bu olaya “Çarprazlanma Kuralı” denir. Çaprazlama yapılırken + ve – dikkate alınmaz. X+m Y-n Xm Yn İyonik Bileşiklerin İsimlendirilmesi Metal ametal bileşiklerinin İsimlendirilmesi Metalin adı+ Ametal iyonunun adı ÖRNEK: CaF2 : Kalsiyum Florür AlBr3 : Alüminyum Bromür NaCl MgI2 : Sodyum Klorür : Magnezyum İyodür NOT: Her ametal iyonu sonuna –ür eki almaya bilir. CaH2 : Kalsiyum Hidrür Ca2C : Kalsiyum Karbür Ca3N2 :Kalsiyum Nitrür Ca3P2 : Kalsiyum Fosfür CaO : Kalsiyum Oksit CaS : Kalsiyum Sülfür Eğer metal değişik değerlik alabiliyorsa; Metalinadı + Metalin Yükü + Ametal iyonunun adı CuCl : Bakır (I)klorür CuCl2 : Bakır (II)klorür FeO :Demir (II)oksit Fe2O3 :Demir (III)oksit Metal - kök bileşiklerinin isimlendirilmesi Metalin adı + kökün adı ÖRNEK: CaSO4 : Kalsiyum Sülfat AlPO4 : Alüminyum Fosfat CaCr2O7 : Kalsiyum di Kromat FeSO4 : Demir(II) Sülfat NaNO3 : Sodyum Nitrat Mg(ClO3)2: Magnezyum Klorat CaCO3 : Kalsiyum Karbonat Fe2(SO4)3 : Demir(III) Sülfat Kök - kök bileşiklerinin isimlendirilmesi Kökün adı + kökün adı ÖRNEK: NH4NO3 : Amonyum Nitrat (NH4)2SO4 : Amonyum Sülfat (NH4)3 PO4 : Amonyum Fosfat NH4ClO3 : Amonyum klorat Kök- ametal bileşiklerinin isimlendirilmesi Kökün adı + ametalin adı ÖRNEK: NH4Cl : Amonyum Klorür (NH4)3N : Amonyum Nitrür Bazı bileşikler özel olarak adlandırılır. ÖRNEK: H2O: Su NH3: Amonyak NaCl: Yemek tuzu CH4: Metan H2SO4: Sülfirik asit CaCO3: Kireç taşı CaO: Sönmemiş kireç NH4 )2S : Amonyum Sülfür (NH4)3P : Amonyum Fosfür