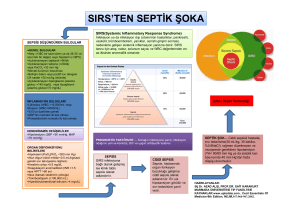
deneysel sepsis modelinde, geç dönem hiperbarik ve normobarik
advertisement

T.C. GENELKURMAY BAŞKANLIĞI GÜLHANE ASKERİ TIP AKADEMİSİ ASKERİ TIP FAKÜLTESİ İÇ HASTALIKLARI BİLİM DALI BAŞKANLIĞI DENEYSEL SEPSİS MODELİNDE, GEÇ DÖNEM HİPERBARİK VE NORMOBARİK OKSİJEN TEDAVİLERİNİN KARACİĞER ÜZERİNE ETKİNLİĞİ HALİL ERTÜRK Dz. Tbp. Yzb. Gülhane Askeri Tıp Akademisi Askeri Tıp Fakültesi’nin İç Hastalıkları Tıp Uzmanlığı için öngördüğü TIPTA UZMANLIK TEZİ olarak hazırlanmıştır. TEZ DANIŞMANI M. Refik MAS Prof. Tbp. Kd. Alb ANKARA 2009 GATA Askeri Tıp Fakültesi Dekanlığına; “Deneysel Sepsis Modelinde, Geç Dönem Hiperbarik ve Normobarik Oksijen Tedavilerinin Karaciğer Üzerine Etkinliği” konulu bu çalışma jürimiz tarafından İç Hastalıkları Bilim Dalı’nda Tıpta Uzmanlık Tezi olarak kabul edilmiştir. Tez Danışmanı : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (imza) (Ünvanı, Adı Soyadı) Üye : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (imza) (Ünvanı, Adı Soyadı) Üye : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (imza) (Ünvanı, Adı Soyadı) Üye : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (imza) (Ünvanı, Adı Soyadı) Üye : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (imza) (Ünvanı, Adı Soyadı) Üye : . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . (imza) (Ünvanı, Adı Soyadı) ONAY: Dz.Tbp.Yzb. Halil ERTÜRK’ün … /… / 2009 tarihinde savunduğu bu tez Akademi Kurulu’nca belirlenen yukarıdaki jüri üyeleri tarafından uygun görülmüş ve kabul edilmiştir. Dekan ii TEŞEKKÜR Bu tez çalışması Gülhane Askeri Tıp Akademisi Komutanlığı İç Hastalıkları BD 31.10.2006 gün ve 0530-153-06/442 sayılı kararı gereği, İç Hastalıkları Bilim Dalı Başkanlığında yapılmıştır. Bu çalışmada deneysel rat sepsis modelinde Hiperbarik Oksijen tedavisi ve Normobarik Oksijen tedavisi karşılaştırılmış, tedavilerin karaciğer üzerine geç dönemdeki etkinlikleri, farklıkları ve üstünlükleri araştırılmıştır. Konunun belirlenmesi ve çalışmanın yürütülmesinde yardım ve katkılarını esirgemeyen, tez yöneticim Prof.Tbp.Kd.Alb. M.Refik MAS’a sonsuz teşekkürlerimi sunarım. Uzmanlık eğitimim boyunca iyi bir hekim olarak yetişmem için değerli katkılarından dolayı başta İç Hastalıkları Bilim Dalı Başkanı sayın Prof.Tbp.Kd.Alb. Kenan SAĞLAM olmak üzere, Prof.Tbp.Tuğg. Mustafa KUTLU’ya, Prof.Tbp.Tuğg. M. Tahir ÜNAL’a, Prof.Tbp.Kd.Alb. M. Refik MAS’a, Doç.Tbp.Alb. Bayram KOÇ’a, Doç.Dz.Tbp.Alb. Fatih BULUCU’ya, Doç.Hv.Tbp.Yb. Levent YAMANEL’e, Doç.Tbp.Bnb. İlker TAŞÇI’ ya, Yrd.Doç.Dz.Tbp.Bnb. Gökhan ERDEM’e, İç Hastalıkları Anabilim Dalı öğretim üyeleri, asistanları, hemşireleri ve klinik çalışanlarına teşekkürlerimi arz ederim. Çalışmamın gerçekleşmesinde büyük destek ve yardımlarından dolayı, Doç.Dr.Ecz.Alb. Cemal AKAY’a, Uzm.J.Tbp.Bnb. Bülent UYSAL’a, istatistiksel incelemeleri yapan Doç.Tbp.Bnb.Turgut TOPAL’a, histopatolojik değerlendirmeleri yapan Yrd.Doç.Tbp.Bnb. Yıldırım KARSLIOĞLU’na, Yrd.Doç.Tbp.Bnb. Orhan BEDİR’e, arkadaşlarım Ahmet ÖZTÜRK ve Elvan ŞAHİN’e sonsuz saygı ve teşekkürlerimi sunarım. Uzmanlık eğitimim boyunca ve tez çalışmam süresince varlıklarıyla bana destek olan annem, babam, kardeşim, kızım Emine Miray ve oğlum Halil Efe’ye sonsuz teşekkür ederim. Halil ERTÜRK Dz.Tbp.Yzb. iii ÖZET Dz.Tbp.Yzb. Halil ERTÜRK, “Deneysel Sepsis Modelinde, Geç Dönem Hiperbarik ve Normobarik Oksijen Tedavilerinin Karaciğer Üzerine Etkinliği”, Gülhane Askeri Tıp Akademisi Askeri Tıp Fakültesi İç Hastalıkları Bilim Dalı, Tıpta Uzmanlık Tezi, Ankara, 2009. Sepsis, mikrobiyal maruziyet sonrasında enflamasyon ve koagülasyonun birlikte aktive olmasıyla karakterize komleks bir sendromdur. Bu olaylar, immün hücreler veya hasar görmüş endotel hücrelerinden salınan proenflamatuvar sitokinler, prokoagülanlar ve adezyon molekülleri yoluyla sistemik enflamatuvar yanıt sendromu / sepsis bulguları ile ortaya çıkar. Sepsis, hastane mortalite oranı %30 ile ölümcül bir hastalıktır. Ciddi sepsis ve septik şokun mortalite oranları ise çok daha yüksektir. Fizyopatolojisi daha iyi anlaşıldıkça, antibiyotik tedavisine ilave olarak birçok ajan denenmiş ama hala yeterli sonuçlar elde edilememiştir. Karaciğer, sendromun aktif oyuncusu ve etkilenen organı olarak sepsiste anahtar organ gibi görünmektedir. Sepsiste gelişen çoklu organ yetmezliğinden sorumlu tutulan karaciğerin, bakteriyel temizlik, bakteriyel ürünlerin inaktivasyonu, enflamatuvar mediyatörlerin üretim ve temizliği gibi fonksiyonları vardır. Bu nedenle, sepsiste karaciğer hasarının önlenmesi ya da azaltılması önem kazanmaktadır. Hiperbarik oksijen (HBO), stres altındaki hücrelere oksijen sunan bir tedavi yöntemidir. Vazokostrüktör, mikroorganizma çoğalmasını önleyici, anjiyogenezisi aktive edici, dokuların bozulmuş oksijen transport kapasitesini düzeltici, antioksidan enzim aktivitesini artırıcı ve reaktif oksijen türevlerini süpürücü özellikleriyle hipoksik dokulara etki eder. Sepsiste karşılaştırmalı çalışması olmasa da yoğunbakım koşullarında kullanılmasında zorluklar olan HBO uygulaması yerine normobarik oksijen (NBO) uygulaması ile bu faydaların elde edilebileceğini düşündüren çalışmalar mevcuttur. Bu çalışmada, deneysel rat sepsis modelinde HBO ve NBO tedavilerinin karaciğer hasarı ve oksidatif stres üzerine etkilerinin araştırılması planlandı. Bu amaçla, 40 erkek wistar rat, randomize olarak 4 iv gruba ayrıldı; sham grubu (n=10), kontrol (SEPSİS+CEFEPİM) grubu (n=10), HBO (SEPSİS+CEFEPİM+HBO) grubu (n=10), NBO (SEPSİS+CEFEPİM+ NBO) grubu (n=10). Sepsis indüksiyonu için kontrol, HBO ve NBO grubundaki ratlara 2,1 x 109 CFU canlı E. Coli IP yolla verildi. Sepsis indüksiyonu sonrasında başlanarak kontrol, HBO ve NBO grubundaki ratlara günde iki kez 50 mg/kg sefepim IP yolla uygulandı. HBO grubundaki ratlara, 2.4 ATA’da günde 2 kez, 90 dk HBO tedavisi uygulandı. NBO grubundaki ratlara ise 5 lt/dk oksijen ile 1 ATA’da günde 2 kez, 90 dk NBO tedavisi uygulandı. Sepsis indüksiyonundan 5 gün sonra hayvanlar sakrifiye edilerek karaciğer doku örnekleri alındı. Kontrol ve NBO grubunda, malondialdehid (MDA) ve süperoksit dismutaz (SOD) düzeylerinde artış görülürken, HBO grubunda MDA ve SOD düzeyleri düşük olarak bulundu. Sepsis oluşturulan bütün gruplarda glutatyon peroksidaz (GSH-Px) düzeyleri yüksek olarak bulunurken aralarında fark saptanmadı. Sepsis oluşturulan gruplarda myeloperoksidaz (MPO) düzeyleri yüksek olarak bulunurken, HBO grubunda, NBO grubuna göre bir düşüş görüldü. Histolojik değerlendirme ile sepsis oluşturulan gruplar arasında bir fark gözlenmedi. Bu çalışmada, HBO’nun antibiyotik tedavisine ilave olarak kullanımı ile karaciğer dokusunda oksidatif doku hasarını azalttığı ortaya konmuştur. Ayrıca, HBO ve NBO tedavilerinin nötrofil infiltrasyonunu azaltma yönünden bir etki oluşturmadığı da gösterilmiştir. Sepsiste adjuvan bir tedavi olarak HBO ve NBO uygulamalarının karşılaştırmasına yönelik kapsamlı çalışmalara ihtiyaç vardır. Anahtar kelimeler : Sepsis, Hiperbarik Oksijen, Normobarik Oksijen, Oksidatif Stres Destekleyen Kurumlar : Yok Yazar adı : Dr. Halil ERTÜRK Danışman : Prof. Dr. M. Refik MAS v SUMMARY MD.Lt. Halil ERTURK, “The Late Phase Efficacy of Hyperbaric and Normobaric Oxygen Therapies on Liver in Experimental Sepsis Model,” Gulhane Military Medical Academy, Military Medical School Department of Internal Medicine, Dissertation-Specialization in Medicine, Ankara, 2009. Sepsis is a complex syndrome characterized by simultaneous activation of inflammation and coagulation in response to microbial insult. These events manifest as systemic inflammatory response syndrome (SIRS)/sepsis symptoms through release of proinflammatory cytokines, procoagulants, and adhesion molecules from immune cells and/or damaged endothelium. Sepsis with a mortality rate of 30 % in hospital is a mortal disease. Mortality rates are higher in severe sepsis and septic shock. In the last decade, the sepsis physiopathology has been elucidated. Various therapeutic agents have been tried in addition to antibiotherapy but no satisfactory results have been acquired. As an active player and a victim, the liver seems as the key organ in sepsis. The liver, thought responsible for developing multi organ dysfunction syndrome, has various functions involving bacterial clearance, inactivation of bacterial products, generation and clearance of inflammatory mediators. Therefore, preventing the liver injury in sepsis is important. Hyperbaric oxygen (HBO) is a treatment modality that presents oxygen to cells. Its effects occur through the mechanisms involving vasoconstriction, inhibition of microorganism profliferation, activation of angiogenesis, improving oxygen transport capacity, enhancing antioxidant enzyme activity and scavenging reactive oxygen species. Because of the difficulties of HBO usage in intensive care units, there are some studies suggesting normobaric oxygen (NBO) treatment instead of HBO treatment in sepsis to get same benefits. In the present study, we planned to compare the effects of HBO versus NBO treatments’ effects on liver injury and oxidative stress in rat sepsis model. We randomized 40 male wistar rats in 4 groups; sham group vi (n=10), control (SEPSIS+CEFEPIM) group (n=10), HBO (SEPSIS+ CEFEPIM+HBO) group (n=10) and NBO (SEPSIS+CEFEPIM+NBO) group (n=10). Sepsis was induced with an intrapreritoneal injection of 2.1 x 109 CFU viable E. coli in sepsis groups. After sepsis induction, CEF was administrated intraperitoneally at dose of 50 mg/kg twice daily to the rats in sepsis groups (control, HBO, NBO). HBO sessions were performed at 2.4 atm absolute 90 minutes twice daily. NBO sessions were performed at 1 atm absolute 90 minutes twice daily with 5 l/min oxygen. All animals were killed 5 days after sepsis induction and liver specimens were taken. Whereas malondialdehid (MDA) and superoxide dismutase (SOD) levels were elevated in control and NBO groups, MDA and SOD levels were decreased in HBO group. Glutathione peroxidase (GSH-Px) levels were elevated in all sepsis groups and there was no difference between these groups. Myeloperoxidase (MPO) levels were elevated in all sepsis groups. A decrease in MPO levels has seen in HBO group compare to NBO group but there was no difference between the HBO and control groups. According to hystopathological examination, there was no difference between sepsis groups. In the present study, we found that the reduction in oxidative tissue injury with HBO treatment in addition to antibiotherapy and no effect of HBO and NBO treatments on neutrophil infiltration. Further studies, focused on comparing NBO to HBO as an adjuvant therapy in sepsis, should be performed. Key words : Sepsis, Hyperbaric oxygen, Normobaric oxygen, Oxidative stress Affiliated foundations : No Author : Dr. Halil ERTURK Moderator : Prof. Dr. M. Refik MAS vii İÇİNDEKİLER ONAY SAYFASI TEŞEKKÜR ÖZET ……………………………………………………………… ii ...………………………………………………………………… iii …………………………………………………………………….…….iv İNGİLİZCE ÖZET İÇİNDEKİLER …………………………………………………..………...vi ………………………………………………………………. viii SİMGELER VE KISALTMALAR ………………………………….…………xi ŞEKİLLER …………………………………………………………………... xiii TABLOLAR …………………………………………………………..……... xiv 1. GİRİŞ …………………………………………………………………..……1 2. GENEL BİLGİLER 2.1. SEPSİS ………………………………………………………… 4 ……………………………………………………………….. 4 2.1.1. TANIMLAR VE TERMİNOLOJİ 2.1.2. ETİYOLOJİ ………………………………4 ……………………………………………………..6 2.1.3. EPİDEMİYOLOJİ ………………………………………………7 2.1.4. PATOGENEZ VE PATOLOJİ ………………………………...8 2.1.4.1. Konakla İlişkili Faktörler ……………………………... 8 2.1.4.2. Enfeksiyon Ajanıyla İlişkili Faktörler 2.1.5. FİZYOPATOLOJİ ……………………………………………. 11 2.1.6. KLİNİK BELİRTİ VE BULGULAR 2.1.7. TANI VE AYIRICI TANI 2.1.8. PROGNOZ 2.1.9. TEDAVİ ………………. 10 ………………………….. 16 ……………………………………...20 …………………………………………………… 22 ………………………………………………………. 23 2.1.9.1. Destek Tedavisi …………………………………….. 24 2.1.9.2. Antimikrobiyal Tedavi ………………………………. 26 2.2. HİPERBARİK OKSİJENİN FİZYOLOJİSİ 2.2.1. HBO’nun Mekanik Etkisi ………………………...28 ……………………………………. 28 2.2.2. HBO’nun Oksijen Çözünürlüğünü Artırıcı Etkisi …………. 29 2.3. HİPERBARİK OKSİJENİN ÇEŞİTLİ SİSTEMLER ÜZERİNE ETKİSİ ……………………………………………………………….. 31 2.4. SERBEST RADİKALLER …………………………………………. 33 2.4.1. Reaktif Oksijen Türevlerinin Oluşumu viii …………………….. 34 2.4.2. Serbest Radikal Reaksiyonları 2.4.2.1. Lipid Peroksidasyonu …………………………….. 35 ………………………………. 37 2.4.2.2. Hücre Membranı ve Organellerinin Serbest Radikal Hasarı ………………………………………………… 37 2.4.2.3. Protein ve Enzimlerin Serbest Radikal Hasarı …... 38 2.4.2.4. Nükleik Asitler ve Bileşenlerinin Serbest Radikal Hasarı ………………………………………………… 38 2.4.2.5. Karbonhidrat Oksidasyonu 2.5. ANTİOKSİDAN SAVUNMA ………………………… 38 ……………………………………….. 38 2.5.1. Hücreiçi Enzimatik Antioksidan Savunma 2.5.2. Nonenzimatik Antioksidanlar 3. GEREÇ VE YÖNTEM ………………... 39 ………………………………. 42 ……………………………………………………45 3.1. DENEY HAYVANLARI 3.2. DENEY GRUPLARI …………………………………………….. 46 ………………………………………………... 46 3.3. SEPSİS İNDÜKSİYONU …………………………………………... 47 3.4. ANTİBİYOTİK UYGULANMASI …………………………………... 47 3.5. HİPERBARİK OKSİJEN TEDAVİSİNİN UYGULANMASI 3.6. NORMOBARİK OKSİJEN TEDAVİSİNİN UYGULANMASI 3.7. KARACİĞER DOKUSUNUN HAZIRLANMASI 3.8. BİYOKİMYASAL ANALİZLER …………………. 50 ………………… 51 ……………………………………………… 52 3.8.3. Malondialdehid (MDA) Ölçümü ……………………………. 52 3.8.4. Süperoksit Dismutaz (SOD) Aktivitesi Ölçümü 3.8.5. Glutatyon Peroksidaz (GSH-Px) Ölçümü 3.8.6. Myeloperoksidaz (MPO) Aktivitesi Ölçümü 3.9. HİSTOPATOLOJİK İNCELEME 3.10. İSTATİSTİKSEL ANALİZ 4. BULGULAR …… 49 …………………………………….. 50 3.8.1. Karaciğer Dokusunun Homojenizasyonu 3.8.2. Protein Ölçümü ……... 48 …………... 53 ………………… 54 ………………. 55 ………………………………….. 55 ………………………………………… 55 ………………………………………………………………. 57 4.1. KARACİĞER DOKUSU OKSİDATİF STRES DÜZEYİ 4.2. ANTİOKSİDAN ENZİM AKTİVİTELERİ 4.3. NÖTROFİL İNFİLTRASYONU ………… 57 ………………………….. 57 ……………………………………. 58 ix 4.4. HİSTOPATOLOJİK DEĞERLENDİRME 5. TARTIŞMA ……………………………………………………………….. 63 6. SONUÇLAR VE ÖNERİLER 7. KAYNAKLAR ………………………… 58 …………………………………………… 66 …………………………………………………………….. 67 x SİMGELER VE KISALTMALAR ATA : Atmosfer absolute ARDS : Akut solunum yetmezliği sendromu cGMP : Siklik guanil monofosfat CAT : Katalaz CEF : Cefepime CO : Karbon monoksit DIC : Yaygın damariçi pıhtılaşma DNA : Deoksiribonükleik asit G-6-PDH : Glukoz -6- fosfat dehidrogenaz GATA : Gülhane Askeri Tıp Akademisi GM-CSF : Granülosit-monosit koloni stimule eden faktör GR : Glutatyon redüktaz GSH : Glutatyon GSH-Px : Glutatyon peroksidaz Hb : Hemoglobin HBO : Hiperbarik oksijen IL-1 : İnterlökin 1 IFN-γ : Gama interferon iNOS : İndüklenebilir nitrik oksit sentaz LBP : LPS-bağlayıcı protein LPS : Lipopolisakkarit MDA : Malondialdehit MODS : Multiple organ disfonksiyon sendromu MRSA : Metisiline dirençli Stafilokokus aureus MPO : Myeloperoksidaz NAD : Nikotinamid adenin dinükleotid NBO : Normobarik oksijen NF-κB : Nükleer faktör kappa- beta NO : Nitrik oksit PAF : Trombosit aktive edici faktör PAI-1 : Plazminojen-aktivatör inhibitörü tip-1 xi PAS : Periyodik asit-schiff PGI2 : Prostosiklin PMNL : Polimorf nüveli lökositler OH : Hidroksil ROT : Reaktif oksijen türevleri SEP : Sepsis SF : Serum fizyolojik SIRS : Sistemik inflamatuar yanıt sendromu SOD : Süperoksit dismutaz SOR : Serbest oksijen radikalleri Strep-TSS : Streptokoksik toksik şok sendromu TCA : Triklorasetik asit TBA : Tiyobarbitürik asit TCR : T-lenfosit reseptörü (TCR) TNF-α : Tümör nekroz faktörü alfa TLRs : Toll-benzeri reseptörler TSS :Toksik şok sendromu TSST-1 : Toksik şok sendromu toksini-1 xii ŞEKİLLER DİZİNİ Şekil Sayfa No: Şekil 2.1. Reaktif oksijen türevlerinin oluşumu ve organizmanın buna oksidan cevabı ………………………………………...36 Şekil 2.2. Reaktif oksijen türevlerinin oluşturduğu hücre hasarı …… 39 Şekil 2.3. Oluşan Çeşitli Reaktif Ürünlere Karşı Enzimatik Savunma . 42 Şekil 3.1. Ratlara intraperitoneal enjeksiyon uygulaması Şekil 3.2. Hiperbarik Oksijen Cihazı Şekil 3.3. Rat karın boşluğu …………... 47 …………………………………...48 …………………………………………… 51 Şekil 4.1. Tüm gruplarda MDA düzeylerinin karşılaştırılması ……… 60 Şekil 4.2. Tüm gruplarda SOD düzeylerinin karşılaştırılması ……… 60 Şekil 4.3. Tüm gruplarda GSH-Px düzeylerinin karşılaştırılması Şekil 4.4. Tüm gruplarda MPO düzeylerinin karşılaştırılması Şekil 4.5. Histopatolojik örnekler ….. 61 ……… 61 …………………………………….... 62 xiii TABLOLAR DİZİNİ Tablo Sayfa No: Tablo 2.1. Konak savunma mekanizmaları ve bunları bozan durumlar ………………………………………………………..9 Tablo 2.2. Sepsis için risk faktörleri …………………………………….. 9 Tablo 2.3. Septik şok patogenezinde rol oynayan bakteriyel yapılar Tablo 2.4. Sepsiste enflamatuvar mediyatörler Tablo 2.5. Sepsiste klinik belirti ve bulgular 11 ……………………… 14 ………………………….. 17 Tablo 2.6. Sepsiste prognozu etkileyen faktörler ……………………. 23 Tablo 2.7. Değişik basınçlarda plazmada çözünmüş oksijen içeriği . 30 Tablo 2.8. HBO uygulaması ile ulaşılan doku parsiyel oksijen basıncı düzeyleri ……………………………………………. 31 Tablo 2.9. Hiperbarik oksijenin fizyolojik etkileri Tablo 4.1. Biyokimyasal sonuçlar ……………………...33 ……………………………………... 58 Tablo 4.2. Histopatolojik değerlendirme sonuçları xiv …………………...59 1 – GİRİŞ Sepsis, mikrobiyal maruziyet sonrasında enflamasyon ve koagülasyonun birlikte aktive olmasıyla karakterize kompleks bir sendromdur. Bu olaylar, immün hücreler veya hasar görmüş endotel hücrelerinden salınan proenflamatuvar sitokinler, prokoagülanlar ve adezyon molekülleri yoluyla sistemik enflamatuvar yanıt sendromu / sepsis bulguları ile ortaya çıkar. Sepsis, % 30’luk hastane mortalite oranı ile ölümcül bir hastalıktır [1]. Ciddi sepsis ve septik şokun mortalite oranları %20-52 ve %82 ile daha yüksektir [2]. Bakteri hücre duvarında yer alan birçok antijenik yapının tetiklemesiyle, dolaşımdaki mononükleer fagositler, endotel hücreleri ve diğer hücrelerden birçok güçlü mediyatör, proenflamatuvar ve antienflamatuvar sitokin salınmaya başlar. Bunların en önemlileri; tümör nekroz faktörü alfa (TNF-α), interlökin (IL) 1, 2, 6, 8 ve trombosit aktive eden faktör (PAF)’dür. Sepsis sürecinde gelişen sistemik enflamatuvar yanıt, endotelyal hasar, mikrovasküler disfonksiyon, doku oksijenizasyon bozukluğu gibi fizyopatolojik olaylar sonucunda çoklu organ hasarı meydana gelmektedir [3]. Tüm bu olaylar eşliğinde vücutta yaygın bir oksidatif stres oluşur ve mikrosirkülasyon bozukluğu meydana gelir. Yapılan çalışmalarda sepsisli olgularda, serbest radikal toksisitesi sonucu antioksidan enzimler olan glutatyon peroksidaz (GSH-Px) ve süperoksit dismutaz (SOD) seviyelerinin azaldığı, oksidatif stres parametresi olarak da malondialdehit (MDA) seviyelerinin yükseldiği bildirilmiştir [3]. Sepsite karaciğerin, sendromun aktif oyuncusu ve etkilenen organı olarak anahtar rolü oynadığı düşünülmektedir [4]. Temel olarak hepatositler, kupfer hücreleri ve endotelyal sinüzoidal hücrelerden oluşan heterojen hücresel yapısı, karaciğerin sepsisteki rolünün önemini oluşturur. Bu hücreler, immün ve metabolik yanıt ile enfeksiyon bariyeri görevlerini üstlenmektedirler. 1 Bir oyuncu olarak karaciğer, bakteriyel temizlik, bakteriyel ürünlerin inaktivasyonu, enflamatuvar mediyatörlerin üretim ve temizliği için esas organdır [5]. Birçok mediyatör (TNF, IL-1, IL-6 gibi) için reseptör sunan hepatositler, amino asit alımı, glukoneogenez, koagülasyon faktörleri, kompleman faktörleri ve akut faz proteinleri olarak bilinen antiproteolitik enzimlerin sentez ve üretimlerinin arttırılması yoluyla metabolik yollarını düzenlerler. Etkilenen bir organ olarak karaciğer hasar görebilir, fonksiyonları bozulabilir ve çoklu organ yetmezliğini arttırabilir veya kötüleştirebilir. Bu sebeple, sepsis tablosunda karaciğer hasarının azaltılmasına yönelik yaklaşımlar önem kazanmaktadır. Hiperbarik oksijen (HBO) stres altındaki hücrelere oksijen sunan bir tedavi yöntemidir. Hipoksik dolaşıma ve dokulara şu mekanizmalarla etki eder [6-7]: • Doku hipoksisi sonrası gelişen iskemi ve ödemi elimine eder ve vazokonstrüktör etki ile ödemi azaltır. • sağlayarak Lökositlere oksidatif fonksiyonlar için ihtiyaç duyduğu oksijeni enfeksiyon karşıtı aktivite gösterir ve mikroorganizma çoğalmasını önleyici bir ortam oluşturur. • Aktive fibroblastlardan vasküler endotel büyüme faktörü ve kollojen üretimini arttırarak anjiogenezisi aktive eder. • Antioksidan ürünlerin oluşumunu arttırır. • Vasküler endotel lökosit adezyonunu engelleyerek mikrosirkülasyonu arttırır. • Dokuların bozulmuş oksijen transport kapasitesini düzeltir. Hiberbarik oksijen uygulaması birçok hastalığın tedavisinde kullanılan bir yöntemdir [8]. Ancak, ciddi dekompresyon hastalığı [9] ve diğer serebral gaz embolisi hastalıklarında [10] etkisi kabul edilirken, diğer önerilen endikasyonlardaki yeri halen tartışmalıdır. Bununla beraber, HBO’nun tek başına ya da adjuvan tedavi olarak faydalı olduğunun gösterildiği çeşitli endikasyonlar da vardır [11-12]. Yeni bulgular, doku oksijenlenmesinin 2 arttırılması, yani oksijen taşıma kapasitesindeki azalmanın kompanze edilmesi mekanizmasının HBO’nun etkisinin sadece bir yönü olduğunu göstermektedir. Normal basıncın üzerinde oksijen verilmesinin sinyal iletici gibi rol oynayarak [13-14], antioksidatif enzim ekspresyonunu arttırdığı ayrıca büyüme hormonu ve sitokinlerin ekspresyonunu düzenlediğini göstermektedir. Supra atmosferik basınçlarda saf oksijen solumanın bu etkileri, araştırmacılara HBO’nun karbonmonoksit (CO) zehirlenmesi ve reperfüzyon injürisindeki yararlı etkilerini açıklamalarına öncülük ederken sistemik inflamasyon üzerindeki etkilerini araştırmak için de yeni bir kapı açmıştır. İntraperitoneal E. coli enjeksiyonu ile sepsis oluşturulmuş ratlarda, sepsis tedavisinin etkinliğinin arttırılmasında HBO’nun iyi bir adjuvan tedavi olabileceği gösterilmiştir [15]. Normobarik oksijen (NBO) tedavisi ise, deneysel peritonit yapılarak sepsis tablosu oluşturulan ratlarda incelenmiş; özellikle antibiyoterapi eklenmiş ratlarda olumlu sonuçlar alınmıştır [16]. Sonuç olarak, sepsis tedavisi konusunda yapılan birçok gayretli çalışma ve araştırmalara rağmen, halen etkin tedavi yöntemleri geliştirilememiştir. Mortalitesi oldukça yüksek olan sepsis sendromunun tedavisinde yeni ajanların bulunması ve kullanılması hayati önem taşımaktadır. Bu çalışma, HBO ve NBO tedavilerinin sepsis oluşturulan ratlarda, oksidatif stres parametreleri ve karaciğer hasarı üzerindeki etkilerini araştırmak ve karşılaştırmak amacıyla yapılmıştır. 3 2- GENEL BİLGİLER 2.1 SEPSİS Sepsis, birçok sistemi tutan, özellikle hemodinamik değişikliklere yol açan, şok, organ fonksiyon bozukluğu ve organ yetmezliğine kadar giden öldürücü bir enfeksiyon hastalığıdır. Tıbbi teknolojideki gelişmeler, invaziv girişimlerin artması, zeminde başka hastalığı olan hastaların yaşam süresinin uzaması, enfeksiyon riskini, özellikle de öldürücü bir enfeksiyon olan sepsis görülme sıklığını arttırmıştır. 2.1.1. TANIMLAR VE TERMİNOLOJİ Klinik uygulamalarda sepsis ve sepsis ile ilgili klinik tabloların ifadesinde; sepsis, septisemi, septikopiyemi, piyemi, bakteriyemi, sepsis sendromu, endotoksemik şok ve septik şok gibi farklı terimler kullanılmaktadır. Bu hastalığın tanımında farklı terimlerin kullanılması, araştırma ve tedavi yorumlanmasında protokollerinin problemlere karşılaştırılmasında, yol açmaktadır. sonuçların Septisemi, mikroorganizmaların ve toksinlerinin dolaşımda bulunması sonucu gelişen sistemik hastalık olarak tanımlanmıştır. Septiseminin, kanı enfekte eden mikroorganizmaların oluşturduğu bütün klinik tabloları tanımlamakta yetersiz kalması nedeniyle kullanılması önerilmemektedir. “American College of Chest Physicians/ Society of Critical Care Medicine” 1991 yılında yaptıkları ortak toplantıda, sepsis ile ilgili tanımları yeniden gözden geçirdiler. Bu toplantıda ortaya konulan, sepsis spektrumu içerisinde yer alan tanımlar aşağıdadır [17]; Enfeksiyon: Mikroorganizmaların, normalde steril konak dokularında bulunması veya invazyonu sonucu gelişen bir enflamatuvar cevaptır. Bakteriyemi: Canlı bakterinin dolaşımda bulunmasıdır. Bakteriyemi tanısı kan kültür pozitifliği ile konur. 4 Sistemik enflamatuvar yanıt sendromu (SIRS): Değişik ağır klinik durumlara enflamatuvar cevap olarak tanımlanmıştır. Enfeksiyon ve enfeksiyon dışı (pankreatit, yanık, multiple travma gibi) nedenlere bağlı gelişebilir. Enflamatuvar cevap, klinik olarak aşağıdaki durumlardan iki veya daha fazlasının bulunması ile tanınır; vücut ısısının >38oC’ veya <36oC olması, kalp atım hızının > 90 vuru/dk olması, solunum hızının >20 /dk veya arteriyel karbondioksit basıncının < 33 mmHg olması, lökosit sayısının >12000/mm3 veya <4000/ mm3 olması, periferik yaymada %l0’ un üzerinde band formunun bulunması. Sepsis: Enfeksiyona karşı gelişen sistemik enflamatuvar cevap, sepsis olarak isimlendirilir. Ortaya konmuş ya da şüpheli enfeksiyona ilave olarak, SIRS bulgularının iki veya daha fazlasının bulunmasıdır. Ağır sepsis: Sepsis ile birlikte organ fonksiyon bozukluğu, hipoperfüzyon veya hipotansiyonun bulunması durumudur. Hipoperfüzyon ve perfüzyon bozukluğunda, laktik asidoz, oligüri veya mental durumda akut değişiklik bulunabilir. Hastalık yalnız bu bulgularla sınırlı değildir. Septik şok: Sepsiste, yeterli sıvı tedavisine rağmen, hipotansiyon ile birlikte perfüzyon bozukluğu belirtilerinin (laktik asidoz, oligüri, akut mental değişiklik) devam etmesi durumudur. Perfüzyon bozukluğu belirlendiği zaman, inotropik veya vazopresör ilaç alanlarda hipotansiyon olmayabilir. Sepsise bağlı hipotansiyon: Sistolik kan basıncının 90 mmHg’nin altına düşmesi veya diğer nedenler olmaksızın, bilinen sistolik kan basıncının 40 mmHg’ den daha fazla aşağı düşmesi. Multiple organ disfonksiyon sendromu (MODS): Akut hastalık tablosu içinde olan bir hastada organ fonksiyon değişikliklerinin bulunması MODS olarak isimlendirilmektedir. Bu klinik tabloda tedavisiz homeostaz sağlanamaz. 5 Sepsis geliştiği yere göre, toplumda gelişen sepsisler ve hastane kaynaklı (nozokomiyal) sepsisler olarak ayrılır. Bir hastanın hastaneye yattıktan 48-72 saat sonra alınan kan kültürlerinde klinik olarak anlamlı kan kültür pozitifliği hastane kaynaklı bakteriyemi olarak isimlendirilir. Hastaların hastaneye yatışından 72 saat sonra ortaya çıkan sepsis klinik tablosu hastane kaynaklı sepsis olarak değerlendirilir [18]. 2.1.2. ETİYOLOJİ Birçok bakteriyel etken sepsis etiyolojisinden sorumludur. Antibiyotiklerin kullanım alanına girmeden önce streptokoklar ve stafilokoklar en sık sepsis nedeni olan bakterilerken, antibiyotiklerin kullanılmaya başlamasıyla gram negatif bakteriler gittikçe artan oranlarda sepsis etkeni olarak izole edilmeye başlandı [19-20]. Son yıllarda yapılan çalışmalarda, gram pozitif bakterilerin sepsis etkeni olarak izole edilme oranlarında tekrar artışların olduğu, özellikle stafilokok sepsislerinin görülme sıklığında artış olduğu bildirilmektedir [19]. Hastane kaynaklı sepsislerde en sık etkenler; Staphylococcus aureus, koagülaz negatif stafilokoklar, Enterococcus türleri, Escherichia coli ve diğer barsak bakterileri, Pseudomonas aeruginosa ve diğer nonfermantatif bakteriler, Candida albicans ve diğer kandidalardır. Anaerop bakterilerin, hastane kaynaklı sepsislerde etken olarak izole edilmesi düşük orandadır. Toplumda gelişen sepsislerde ise; S. aureus, Streptococcus pneumoniae, E. coli ve diğer barsak bakterileri en sık izole edilen bakterilerdir. Toplumda gelişen sepsislerde, anaerop bakteriler ve mantarlara, daha az rastlanmaktadır [21]. Yapılan çalışmalarda, sepsislerin % 20-64’ünde gram negatif bakterilerin etken olduğu, % 27-74’ünde gram pozitif bakterilerin etken olduğu, % 15 ve daha az oranda ise polimikrobiyal etken izole edildiği görülmektedir [21-22]. İyi planlanmış klinik çalışmalarda, sepsislerde kan 6 kültür pozitifliği % 70’e kadar çıkmaktadır. Erciyes Üniversitesi Tıp Fakültesi Hastanesi yoğun bakım ünitelerini kapsayan bir yıllık çalışmada 119 nozokomiyal sepsis epizodunda % 48,7 oranında gram negatif bakteriler sorumlu olarak bulunup, en sık izole edilen bakteriler; P. Aeruginosa ve E. coli olarak rapor edilmiştir. Gram pozitif koklar % 47,9 epizotta izole edilmiş ve metisiline dirençli S.aureus (MRSA) en sık izole edilen gram pozitif kok olarak rapor edilmiştir [23]. 2.1.3. EPİDEMİYOLOJİ Sepsis, septik şok ve organ yetmezliği gibi sepsis ile ilgili klinik tabloların gerçek görülme sıklığını vermek ülkemiz ve diğer ülkeler için de zordur. Son yıllarda toplumda gelişen sepsislerin görülmesinde rölatif bir azalma gözlenirken, hastane kökenli sepsis olgularında artış dikkati çekmektedir. Gevher Nesibe Hastanesi yoğun bakım ünitelerinde yapılan bir yıllık sürveyansda; hastane kökenli enfeksiyon oranı % 18,9 ve hastane kökenli sepsis görülme oranı ise % 7,6 olarak belirlenmiş [23]. Amerika Birleşik Devletleri’nde her yıl 35 milyon hastanın hastaneye yattığı, bunların yaklaşık 250000’ inde hastane kaynaklı sepsis geliştiği, mortalitenin % 12-80 arasında, ortalamasının ise % 35 olduğu belirtilmektedir [24]. Hollanda da bir üniversite hastanesinde yapılan çalışmada, hastaneye yatırılan her 1000 hastanın 13,6’sında sepsis sendromu gözlendiği rapor edilmiştir [25]. Ülkemizde sepsis ile ilgili en geniş çalışma Hacettepe Üniversitesi’nde yapılmıştır. Yedi yılı (1983-1989) kapsayan bu çalışmada gram negatif bakteriyemi vakaları değerlendirilmiş, fakat sepsisin görülme sıklığı konusunda bilgi verilmemiştir [22]. Hastane kaynaklı sepsis sıklığı giderek artmaktadır. Toplumda ileri yaş grubunun artması, kronik hastalığı olan hastaların yaşam sürelerinin uzaması, immünsüpresif ilaçların yaygın kullanılması, teşhis veya tedavi amacı ile invaziv girişimlerin yaygın kullanılması sepsis görülme sıklığını arttırmaktadır. Yatak kapasitesi fazla olan, yoğun bakım üniteleri bulunan ve 7 invaziv işlemlerin fazla yapıldığı hastanelerde, hastane kökenli sepsis daha sık görülmektedir [18, 23-24]. 2.1.4. PATOGENEZ VE PATOLOJİ Sepsis patogenezi karmaşık bir olaydır. Bakterinin organizmaya yerleşmesi ve konak savunması ile etkileşimi sonucu hastalık ortaya çıkar. Hastalığın ortaya çıkışını, konağın immün sistemi ve bakteriyel virulans faktörleri belirler. 2.1.4.1. Konakla İlişkili Faktörler Sepsis oluşumuna neden olan bakteriler genellikle, damar dışı bir enfeksiyon odağından yayılımla dolaşıma girerler, bazen de enfeksiyon, damar içi kateter, septik tromboflebit, bakteriyel endarterit, endokardit, mikotik anevrizmalar ve damar greftlerinden kaynaklanabilir [26-27]. Üriner sistem, genital sistem, solunum sistemi, deri ve yumuşak doku, karın içi ve damar içi kateterler, sepsiste görülen en sık primer enfeksiyon odaklarını oluşturur. Hastane dışında gelişen sepsislerde en sık giriş kapısını solunum sistemi ve üriner sistem oluştururken, hastane kaynaklı sepsislerde ise damar içi kateter ve üriner kateterler oluşturmaktadır. Yoğun bakım ünitelerinde ise hastane kaynaklı pnömoniler ön plana çıkmaktadır [24, 28]. Konağın savunma mekanizmalarının bozulması, lokal veya sistemik enfeksiyonlara eğilim yaratır. Konak savunma mekanizmalarını anatomik bariyer, hücresel savunma (fagositik hücreler, lenfositler), spesifik ve nonspesifik hümoral savunma olarak üç başlık altında toplayabiliriz. Konak savunma mekanizmaları ve bunları bozan durumlar Tablo 2.1.’de özetlenmiştir. Sepsisle ilgili yapılan çalışmalarda konağa ait bazı faktörler ve bazı tedaviler sepsis için risk faktörleri olarak verilmiştir. Bunlar Tablo 2.2.’de özetlenmiştir [26-27, 29]. Bu faktörler bakteriyel etkene göre de farklılık 8 gösterebilir. Örneğin Staphylococcus epidermidis sepsislerinde en sık damar içi kateterler sorumlu tutulmaktadır [30]. Tablo 2.1. Konak savunma mekanizmaları ve bunları bozan durumlar Savunma mekanizması Bozan durumlar Deri ve mukoza Damar içi kateter Yanıklar Travma Fagositik hücreler Granülositopeni Diyabetes mellitus Kompleman sistemi Konjenital veya akkiz yetmezlik T lenfositler Lenfomalar AIDS Tablo 2.2. Sepsis için risk faktörleri Konağa ait faktörler Altta yatan öldürücü hastalık İleri yaş Siroz Diyabetes mellitus Kronik böbrek hastalığı Granülositopeni Geniş travma ve yanıklar Kortikosteroid ve diğer immünsüpresif tedaviler Lokal enfeksiyonlar Tedaviye ait faktörler Yoğun bakım ünitesinde bakım İnvaziv damar içi kateterler Fazla miktarda parenteral mayi, kan veya kan ürünleri verilmesi Hemodiyaliz Diğer invaziv kateter ve enstrümantasyonlar (Üriner kateter ve enstrümantasyon, entübasyon, endotrakeal tüp, mekanik ventilatör) Büyük cerrahi girişimler 9 Sepsisli hastalarda bakteriyemi şu klinik durumlardan biri şeklinde başlar [26-27]; a. immün sistemi sağlam, sağlıklı kişilerde bölgesel enfeksiyonun (peritonit, apse, hidronefroz veya kolanjit gibi) yayılması, b. yenidoğanlarda, immün sistemi baskılanmış hastalarda, küçük bir enfeksiyon odağından (sülülit, follikülit gibi) kaynaklanabilir. Enfeksiyon odağının belirlenemediği de olabilir, c. Bakteri, damar içi kateter, intravenöz mayi ile lokal bariyeri aşarak direkt dolaşıma geçer. Streptococcus pneumoniae, Haemophilus influenzae, Neisseria meningitidis ve S. aureus genellikle belirlenebilen herhangi bir fokal enfeksiyon odağı olmadan bakteriyemi yapabilir. Gram negatif basiller ise Tablo 2.2.’de verilen predispozan faktörlerden biri olmadan nadiren bakteriyemiye neden olurlar [26-27]. 2.1.4.2. Enfeksiyon Ajanıyla İlişkili Faktörler Sepsise neden olan bakterilerin çoğu, endojen florada mevcuttur. Enfeksiyonun gelişmesinde bakteriyel virulans faktörleri (adherans, seruma direnç, antifagositik yüzey, hücre içinde canlılığını koruma, enzim ve toksinler gibi) önemli rol oynar. Sepsis ve onun sonucu olarak gelişen klinik tabloların oluşmasında, bakteriyel invazyon ile beraber bakteriyel hücresel yapılar ve toksinleri organizmada değişik biyolojik sistemleri aktive ederek sepsisteki fizyopatolojik değişikliklerden sorumlu endojen mediyatörlerin açığa çıkmasını sağlarlar [26-27, 31]. Sepsiste en sık izole edilen bakterilerin, biyolojik sistemi aktive eden bilinen hücresel yapı ve toksinleri Tablo 2.3’de özetlenmiştir. Kapsül polisakkaridleri, peptidoglikan yapı, lipoteikoik asit, protein A ve endotoksin, in vitro kompleman kompenentlerini ve koagulasyon sistemlerini aktive ederler [19, 31-33]. Gram negatif bakterilerin hücre duvarında yer alan lipopolisakkarid yapısındaki endotoksinler, etkisi en iyi bilinen bakteriyel yapı dır. Lipopolisakkarid yapısında yer alan lipid A yapısı, bütün gram negatif 10 bakterilerde ortak olup, endotoksemiden sorumludur [27, 32]. Endotoksin, toksik şok sendromu toksini-1(TSST-1), pirojenik ekzotoksin A, ekzotoksin A, gram pozitif bakteri veya mantar hücre duvarı yapıları, mantar antijenleri sepsis kaskadını başlatabilir [19, 32, 34]. Tablo 2.3. Septik şok patogenezinde rol oynayan bakteriyel yapılar Bakteriyel yapı Kaynak Örnek Endotoksin (LPS, lipid A) Bütün gram negatif bakteriler E.coli sepsisi Menengokoksemi Peptidoglikan Bütün bakteriler Lipoteikoik asit Gram pozitif bakteri “Pore-forming” S. aureus α-hemolizin Ekzotoksinler S. pyogenes Streptolizin - O E.coli E. coli hemolizini Aeromonas spp. Aerolizin S. aureus Toksik şok sendromu toksini-1 S. pyogenes Enterotoksin A-F Süperantijenler Pirojenik ekzotoksin A+C, SPE Enzimler S. pyogenes 1L-1β konvertaz Clostridium perfringens Fosfalipaz C SPE. Streptokokal pirojenik ekzotoksin 2.1.5. FİZYOPATOLOJİ Sepsisteki fizyopatolojik olaylar oldukça karmaşıktır. Bakteri hücre duvarında yer alan birçok antijenik yapı ve toksinler, dolaşımdaki mononükleer fagositler, endotel hücreleri ve diğer hücrelerden birçok güçlü mediyatörlerin salınımını başlatırlar. Bunların en önemlileri; tümör nekroz faktörü alfa (TNF-α), interlökin –1, 2, 6 ve 8 (IL-1, IL-2, IL-6 ve IL-8) ve 11 trombosit aktive eden faktör (PAF)’dür [19, 31-32]. Sepsiste araşidonik asit metabolitleri de önemli rol oynar. Siklooksijenaz yolla prostoglandinler ve tromboksan A2, lipoksijenaz yolla ise lökotrienler açığa çıkar. Endotoksin ve TNF, IL-1 gibi mediyatörler araşidonik asit metabolitlerinin açığa çıkmasını ve sentezini aktive eder. Tromboksan A2 kuvvetli vazokonstrüktör ve prostoglandinler ise vazodilatör etkiye sahiptir. Araşidonik asit metabolitleri, ateş, taşikardi, takipne, ventilasyon-perfüzyon bozukluğu ve laktik asidoz oluşumunda rol alırlar [35]. IL-1 ve IL-6, T hücrelerini aktive eder. Gama interferon (IFN-γ), IL-2, IL-4 ve granülosit-monosit koloni stimüle eden faktör (GM-CSF) oluşur. Bu esnada koagülasyon kaskadı ve kompleman sistemi de aktive olur [19, 32-33]. Enfeksiyona sistemik cevap bu salınan mediyatörler tarafından oluşturulur. Bu mediyatörlerin bir kısmı proenflamatuvar ( TNF-α, IL-1, IL-8) ve bir kısmı ise antienflamatuvar (IL-4, IL-10) özelliğe sahiptir. Sepsis patogenezinde rol oynadığı bilinen proenflamatuvar, antienflamatuvar sitokinler ve diğer moleküller Tablo 2.4’de görülmektedir. Normalde sitokin cevabi belli bir düzen içerisinde düzenlenir. Bu düzenin bozulmasını proenflamatuvar reaksiyon (SIRS) veya kompensatuvar antienflamatuvar reaksiyon takip eder. Bu reaksiyonların sonucu olarak da sepsis klinik tablosu ortaya çıkar [31, 36]. TNF-α ve IL-1’in, birçok biyolojik etkileri ortak olup sinerjistik etki gösterirler. Sepsiste, ateş, hipotansiyon şok patogenezinde rol oynayan en önemli sitokinlerdir. IL-6 ve IL-10, TNF-α sentezini önler, akut faz reaktanlarının ve immünglobülinlerin etkisini artırır, T lenfositlerinin ve makrofajların fonksiyonlarını inhibe eder. Bu sitokinler, bu özellikleri ile sepsiste enflamasyonu düzenleyici ve antienflamatuvar rol oynarlar [35]. Pirojenik ekzotoksin A oluşturan grup A streptokoklarla oluşan bazı enfeksiyonlarda şok, akut solunum yetmezliği sendromu (ARDS), böbrek yetmezliği ve doku hasarı görülür. Bu tablo streptokoksik toksik şok sendromu (Strep-TSS) olarak isimlendirilmektedir. Pirojenik ekzotoksin ile 12 yapılan insan ve hayvan çalışmalarında, bu toksinin ateş oluşturduğu gözlenmektedir. Streptokokal pirojenik ekzotoksin A ve B’nin insan mononükleer hücrelerinden TNF-α, IL-1, IL-6 sentezini başlattığı gösterilmiştir. Bu da TNF-α’nın, Strep TSS‘de ateş, şok ve doku hasarında önemli mediyatör olduğunu desteklemektedir [34]. TSST-1 de endotoksin etkisini arttırmakta, enflamatuvar mediyatörlerin yapımını stimüle etmekte ki bunlardan en önemlisi TNF-α dır. Böylece toksik şok sendromunda (TSS) şok ve organ yetmezliği tablosu gelişir [19, 33]. Etkisi en iyi bilinen bakteriyel antijen endotoksindir. Endotoksin mononükleer fagositleri, endotel hücrelerini ve diğer hücreleri de aktive eder. Bu hücrelerle beraber koagülasyon kaskadı ve kompleman sistemi de aktive olur [26, 31, 33]. Sepsiste hedef organ damar endotelidir ve hemen hemen bütün mediyatörler damarlar üzerine etkilidir. Endotoksin, TNF-α, IL-1, PAF, lökotrienler, tromboksan A2 ve nitrik oksit (NO) endotel permeabilitesini arttırır. Kompleman sisteminin aktivasyonu da endotel hasarı yapar. Komplemanın aktivasyonu, damar permeabilitesini direkt veya nötrofilleri aktive ederek indirekt yolla bozar. Ayrıca degranülasyon esnasında nötrofillerden açığa çıkan toksik oksijen redikalleri ve lizozomal enzimler de endotel permeabilitesini arttırır. Damar permeabilitesinin artması ve endotel hasarı, ekstravazasyon ve mikrotrombüslerin oluşumunu kolaylaştırır. Bir anatomik yerde yeterli endotel hasarı oluşunca, orada organ perfüzyonu bozulur ve organ yetmezliği gelişir. Eğer birçok yerde endotel hasarı oluşur ise multiorgan yetmezliği ile sonuçlanır. Hasar kontrol edilemez ise metabolik karmaşa gelişir ve hasta ölür. Sepsiste en sık karşılaştığımız organ yetmezliği; akciğer, böbrek, karaciğer ve kalp yetmezliğidir [19, 32, 35]. Sepsiste damar permeabilitesinin bozulması, trombosit ve nötrofil mikrotrombüslerin oluşumunu başlatır. 13 agregasyonu, küçük damarlarda Tablo 2.4. Sepsiste enflamatuvar mediyatörler Konak hücre Proenflamatuvar Düzenleyici Anti-enflamatuvar mediyatörler mediyatörler mediyatörler Monosit/makrofaj TNF-α, IL-1, IL-8, IL-6 IL-1Ra IFN-γ, IL-12 sTNFr Doku faktörü, TGF-β Prostonoidler, Lökotrienler, PAF, NO Nötrofiller İntegrin BPI ekspresyonu, Defensinler Süperoksit, Asikloksiasilhidrolaz TNF-α , IL-1 Lenfositler Selektin, VCAM, ICAM, NO, Doku faktörü Trombositler Serotonin, PDGF Prostonidler Plazma Koagulasyon CRP, LBP komponentleri kaskadı, Kompleman aktivasyonu, Bradikinin BPI, bakteriyel/permeabilite arttıran protein; CRP, C-reaktif protein; ICAM, hücreiçi adezyon molekülü; IFN-γ, interferon γ ; IL-1Ra, interlökin-1 reseptör antagonisti; LBP, lipopolisakkarid bağlayan protein; NO, nitrik oksit, PAF, trombosit aktive eden faktör; PDGF, trombositten açığa çıkan büyüme faktörü; sIL-2r, çözünür IL-2 reseptör; sTNFr, çözünür TNF reseptör; TGF-β, transforming büyüme faktörü; TNF, tümör nekroz faktörü; VCAM, damar hücre adezyon molekülü. Endotoksin, TNF-α, IL-1 ve diğer endojen mediyatörler, kontakt sistem ve doku faktörünü aktive eder. Hegeman faktörünün aktivasyonu (faktör XII), plazminojeni plazmine çevirir ve intrinsek koagülasyonu başlatır. Fibrinojen, fibrine dönüşür. Bunu pıhtılaşma izler. Fibrinolitik aktivite artar. Genellikle şok ile beraber kontrol edilemeyen koagülasyonun aktivasyonu, tromboz, trombositlerin ve pıhtılaşma faktörlerinin (faktör II, V ve VIII) tüketimi ile sonuçlanan DIC tablosu ortaya çıkar. Klinikte, deri ve mukoza kanamaları ile kendini gösterir [26, 31-33, 37-38]. DIC, sepsisli hastalarda prognozu kötü 14 yönde etkileyen fizyopatolojik bir olaydır. DIC gelişen hastalarda ölüm oranı % 77, DIC olmayanlarda %32 olarak bildirilmiştir [39]. Sepsiste, aktive nötrofiller, moleküler oksijen üzerindeki membrana bağlı NADPH oksidaz etkisi yoluyla respiratuvar patlamanın parçası olarak sitotoksik ajan gibi süperoksit üretebilirler. Nötrofiller ayrıca, peroksinitrit üretmek için süperoksitle reaksiyona girebilen serbest radikal nitrik oksit (NO) de üretir. NO, hidroksil radikali oluşturmak için ayrışabilen, tek başına güçlü bir oksidandır. Reperfüzyon tarafından takip edilen iskemik durumlarda, ksantin oksidaz enzimi ürik asit oluşturmayı katalizler ve birlikte süperoksit de üretilir. Süperoksit salınımı; nötrofillerin toplanması, aktivasyonu ve daha fazla süperoksit üretimi ile birlikte ksantin oksidaz oluşumunu uyaran eden endotel hücrelerine yapışması ile sonuçlanır. Glutatyon peroksidaz (GSH-Px) metabolizması sepsiste değişmiştir. GSH-Px’nin GSSG’ye oksidasyonunun gamma glutamilsistein sentetaz (gammaGCS) enziminin upregülasyonunun sonucu olarak GSH-Px sentezinde rebound yükselme tarafından takip edilmesi nedeniyle, in vitro olarak TNF-α’ya cevapta insan ve hayvan endotelyal ve epitelyal hücrelerde intraselüler GSH-Px’de hızlı bir düşme ortaya çıkar. Ratlardaki sepsiste, birçok dokuda (özellikle karaciğer) artmış sentezi ile birlikte GSH-Px devri erken dönemde artmıştır, fakat birlikte düşük kan GSH-Px düzeyleri vardır. Bir rat lipopolisakkarit endotoksik şok modelinde, karaciğer GSH’ındaki düşme ile oluşan, azalmış plazma antioksidan kapasite ile birlikte oksidatif stres belirgin artış saptanmıştır. GSH-Px selenyum içeren bir enzimdir (selenoenzim) ve bu yüzden selenyum eksikliği, azalmış GSH-Px aktivitesine sekonder olarak antioksidan savunmada çok önemli gibi görünmektedir. Selenyumun kendisi, transkripsiyonu ve proenflamatuvar gen ekspresyonunu inhibe eder. Bununla birlikte, selenyum fazlalığı da oksidatif stres ile ilişkilidir. Sepsiste gelişen en önemli fizyopatolojik olaylardan biri de septik şoktur. Septik şok en fazla gram negatif bakteriyel sepsislerde görülür. Benzer klinik sendrom, gram pozitif bakteriler, mantar, mikobakteriler, riketsia 15 ve protozoer enfeksiyonlarda da görülebilir [32]. Sepsiste açığa çıkan mediyatörlerin tromboksan birçoğu A2, vazoregülatördür. histamin (kompleman Bunlar; prostosiklin aktivasyonunu takiben (PGI2), mast hücrelerinden salınır) , seratonin (aktive olan trombositlerden salınır) ve NO’dur. Vazoaktif mediyatörlerin etkisi ile sistemik damar direnci azalır. Bu da dokulara giden kan akımının azalmasına neden olur. Ayrıca sepsiste miyokardı deprese eden bir madde “myocardial depressant substance” izole edilmiştir. Bu madde, ventriküler dilatasyon, miyokardda depresyon ve sol ventikül ejeksiyon fraksiyonunda azalmaya yol açar [32, 39-40]. TNF-α miyokardı deprese eder, PAF kalp üzerine negatif inotropik etkilidir ve arteriyel kan basıncını düşürür. Lökotrienler C4, D4 ve E4, koroner ve miyokard kan akımını azaltır. IL-2’de kardiyovasküler fonksiyon bozukluğuna yol açar. Sepsiste salınan bu mediyatörlerin etkisi ile hipotansiyon ve şok gelişir [33, 41-42]. Sepsiste birçok organda patolojik değişiklikler görülebilir. En fazla organ hasarı akciğerler, karaciğer, böbrekler, kalp ve barsaklarda görülür. Bu değişiklikler, bakteriyel invazyon, bakteriyel toksinler ve enzimlerin direkt etkisi, mediyatörler aracılığı ile oluşan etki, perfüzyon bozukluğu ve DIC sonucu gelişen patolojik değişikliklerdir. Histopatolojik değişiklikler; konjesyon, ödem, fibrin trombüsleri, hemoraji ve nekroza kadar giden lezyonlarla karakterizedir. Akciğerde hemorajik değişikliklere sık rastlanır ve ağır solunum yetmezliğine yol açar. Akciğerlerden sonra ikinci sıklıkla lezyonlar, barsaklarda akut iskemik enterokolit ve karaciğerde zonal nekrozlar seklinde gelişir. Diğer organlarda da hemoraji ve nekrotik değişiklikler gözlenir [43]. 2.1.6 KLİNİK BELİRTİ VE BULGULAR Sepsis evresine göre klinik belirti ve bulgular değişir. Klinik tablo bir evreden diğerine geçebilir. Tablo 2.5’de sepsiste en sık görülen klinik belirti ve bulgular görülmektedir. Bu belirti ve bulguları olan hastalardan süratle kan 16 kültürü, enfeksiyon odağından kültürler alınmalı ve uygun tedavi hemen başlanmalıdır. Sepsisli hastaların büyük çoğunluğunda vücut ısısı yükselir. Ateş ile beraber titreme de gözlenir. Bazı hastalarda vücut ısısı normal sınırlarda olabileceği gibi, hipotermi de görülür. Sepsise bağlı hipotermi, bebeklerde, ileri yaşlarda, üremi veya alkolizm gibi kronik altta yatan hastalığı olan hastalarda görülür. Hipotermi sepsiste kötü prognozun bir işareti olarak yorumlanmaktadır. Nötropenik ve immünsüpressif hastalar sistemik enfeksiyona yatkındırlar. Ateş görülmeden sepsis gelişebilir. Hipotansiyon, oligüri, trombositopeni ve kanamanın gözlenmesi, bu hastaların sepsis yönünden değerlendirilmesini gerektirir [31, 44-45]. Tablo 2.5. Sepsiste klinik belirti ve bulgular Belirti ve bulgu Komplikasyon Ateş veya hipotermi Hipotansiyon Üşüme ve titreme Kanama Hiperventilasyon Trombositopeni Taşikardi Lökopeni Deri lezyonları Organ yetmezliği Şuur değişikliği Akciğer: ARDS Böbrek: Oligüri, anüri, asidoz Karaciğer: Sarılık Kalp: Konjestif yetmezlik Hiperventilasyon, sepsisin en erken belirtisi olabilir. Ateş, titreme ve diğer belirtiler daha sonra gelir. Yoğun bakım ünitelerinde devamlı takip edilen hastalarda hiperventilasyon ve respiratuvar alkaloz gözlenmesi, sepsisi ilk planda düşündürmelidir [27, 45-46]. Santral sinir sistemi tutulumu olmaksızın mental değişikliklerin olması sepsiste önemli bir bulgudur. Klinik tablo bir ensefalopatidir. Oryantasyon bozukluğu, konfüzyon, letarji, ajitasyon ve şuurda küntlük şeklinde klinik tablo ortaya çıkar [27, 45]. 17 Sepsiste selülit, eritrodermi, erizipel, fasiit, ektima gangrenozum, peteşi, purpura ve ekimoz gibi deri lezyonları görülebilir. Bu lezyonları üç kategoride değerlendirebiliriz; 1.Deri ve derialtı dokusunun bakteriyel enfeksiyonu, 2. Sepsise bağlı şok ve/veya DIC tablosu sonucu, bakteriyel invazyon olmadan gelişen deri lezyonları, 3. Mikroemboli ve immünkompleks vaskülit sonucu end-arteriyel obstrüksiyona bağlı gelişen deri lezyonları; infektif endokarditte görülen deri lezyonları buna örnektir [45]. Sepsis ve DIC, hastalarda, el ve ayak parmaklarında, kulak ve burun uçlarında nekroza kadar giden akrosiyanoza yol açabilir. Bu lezyonlar simetrik periferik gangren olarak da isimlendirilmektedir. Genellikle gram negatif bakteriyel sepsislerde görülür. Gram pozitif bakteriyel sepsislerde nadiren gözlenir [37-38, 45, 47]. Sepsisin erken döneminde kalp atım hacmi artar. Periferik damar direnci azalır. Arteriyel kan basıncı düşer. Bu erken hiperdinamik fazda, periferik vazodilatasyon vardır. Pek perfüzyon bozulmaz. Bu dönemi şok takip eder. Sepsisli hastalarda sistolik kan basıncının 90 mmHg’nin altına düşmesi, klinik olarak şok kabul edilmektedir. Hastalarda, hipotansiyon, taşikardi, takipne ve periferik vazodilatasyon gözlenir. Deri sıcaktır (sıcak şok). Şokun uzaması ile periferik vazokonstrüksiyon gelişir. Organ perfüzyon bozuklukları belirtileri ortaya çıkar, anüri gelişir, deri soluk ve soğuktur. Tedavi edilmeyen veya tedaviye cevap vermeyen vakalarda organ yetmezliği ve ölüm gelişir [31, 41-42, 44]. Hiperventilasyon, sepsisin en erken belirtisi olabilir. Hatta ateş, lökositoz veya hipotansiyon olmadan bile gözlenebilir. Respiratuvar alkaloz (arteriyel CO2 basıncı < 30 mmHg) gelişir. Sepsiste akciğer komplikasyonları önemli yer tutar. Bunlar hiperventilasyon, ARDS ve solunum adalelerinde yetersizliktir. Sepsis, pnömoniyi takiben gelişebileceği gibi, bakteriyemi sonucu da diffüz pnömoni gelişir. Akciğer tutulumu klinik tabloyu ağırlaştırır. ARDS veya şok akciğeri, gram negatif bakteriyel sepsislerde daha sık 18 görülür. ARDS, sepsis klinik tablosunun başlangıcında görülebileceği gibi daha sonra da gelişebilir [31, 43-46]. Sepsiste görülen en önemli komplikasyonlardan biri de organ yetmezlikleridir. Yetmezlik kardiyovasküler sistem, yönünden akciğerler, risk altında böbrekler, olan karaciğer, organlar; pankreas, gastrointestinal sistem, koagülasyon sistemi ve santral sinir sistemidir. Sepsiste hipotansiyon ile beraber oligüri gözlenir. Hastanın şoka girmesi ile anüriye kadar giden böbrek fonksiyon değişiklikleri görülür. Bazen septik şok gelişmeden de hastalarda, glomerülonefrit veya interstisyel nefrit sonucu akut veya subakut böbrek yetmezliği gelişir. Bakteriyel endokardit, ventriküloatriyal şant enfeksiyonu, piyojenik organ enfeksiyonları ve vücudun herhangi bir yerinden enfeksiyon odağı varlığında, glomerüler orijinli böbrek yetmezliği gelişebilir [31, 39, 45]. Primer hepatobiliyer hastalık olmaksızın sarılık sık görülür. Direkt bilirübin artışı ile beraber hiperbilirübinemi, alkalen fosfataz ve transaminaz seviyelerinde artış görülür [31, 39, 48]. Sepsis en sık akut DIC nedenidir. Trombositopeni, intravasküler trombin oluşumu, fibrin birikimi, pıhtılaşma faktörlerinde azalma ve fibrinoliz ile karakterizedir. Deri ve mukozalarda peteşi ve purpura, hemorajik büller, akral siyanoz ve bazen de gangrenler görülebilir. Cerrahi veya travmaya bağlı yarası olan hastalarda yara yerinde kanama, damardan enjeksiyon yerlerinde ve intraarteriyel kateter yerlerinde sızıntı, büyük derialtı hematomları ve derin doku içine kanamalar sık görülür. Uzayan şok DIC tablosunu ağırlaştırır. DIC, hem gram negatif bakteriyel sepsislerde ve hem de gram pozitif bakteriyel sepsislerde görülür. Gram negatif bakteriyel sepsislerde görülme sıklığı daha fazladır [39, 44, 47]. Sepsisin erken döneminde hastaların çoğunda hiperventilasyona bağlı respiratuvar alkaloz görülür. Hipotansiyonun uzaması ve şok gelişmesi ile metabolik asidoz gelişir [27, 45]. Sepsiste hipoglisemi görülebilir. Diyabetli hastalarda ise hiperglisemi enfeksiyon gelişmesinin en önemli ipucu olabilir [45]. 19 2.1.7 TANI VE AYIRICI TANI Hastalardan dikkatli hikaye alınması, klinik belirti ve bulguların iyi değerlendirilmesi, sepsisin erken tanısını koydurur. Özellikle sepsise zemin hazırlayan alt hastalıkların veya predispozan faktörlerin; cerrahi girişim, transplantasyon, kemoterapi veya travma gibi durumların belirlenmesi, hastaların değerlendirilmesinde önemlidir. Hastaların seyahat hikayeleri, herhangi bir çevresel enfeksiyon kaynağı ile temas, belli bir enfeksiyon hastalığı olasılığı açısından ipucu verir. İmmünsüpressif ve nötropenik hastalarda enflamatuvar cevap zayıftır. Endurasyon, fluktuasyon, lokal ısı artışı, reaktif lenfadenopati ve eksüdasyon gözlenmeyebilir. Hatta klasik üriner sistem enfeksiyonu belirtileri olmayabilir. Menenjit durumlarında, menengial iritasyon belirtileri gözlenmeyebilir. Bu nedenle bu hastalarda primer enfeksiyon odağının belirlenmesi ve sepsis tanısı oldukça zordur [31, 44-45]. Hastaların fizik muayeneleri titiz yapılmalı, semptom ve bulgular çok iyi değerlendirilmeli. Klinik tanı da laboratuar bulguları ile desteklenmelidir. Sepsiste klinik evrelere göre farklı laboratuvar bulguları gözlenir. Hematolojik bulgular; genellikle lökositoz ve sola kayma görülür. Lökosit sayısı 12000/mm3’ün üstündedir. Bazen lökomoid reaksiyon görülebilir ve lökosit sayısı 50-100 bin/ mm3’e kadar ulaşır. Lökosit sayısının 4000/mm3’ün altına düştüğü lökopeni durumları da görülebilir. Özellikle yenidoğanlarda, yaşlılarda, alkoliklerde ve diğer kemik iliği rezervi yeterli olmayan hastalarda lökopeni görülür. Periferik yaymada, nötrofillerde toksik granülasyon, Dohle cisimleri ve vakuolizasyon görülür. Toksik granülasyon ve Dohle cisimleri bakteriyemi için spesifik kabul edilmemekte, fakat vakuolizasyon bakteriyeminin önemli işareti kabul edilmektedir. Sepsiste eritrosit yapımı azalır, eğer enfeksiyon uzamaz ise bu anemiye neden olmaz. Serum demiri de azalır. DIC gelişen hastalarda, laboratuvar tanıda kullanılacak spesifik bir test yoktur. Tanıda birden çok testten yararlanılır. Trombosit sayısında hızlı düşüş veya 100000/mm3’ün altında olması, protrombin zamanı ve aktive parsiyel tromboplastin zamanında uzama, plazma fibrin yıkım ürünlerinde 20 artış ve koagülasyon inhibitörlerinin (antitrombin ve protein C) plazma seviyelerinin azalmasının gösterilmesi DIC tanısını koydurur. Plazma fibrinojen seviyesi, sepsisin erken döneminde normal sınırlarda olabilir, çünkü bu protein akut faz reaktanıdır. Ağır sepsislerde hipofibrinojenemi gelişir. DIC gelişen hastaların periferik kan yaymasında, eritrositlerde parçalanma ve sistositler görülür [27, 31, 37, 44-45, 47]. Kan gazları, sepsis takibinde önemlidir. Erken dönemde respiratuvar alkaloz, daha sonra metabolik asidoz gelişir. Kan üre nitrojeni (BUN) ve kreatinin seviyesi, şok varlığında veya olmadan da artabilir. Şok durumunda azotemi ve oligüri genellikle akut tübüler nekroz sonucu gelişir. İdrar sedimentinde fazla miktarda tübüler epitel ve granüler silendirler görülür. Hepatobiliyer sistem tutulumu olmadan da sepsisli hastalarda karaciğer fonksiyon testleri bozulabilir. Özellikle direkt bilirübin artışı ile beraber hiperbilüribinemi, alkalen fosfataz ve transaminaz seviyelerinde orta derecede artış görülür [27, 29, 39, 48]. Sepsisin etiyolojik tanısı primer enfeksiyon odağından yapılan kültür ve kan kültürleri ile konur. Hastalarda belirlenebilen bir enfeksiyon odağı varsa, oradan alınan materyalden yapılan preparatta veya kandan hazırlanan “buffy coat” preparatında, Gram boyası ile etken gösterilebilir. Hasta serumunda endotoksinlerin belirlenmesi gram negatif bakteriyel sepsis tanısı koydurabilir. Başlangıç ampirik antibiyotik tedavisi için bu işlemler yol gösterici olacaktır. Kan kültürleri, aseptik koşullarda ve antibiyotik verilmeden önce, değişik venlerde en az üç set alınmalıdır. Aerop ve anaerop koşullarda inkübe edilmelidir. Serum endotoksin ve sitokin (özellikle TNF–α ve IL-6 ) düzeylerinin belirlenmesi prognoz yönünden önemli olabilir. Bu testler henüz rutin testler arasına girmemiştir [31, 36, 44]. Akciğer grafilerinde, akciğerin enfeksiyona iştirak ettiği durumlarda pnömonik infiltrasyonlar, ARDS gelişen durumlarda bilateral diffüz infiltrasyon saptanır. Diğer sepsis vakalarında akciğer grafileri normaldir [46]. 21 Sepsis tanısı konulan hastaların ancak %50-60’ında kan kültür pozitifliği elde edilmektedir [45]. Pozitif kültür sonucu olmadan bazı hastalarda sepsis tanısı koymak zor olabilir. Ayrıca tanıda sistemik enflamatuvar cevap sendromu oluşturan hastalıklar düşünülmelidir. Akut pankreatit, vaskülitler, çoğul travmalar, yanıklar, akut DIC nedenleri, çoklu akciğer embolileri, miyokard enfarktüsü, diyabetik ketoasidoz, sistemik lupus eritematozus, aşırı kanama ve hipovolemiler, masif aspirasyon ve atelektazi gibi hastalıklar ayırıcı tanıda göz önünde bulundurulmalıdır [17, 44-45]. Adrenal yetmezliği, sepsis klinik tablosu ile karışabilir. Akut adrenal yetmezliğinde, hipotansiyon, mental durumda değişiklik ve ateş olabilir. Ayrıca adrenal yetmezlik, bakteriyel enfeksiyonlar veya sepsis ile beraber ortaya çıkabilir. Ayırıcı tanıda bazal kortizol ve ACTH düzeyi ve ACTH stimülasyon testi yardımcı olacaktır [49]. 2.1.8. PROGNOZ Sepsis tedavisinde yeni gelişmelere rağmen ölüm oranı hala yüksektir. Değişik çalışmalarda ölüm oranı %20-80 arasında bildirilmektedir [21, 32]. Bu çalışmalarda farklı ölüm oranlarının bildirilmesi çalışma gruplarının heterojen olmasına bağlıdır. Gram negatif bakteriyel sepsislerde ölüm oranı %45-50 [20, 22, 25, 29, 46], gram pozitif bakteriyel sepsislerde % 20-30 [19, 30] ve anaerop sepsislerde ise ölüm oranı %15-30 dur [49]. Şok, DIC, ARDS ve diğer organ yetmezliği komplikasyonları geliştiğinde ölüm oranı %70-90 arasında değişmektedir [22, 39, 45]. Etkenlere göre de ölüm oranları farklılık gösterir. En yüksek ölüm oranı P.aeruginosa sepsislerinde bildirilmektedir [22, 24, 45]. Sepsiste prognozu etkileyen birçok faktör Tablo 2.6’ da özetlendi. 22 Tablo 2.6. Sepsiste progrozu etkileyen faktörler Altta yatan hastalık Nötropeni Hipogammaglobülinemi Diyabet Alkolizm Böbrek yetmezliği Solunum yetersizliği Tedavi başladığında enfeksiyona bağlı komplikasyonların gelişmiş olması (şok, anüri gibi) Bakteriyeminin şiddeti (polimikrobiyal bakteriyemi ) Enfeksiyon kaynağı Enfeksiyonun geliştiği yer (Nozokomiyal) Hastanın yattığı servis (Yoğun bakım ünitesi) Antibiyotik tedavisinin uygunluğu Tedavinin başlanmasına kadar geçen zaman İleri yaş 2.1.9. TEDAVİ Tedavinin başarısı, doğru ve erken klinik tanı, etiyolojik tanının konulması, destekleyici ve etkene yönelik uygun tedavinin erken başlanması, altta yatan hastalığın ortadan kaldırılması veya düzeltilmesine bağlıdır. Sepsis tedavisini su başlıklar altında toplayabiliriz: 23 1. Destek tedavisi a. Solunum desteği b. Hemodinamik destek ve şok tedavisi c. DIC tedavisi 2. Enfeksiyon odağının kaldırılması 3. Altta yatan hastalığın tedavisi 4. Antimikrobiyal tedavi 5. Diğer tedavi girişimleri 2.1.9.1. Destek tedavisi Sepsiste, destek tedavisi antimikrobiyal tedavi kadar önemlidir. Hasta tecrübeli personel tarafından yoğun bakım koşullarında takip edilmelidir. Hastalarda mutlaka hava yolu açık tutulmalı, idrar çıkışını takip için bir üriner kateter ve parenteral tedavi için de damar içi kateter yerleştirilmelidir. Ağır sepsis ve septik şoktaki hastalarda hemodinamik değişiklikleri takip etmek amacıyla arteriyel kateter, santral venöz kateter veya pulmoner arter kateteri konulması gibi invaziv teknikler uygulanabilir. Septik şok tedavisinde ana hedef kan volümünün düzeltilmesi, yeterli doku perfüzyonunun ve dokuların oksijen ihtiyacının sağlanmasıdır. Bu amaçla ilk yapılması gereken yeterli sıvı tedavisidir. Sıvı tedavisi ile ”pulmoner wedge” önerilmektedir. basıncının Başlangıçta 15-18 genellikle mmHg ”pulmoner arasında wedge” tutulması basıncı 8 mmHg’den azdır ve hastaların çoğunda 4-6 litre mayi açığı vardır. Sıvı tedavisinde kolloid solüsyonlar veya kristaloid mayiler kullanılabilir. Kolloid solüsyonlarda akciğer ödemi ve sistemik ödem riski daha azdır. Sıvı tedavisi ile mayi açığı kapatılan ve “pulmoner wedge” basıncı 15-18 mm Hg olmasına rağmen hala hipotansif olan hastalarda vazoaktif ilaç verilmesi gerekir. Vazoaktif ilaç ihtiyacı olan hastalarda ilk önerilen ilaç dopamindir. Dopamin dozu, 2-20 mg/kg/dk arasında ihtiyaca göre verilir. Eğer istenilen etki sağlanamaz ise norepinefrin verilmesini önerenler vardır. Düşük doz 24 dopamin (1-4 mg/kg/dk) ile noradrenalin verilmesini önerenler de vardır. Bu kombinasyon böbrek kan akımını arttırmaktadır. Dobutamin, kalp debisini artırmada daha etkili olması nedeni ile bazı araştırıcılar bu ilacı önerirler. Mayi açığı olan hastalarda vazopresör ilaçlarla istenilen etki elde edilemez, aksine hipotansiyon gelişir ve doku perfüzyonu bozulur. Sempatomimetikler kalbin oksijen ihtiyacını artırır ve taşiaritmilere yol açar. Bu nedenle endikasyonun doğru konulması gerekir [35, 50-51]. Kalp yetmezliği gelişen vakalarda dijital verilebilir. Dijital miyokardın oksijen ihtiyacını artırır. Küçük dozlarda bile dijital toksisitesi riski vardır. Ayrıca sempatomimetiklerle beraber kullanılması, yan etki riskini daha da artırır. Diüretikler, septik şokun oligürik ve anürik döneminde kullanılabilir [5051]. Septik şokta, solunum sayısının artması ve akciğer patolojilerine bağlı olarak solunum isi ve oksijen tüketimi artar. Bu nedenle hastalara oksijen desteği yapılmalıdır. Septik şoktaki hastaların oksijen satürasyonu % 90-92 arasında tutulması önerilmektedir. Bu nedenle hastalara erken ventilatör desteği gerekebilir. Septik şoktaki hastalarda yeterli sıvı tedavisi ve vazopresör ilaçların kullanılması ile laktik asidoz genellikle düzelir. Tedaviye cevap alınamayan ve pH 7,2 altında olan vakalarda bikarbonat infüzyonu yapılır [35]. Anemisi olan hastalarda eritrosit süspansiyonu veya tam kan verilebilir. Hastalarda hematokrit değerinin % 30-35’den daha aşağı olmaması arzu edilir. DIC’in laboratuvar bulgusu olan hastalarda heparin tedavisine hemen başlanır. DIC’e bağlı kanama gelişen hastalarda ise heparin verilmez, yerine koyma tedavisi yapılır. Bu amaçla taze kan, trombosit süspansiyonu, taze plazma, kriyopresipitat verilebilir [29, 31, 52]. Septik şok tedavisinde, steroidlerin yeri yoktur [53-54]. Ancak ağır sepsislerde adrenal bez etkilenir ve adrenal yetmezlik gelişebilir [49]. 25 Septik şok tedavisinde naloksan, nonsteroid antienflamatuvar ilaçlar (indometazin, ibuprofen), antihistaminikler, pentoksifillin denenmiş olup, klinik kullanıma girmemiştir. Doğal veya sentetik antioksidanlar; ksantin oksidaz inhibitörü ( allopürinol ), süperoksit dismutaz, katalaz, NADPH oksidaz inhibitörleri ( adenozin gibi), desferroksamin, N-asetilsistein, vitamin C ve E ile deneysel düzeyde çalışmalar devam etmektedir. NO damar endotelinden açığa çıkan ve septik şokta vazodilatasyondan sorumlu olan bir maddedir. Lipopolisakkaridler ve birçok enflamatuvar sitokinler NO’nun güçlü aktivatörleridir. Bazı hayvan modellerinde NO sentez inhibitörlerinin olumlu etkisi gösterilmiştir. Bilinen NO sentetaz inhibitörü N-monomethyl–Larginindir. L-arginin ile az sayıda hasta ile yapılan klinik çalışmada olumlu etkiler ortaya konulamamıştır. İleri klinik çalışmalara gereksinim vardır. Endotoksine karşı hazırlanan poliklonal ve monoklonal antikorlar (HA-1A, E5) birçok klinik çalışmalarda kullanılmış, fakat tatmin edici klinik sonuçlar alınamamıştır. çalışmalardan Sitokinlerin da etkisini beklenilen bloke sonuçlar elde etmeye yönelik edilememiştir. yapılan Anti-TNF monoklonal antikor, IL-1 reseptör antagonisti ve çözünmüş TNF reseptörleri ile yapılan deneysel çalışmalar ve faz II-III çalışmaları ile beklenen klinik cevap alınamamıştır. Antisitokin tedavisi ile ilgili çalışmalar halen devam etmektedir [52, 55]. Sepsiste katabolik olaylar süratlenir ve protein yıkımı artar. Hastaların beslenme durumunun erken planlanması önemlidir. Oral beslenme için herhangi bir kontrendikasyon yoksa enteral beslenme hemen başlanır. Enteral beslenme, barsak mukozasını iskemik hasardan korumaya yardım eder ve barsaklardan bakteriyel translokasyonu azaltır. Enteral beslenme için bir sakınca var ise, hasta parenteral beslenir. Total parenteral beslenmede, kateter enfeksiyonu sık görüldüğünü unutmamak gerekir [31, 35]. 26 2.1.9.2. Antimikrobiyal tedavi Sepsis tedavisinin esasını antimikrobiyal tedavi oluşturur. Klinik tanının erken konulması, teşhis için kan ve diğer kültürlerin hemen alınması, diğer tanı yöntemlerinin hızlı uygulanması, destek tedavisinin hemen başlanması, uygun antibiyotik tedavisinin hemen başlanması, predispozan faktörlerin düzeltilmesi, tedavinin başarısı için gereklidir. Eğer apse odağı varsa direne edilmeli, yabancı cisim varsa çıkarılmalıdır. Hastalarda başlangıç antibiyotik tedavisi empirik olacaktır. Kültür ve antibiyotik duyarlılık sonuçları en erken 48-72 saat sonra alınır. Birçok sepsis olgusunda da etiyolojik tanı konulamayabilir. İyi planlanmış çalışmalarda bile kültür pozitiflik oranı % 70’e kadar çıkmaktadır. Empirik tedavinin uygun olması hastaların tedavi başarısını arttırmaktadır. Uygun antibiyotik seçiminde primer enfeksiyon odağı, epidemiyolojik faktörler, altta yatan hastalık, enfeksiyonun hastane veya toplumda kazanılmış olması, sık izole edilen bakterilerin antibiyotik duyarlılık durumları göz önünde bulundurulur. Seçilen antibiyotik bakterisit etkili olmalı ve damar yolundan verilmelidir. Antibiyotik dozunun ayarlanmasında ise hastanın yaşı, karaciğer ve böbrek fonksiyonları göz önünde bulundurulur [31, 44, 52, 56]. Başlangıç antibiyotik tedavisinde genellikle uygun iki antibiyotiğin kombinasyonu konusunda fikir birliği vardır. Bu kombinasyondan amaç hem gram negatif, hem gram pozitif enfeksiyonları içine alacak geniş spektrum elde etmek, polimikrobiyal enfeksiyona etkili olmak, direnç gelişimini önlemek ve sinerjistik etki elde etmektir. Bir beta-laktam antibiyotik ile bir aminoglikozid kombinasyonu başlangıç tedavisi için tercih edilen kombinasyondur. Yeni kullanıma giren geniş spektrumlu antibiyotikler; karbopenemler inhibitörleri (imipenem, meropenem), (sefaperazon-sulbaktam, betalaktam-betalaktamaz tikarsilin-klavulanat, tazobaktam- piperasilin), bazı kinolonlar (siprofloksasin, levofloksasin ) tek kullanılabilir. Bu antibiyotikler özellikle nozokomiyal sepsislerde önerilmektedir. Etken izole edilen olgularda, antibiyotik tedavisi bakterinin duyarlı olduğu antibiyotiklere göre yeniden düzenlenir [31, 44, 52, 56-57]. 27 Sepsiste kesin bir tedavi süresi vermek mümkün değildir. Genellikle 1014 günlük bir antimikrobiyal tedavi yeterli olmaktadır. Bakteriyemi odağında enfeksiyonun devam etmesi halinde tedavi süresi uzatılır. Tedaviyi kesmek için hastanın ateşinin düşmesi, lökosit sayısının normal sınırlara inmesi, semptomların düzelmesi, bakterinin eradike edilmesi gibi kriterler göz önünde bulundurulur [44, 52]. 2.2. HİPERBARİK OKSİJENİN FİZYOLOJİSİ Hiperbarik oksijen (HBO) tedavisinin basit tanımı “hastaların tamamen kapalı basınç odalarında, 1 ATA’dan daha büyük basınç altında %100 oksijenin solutulduğu tedavi yöntemi” şeklinde yapılabilir [58]. ATA (atmosphere absolute), basınç birimidir ve 1 ATA deniz seviyesindeki basınca, yani 760 mmHg’ye eşittir. HBO’nun iki temel etkisi vardır; vücut içindeki gazlar üzerine mekanik etkisi ve kanda parsiyel oksijen basıncını arttırıcı etkisi. Bütün etkinliklerini bu iki temel mekanizma üzerinden gerçekleştirmektedir. 2.2.1. HBO’nun Mekanik Etkisi Artan basıncın, Boyle yasası ile de açıklanan mekanik etkisi ile insan vücudundaki hava kabarcıkları ve gaz içeren boşluklarda değişiklikler oluşur. Boyle yasasına göre; uygun koşullarda hacim basınçla ters orantılıdır. Hacmin azaltılması boşluk yüzeyindeki basıncı düşürür. Orta kulak basıncı, sinüs gerilmesi, barsaklarda hapsolmuş gaz gerginliği ve akciğer gerilmesinde ortaya çıkan barotravma gibi durumların tedavisinde, dışardan uygulanan basınçla bu bölgelerdeki hacmin azaltılmasının ve gazın çözünmesinin sağlanması bu fizyolojik özelliğe örnektir. Örneğin gazlı gangrende, gaz kabarcıkları dokuda gerilim oluşturursa, bu fizyolojik özellik sayesinde hiperbarik odada uygulanacak basınç tedavisi ile dokudaki 28 kabarcık büyüklüğünün azalması, dolayısıyla dokunun daha iyi kanlanması sağlanacak ve aynı zamanda ağrı da azalacaktır [59-60]. Dekompresyon hastalığı ve hava embolisinde damar içinde meydana gelen gaz kabarcıkları, damarı tıkayarak doku kanlanmasını bozar, aynı zamanda kabarcığın aşırı miktarda büyümesi trombositleri aktive eder ve damar içi pıhtılaşma meydana gelir. Bu durumlarda basınç uygulamasının mekanik etkisi ile kabarcıkların küçültülüp çözünmesini sağlayarak tedaviye katkıda bulunulur. 2.2.2. HBO’nun Oksijen Çözünürlüğünü Arttırıcı Etkisi Normal fizyolojik koşullarda, oksijenin büyük bir bölümü hemoglobine bağlı olarak taşınır. Oksijenin, sadece çok az bir kısmı kanda çözünür halde bulunmaktadır. Hiperbarik oksijen ugulaması ile vücudun gereksinimlerini tek başına karşılayabilecek miktardaki oksijenin plazmada çözünmesini sağlamak mümkündür (Tablo 2.7). Örneğin, 3 ATA’da (3 x 760 = 2280 mmHg’lik bir basınçta) kandaki çözünmüş oksijen içeriği %6,8’lik bir hacme yükselir. Plazma içerisindeki erimiş oksijen, hemoglobine bağlı oksijene göre çok daha kolay kullanılma özelliğine sahiptir. HBO uygulaması ile plazmadaki çözünmüş oksijen oranı %6’yı geçtiğinde, oksihemoglobin, arteriyel sistemden venöz sisteme değişime uğramadan geçebilir [61]. Bu sayede plazma, normal kanlanan dokuların ihtiyaçlarını fazlasıyla karşıladığı gibi, kanlanması azalmış dokular için de yeterli oksijen taşıma kapasitesine ulaşmış olur. Dolayısıyla doku oksijenizasyonunun yetersizliği ile seyreden birçok hastalıkta HBO ideal bir tedavi yöntemi olarak göze çarpar. HBO uygulaması sonrasında venöz kanda bile oksijen satürasyonu %100’e çıkar, tüm hemoglobinler oksijenle satüre olur ve CO2’yi taşıyacak hemoglobin kalmaz, kandaki karbondioksit (CO2) miktarı artar ve bunun sonucunda pH düşer. Çünkü artmış parsiyel oksijen basıncı (pO2), oksihemoglobinin hemoglobine indirgenmesini inhibe eder ve CO2’nin plazma 29 içinde çözünmüş olarak taşınma oranı artar. Bunun sonucunda CO2 retansiyonu meydana gelir. Bu da hidrojen iyonunun dokularda hafifçe artmasına sebep olur. Kandaki fazla miktardaki CO2’nin %70’i bikarbonat halinde, geri kalanı ise çözünmüş halde ve karbonik asit olarak taşınır. Sonuç olarak, venöz hemoglobin O2 ile %100 doygunluğa ulaştığında beyin venlerindeki parsiyel CO2 basıncında (pCO2) 5–6 mmHg’lik bir artış olur. Normal bir bireyde, kan akımı sabit kaldığı sürece, CO2 kanda ve dokularda daha fazla artmaz ve herhangi bir problem ortaya çıkmaz [61]. Tablo 2.7. Değişik Basınçlarda Plazmada Çözünmüş Oksijen İçeriği [61] Uygulama Basıncı Plazmada Çözünmüş Oksijen Miktarı (%ml) ATA (mmHg) Normal Hava Saf Oksijen 1 (760) 0.32 2.09 1.5 (1140) 0.61 3.26 2 (1520) 0.81 4.44 2.5 (1900) 1.06 5.62 3 (2280) 1.31 6.8 4 (3040) 1.8 3 ATA üzerinde uygulanmamaktadır 5 (3800) 2.3 3 ATA üzerinde uygulanmamaktadır 6 (4560) 2.8 3 ATA üzerinde uygulanmamaktadır 3 ATA’da %100 oksijen solunursa arteriyovenöz oksijen farkı 350 mmHg’ye kadar çıkar. Dokudaki kan akımı yarıya düştüğünde arteryel ve venöz pO2’ler sırayla 288 ve 50 mmHg olarak alınır (fark 238 mmHg). Arteriyel pO2 çok arttığında, yeterli hücresel oksijenlenme çok düşük bir kan akımıyla bile sağlanabilir [61]. Görülüyor ki, 3 ATA’da %100 O2 kullanarak doku oksijenlenmesini 10–15 kat artırmak mümkün olabilmektedir (Tablo 2.8). 30 Tablo 2.8. HBO Uygulaması ile Ulaşılan Doku Parsiyel Oksijen Basıncı Düzeyleri (mmHg) [62]. 1 ATA (hava) 1 ATA (O2) 2 ATA (O2) 2.5 ATA (O2) 100 600 1400 1800 Transkutanöz pO2 70-75 450-550 1200-1300 1400-1500 Kas pO2’ si 30-35 60-75 220-300 - Subkutanöz pO2 30-50 90-150 200-300 300-500 Yara pO2’ si 5-20 200-400 600-800 800-1100 Arteryel pO2 2.3. HİPERBARİK OKSİJENİN ÇEŞİTLİ SİSTEMLERE ETKİSİ HBO uygulamasının hematokritte azalma, viskozitede düşme, eritrosit membran elastisitesinin artması, trombosit agregasyonunda azalma gibi kan elemanları üzerinde etkileri vardır. HBO uygulaması ile plazmanın oksijen taşıma kabiliyetinde artış meydana geldiğinden dolayı, eritrositler hipoksik dokulara ulaşamasa bile, bu dokuların oksijenlenmesi sağlanabilir. Yine, doku oksijen basıncının yükseltilmesi, lökositlerin patolojik bakterileri öldürme kapasitesinde artış sağlar [63-64]. 2 atm basınçta oksijen solunduğunda, vazokonstriksiyon gelişir ve kaslara giden kan akımında %20 oranında düşme olur [65]. HBO uygulamasının santral sinir sistemi üzerindeki etkilerinin şiddeti, uygulanan basınca ve uygulama süresine bağlı olarak değişmektedir. 3 ATA’nın üzerindeki basınçlarda uygulanan HBO’ya maruz kalındığında, oksijen toksisitesi sonucu oksijen konvülziyonları gözlenmiştir [66]. Oksijen toksitesinin konvülziyon öncesi döneminde ise; elektriksel aktivite, kan akımı ve doku pO2 ile metabolik aktivitesinde değişiklikler gibi karakteristik değişimler gözlenir. Yine son yıllarda, yoğun bir şekilde HBO’nun merkezi sinir sistemi üzerindeki etkileri çalışılmıştır. Bu çalışmalar sonucu, 2–6 ATA basınçlarda serebral kan akımının düştüğünü [67]; bunda da nitrik oksitin (NO) aracı olduğunu göstermişlerdir [68]. Fakat 1,5–2 ATA basınç 31 uygulandığında vazokonstriksiyona ve beyin kan akımında düşmeye dair herhangi bir klinik belirti gözlenmemiştir. HBO ayrıca, serebral ödemi azaltır ve iskemi veya hipoksi nedeniyle inaktive olan nöron fonksiyonlarının yeniden aktive olmasını sağlar. Beyin fonksiyonlarındaki bu düzelmeyi, beynin elektriksel aktivitesindeki iyileşme takip edilebilir [69]. HBO uygulması sonrasında gelişen bradikardi ile kalbin dakika hacmi düşer, fakat kan basıncı değişmez. Derideki kan akımı da hiperoksiye cevap olarak gelişen vazokonstrüksiyon nedeniyle düşer. Ayrıca hiperoksi, CO2’ye olan solunumsal yanıtı da baskılar ve bunun sonucu başlangıçta solunumda hafif bir depresyon gelişirken, daha sonrasında hiperventilasyon gözlenir. HBO bu etkiyi olasılıkla karotid arter üzerinde bulunan CO2 reseptörlerine doğrudan etki ederek gerçekleştirmektedir [61, 69]. HBO uygulamasında, 1,5–2 ATA’lık uygulama basıncı güvenli bir aralık olarak kabul edilmektedir ve bu basınçtaki HBO uygulaması gerek deney hayvanları, gerekse insanlar tarafından iyi tolere edilmektedir. 1,5 ATA’da ve 40–60 dakikalık HBO uygulamalarında hiç bir zararlı etki görülmediği yapılan çalışmalarla gösterilmiştir [58]. Ancak, birçok endikasyonda, 2 ATA’dan yüksek basınçta ve 1 saatten uzun süreli HBO uygulaması gerekli olabilmektedir [58] ve bu değerlerde uygulanan HBO sonucu serbest radikal üretiminde artış ve buna bağlı değişiklikler de söz konusu olabilmektedir [7073]. Bu nedenle tıp dünyasında kullanımı gittikçe yaygınlaşan HBO tedavisi, uygulama sırasında oluşan reaktif oksijen türevleri ve bunlar tarafından indüklenen lipid peroksidasyonu gibi bazı zararlı olabilecek yan etkilerin önlenmesine dair araştırmalara konu olmaktadır. HBO’nun fizyolojik etkileri yukarıda anlatılan temel mekanizmalar üzerinden tablo 2.9’da özetlenmiştir. 32 Tablo 2.9. Hiperbarik Oksijenin Fizyolojik Etkileri. Etki Yeri Fizyolojik Etkisi Oksijen transportu ve Kanda CO2 taşınmasında hemoglobinin metabolizması inaktive olması Normal oksijen metabolizmasının aktive olması Solunum sistemi Solunum depresyonu Akciğer kollapsına eğilimin artması Dolaşım sistemi Bradikardi Kardiyak atım hacminin ve beyin kan akımının azalması Periferik damar sistemi Beyin, böbrek ve göz damarlarında vazokonstriksiyon Periferik direncin artması Metabolik ve biyokimyasal CO2 ve H+ iyonu artışı ile dokularda pH’nın azalması Hücre solunumunun inhibisyonu Sülfidril (SH) grubu içeren enzimlerin aktivitesinin azalması Serbest radikal oluşumunun artması 2.4. SERBEST RADİKALLER Serbest radikaller, çeşitli patolojik süreçleri başlatan veya bu süreçlerin ara basamaklarında işe dâhil olabilen ya da bu süreçlerin sonucunda ortaya çıkabilen oldukça reaktif maddelerdir. Serbest radikaller, organizmada normal aerobik solunum gibi fizyolojik durumlarda oluşabildikleri gibi, hava kirliliği 33 (azot oksitler, ozon, kükürt dioksit, sigara dumanı), çeşitli entoksikasyonlar (karbon monoksit, alkol, insektisidler, çeşitli ilaçlar), hemorajik ve iskemik durumlar, allerji, enfeksiyonlar, radyoaktiviteye maruz kalım, yaşlanma ve stres gibi değişik birçok nedenle de ortaya çıkabilmektedirler [74-76]. Canlı yapılarda yaygın olarak bulunan oksijenin dış yörüngesinde iki adet eşleşmemiş elektron bulunur. Bu nedenle oksijen, bir ‘biradikal’ olarak da nitelendirilmektedir ve organizmada gerçekleşen kimyasal reaksiyonlarda rol alan elementlerin başında gelmesi nedeniyle bir serbest radikale dönüşmeye her zaman aday görünmektedir. Moleküler oksijen üzerindeki değişiklikler ile meydana gelen ‘serbest oksijen radikalleri’ veya diğer adıyla ‘reaktif oksijen türevleri’ (ROT) serbest radikaller içerisinde karşımıza oldukça sık çıkan bir sınıfı oluşturmaktadır [77]. 2.4.1. Reaktif Oksijen Türevlerinin Oluşumu Oksijen molekülü tetravalan indirgenme (yani her iki oksijen atomundan gelen dört eşleşmemiş elektronun da indirgenmesi) sırasında çeşitli reaktif türevlere yönlenebilmektedir. Oluşan bu türevler de daha sonra biyolojik sistemlerde hasara yol açabilmektedir [77-79]. Bu şekilde oluşabilen başlıca ROT’lar, süperoksit anyonu (O2-), hidrojen peroksit (H2O2) ve hidroksil radikalidir (OH) (Şekil 2.1). Bu reaksiyonlar ile oluşabilecek radikallerin önüne geçebilmek için çeşitli oksidatif enzimler gelişmiştir; bu enzimler reaktif oksijen türevlerinin yaşayan organizmaya zarar oluşturabilecek miktarlarda oluşmasını engellerler. Hücresel metabolizma sırasında dar sınırlarda oluşan reaktif oksijen türevleri bu savunma sistemleri yoluyla etkisiz hale getirilmektedir [77-78]. Doğal O2 molekülünün, çevresindeki herhangi bir molekülden bir elektron almasıyla süperoksit molekülü oluşur. Eşleşmemiş bir elektron içeren süperoksit bütün radikaller gibi kararlı hale geçmeye, yani eşleşmemiş 34 elektronundan kurtulmaya çalışır. Süperoksit, bir serbest radikal olduğu halde çok toksik değildir. Asıl etkisini daha güçlü reaktif oksijen metabolitlerinin açığa çıkmasına yol açarak gösterir. Doğal O2, çevresindeki moleküllerden 2 elektron aldığında veya süperoksit molekülüne bir elektron eklendiğinde ise peroksit molekülü oluşur. Peroksit molekülünün 2 H+ atomu ile birleşmesi sonucunda da hidrojen peroksit meydana gelir [77-78]. Oksijen molekülünün yalnızca bir atomu bir H+ iyonu ile birleşecek olursa en reaktif, yani en toksik radikal olarak kabul edilen hidroksil radikali meydana gelir. Süperoksit ve ondan oluşan hidrojen peroksitin hidroksil radikalini meydana getirmesi, demir veya bakırın katalizlediği Haber-Weiss reaksiyonuyla olur. Bu reaksiyon iki basamaklıdır: Birinci basamak ferik (Fe+3) veya kuprik (Cu+2) iyonların süperoksit tarafından redüksiyonu, ikinci basamak ise redükte metal iyonlarının (ferröz veya kupröz, Fe+2 veya Cu+1) hidrojen peroksit ile reaksiyona girmeleri ve hidroksil radikalini oluşturmasıdır (reaksiyonun bu ikinci basamağına Fenton tepkimesi de denir). Bu durumda net Haber-Weiss reaksiyonu şu şekilde gerçekleşmiş olur: O2-+ H2O2 → OH + OH + O2 [79]. Hidroksil radikali en kısa ömürlü, ancak buna karşılık en reaktif serbest oksijen radikalidir. 2.4.2. Serbest Radikal Reaksiyonları Serbest radikal reaksiyonları genel olarak nonenzimatik zincir reaksiyonlardır. Radikaller, genellikle bu reaksiyon zincirlerinin başlangıç basamaklarında oluşmaktadır. Sonraki basamaklarda bir yandan yeni radikaller üretilirken, diğer taraftan serbest radikallerin sayısı korunmaktadır. Son basamakta ise normal şartlarda radikal yapının bozulması beklenir. Fizyolojik koşullarda, canlı organizmada serbest radikaller kontrollü bir şekilde fizyolojik olaylar sırasında meydana gelir ve fagositoz, trombosit 35 aktivitesi, mikrozomal elektron transport zinciri, önemli biyomoleküllerin sentez veya yıkımı (araşidonik asit metabolizmasında, adrenokortikal hormonların sentezinde, melaninle ilgili fonksiyonları, biyomoleküllerin otooksidasyonu ve bazı enzim fonksiyonları), üreme ve embriyo gelişimi gibi fizyolojik rolleri üstlendiği bilinmektedir [77, 79-81]. Şekil 2.1. Reaktif Oksijen Türevlerinin Oluşumu ve Organizmanın buna Oksidan Cevabı [82]. Bu cevapta, organizmanın endojen antioksidan enzimleri olan, süperoksit dismutaz (SOD), katalaz (CAT), glutatyon peroksidaz (GSH-Px) ve glutatyon redüktaz (GR) etkin rol oynamaktadır. Fizyolojik koşullarda oluşan serbest radikal reaksiyonlarının organizmanın antioksidan kapasitesini aşmasıyla veya bazı ajanlar ya da fiziki etkiler (iyonize radyasyon, ultraviyole, bazı plastik implantlar) sonucunda, kontrol dışına çıkmış, anormal serbest radikal reaksiyonları gelişebilir (Şekil 2.2). 36 2.4.2.1. Lipid Peroksidasyonu Lipid peroksidasyonu, membran fosfolipidlerinin yağ asiti yan zincirlerini ilgilendiren, biyolojik hasarla karakterize radikal bir reaksiyondur. Hidrojen peroksit ya da başka bir radikalden türeyen diğer bir radikal, oksijen varlığında bir lipid çift bağına ulaşabilirse, kararsız lipid peroksitleri ortaya çıkar ve bir dizi zincir reaksiyonu başlar. Lipidlerin otooksidasyonu, fizyolojik şartlarda son derece yavaş bir olayken, patolojik durumlarda veya metal iyonlarının varlığında bu olay çok hızlanabilir. Tüm bu reaksiyonlar organizmanın savunma sistemlerinin kontrolünden çıkarsa, çevrelerindeki moleküllerin de hasar görmelerine neden olur. Lipid peroksidasyonu reaksiyonları sonucunda ortaya çıkan lipid hidroperoksitler, aldehidler (Ör. MDA) gibi yüksek derecede toksik ürünler oluşturabilirler. Malonildialdehid (MDA), amino asit ve protein oksidasyonu ile çeşitli çapraz bağlanmalar yoluyla zararlı etkilere yol açarak, doğrudan peroksidatif etkiye maruz kalmayan lipid yapısında olmayan dokuların da hasar görmesine neden olabilmektedir [78]. 2.4.2.2. Hücre Membranı ve Organellerinin Serbest Radikal Hasarı Lipid peroksidasyonu tarafından başlatılan hasarın esas hedefi biyolojik membranlar ve hücre içi organellerdir. Çoklu doymamış yağ asidi (poly unsaturated fatty acids –PUFA) içeriği plazma membranına göre daha fazla olması nedeniyle, mitokondriyal ve mikrozomal membranlar peroksidasyona daha hassastırlar. 37 2.4.2.3. Protein ve Enzimlerin Serbest Radikal Hasarı Proteinlerin membran bileşimine giren önemli yapı taşları olmasından dolayı, bu değişiklikler, serbest radikallerin etkisi sonucu gelişen membran hasarında önemli rol oynarlar. 2.4.2.4.Nükleik Asitler ve Bileşenlerinin Serbest Radikal Hasarı Hidroksil radikali başta olmak üzere serbest radikaller, nükleik asit bazlarının modifikasyonu ve DNA şerit kırılmasına neden olurlar, DNA polimerazı inhibe ederler. Karsinogenez, hücre yaşlanması ve hücre ölümüne kadar giden süreçleri başlatıp ilerletebilirler. Nükleik asitlerin tüm elemanları serbest radikal hasarına açıktır ve oluşan hasar özel tamir mekanizmaları ile onarılabildiği gibi, kalıcı da olabilmektedir. 2.4.2.5. Karbonhidrat Oksidasyonu Diyabet, kanser ve sigara içimi ile birlikte olan kronik hastalıkların patogenezinde monosakkaridlerin oksidasyonu ile meydana gelen oksialdehitlerin rol oynadığı düşünülmektedir [83]. 2.5. ANTİOKSİDAN SAVUNMA Canlı organizmalarda, oksidatif harabiyetin önlenmesi, sınırlanması ya da kısmen düzeltilmesini sağlayan koruyucu mekanizmalar vardır. Oksidan ürünlere karşı korunma, oluşan radikallerin detoksifikasyonu, radikal reaksiyonların sona erdirilmesi ve radikal oluşumunun sınırlandırılması şeklinde gelişir. 38 Şekil 2.2. Reaktif oksijen türevlerinin oluşturduğu hücre hasarı [82]. Düşük konsantrasyonlarda, okside olabilecek bir substratın oksidasyonunu geciktiren veya inhibe eden maddeler antioksidan, olarak tanımlanmaktadır. Antioksidanlar, biyomoleküllerde bozulmaya neden olan ROT’ları ortadan kaldırabilen, oksidatif hasarın yayılmasını engelleyen maddelerdir. Farklı organ, hücre ve hücre organellerinde farklı ROT’lara karşı, farklı antioksidanlar bulunmaktadır [79]. 2.5.1. Hücreiçi Enzimatik Antioksidan Savunma: Hücreiçi ROT’ların başlıca detoksifikasyonu enzimatik yollarla sağlanır. Enzimatik antioksidanlar aktif merkezlerinde bakır, çinko, mangan, demir, selenyum gibi metaller içerirler. Süperoksit dismutaz (SOD), katalaz (CAT) ve glutatyon peroksidaz (GSH-Px) gibi süperoksit ve hidrojen peroksiti 39 temizleyen spesifik enzimler antioksidan savunmanın önemli bölümünü oluşturur [79]. SOD, süperoksitin hidrojen peroksite dismutasyonunu katalize eden bir metalloenzimdir: 2 O2- + 2H+ ⎯SOD → H2O2 + O2 İnsan vücudunda 3 farklı SOD enzimi vardır. Sitozolik SOD (SOD1) bir bakır-çinko enzimidir. Diğer bir CuZn-SOD (SOD3) vasküler endotele bağlıdır ve ekstraselüler SOD olarak adlandırılır. Mitokondriyal SOD (SOD2) ise mangan (Mn) içerir. Böylece süperoksitin potansiyel substratlarla reaksiyona girmesi önlenir ve daha toksik ürünlerin (OH gibi) oluşması önlenmiş olur [77, 79]. Ayrı ve nonenzimatik bir antioksidan olarak seruloplazmin de süperoksit radikali ile reaksiyona girebilir, ancak aktivitesi SOD’a göre çok düşüktür [79]. CAT, konsantrasyonu değişmekle birlikte bütün hücre tiplerinde bulunan bir enzimdir. Sitozolde ve daha çok peroksizomlarda lokalizedir. Ekstraselüler mesafede ya çok az bulunur ya da hiç bulunmaz. CAT, kendisi radikal olmasa da en reaktif ROT olarak kabul edilen hidroksil radikalinin öncüsü olan, hidrojen peroksit moleküllerinin suya redüksiyonunu sağladığı için önemlidir. Hidrojen peroksiti, düşük oluşum hızlarında peroksidatik reaksiyonla, yüksek oluşum hızlarında ise katalitik reaksiyonla suya dönüştürerek temizler: Peroksidasyon: H2O2 + AH2 ⎯ katalaz → 2H2O + A Kataliz: H2O2 + H2O2 ⎯ katalaz → 2H2O + O2 GSH-Px de H2O2’yi katalitik reaksiyonla redükte eder. Bu reaksiyonda redükte glutatyon (GSH) işleme girerek okside glutatyona (glutatyon disülfit; GSSG) dönüşür: 2H2O2 + 2GSH ⎯ GSH-Px → 2H2O + GSSG [79, 81] 40 Antioksidan etkinliğinin devam edebilmesi için okside glutatyonun tekrar indirgenmesi gereklidir; bu işlem NADPH bağımlı bir enzim olan glutatyon redüktaz (GR) tarafından yerine getirilir: GSSG + NADPH + H+ ⎯ GR → 2GSH + NADP+ NADPH’ın rejenerasyonu için ise glukoz-6-fosfat dehidrojenaz (G-6PDH) enzimi gereklidir. Sonuçta hücre içi savunmada GSH, GR ve G-6PDH’nin de rolü vardır [78, 84-85]. Gerek CAT gerekse GSH-Px, hücre içi H2O2 konsantrasyonunun regülasyonunda görev alır. Düşük düzeylerde GSH-Px daha etkin iken, H2O2 oluşumunun arttığı durumlarda daha çok CAT görev alır. CAT en çok peroksizomlarda, GSH-Px ise sitozol ve mitokondride yer alır. Yeterli GSH seviyesinde, her iki enzimin de H2O2’yi redükte etme hızları hemen hemen aynıdır [79]. Bunlara ek olarak, GSH’ya dayalı antioksidan savunma yalnızca H2O2 detoksifikasyonu ile sınırlı değildir; CAT’dan farklı olarak, GSH-Px hidroperoksitleri de redükte edebilir [84]. Organizmada hidroksil radikali miktarını kontrol eden enzim sistemleri ise yoktur. Kuvvetli okside edici potansiyeli nedeniyle hiç bir enzim kendisi oksidatif harabiyete uğramadan bu ürünü detoksifiye edemez. Bunun için hücrelerde temel strateji SOD, CAT ve GSH-Px aracılığıyla süperoksit anyonu ve H2O2’yi detoksifiye ederek daha toksik ürünlerin oluşumunu önceden önlemektir. Ekstraselüler alanda ise gerek süperoksit anyonu gerekse H2O2 çok sıkı kontrol altında değildir. Plazma ekstrasellüler SOD aktivitesi çok düşüktür ve buradaki H2O2’nin dolaşımdaki eritrositler tarafından metabolize edildiği kabul edilmektedir [77, 79]. Organizmadaki antioksidan enzimler ve rol aldıkları mekanizmalar şekil 2.3 de özetlenmiştir. 41 Şekil 2.3. Oluşan Çeşitli Reaktif Ürünlere Karşı Enzimatik Savunma [82]. 2.5.2. Nonenzimatik Antioksidanlar Doğal enzim sistemlerinin (SOD, CAT, GSH-Px, GR, sitokrom c oksidaz, hidroperoksidaz) dışında antioksidan etki gösteren başka maddeler de vardır. Bunlar bazı makromoleküller (seruloplazmin, transferrin, hemoglobin, miyoglobin, ferritin), mikromoleküller (vitamin E, C ve A, ürik asit, glutatyon, N-asetil sistein, metyonin, kaptopril, ubiquinon, glukoz, bilurubin), bazı ilaçlar (rekombinant h-SOD, 21-aminosteroidler, demir şelatörleri, interlökin-1, ksantin oksidaz inhibitörleri, mannitol, barbitüratlar), karboksimetilsistein, trakeobronşial mukus, albumin ve taurin olarak sayılabilir. Daha çok hücre içinde etkili olan enzimatik antioksidanlara karşılık, nonenzimatik antioksidanlar ekstraselüler mesafede de etkinlik gösterir. Bu antioksidanları, temel olarak yağda eriyenler ve suda eriyenler olarak ikiye ayırabiliriz. Yağda eriyen antioksidanlar membranlarda ve lipoproteinlerde, suda eriyenler ise daha çok ekstraselüler mesafe olmak üzere enzimatik antioksidanlar ile birlikte intraselüler mesafede de etkilidir [79, 86]. 42 Antioksidan savunmanın önemli bir kesimini lipid peroksidasyon zincir reaksiyonlarını kıran antioksidanlar oluşturur. Bunlar, peroksi (ROO.) ve alkoksi (RO.) radikaller ile reaksiyona girerek lipid peroksidasyon reaksiyonlarının ilerlemesini önlerler. Bu savunma başlıca E vitamini (αtokoferol) tarafından sağlanır. Alfa tokoferol insanda en fazla bulunan yağda çözünen antioksidandır ve membranlar ile lipoproteinlerdeki zincir kırıcı antioksidan kapasitenin büyük bir kısmını meydana getirir. E vitamini, peroksi radikali ile reaksiyona girerek onu radikal olmayan bir bileşik haline dönüştürürken, kendisi radikal haline gelir. Reaksiyon bir peroksi radikali ile tokoferolün fenolik hidroksil grubunun, organik bir hidroperoksit ve tokoferil radikali meydana getirmesi ile sonuçlanır: ROO + Vit E-H → ROOH + Vit E. Tokoferil stabil ve reaktivitesi az olan bir radikaldir; askorbat (C vitamini) veya tiyoller ile reaksiyona girerek elektronunu onlara transfer eder ve kendisi redükte olur: Vit E + Vit C → Vit E + Vit C. Siklus, oluşan Vit C’nin (semiaskorbat radikali) semiaskorbat redüktaz tarafından indirgenmesi ile tamamlanır. Böylece, membranlarda zincirleme radikal oluşumuna neden olan peroksil radikali, interselüler mesafenin sıvı ortamına iletilmiş ve membrandan uzaklaştırılmış olur [86]. Antioksidan savunmanın diğer bir kesimini de Haber-Weiss reaksiyonlarını katalize eden metalleri bağlayan bileşikler oluşturur: Bunlar başlıca seruloplazmin, transferrin, haptoglobin ve albumin olup ekstraselüler antioksidanlar olarak da adlandırılırlar. İnsanda plazma antioksidan aktivitesinin büyük kısmı seruloplazmine bağlıdır. Seruloplazmin, demirin transferrine bağlanmasını kolaylaştırarak ve ekstraselüler SOD gibi davranarak etki gösterir. Transferrin demiri, haptoglobin demir gibi davranabilen serbest hemoglobini, albumin ise bakırı 43 bağlayarak antioksidan fonksiyon yapar. Bunlara ilave olarak, beta-karoten de, özellikle düşük pO2’de fonksiyon gösteren, lipofilik bir antioksidandır [79, 84, 86]. Gerek ROT’lar, gerekse antioksidanlar, hem klinik biyokimyada rutin olarak kullanılamayacak, hem de klinik temelli antioksidan çalışmalarının yapılmasını engelleyecek kadar nonspesifiktirler. Ancak hastalıkların büyük bir kısmının patogenezi ve tedavisindeki önemleri giderek artmaktadır. Sonuçta oksijen radikallerinin kantitatif olarak çalışılmasının zor olması, çeşitli antioksidanların aktivite ve konsantrasyon ölçümleri yoluyla oksidanlarla ilgili dolaylı olarak yorum yapılmasına neden olmaktadır [87]. 44 3 - GEREÇ VE YÖNTEM Bu tez Gülhane Askeri Tıp Akademisi Komutanlığı Hayvan Deneyleri Etik Kurulunun 06 şubat 2009 gün ve 09/4K nolu kararı ile izin alındıktan sonra ve Helsinki bildirisindeki hayvan çalışması etik kurallarına uyularak GATA Araştırma ve Geliştirme Başkanlığı ve Fizyoloji BD Başkanlığı bünyesindeki Laboratuvarlarda 16 Haziran-13 Temmuz 2009 tarihleri arasında gerçekleştirildi. Bu çalışmada, bakteriyel inokülasyon metodu ile sepsis oluşturulan ratlarda, güncel sepsis tedavisinin ana parçasını oluşturan antibiyotik tedavisine ilave olarak uygulanan HBO ve NBO tedavilerinin, sepsiste anahtar rol oynayan karaciğerin hasarı üzerindeki geç dönemdeki etkileri değerlendirilmiştir. Oksidatif stres başlıca ROT ile meydana gelmekle birlikte, diğer yandan reaktif nitrojen türevleri (RNT) ile de nitrozatif stres gelişebilmektedir. Bunların direkt olarak ölçümü son derece zordur. Bundan dolayı vücutta oluşan oksidatif ve nitrozatif stresin ölçütü olarak yaygın bir şekilde kullanılan yöntemler, çeşitli aldehid türevi ürünler veya savunma enzimlerinin tayini şeklinde olup, bunların tamamı aslında indirekt yöntemlerdir [87]. ROT ve RNT ile oluşan patolojik süreçlerden olan protein karbonilasyonu ve lipid peroksidasyonu zincir reaksiyonlarının çeşitli ara ve son ürünlerinin doku düzeylerinin belirlenmesi belki de bu amaçla kullanılagelen yöntemler arasında en yaygın olanıdır. Bunlar içinde ise sıklıkla kullanılanları karbonile protein (PCO) ve MDA tayinleridir [88-89]. Antioksidan SOD ve GSH-Px enzimlerin doku düzeylerinin belirlenmesi yoluyla da organizmada oluşan biyokimyasal stres reaksiyonlarına karşı endojen antioksidan savunma sistemlerinin durumu ile HBO ve NBO tedavilerinin bunlara katkısı ortaya konmaya çalışılmıştır [90-91]. 45 3.1. DENEY HAYVANLARI Bu deneysel çalışmada GATA Araştırma ve Geliştirme Başkanlığı hayvan laboratuvarından temin edilen, ağırlıkları 300-400 gram arasında değişen sağlıklı, genç erişkin 40 adet erkek wistar cinsi ratlar kullanıldı. Hayvanlar çalışma süresince aynı laboratuvar koşullarında tutuldu, ticari rat yemi ve normal musluk suyuyla beslendi. 3.2. DENEY GRUPLARI Ratlar ‘basit rastgele örnekleme’ yöntemiyle dört gruba ayrıldı. 1. Sham grubu (Sham) (n=10): Bu gruptaki hayvanlara, sepsis indüksiyonu için verilen E. coli ile aynı hacimde intraperitoneal serum fizyolojik uygulanmıştır. Bu grupta yapılan ölçümler ile bakılacak parametrelerin fizyolojik normal değerlerin saptanması hedeflenmiştir 2. Kontrol grubu (SEPSİS+CEFEPİM) (n=10): Bu grubtaki hayvanlara, sepsis indüksiyonu sonrası günde iki kez 50 mg/kg cefepim IP yolla verilmesi dışında ilave bir tedavi uygulanmamıştır [92]. 3. NBO grubu (SEPSİS+CEFEPİM+NBO) (n=10): Bu gruptakli hayvanlara, sepsis indüksiyonunu mütakiben günde iki kez 50 mg/kg cefepim IP yolla verilmiş ve NBO (5lt/dk O2, 2x90 dk/ gün, 5 gün) tedavisi uygulanmıştır [16]. 4. HBO grubu (SEPSİS+CEFEPİM+HBO) (n=10): Bu gruptaki hayvanlara, sepsis indüksiyonunu müteakiben günde iki kez 50 mg/kg cefepim IP yolla verilmiş ve HBO (2.4 ATA’da, 2x90 dk/gün, 5 gün) tedavisi uygulanmıştır. 46 3.3. SEPSİS İNDÜKSİYONU Sepsis indüksiyonu için kontrollü inokülasyon modeli tercih edilmiştir. Bu modelde en sık kullanılan bakteri E. coli’dir [93]. Bu nedenle standart ATCC 25922 E. coli suşu kullanılmıştır. Sepsis oluşturulan gruplardaki (Kontrol, NBO, HBO) ratlara 2,1 x 109 CFU canlı E. Coli içeren 1 ml SF IP yolla verilmiştir [15] (Şekil 3.1). Biyolojik ritmin olası etkilerinden korunmak için, sepsis oluşturulacak bütün gruplarda E. coli inokülasyonuna aynı saatte başlanmıştır (08:00). Sepsis tablosu, rektal ısı artışı, solunum sayısı ve nabız takipleri ile doğrulanmıştır. Şekil 3.1. Ratlara intraperitoneal enjeksiyon uygulaması. 3.4. ANTİBİYOTİK UYGULAMASI Sepsis oluşturulan gruplardaki (Kontrol, NBO, HBO) hayvanlara, sepsis indüksiyonu sonrasında başlanarak günde iki kez 50 mg/kg sefepim (Unisef, Mustafa Nevzat) IP yolla verildi [92]. 47 3.5. HİPERBARİK OKSİJEN TEDAVİSİNİN UYGULANMASI Hiperbarik oksijen uygulaması için, T.S.K. 800 Ana Depo ve Fabrika Komutanlığında (Etimesgut/Ankara) özel olarak tasarlanıp imal edilen, çapı 40 cm, uzunluğu 60 cm olan, krom, nikel ve çelik karışımı bir gövdeye sahip ve 10 ATA basınca dayanıklılığı test edilmiş silindirik biçimdeki yüksek basınç odası (‘hyperbaric chamber’) kullanıldı (Şekil 3.2). Bu chamber’in içerisindeki basınç, üzerindeki manometre ile devamlı kontrol edilerek gerektiğinde gazın fazlası otomatik olarak tahliye edilebilmektedir. Chamber’a GATA Biyomedikal Klinik Mühendislik Merkezi - Tıbbi Gazlar Bölümünden temin edilen ve yüksek basınç altında saf oksijen içeren tüpler yoluyla 1,5–2 lt/dk akım hızında [94-95] oksijen girişi sağlandı. Şekil 3.2. Hiperbarik Oksijen Cihazı Hayvanlar chamber’e yerleştirildikten sonra ortam öncelikle hızla verilen oksijen ile yıkandı (‘flushing’). Bu arada, hayvanların ventilasyonu 48 sonucunda ortamda birikebilecek CO2’yi tutması için, chamber içine – değişebilir oranlarda sodyum hidroksit, kalsiyum–2–oksit ve kalsiyum hidroksitin karışımından oluşan - ‘soda lime’ olarak adlandırılan absorbe edici granüller konuldu [96]. Daha sonra chamber kapatılarak iç basıncın uygulanacak değere kadar dakikada 1 atm basıncı geçmeyecek hızda yükselmesi sağlandı. 3 ATA’lık uygulama basıncına ulaşıldığı anda chamber’e giren ve çıkan oksijen miktarı sabitlenerek süre tutulmaya başlandı. Toplam seans süresi 90 dk olarak belirlendi ve seans bitiminde, hayvanları ağrılı barotravmalardan korumak ve hesaplanamayan ilave stres faktörlerinden kaçınmak amacıyla, yine yavaş bir hızla ortam basıncına geri dönüldü. HBO uygulaması 08.00–09.30 ve 20.00–21.30 saatleri arasında gerçekleştirildi. 3.6. NORMOBARİK OKSİJEN TEDAVİSİNİN UYGULANMASI Normobarik oksijen uygulaması için, T.S.K. 800 Ana Depo ve Fabrika Komutanlığında (Etimesgut/Ankara) özel olarak tasarlanıp imal edilen, çapı 40 cm, uzunluğu 60 cm olan, krom, nikel ve çelik karışımı bir gövdeye sahip ve 10 ATA basınca dayanıklılığı test edilmiş silindirik biçimdeki yüksek basınç odası (‘hyperbaric chamber’) kullanıldı (Şekil 3.2). Chamber’a GATA Biyomedikal Klinik Mühendislik Merkezi - Tıbbi Gazlar Bölümünden temin edilen ve yüksek basınç altında saf oksijen içeren tüpler yoluyla 5 lt/dk akım hızında [94-95] oksijen girişi sağlandı. Hayvanlar chamber’e yerleştirildikten sonra ortam öncelikle hızla verilen oksijen ile yıkandı (‘flushing’). Bu arada, hayvanların ventilasyonu sonucunda ortamda birikebilecek CO2’yi tutması için, chamber içine değişebilir oranlarda sodyum hidroksit, kalsiyum–2–oksit ve kalsiyum hidroksitin karışımından oluşan - ‘soda lime’ olarak adlandırılan absorbe edici granüller konuldu [96]. Chamber basıncı ise otomatik olarak 1 ATA’ya ayarlandı. Toplam seans süresi 90 dk olarak belirlendi. NBO uygulaması 09.45–11.15 ve 21.45–23.15 saatleri arasında gerçekleştirildi. 49 3.7. KARACİĞER DOKUSUNUN HAZIRLANMASI Önce hayvanlar bir kez daha ketamin-ksilazin anestezisine alındı [97]. Anestezi gerçekleştikten sonra, ratlar küçük deney hayvanları için özel olarak yapılmış bir disseksiyon masasına sırtüstü yatırılarak dört ayağından sabitlendi. Bundan sonra karın boşlukları açılarak karaciğerin ortaya çıkması sağlandı (şekil 3.3). Enzimatik çalışmalarda doku içerisinde kalabilecek fazla miktardaki kan nedeniyle homojenatta oluşabilen hemolizi önlemek için, karaciğerin mümkün olduğu nisbette kansız olarak çıkarılması gerekiyordu. Bundan dolayı bir yandan vena cava inferiordan bir enjektör yardımıyla kan alınırken, bir yandan da sağ ventriküle ince uçlu bir iğne ile +4°C’de izotonik NaCl (serum fizolojik; SF) verildi [98]. Bu şekilde hem karaciğer içerisinde dolaşımda olan kanın SF ile yer değiştirmesi sağlandı, hem de soğutma yoluyla karaciğer metabolizması yavaşlatılmış oldu. Karaciğerin renginde gözle görülebilen solma ile beraber kan-SF değişiminin yeterli düzeyde olduğu kanısına varılarak karaciğer çıkarıldı. Çıkarılan karaciğer, yine soğuk SF içerisinde yıkanarak dışındaki kan artıklarından arındırıldı ve önceden etiketlenmiş kapaklı plastik ependorf tüpleri içerisine konularak, işlem sonunda -80°C’de saklanmak üzere, sıvı nitrojen (azot) tankına konuldu. 3.8. BİYOKİMYASAL ANALİZLER Oluşan lipid peroksidasyonu düzeyinin tayini için MDA, antioksidan cevabın derecesinin belirlenmesi için ise süperoksit radikaline karşı oluşan SOD ve hidrojen peroksit ile savaşan GSH-Px’in karaciğer dokusu düzeylerinin ölçümü yapıldı. Bu tetkiklere ait sonuçları sayısal olarak ifade edebilmek için, ek olarak doku protein düzeyleri de hesaplandı. MPO aktivitesi ile nötrofil migrasyonu ve bunun karaciğer hasarına katkısının değerlendirilmesi planlandı. 50 Şekil 3.3. Rat karın boşluğu 3.8.1. Karaciğer Dokusunun Homojenizasyonu Tüm bu tetkiklerden önce, eldeki karaciğer dokularının analizler için hazır hale getirilmesi gerektiğinden, dokular derin dondurucudan çıkarılarak çözünmesi sağlandıktan sonra ‘fosfat tampon’ ile 1/9 hacim oranında karıştırılarak Retsch marka “Mixer Mill MM 400” model homojenizatör ile homojenize edildi ve bir kısmı MDA, MPO bakılması için ayrıldı. GSH-Px ve SOD analizleri sırasıyla süpernatan ve ekstrede bakıldığından, elde edilen homojenatların diğer kısmı, 700 devirde 10 dk santrifüj edilerek süpernatanlar, süpernatanlarında kloroform-etanol (3:5oranında) karışımı ile santrifüjlerinden ekstreler elde edildi. Fosfat tampon (50 mM); distile sudaki 6,8 g/l oranındaki KH2PO4 çözeltisi üzerine pH 7,4 olana kadar yine distile suda 7,1 g/l oranında çözünmüş Na2HPO4 ilave edilerek hazırlandı. 51 3.8.2. Protein Ölçümü Lowry’nin tarif ettiği yöntem kullanılmıştır [99]. Protein ölçümleri; MDA ve PCO için homojenatta, GSH-Px için süpernatanda, SOD için ise ekstrede ayrı ayrı yapıldı. Protein ölçümü için; kimyasal bileşikler olarak CuSO4, Na3Sitrat, Na2CO3, NaOH ve Phenol-Folin-Ciocalteu reaktifleri kullanıldı. Bunlar aşağıdaki oranlarda hazırlanarak A, B, C ve D reaktifleri hazırlandı. A reaktifi: 0,5 g CuSO4.5H2O ve 1 g Na3Sitrat (susuz) 100 ml distile suda çözüldü. B reaktifi: 20 g Na2CO3 ve 4 g NaOH, 1 l distile suda çözüldü. C reaktifi: 50 ml B çözeltisine, 1 ml A çözeltisi ilave edildi. A ve B reaktifleri hazırlandıktan sonra numune sayısına göre C reaktifi hemen taze olarak hazırlanıp bekletilmeden kullanıldı. D reaktifi: Phenol-Folin-Ciocalteu reaktifi Her numuneden 10 μl, distile sudan 490 μl, C reaktifinden 2500 μl alınarak 10 ml’lik cam tüplere alındı ve 10 dk beklendi. Kör tüpüne ise numune konulmayıp distile su ilave edildi. Daha sonra bunların üzerine 250 μl D reaktifi eklenerek vortekslendi. 20-30 dk oda ısısında inkübe edilerek her bir tüpten 300 μl Elisa kuyucuklarına pipetlenerek 700 nm’de köre karşı okundu. 3.8.3. Malondialdehid Ölçümü (MDA) MDA ölçümü Okhawa ve arkadaşlarının tarif ettiği yöntemle yapıldı [100]. Bu amaçla için %10’luk triklorasetik asit (TCA) ve %0,675’lik tiobarbitürik asit (TBA) kullanıldı. Vidalı kapaklı 10 ml’lik deney tüplerine 2,5 ml %10’luk TCA ve bunun üzerine 0,5 ml numune (homojenat) ilâve edilerek 3–5 sn vortekslendi. Tüpün ağzı kapatılarak 90°C’de 15 dakika inkübe edildi. 52 Soğuk çeşme suyu ile soğutuldu. 3000 devirde 20 dk santrifüj edildi. Bu şekilde elde edilen süpernatanlardan 2 ml alınarak üzerlerine 1 ml %0,675’lik TBA eklendi ve tekrar vortekslendi. Tüplerin ağzı kapatılarak yeniden 90°C’de 15 dk inkübe edildi. Soğuk çeşme suyu ile soğutulduktan sonra 532 nm’de köre karşı okundu. Hesaplama, TBA-MDA kompleksinin ekstinksiyon katsayısından (1,56x105 cm-1M-1) yararlanılarak mmol/g-prot cinsinden MDA değerleri hesaplandı. 3.8.4. Süperoksit Dismutaz Ölçümü (SOD) SOD aktivitesi Sun ve arkadaşları tarafından tarif edilen yöntemle ölçüldü [101]. Bu yöntem spektrofotometride 560 nm’de mavi renkli formazon oluşumunun belirlenmesi ilkesine dayanır. Bunun için ilk önce 0,3 mmol/L ksantin, 0,6 mmol/l EDTA, 150 μmol/l NBT, 400 mmol/l Na2CO3 ve 1g/L bovine serum albumin (BSA) karışımından oluşan ölçüm reaktifi hazırlandı ve koyu renkli cam bir şişe içinde kullanılmak üzere depolandı. Daha sonra ise, 0,8 mmol/l CuCl2, 2M (NH4)2SO4 (Amonyum sülfat) ve amonyum sülfat içinde 167 U/l ksantin oksidaz (XO) hazırlandı. Son olarak, homojenatlar 3220 devirde +6°C’de 30 dk santrifüj edilerek süpernatanları elde edildi. Süpernatanlar ile kloroform-etanol solusyonu cam tüplerde 1:1 oranında karıştırılarak vortekslendi ve 3220 devirde +4°C’de 40 dk santrifüj edilerek, elde edilen etanol fazından cam tüpler içine 50’şer μl konuldu. Bunların üzerine yine 1425 μl ölçüm reaktifi ve 25 μl 167 U/l XO ilave edildi. Kör tüpüne ise etanol fazı yerine distile su ilave edilerek, 25ºC'de 20 dk inkübe edildi. İnkübasyon sonunda her bir numuneden 200 μl Elisa kuyucuklarına alınarak üzerlerine 100 μl 0,08 mM/l CuCl2 eklenerek reaksiyon durduruldu ve distile suya karşı absorbans sıfırlanarak körden başlanarak numuneler 560 nm’de okundu. Bulunan absorbans değerleri aşağıdaki formüle konarak SOD aktivitesi hesaplandı: [((K-N) / N) x D x 20] / E = U/g-protein 53 Bu formülde: K, körün absorbansı; N, numune absorbansı; D, dilüsyon miktarı; E, ekstrakt protein miktarı (g/ml) 3.8.5. Glutatyon Peroksidaz Ölçümü (GSH-Px) GSH-Px aktivitesi düzeylerinin ölçümü Paglia’nın tarif ettiği yöntemle yapıldı [102]. Yöntemde, GSH-Px tamponu (pH 7, 50 mM fosfat tamponu + 5 mM EDTA’lı), 3,2 M (NH4)2SO4 (Amonyum Sülfat), 150 mM redükte glutatyon (GSH), 8 mM redükte NADPH, 1 M NaN3 (Sodyum Azid), GSHRedüktaz enzimi ve 2 mM H2O2 kullanıldı. Her numune için, cam tüplere aşağıdaki miktarlarda olmak üzere, dokulardan elde edilen süpernatan ve kimyasal madde konularak 30 dk oda ısısında inkübe edildi: KULLANILAN REAKTİF MİKTAR (mL) Fosfat tamponu (pH 7, 50 mM) 5 mM EDTA’lı 2,65 150 mM redükte GSH 0,10 8 mM NADPH 0,10 GSH-Redüktaz 0,01 1 M NaN3 0,01 Numune (süpernatan) 0,02 30 dakika oda ısısında inkübasyon sonunda her bir cam tüpteki numuneler 290 μl olmak üzere Elisa kuyucuklarına pipetlenerek, üzerlerine 10 μl 2 mM H2O2 ilave edildi ve dalga boyu 340 nm’ye ayarlanmış Elisa okuyucuda numunelerin absorbans değerleri 5 dk boyunca kaydedildi. Lineer aktivite azalışının olduğu absorbans aralığının 1 dk’lık süresi esas alınarak hesap yapıldı. Değerler U/g-protein olarak ifade edildi. 54 3.8.6. Myeloperoksidaz Aktivtesi Ölçümü (MPO) MPO ölçümü için gereken ekstraktlar şu şekilde elde edildi; Homojenatlar 3220 rpm’de 30 dakika +6°C soğutmalı santrifüjde santrifüj edilerek testin çalışılacağı süpernatant elde edildi. MPO ölçümü için örnekler USCNLIFE ELİZA Kiti (USCN LIFE SCIENCE INC. WUHAN) ile çalışıldı. Sonuçlar U/L olarak belirlendi. 3.9. HİSTOPATOLOJİK İNCELEME Karaciğer dokuları 24 saat boyunca %10’luk formalin tamponda sabitlendi ve sonra parafin mumuna gömüldü. 4 µm kalınlığında alınan kesitler hematoksilin-eozin ile boyandı. Patoloji uzmanı, kör olarak belirlenen ölçeğe göre preparatları ışık mikroskobunda değerlendirdi. Alfa serbestlik derecesi %95 olup, p<0.05 değeri istatistiksel olarak anlamlı kabul edildi Karaciğer doku hasarını derecelendirmek için, Müftüoğlu ve arkadaşılarının [103] oluşturduğu “Hepatik Injury Severity Scoring” ile Şener ve arkadaşlarının [104] doku hasarını belirlemek için kullandıkları kriterlerden faydalanılarak bir ölçek oluşturuldu. Yağlı değişiklik (mikroveziküler, makroveziküler), balonlaşma, enflamasyon (portal, parankimal, interface), kolestaz, konjesyon/sinüzoidal dilatasyon, nekroz ve fibrozis (portal, periportal, periveziküler, perisellüler) bulgularını içeren ölçeğe göre, her bulgu için 0-3 arasında (0:yok, 1:hafif/fokal, 2:orta, 3:şiddetli/yaygın) derecelendirme yapılarak, bütün bulguların değerleri toplandı. 3.10. İSTATİSTİKSEL ANALİZ Tüm istatistiksel analizler GATA Fizyoloji Anabilim Dalı’nda, SPSS11.0 (SPSSFW, SPSS Inc., Chicago, IL., USA) istatistik paket programı ile yapılmıştır. Önce ‘’Kruskal wallis’’ testi ile analiz yapıldıktan sonra, anlamlı 55 sonuç veren grupların ikişerli olarak karşılaştırılmalarında denek sayısına uygun olarak nonparametrik bir yöntem olan “Mann Whitney-U” testi kullanıldı. Sonuçta p<0.05 bulunduğunda sonuç anlamlı olarak kabul edildi. 56 4. BULGULAR Çalışmada elde edilen rakamsal veriler ayrıntılı olarak tablo 4.1 üzerinde bölüm sonunda gösterilmiştir. Bunun yanında daha kolay anlaşılır bir sunum için tüm bulgular çalışılmış parametrelere göre grafiklerle anlatılmıştır (Şekil 4.1, 4.2, 4.3, 4.4). 4.1. KARACİĞER DOKUSU OKSİDATİF STRES DÜZEYİ Kontrol (0,43±0,11 mmol/gprot) ve NBO (0,39±0,09 mmol/gprot) gruplarında MDA düzeyi, sham grubuna (0,29±0,04 mmol/gprot) göre yüksek olarak tespit edildi (p<0.05). HBO grubunda (0,33±0,05 mmol/gprot) MDA düzeyleri, kontrol grubuna göre düşük (p<0.05) ve sham grubundan farksız bulunurken, kontrol ve NBO grupları arasında fark gözlenmedi. 4.2. ANTİOKSİDAN ENZİM AKTİVİTELERİ Kontrol (61,39±14,88 U/gprot) ve NBO (70,48±11,48 U/gprot) gruplarındaki SOD düzeyleri, sham grubuna (39,59±7,82 U/gprot) göre yüksek olarak bulundu (p<0.05). HBO grubunda (47,88±9,34 U/gprot) SOD düzeyleri, kontrol ve NBO gruplarına göre anlamlı olarak düşük tespit edildi (p<0.05). Kontrol (73,50±16,79 U/gprot) ve HBO (68,79±10,94 U/gprot) gruplarındaki GSH-Px düzeyleri, sham grubuna (55,03±8,07 U/gprot) göre yüksek olarak bulundu (p<0.05). NBO (64,64±12,62 U/gprot) grubunda GSHPx düzeyleri yükselmiş gibi görünse de sham grubu ile aralarında anlamlı fark yoktu. HBO ve NBO gruplarındaki GSH-Px enzim aktiviteleri ise benzer düzeydeydi. 57 4.3. NÖTROFİL İNFİLTRASYONU Kontrol (13,30±2,77 U/L), HBO (12,53±2,54 U/L) ve NBO (14,65±2,42 U/L) gruplarında MPO düzeyleri, sham (6,55±1,94 U/L) grubuna göre belirgin olarak yüksek tespit edildi (p<0.05). HBO grubunda MPO düzeyleri kontrol grubuna göre azalmış görülse de istatistiksel anlama ulaşmamıştır. NBO grubunda MPO düzeyleri, kontrol grubuna göre yükselmiş gibi görünse de gruplar arasında fark tespit edilmezken, HBO grubunda MPO düzeyleri, NBO grubuna göre anlamlı olarak düşük bulundu (p<0.05). 4.4. HİSTOPATOLOJİK DEĞERLENDİRME Yukarıda belirtilen metoda göre yapılan histopatolojik değerlendirme sonuçları tablo 4.2.de özetlenmiştir. Sepsis oluşturulan gruplar arasında (kontrol, HBO, NBO), enflamasyon ve karaciğer hasarı yönünden istatistiksel olarak anlamlı fark saptanmadı. Histopatolojik inceleme ile ilgili örnek görüntüler şekil 4.5’de sunulmuştur. Tablo 4.1. Biyokimyasal sonuçlar (Ortanca±standart sapma) Gruplar Sham MDA SOD (mmol/gprotein) (U/gprotein) 0,29±0,04 39,59±7,82 Kontrol 0,43±0,11 a GSH-Px (U/gprotein) 55,03±8,07 MPO (U/L) 6,55±1,94 61,39±14,88 a 73,50±16,79 a 13,30±2,77 a HBO 0,33±0,05 b, d 47,88±9,34 b, d 68,79±10,94 c 12,53±2,54 c, d NBO 0,39±0,09 c 70,48±11,48 c 64,64±12,62 14,65±2,42 c a p<0.05, Sham grubuna göre Kontrol grubunda anlamlı artma b p<0.05, Kontrol grubuna göre HBO grubunda anlamlı azalma c p<0.05, Sham grubuna göre HBO ve NBO gruplarında anlamlı artma d p<0.05, NBO grubuna göre HBO grubunda anlamlı azalma 58 Tablo 4.2. Histopatolojik değerlendirme sonuçları Sham Kontrol HBO NBO (n=10) (n=10) (n=10) (n=10) Makroveziküler (skor) 0 0 0 0 Mikroveziküler (skor) 0 0 0 0 Balonlaşma (skor) 0 1 0 4 Balonlaşma 0 0(0-1) a 0 0(0-1) a Portal (skor) 0 8 7 6 Parankimal (skor) 0 1 3 4 İnterface (skor) 0 0 Yağlı değişiklik (ortanca (minimum-maksimum)) Enflamasyon Toplam enflamasyon 0 1(0-2) Kolestaz (skor) 0 0 Konjesyon/sinozoidal dilatasyon(skor) 0 1 0 a 1(0-2) 0 a 1(0-2) a (ortanca (minimum-maksimum)) Konjesyon/sinozoidal dilatasyon 0 0 2 a 0(0-1) 1 a 0(0-1) a 0 0(0-1) 0 0 0 0 Portal/periportal (skor) 0 0 0 0 .Perivenüler/perisellüler (skor) 0 0 0 0 (ortanca (minimum-maksimum)) Nekroz (skor) Fibrozis Toplam hasar 0 1(0-4) a 1(0-2) a 1(1-3) a (ortanca (minimum-maksimum)) a p<0.05, Sham grubuna göre Kontrol, HBO ve NBO gruplarında anlamlı artma 59 Şekil 4.1. Tüm gruplarda MDA düzeylerinin karşılaştırılması Şekil 4.2. Tüm gruplarda SOD düzeylerinin karşılaştırılması 60 Şekil 4.3. Tüm gruplarda GSH-Px düzeylerinin karşılaştırılması Şekil 4.4. Tüm gruplarda MPO düzeylerinin karşılaştırılması 61 Şekil 4.5. Histopatolojik örnekler. Portal alanda çoğu lenfositlerden oluşan, çok az sayıda PMN lökosit de içeren enflamatuvar hücre infiltrasyonu görülmektedir (A). Parankimde, enflamatuvar hücreler ve bunlar tarafından çevrelenen zedelenmiş hepatositlerden oluşan "spotty" nekroz odağı (B). Bir portal alan (resmin sol alt köşesi) komşuluğundan başlayan ve santral vene (resim sağ üst köşesi) kadar tüm zonları içeren belirgin yerel hepatosit balonlaşması görülmektedir (C). Belirgin sinüzoidal dilatasyon (D). (X400 büyütme, Hematoksilen & Eozin). 62 5. TARTIŞMA Sepsis sendromunda karaciğerin, hem primer yanıtta rol alan bir organ olarak aktif bir oyuncu, hem de etkilenen hedef bir organ olduğu bilinmektedir [4]. Karaciğer, travma, şok ve sepsis gibi durumlara yanıtta merkezi bir organdır. Karaciğer, sepsis sürecinde gelişen çoklu organ yetmezliğinde oldukça önemli bir rol üstlenmektedir. Bu pencereden bakıldığında, birçok araştırmacı, sepsis tedavisinde, özgül antibiyoterapiye ilaveten adjuvan tedavi arayışındadır. Sepsis tablosunda oksijen eksikliği olması, HBO tedavisinin iyi bir adjuvan tedavi seçeneği olabileceğini düşündürmektedir. Daha öncesinde de sepsis tablosunda adjuvan bir tedavi olarak HBO ile ilgili araştırmalar yapılmış ve faydalı etkileri rapor edilmiştir [105-107]. Hücresel oksidatif hasarın, çoklu organ yetmezliğindeki rolü iyi bilinmektedir [108]. Aşırı üretildiğinde ya da yeterli temizlenmediğinde ROT’lar, biyolojik membranlardaki lipid [109] ile protein [110] yapılarına direkt saldırır ve membran yapısını bozarlar. MDA, biyolojik membranlarda, ROT’ların neden olduğu lipid peroksidasyonu ile oluşur ve oksidatif hasarın bir belirtecidir. Çalışmamızda, kontrol ve NBO gruplarında MDA düzeyleri yüksek olarak bulunurken, HBO grubunda MDA düzeyleri, sham grubu ile benzer olarak saptandı. Bu bulgularla, sepsiste antibiyotik tedavisine ilave olarak HBO uygulamasının lipid peroksidasyonu ve oksidatif hasarı azalttığı söylenebilir. Endotoksemi, sepsis ve septik şok ile ROT’ların oluşumu ve salınımı arasındaki ilişkisini gösteren kanıtlar, ROT’ların sepsis ve/veya septik şokta önemli rol oynadıklarını ortaya koymaktadır [111]. E. coli gibi gram negatif bakteriler, lipopolisakkaritler, aktive nötrofiller, TNF-α ile diğer sitokinler aracılığıyla oksijen tüketimini arttırır ve ROT’ların ortaya çıkışına neden olurlar [112]. Yapılan çalışmalarda, ROT’ların septik karaciğer fonksiyon bozukluğunda önemli rol oynadığı saptanmıştır [113]. ROT’lar genellikle, HBO uygulamasına zıt tepkime ile ilgili olmasının yanı sıra bu tedavinin antibakteriyel etkinliğinin olduğuna da inanılmaktadır [114]. HBO uygulaması 63 ile artan hücresel ROT’ların, oksijen toksisitesinde önemli rol oynadığı düşünülmektedir [115]. Yine de, ROT’ların, hücresel fonksiyonların düzenlenmesinde faydalı etkilerinin olduğu desteklenmektedir [116]. Son çalışmalar, deneysel sepsiste antioksidan enzim aktivitelerinin azaldığını bildirmektedir ki bu da sepsis sürecinde antioksidan sistemin zayıfladığını göstermektedir [117-119]. HBO uygulamasının hem ROT’ların oluşumunu, hem de antioksidan enzimleri arttırdığı iyi bilinmektedir [120]. Buradan hareketle, enfeksiyon tablosunda HBO uygulamasının, oluşumunu arttırdığı süperoksit ve hidrojen peroksit gibi ROT’ların fagositozu arttırıcı etkisi yoluyla faydalı etkilerinin olabileceği söylenebilir [114]. Çalışmamızda, sepsis oluşturulan gruplarda (kontrol, HBO, NBO) hem SOD hem de GSH-Px aktivitelerinde artış gözlendi. Bu bulgu, sepsis tablosunda ortaya çıkan ROT’ların ortadan kaldırılması için antioksidan enzimlerdeki artış olarak değerlendirilebilir. HBO uygulanan grupta SOD düzeyleri, kontrol ve NBO grubuna göre daha düşük olarak bulundu. HBO uygulanan grupta, kontrol ve NBO grubuna göre MDA düzeylerinin de düşük olmasıyla, HBO grubunda oksidatif hasarın daha az olmasına ve değerlendirmenin sepsis indüksiyonundan 5 gün sonra yapılması, yani geç dönemdeki verileri göstermesi olarak yorumlanabilir. Lökosit infiltrasyonu ve karaciğer hasarı arasındaki ilişki çok açık olmasa da, karaciğer hasarı, nötrofil aktivasyonu ve degranülasyonu ile uyumlu olarak mortalite oranlarında artışı gösteren kanıtlar mevcuttur [121122]. Karaciğer, dolaşımdaki bakteri ve ürünlerinin güçlü bir süpürücüsü gibi görünmektedir ve E. coli bakteriyemisinde, karaciğer sinuzoidlerinde görülen nötrofil birikimi iyi bilinmektedir [123]. Yeni bir çalışmada, E. coli lipopolisakkaritlerinin neden olduğu, karaciğerde belirgin polimorfonükleer lökosit infitrasyonu gösterilmiştir [124]. ROT’ların üretimi için esas potansiyel bölge olarak nötrofiller, oksidatif stresin gelişmesinde önemli rol oynarlar. Nötrofiller, oksidatif stres oluşturarak Kupfer hücrelerini aktive ederler, mikrovasküler fonksiyon bozukluğu ve ödem oluşumuna katkıda bulunurlar [125]. Nötrofillerde bulunan MPO, yaygın olarak, nötrofil infiltrasyonu belirteci olarak kullanılmaktadır [126] ve sepsis gibi ciddi enflamatuvar olaylarda MPO 64 düzeylerinin yükseldiği gösterilmiştir [127-128]. Bizim çalışmamızda da bu bulguları destekler nitelikte, sepsis oluşturulan gruplarda MPO düzeylerinin yüksek olduğu görülmektedir. HBO grubunda MPO düzeyleri, kontrol grubundan daha düşük gibi görülse de anlamlı bir fark yokken, NBO grubu MPO düzeylerinden daha düşük olarak tespit edilmiştir. Bu bulgular, HBO’nun, nötrofil infiltrasyonunu, NBO’ya göre azatlığını gösterse de, bu iki adjuvan tedavi yönteminin de, nötrofil infiltrasyonunu azaltma açısından mevcut tedaviye ilave bir katkılarının olmadığını göstermektedir. Sepsis oluşturulan grupların karaciğer dokularının histopatolojik inceleme sonuçlarında, MPO düzeylerinden elde edilen sonuçlara paralel olarak, gruplar arasında nötrofil infiltrasyonu açısından istatistiksel olarak anlamlı bir fark bulunmadı. Bu bulgular ışığında, HBO ve NBO uygulamasının nötrofil infiltrasyonunu azaltmadığı görülmektedir. Deneysel sepsis modellerinde, erken dönemde, oksidatif hasardan lökositlerin sorumlu olduğu hakkında yayınlar mevcuttur. Pankreatit gibi enflamasyon oluşturulan diğer modellerde, yine erken dönemde lökositlerin oluşturduğu hasarın arttığı, geç dönemde ise pankreas dokusundan kaynaklı doku hasarının etkili olduğu söz konusudur. Bu bulguları karaciğere uyarladığımızda, bizim sonuçlarımızda, kontrol grubu ile kıyaslandığında HBO uygulması ile lökosit infiltrasyonunda fark oluşmaması, geç dönemde tedavinin etkilerini, karaciğer hücre kaynaklı doku hasarını azaltarak gösterdiği söylenebilir. Çalışma grupları oluşturulurken, sepsis tedavisinde antibiyotiğin ana öğe olması, ancak adjuvan tedavi olabilecek HBO ve NBO uygulamalarının karşılaştırılmasının amaçlanması, ayrıca yapılan ön çalışmada sepsis oluşturulan ve antibiyotik verilmeyen ratların planlanan beş günlük çalışma süresi öncesinde ölmeleri (ilk 24 saat içinde) nedeniyle sepsis oluşturulan ve antibiyotik verilmeyen gruplar planlanmamıştır. 65 6. SONUÇLAR VE ÖNERİLER Çalışmamız sonucunda şu bulgular elde edilmiştir; 1. E. coli kullanarak, kontrollü inokülasyon yöntemi ile sepsis oluşturulan ratlarda, antibiyotik tedavisine ilave olarak HBO uygulamasının, MDA düzeyleri ile de belgelenebilen, karaciğerde oksidatif doku hasarını azalttığı, NBO tedavisinin ise böyle bir etkisinin olmadığı ortaya çıkmıştır. 2. Sepsiste, antibiyotik tedavisine ilave olarak HBO uygulamasıyla, karaciğerde oksidatif doku hasarının azaldığı ratlarda, doku antioksidan kapasitesinin göstergesi olan SOD düzeylerinde daha az artış olduğu saptanmıştır. 3. Sepsiste, MPO düzeyleri ve histopatolojik inceleme ile değerlendirildiğinde, antibiyotik tedavisine ilave olarak HBO ya da NBO uygulamasıyla, karaciğer hasarında önemli rol oynayan nötrofil infiltrasyonunda azalma sağlanmadığı görülmüştür. 4. az invaziv Sepsiste adjuvan bir tedavi olarak HBO uygulaması yerine daha ve uygulaması daha kolay olan NBO uygulamasının kullanılamayacağı söylenebilir. 5. Sepsiste adjuvan bir tedavi olarak HBO ve NBO uygulamalarının karşılaştırmasına yönelik daha kapsamlı çalışmalara ihtiyaç vardır. 66 7- KAYNAKLAR Kitap 4. Arias IM, J.W., Popper H, et al, The Liver: Biology and Pathobiology. 1988. Second Edition(New York: Raven Press). 58. Feldmeier, J.J., The Hyperbaric Oxygen Therapy Committee Report. 2003, Kensington: Undersea and Hyperbaric Medical Society. 62. Kindwall, E.P., Hyperbaric Medicine Practise. Second Edition Revised ed. 2002: Best Publishing Company. 81. Feher, J., Free Radical Reactions in Medicine. 1987. 87. Yalçın, A.S., Oksidan Stres ile İlgili Deneysel Modeller. Hücre-II: Oksidan Stres ve Hücre Hasarı. 1993, Kızılcahamam: TürkTabipleri Birliği Tıpta Temel Bilimler Kolu - Sonbahar Okulu. Kitap bölümü 26. Doğanay, M., Gram negatif bakteri sepsislerinde patogenez ve tedavi, in 1. Ulusal Infeksiyon Hastaliklari Kongresi, Kongre Kitabi, A.Ö. Tümbay E, Karakartal G, Editor. 1987, Bilgehan basimevi: Izmir. p. 48. 27. Hamill, R., Endotoxin shock in man caused by gram-negative bacilli, in Handbook of Endotoxin, R. Proctor, Editor. 1986. p. 55. 31. Lynn, W., Sepsis, in Infectious Diseases, A. D, Editor. 1999: London:Mosby. p. 1-14. 43. Archer, L., Pathologic manifestations of septic shock, in Handbook of Endotoxin, R. Proctor, Editor. 1986: Amsterdam. p. 18. 44. Young, L., Sepsis syndrome, in Principles and Practice of Infectious Diseases, G. Mandell, Editor. 1995, Churchill Livingstone: New York. p. 690-705. 61. Jain, K., Physical, Physiological, and Biochemical Aspects of Hyperbaric Oxygenation, in Textbook of Hyperbaric Medicine. 2004, Hogrefe & Huber Publishers. p. 9-20. 67 63. Jain, K., HBO Therapy in Infections, in Textbook of Hyperbaric Medicine. 2004, Hogrefe & Huber Publishers. p. 133-146. 64. Jain, K., HBO Therapy in Wound Healing, Plastic Surgery, and Dermatology, in Textbook of Hyperbaric Medicine. 2004, Hogrefe & Huber Publishers. p. 147-166. 69. Jain, K., Oxygen Toxicity, in Textbook of Hyperbaric Medicine. 2004, Hogrefe & Huber Publishers. p. 47-58. 76. Yagi, K., Lipid Peroxides and Related Radicals in Clinical Medicine, in Free Radicals in Diagnostic Medicine, D. Armstrong, Editor. 1994, Plenum Press: New York. Dergi makalesi 1. Angus, D.C., et al., Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med, 2001. 29(7): p. 1303-10. 2. Matot, I. and C.L. Sprung, Definition of sepsis. Intensive Care Med, 2001. 27 Suppl 1: p. S3-9. 3. Cunneen, J. and M. Cartwright, The puzzle of sepsis: fitting the pieces of the inflammatory response with treatment. AACN Clin Issues, 2004. 15(1): p. 18-44. 5. Cerra, F.B., Hypermetabolism, organ failure, and metabolic support. Surgery, 1987. 101(1): p. 1-14. 6. Bowler, P.G., B.I. Duerden, and D.G. Armstrong, Wound microbiology and associated approaches to wound management. Clin Microbiol Rev, 2001. 14(2): p. 244-69. 7. Mas, N., et al., Hyperbaric oxygen-induced changes in bacterial translocation and acinar ultrastructure in rat acute necrotizing pancreatitis. J Gastroenterol, 2005. 40(10): p. 980-6. 8. Hampson, N.B., Hyperbaric oxygen: a plea for uniform nomenclature. Undersea Hyperb Med, 1999. 26(4): p. 267. 68 9. Tetzlaff, K., E.S. Shank, and C.M. Muth, Evaluation and management of decompression illness--an intensivist's perspective. Intensive Care Med, 2003. 29(12): p. 2128-36. 10. Blanc, P., et al., Iatrogenic cerebral air embolism: importance of an early hyperbaric oxygenation. Intensive Care Med, 2002. 28(5): p. 559-63. 11. Kindwall, E.P., Hyperbaric oxygen. BMJ, 1993. 307(6903): p. 515-6. 12. Tibbles, P.M. and J.S. Edelsberg, Hyperbaric-oxygen therapy. N Engl J Med, 1996. 334(25): p. 1642-8. 13. Davidson, J.D. and T.A. Mustoe, Oxygen in wound healing: more than a nutrient. Wound Repair Regen, 2001. 9(3): p. 175-7. 14. Buras, J., Basic mechanisms of hyperbaric oxygen in the treatment of ischemia-reperfusion injury. Int Anesthesiol Clin, 2000. 38(1): p. 91109. 15. Oter, S., et al., Effects of hyperbaric oxygen treatment on liver functions, oxidative status and histology in septic rats. Intensive Care Med, 2005. 31(9): p. 1262-8. 16. Yucel T, G.D., Guclu S, Sit M, Adaleti R, Tetikkurt S, Ozcan A, Koksoy FN, Normobarik oksijenin deneysel peritonitin tedavisindeki yeri ve tedavisinin izlenmesinde rektal ateş, lökosit, CRP ve prokalsitonin etlinliği. Travma Acil Cerrahi Dergisi, 2008. 14(1): p. 14-20. 17. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med, 1992. 20(6): p. 864-74. 18. Doğanay, M., Nozokomiyal sepsis: önemi ve tanımlar. Hastane Infeksiyonları Dergisi, 1998. 2: p. 179-181. 19. Bone, R.C., Gram-positive organisms and sepsis. Arch Intern Med, 1994. 154(1): p. 26-34. 20. Martin, M.A., Epidemiology and clinical impact of gram-negative sepsis. Infect Dis Clin North Am, 1991. 5(4): p. 739-52. 69 21. Weinstein, M.P., et al., The clinical significance of positive blood cultures in the 1990s: a prospective comprehensive evaluation of the microbiology, epidemiology, and outcome of bacteremia and fungemia in adults. Clin Infect Dis, 1997. 24(4): p. 584-602. 22. Uzun, O., et al., Factors influencing prognosis in bacteremia due to gram-negative organisms: evaluation of 448 episodes in a Turkish university hospital. Clin Infect Dis, 1992. 15(5): p. 866-73. 23. Kayabaş, Ü., Erciyes Üniversitesi Tip Fakültesi Yogun Bakim Üniteleri nozokomiyal infeksiyonlari sürveyansi. Erciyes Üniversitesi Tip Fakültesi, Klinik Mikrobiyoloji ve Enfeksiyon Hastaliklari Anabilim Dali Uzmanlik Tezi, 1998. 24. Pittet, D., et al., Microbiological factors influencing the outcome of nosocomial bloodstream infections: a 6-year validated, populationbased model. Clin Infect Dis, 1997. 24(6): p. 1068-78. 25. Kieft, H., et al., The sepsis syndrome in a Dutch university hospital. Clinical observations. Arch Intern Med, 1993. 153(19): p. 2241-7. 28. Weinstein, M.P., et al., The clinical significance of positive blood cultures: a comprehensive analysis of 500 episodes of bacteremia and fungemia in adults. II. Clinical observations, with special reference to factors influencing prognosis. Rev Infect Dis, 1983. 5(1): p. 54-70. 29. Aube, H., C. Milan, and B. Blettery, Risk factors for septic shock in the early management of bacteremia. Am J Med, 1992. 93(3): p. 283-8. 30. Martin, M.A., M.A. Pfaller, and R.P. Wenzel, Coagulase-negative staphylococcal bacteremia. Mortality and hospital stay. Ann Intern Med, 1989. 110(1): p. 9-16. 32. Bone, R., The patogenesis of sepsis. Ann Intern Med, 1999. 1(115:457). 33. Doğanay, M., Sepsis : yeni tanımlar ve patogenez. Flora Infeksiyon Hastaliklari ve Klinik Mikrobiyoloji Dergisi, 1996. 1: p. 3. 34. Stevens, D.L., Invasive group A streptococcus infections. Clin Infect Dis, 1992. 14(1): p. 2-11. 70 35. Wheeler, A.P. and G.R. Bernard, Treating patients with severe sepsis. N Engl J Med, 1999. 340(3): p. 207-14. 36. Bone, R.C., C.J. Grodzin, and R.A. Balk, Sepsis: a new hypothesis for pathogenesis of the disease process. Chest, 1997. 112(1): p. 235-43. 37. Levi, M. and H. Ten Cate, Disseminated intravascular coagulation. N Engl J Med, 1999. 341(8): p. 586-92. 38. van Gorp, E.C., et al., Review: infectious diseases and coagulation disorders. J Infect Dis, 1999. 180(1): p. 176-86. 39. Fourrier, F., et al., Septic shock, multiple organ failure, and disseminated intravascular coagulation. Compared patterns of antithrombin III, protein C, and protein S deficiencies. Chest, 1992. 101(3): p. 816-23. 40. Wenzel, R.P., et al., Current understanding of sepsis. Clin Infect Dis, 1996. 22(3): p. 407-12. 41. Glauser, M.P., et al., Septic shock: pathogenesis. Lancet, 1991. 338(8769): p. 732-6. 42. Voyce, S.J. and R.C. Becker, Adaptive and maladaptive cardiovascular responses in human sepsis. Am Heart J, 1991. 122(5): p. 1441-8. 45. Harris, R., Manifestation of sepsis. Arch Intern Med, 1987. 147: p. 1895. 46. Martin, M.A. and H.J. Silverman, Gram-negative sepsis and the adult respiratory distress syndrome. Clin Infect Dis, 1992. 14(6): p. 1213-28. 47. Bick, R.L., Disseminated intravascular coagulation. Objective criteria for diagnosis and management. Med Clin North Am, 1994. 78(3): p. 511-43. 48. Franson, T.R., W.J. Hierholzer, Jr., and D.R. LaBrecque, Frequency and characteristics of hyperbilirubinemia associated with bacteremia. Rev Infect Dis, 1985. 7(1): p. 1-9. 49. Aygen, B., et al., Adrenal functions in patients with sepsis. Exp Clin Endocrinol Diabetes, 1997. 105(3): p. 182-6. 71 50. Lynn, W.A. and J. Cohen, Management of septic shock. J Infect, 1995. 30(3): p. 207-12. 51. Mayer, J., et al., Sepsis and septic shock. II. Treatment. Support Care Cancer, 1995. 3(2): p. 111-9. 52. Doganay, M., Sepsis tedavisi. Türkiye Tıp Dergisi, 1998. 5: p. 42. 53. Effect of high-dose glucocorticoid therapy on mortality in patients with clinical signs of systemic sepsis. The Veterans Administration Systemic Sepsis Cooperative Study Group. N Engl J Med, 1987. 317(11): p. 659-65. 54. Bone, R.C., et al., A controlled clinical trial of high-dose methylprednisolone in the treatment of severe sepsis and septic shock. N Engl J Med, 1987. 317(11): p. 653-8. 55. Lynn, W.A. and J. Cohen, Adjunctive therapy for septic shock: a review of experimental approaches. Clin Infect Dis, 1995. 20(1): p. 143-58. 56. Cunha, B.A., Antibiotic treatment of sepsis. Med Clin North Am, 1995. 79(3): p. 551-8. 57. Geddes, A., et al., Levofloxacin in the empirical treatment of patients with suspected bacteraemia/sepsis: comparison with imipenem/cilastatin in an open, randomized trial. J Antimicrob Chemother, 1999. 44(6): p. 799-810. 59. Cross, F.S., The effect of increased atmospheric pressures and the inhalation of 95 per cent oxygen and helium-oxygen mixtures on the viability of the bowel wall and the absorption of gas in closed-loop obstructions. Surgery, 1954. 36(5): p. 1001-26. 60. Cross, F.S. and O.H. Wangensteen, The effect of increased atmospheric pressures on the viability of the bowel wall and the absorption of gas in closed-loop obstructions. Surg Forum, 1953(38th Congress): p. 111-6. 65. Kindwall, E.P., L.J. Gottlieb, and D.L. Larson, Hyperbaric oxygen therapy in plastic surgery: a review article. Plast Reconstr Surg, 1991. 88(5): p. 898-908. 72 66. Demchenko, I.T. and C.A. Piantadosi, Nitric oxide amplifies the excitatory to inhibitory neurotransmitter imbalance accelerating oxygen seizures. Undersea Hyperb Med, 2006. 33(3): p. 169-74. 67. Demchenko, I.T., et al., Cerebral blood flow and brain oxygenation in rats breathing oxygen under pressure. J Cereb Blood Flow Metab, 2005. 25(10): p. 1288-300. 68. Gutsaeva, D.R., et al., The roles of nitric oxide and carbon dioxide gas in the neurotoxic actions of oxygen under pressure. Neurosci Behav Physiol, 2005. 35(7): p. 751-6. 70. Jamieson, D., et al., The relation of free radical production to hyperoxia. Annu Rev Physiol, 1986. 48: p. 703-19. 71. Dirks, R.C. and M.D. Faiman, Free radical formation and lipid peroxidation in rat and mouse cerebral cortex slices exposed to high oxygen pressure. Brain Res, 1982. 248(2): p. 355-60. 72. Monstrey, S.J., et al., Hyperbaric oxygen therapy and free radical production: an experimental study in doxorubicin (Adriamycin) extravasation injuries. Ann Plast Surg, 1997. 38(2): p. 163-8. 73. Nylander, G., et al., Lipid peroxidation products in postischemic skeletal muscle and after treatment with hyperbaric oxygen. Scand J Plast Reconstr Surg Hand Surg, 1989. 23(2): p. 97-103. 74. Richter, C., Reactive oxygen and DNA damage in mitochondria. Mutat Res, 1992. 275(3-6): p. 249-55. 75. Roehm, J.N., J.G. Hadley, and D.B. Menzel, Oxidation of unsaturated fatty acids by ozone and nitrogen dioxide. A common mechanism of action. Arch Environ Health, 1971. 23(2): p. 142-8. 77. Halliwell, B., Reactive oxygen species in living systems: source, biochemistry, and role in human disease. Am J Med, 1991. 91(3C): p. 14S-22S. 78. Basaga, H.S., Biochemical aspects of free radicals. Biochem Cell Biol, 1990. 68(7-8): p. 989-98. 79. Bast, A., G.R. Haenen, and C.J. Doelman, Oxidants and antioxidants: state of the art. Am J Med, 1991. 91(3C): p. 2S-13S. 73 80. Pierrefiche, G. and H. Laborit, Oxygen free radicals, melatonin, and aging. Exp Gerontol, 1995. 30(3-4): p. 213-27. 83. Farber, J.L., M.E. Kyle, and J.B. Coleman, Mechanisms of cell injury by activated oxygen species. Lab Invest, 1990. 62(6): p. 670-9. 84. Krinsky, N.I., Membrane antioxidants. Ann N Y Acad Sci, 1988. 551: p. 17-32; discussion 32-3. 85. Sies, H., Oxidative stress: from basic research to clinical application. Am J Med, 1991. 91(3C): p. 31S-38S. 86. Frei, B., Reactive oxygen species and antioxidant vitamins: mechanisms of action. Am J Med, 1994. 97(3A): p. 5S-13S; discussion 22S-28S. 88. Dalle-Donne, I., et al., Protein carbonyl groups as biomarkers of oxidative stress. Clin Chim Acta, 2003. 329(1-2): p. 23-38. 89. Nielsen, F., et al., Plasma malondialdehyde as biomarker for oxidative stress: reference interval and effects of life-style factors. Clin Chem, 1997. 43(7): p. 1209-14. 90. Boadi, W.Y., et al., Effects of dietary factors on antioxidant enzymes in rats exposed to hyperbaric oxygen. Vet Hum Toxicol, 1991. 33(2): p. 105-9. 91. Puglia, C.D. and G.A. Loeb, Influence of rat brain superoxide dismutase inhibition by diethyldithiocarbamate upon the rate of development of central nervous system oxygen toxicity. Toxicol Appl Pharmacol, 1984. 75(2): p. 258-64. 92. Kim, K.S. and A.S. Bayer, Efficacy of BMY-28142 in experimental bacteremia and meningitis caused by Escherichia coli and group B streptococci. Antimicrob Agents Chemother, 1985. 28(1): p. 51-4. 93. Gurtner, G.C., et al., Effect of carbon dioxide pneumoperitoneum on bacteraemia and endotoxaemia in an animal model of peritonitis. Br J Surg, 1995. 82(6): p. 844-8. 94. Jenkinson, S.G., J.M. Jordan, and R.A. Lawrence, BCNU-induced protection from hyperbaric hyperoxia: role of glutathione metabolism. J Appl Physiol, 1988. 65(6): p. 2531-6. 74 95. Weber, C.A., et al., Depletion of tissue glutathione with diethyl maleate enhances hyperbaric oxygen toxicity. Am J Physiol, 1990. 258(6 Pt 1): p. L308-12. 96. Lutz, J. and M. Stark, Administration of perfluorochemicals under hyperbaric oxygen pressure and treatment with free oxygen radical scavengers. Biomater Artif Cells Artif Organs, 1988. 16(1-3): p. 395402. 97. Etlik, O., et al., The effect of antioxidant vitamins E and C on lipoperoxidation of erythrocyte membranes during hyperbaric oxygenation. J Basic Clin Physiol Pharmacol, 1997. 8(4): p. 269-77. 98. Zamboni, W.A., H.P. Wong, and L.L. Stephenson, Effect of hyperbaric oxygen on neutrophil concentration and pulmonary sequestration in reperfusion injury. Arch Surg, 1996. 131(7): p. 756-60. 99. Lowry, O.H., et al., Protein measurement with the Folin phenol reagent. J Biol Chem, 1951. 193(1): p. 265-75. 100. Hammouda, A.e.-R., M.M. Khalil, and A. Salem, Lipid peroxidation products in pleural fluid for separation of transudates and exudates. Clin Chem, 1995. 41(9): p. 1314-5. 101. Sun, Y., L.W. Oberley, and Y. Li, A simple method for clinical assay of superoxide dismutase. Clin Chem, 1988. 34(3): p. 497-500. 102. Paglia, D.E. and W.N. Valentine, Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase. J Lab Clin Med, 1967. 70(1): p. 158-69. 103. Muftuoglu, M.A., et al., Liver injury in sepsis and abdominal compartment syndrome in rats. Surg Today, 2006. 36(6): p. 519-24. 104. Sener, G., et al., Melatonin protects against oxidative organ injury in a rat model of sepsis. Surg Today, 2005. 35(1): p. 52-9. 105. Pedoto, A., et al., Beneficial effect of hyperbaric oxygen pretreatment on lipopolysaccharide-induced shock in rats. Clin Exp Pharmacol Physiol, 2003. 30(7): p. 482-8. 75 106. Edremitlioglu, M., et al., The effect of hyperbaric oxygen treatment on the renal functions in septic rats: relation to oxidative damage. Surg Today, 2005. 35(8): p. 653-61. 107. Thom, S.R., M.W. Lauermann, and G.B. Hart, Intermittent hyperbaric oxygen therapy for reduction of mortality in experimental polymicrobial sepsis. J Infect Dis, 1986. 154(3): p. 504-10. 108. Tanjoh, K., et al., Nitric oxide and active oxygen species in severe sepsis and surgically stressed patients. Surg Today, 1995. 25(9): p. 774-7. 109. Yamamoto, Y., et al., Oxidation of biological membranes and its inhibition. Free radical chain oxidation of erythrocyte ghost membranes by oxygen. Biochim Biophys Acta, 1985. 819(1): p. 29-36. 110. Koster, J.F. and R.G. Slee, Lipid peroxidation of human erythrocyte ghosts induced by organic hydroperoxides. Biochim Biophys Acta, 1983. 752(2): p. 233-9. 111. Liaw, W.J., et al., Effects of a membrane-permeable radical scavenger, Tempol, on intraperitoneal sepsis-induced organ injury in rats. Shock, 2005. 23(1): p. 88-96. 112. Suntres, Z.E. and P.N. Shek, Treatment of LPS-induced tissue injury: role of liposomal antioxidants. Shock, 1996. 6 Suppl 1: p. S57-64. 113. Basile, M., et al., Melatonin protects from, but does not reverse, the effects of mediators of sepsis on liver bioenergetics. Pediatr Surg Int, 2004. 20(4): p. 263-6. 114. Hink, J. and E. Jansen, Are superoxide and/or hydrogen peroxide responsible for some of the beneficial effects of hyperbaric oxygen therapy? Med Hypotheses, 2001. 57(6): p. 764-9. 115. Jamieson, D., Oxygen toxicity and reactive oxygen metabolites in mammals. Free Radic Biol Med, 1989. 7(1): p. 87-108. 116. McCord, J.M., The evolution of free radicals and oxidative stress. Am J Med, 2000. 108(8): p. 652-9. 117. Demirbilek, S., et al., Effects of polyenylphosphatidylcholine on cytokines, nitrite/nitrate levels, 76 antioxidant activity and lipid peroxidation in rats with sepsis. Intensive Care Med, 2004. 30(10): p. 1974-8. 118. Varalakshmi, P., S. Sandhya, and K.P. Malarkodi, Evaluation of the effect of lipoic acid administered along with gentamicin in rats rendered bacteremic. Mol Cell Biochem, 2003. 248(1-2): p. 35-40. 119. Javesghani, D., et al., Superoxide production in the vasculature of lipopolysaccharide-treated rats and pigs. Shock, 2003. 19(5): p. 48693. 120. Topal, T., et al., Exogenously administered and endogenously produced melatonin reduce hyperbaric oxygen-induced oxidative stress in rat lung. Life Sci, 2004. 75(4): p. 461-7. 121. Molnar, R.G., et al., The role of neutrophils in producing hepatocellular dysfunction during the hyperdynamic stage of sepsis in rats. J Surg Res, 1997. 73(2): p. 117-22. 122. Chishti, A.D., et al., Neutrophil chemotaxis and receptor expression in clinical septic shock. Intensive Care Med, 2004. 30(4): p. 605-11. 123. Sato, T., et al., Hepatic cellular injury following lethal Escherichia coli bacteremia in rats. Lab Invest, 1982. 47(3): p. 304-10. 124. Tsao, C.M., et al., Propofol ameliorates liver dysfunction and inhibits aortic superoxide level in conscious rats with endotoxic shock. Eur J Pharmacol, 2003. 477(2): p. 183-93. 125. Jaeschke, H., Reactive oxygen and mechanisms of inflammatory liver injury. J Gastroenterol Hepatol, 2000. 15(7): p. 718-24. 126. Serafin, A., et al., Ischemic preconditioning increases the tolerance of Fatty liver to hepatic ischemia-reperfusion injury in the rat. Am J Pathol, 2002. 161(2): p. 587-601. 127. Youn, Y.K., et al., Recombinant human growth hormone decreases lung and liver tissue lipid peroxidation and increases antioxidant activity after thermal injury in rats. J Burn Care Rehabil, 1998. 19(6): p. 542-8. 77 128. Shirahane, K., et al., Hepatic ischemia/reperfusion injury is prevented by a novel matrix metalloproteinase inhibitor, ONO-4817. Surgery, 2006. 139(5): p. 653-64. Tez 82. TOPAL, T., Endojen Olarak Salınan veya Eksojen Olarak Verilen Melatoninin Antioksidan Etkinliği ve Hiperbarik Oksijen Uygulaması İle Etkileşimi, in GATA Fizyoloji A.D. Tıpta Uzmanlık Tezi. 2002, GATA: Ankara. 78