proteinler
advertisement
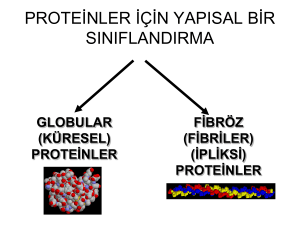
PROTEİNLER PROTEİNLER İÇİN YAPISAL BİR SINIFLANDIRMA GLOBULAR (KÜRESEL) PROTEİNLER FİBRÖZ (FİBRİLER) (İPLİKSİ) PROTEİNLER İPLİKSİ (FİBRÖZ) PROTEİNLER • Lifli ve uzunlamasına yapılar oluştururlar. • Çoğu hayvansal hücrelerde YAPISAL ROLLER üstlenir. • Deri, bağ doku, saç, kıl, boynuz ve ipek gibi lifli yapıların ana bileşenidirler. BAZI İPLİKSİ PROTEİNLERİN AMİNO ASİT BİLEŞİMİ Sağlamlık kazandırır. Polisakkaritler için tutunma yeri KERATİNLER • Amino asit dizileri ve biyolojik işlevleri birbirine benzeyen iki önemli protein grubu: -keratinler Saç, tırnak ve derinin ana bileşeni Ara filament proteinler denilen geniş bir ailenin üyesidirler. -keratinler Daha çok -tabaka içerirler. Kuş ve sürüngenlerin tüy ve kabuklarında bulunurlar. Saçtaki -keratinin yapısı Proposed structure for keratin-type intermediate filaments. Her bir zincir -sarmal yapısındadır ve 300’ün üzerinde amino asit içerir. Bir monomer çifti (a) paralel konumda birbirlerine dolanarak 50 nm uzunluğunda dimerik bir yapı olan sarımlı sarmalı (b) oluştururlar. Çok sayıda dimer birbirleriyle etkileşerek protofilamenti (c) ve sonra da protofibrili (d) ortaya koyarlar. Bu tip sağlam bir yapı bazı dokularda disülfit çapraz bağlarıyla daha da dayanıklı hale gelir. Tırnaktaki -keratin saçtaki -keratine göre çok daha fazla sayıda bu tip çapraz bağ içerir. Perma: Bu işlem keratindeki disülfit bağlarının indirgenmesi, yeniden şekillendirme ve yeni şeklin sabitlenmesi işlemlerini kapsar. İPEK PROTEİNİ FİBRONİNİN YAPISI FİBROİN İPEKBÖCEĞİ KOZASINDA ve ÖRÜMCEKLERİN AĞINDA BULUNAN PROTEİN Çok sayıda antiparalel -tabaka içerir. Üç boyutlu yapı kesidi. Bu bölgede sadece alanin ve glisin kalıntıları görülmekte. Alanin veya serin yan zincirleri ile glisin yan zincirlerinin etkileşimi (üstten görünüş) FİBROİNİN TAMAMI -TABAKA YAPISINDA DEĞİLDİR. • İpliksi proteinlerin amino asit bileşimini gösteren tabloda gördüğümüz gibi, fibroin valin ve tirozin gibi -tabakaya uymayacak amino asitler de içerir. Bu amino asitler nedeniyle de -tabakaları arasında yer yer tıkız bir şekilde katlanmış bölgeler yer alır. Böyle bir yapı fibroine oldukça esnek bir yapı kazandırır. KOLLAJEN İnsan da dahil omurgalıların büyük bir kısmında en bol bulunan proteindir. Bazı hayvanlarda total protein kitlesinin ~1/3’ini oluşturur. •Kemiklerde minerallerin üzerinde çöktüğü matriks materyalini oluşturur. •Tendonların ana bileşenidir. •Derinin önemli bir elemanıdır. Kısacası, pek çok hayvanın bütünlüğünden bu molekül sorumludur, diyebiliriz. YAPISAL BİRİM: TROPOKOLLAJEN Kollajenin Yapısı • Temel yapısal birim, her biri ~ 1000 amino asit kalıntısı uzunluğundaki üç polipeptit zincirininin birbirine sarılmasıyla oluşan üçlü sarmal yapıdaki TROPOKOLLAJEN molekülüdür. • Tropokollajendeki her bir zincir sola dönümlü olup, her bir dönümde yaklaşık 3.3 amino asit yer alır. Yapının böyle olmasının en önemli iki nedeni: • Böyle bir yapıda her 3 kalıntıda bir GLİSİN amino asidi bulunur. Çünkü sadece bu amino asidin yan zinciri bu yapı içerisinde yer alacak kadar küçüktür. • Üçlü sarmal kıvrıma uygun, bu oluşumu kolaylaştıran bir başka özellik de her bir zincirde yer alan PROLİN ve HİDROKSİPROLİN kalıntılarıdır. Zincirlerde belli dizilerin sık sık tekrarlandığı görülür: Gly-X-Y X= genelde PROLİN Y= PROLİN veya HİDROKSİPROLİN (X ve Y’de yer yer başka amino asitler de bulunabilir. Ancak yukarıdaki yapılanma özgün yapının oluşumundan sorumludur. Prolin kalıntılarının sıradışı bir şekilde hidroksile olmasının avantajı: • Üçlü sarmalı oluşturan ana bağ tipi omurgadaki amit protonları ile karbonil oksijenleri arasındaki H bağlarıdır. Ancak hidroksiprolindeki OH grupları ek bağların kurulmasına katkıda bulunarak bu yapıyı daha da sağlamlaştırır. Kollajendeki lizin kalıntılarının da bir kısmı hidroksile durumdadır. Bu modifikasyonun rolü: • Lizindeki OH grupları polisakkaritlerin tutunma noktalarını oluşturur. Prolin Hidroksiprolin dönüşümü ENZİMATİK bir olaydır ve C vitamini (askorbik asit) gerektirir. C vitamininin eksikliği İSKORBÜT denilen bir hastalığa yol açar. Deride ve dişetlerinde yaralar oluşur, damarlar incelir. Dışarıdan vitamin takviyesiyle bu rahatsızlıklar ortadan kalkar. Tropokollajen molekülleri kollajen liflerini oluşturmak üzere özgül bir biçimde birlikte paketlenir: Kollajenin dayanıklığının bir nedeni de tropokollajen moleküllerinin, lizin yan zincirlerinin yer aldığı özel bir reaksiyon aracılığıyla çapraz bağlanmasıdır. Zincir içi ve zincirler arası gerçekleşen bu olay enzimatiktir. Bazı lizin kalıntıları lizil oksidaz enzimi tarafından oksitlenerek aldehit türevine dönüşür, bu da başka bir lizinle veya diğer bir molekülle kondensasyon reaksiyonuna girerek çapraz bağlar oluşturur. Bu reaksiyon yaşam boyunca sürer. Çapraz bağlar, kollajen molekülünün elastikiyetini kaybetmesine ve daha kırılgan hale gelmesine yol açar. Yaşlanma ile ilgili görsel belirtilerin büyük bir kısmı bu çapraz bağlardan kaynaklanmaktadır. Kollajen Sentezi Tropokollajeni oluşturan zincirlerin ribozomda sentezlenen ilk halleri çok farklıdır. •1.adım ribozomlarda translasyondur. •2.adımda polipeptit hidroksillenir. •3.adımda şekerler bağlanır. •4.adımda prokollajen oluşturulur. Prokollajen 1500 kalıntıdan ibarettir. Üç prokollajen molekülü orta kısımlarından üçlü sarmal oluştururken N- ve C-uçları kıvrılıp katlanarak küresel yapı kazanır. •5.adımda prokollajen üçlüleri hücredışı alana salınır. •6.adımda N- ve C-uçlar spesifik proteazlar tarafından kesilip atılır. •7.adımda lizin kalıntıları arasında çapraz bağlantılar kurularak molekülün yapısı tamamlanmış olur. ELASTİN Bağ doku ve atardamarlarda daha elastik bir yapı olması gerekir. İşte elastin bu yapıları oluşturan ipliksi proteindir. Polipeptit zinciri glisin, alanin, ve valin bakımından zengindir. Oldukça elastik bir yapıya sahiptir, çünkü çapraz bağlı lizin kalıntıları da içerir. Dört lizin kalıntısı DESMOZİN oluşturmak üzere birleşir: KÜRESEL (GLOBULAR) PROTEİNLER Oksijenin taşınmasında ve depolanmasında globinlerin rolü Hemoglobin ve Miyoglobin hayvanlarda sırasıyla, oksijen taşınması ve depolanmasında görev alan proteinlerdir. Hayvanlar yaşamak için hücrelerine oksijen pompalamak ve metabolizma sonucu oluşan artık ürünleri de (ör. CO2) dışarı atmak zorundadırlar. Dokular arasında difüzyon ile taşınma hızı yeterince yüksek değildir. Böcekler hariç tüm hayvanlar kan (atardamarlar) yoluyla dokulara oksijen taşır ve CO2’yi yine aynı yolla (toplardamarlarla) dışarı atar. Kanda oksijen taşıma görevi, değişik canlılarda farklı tipleri bulunan oksijen taşıyıcı proteinler tarafından sağlanır. Bu proteinler ya bazı omurgasızlarda olduğu gibi kanda çözünmüş olarak bulunur, ya da insan eritrositlerinde olduğu gibi belli hücrelerde yoğunlaşır. Tüm omurgalılarda oksijen taşıyıcı protein HEMOGLOBİN, oksijen depolayıcı protein MİYOGLOBİN’dir. Her ikisi de küresel proteindir.Ortak yapısal motife sahiptirler. Miyoglobin monomerik, hemoglobin oligomerik (tetramerik) proteindir. MİYOGLOBİN HEMOGLOBİN myo- Yunanca’da “kas” hemo- ise “kan” anlamına gelir. • Her ikisi de hem grubu içerir, yani bileşik proteindir. Oksijeni bağlayan bu grup, protein kısmına (globin) kovalent olmayan etkileşimlerle bağlı durumdadır. Hem (Demir protoporfirin) KIRMIZI RENKTEN DE SORUMLU GRUP! MİYOGLOBİN • Kas dokusunda bulunur. Oksijen bağlayarak depo eder. Yoğun kas aktivitesi sırasında gerekli olan oksijeni mitokondrilere aktarır. En çok iskelet bulunur. ve kalp kasında •Suda çok derinlere dalan fok ve balinaların total kas proteininin %8’i miyoglobindir. -Sarmal bölgelerince zengin tek zincirli bir polipeptittir. %80’i 8 adet -sarmalından (A-H) oluşur: Hem grubu molekülün apolar özellikteki iç kısmına (F ve E sarmalları arasındaki cebe) yerleşmiştir. Bu cep apolar amino asitlerle çevrilidir. Bunlardan 2 tane histidin kalıntısının çok özel fonksiyonları vardır: PROKSİMAL HİSTİDİN : Doğrudan HEM’in demirine bağlıdır. DİSTAL HİSTİDİN : HEM ile doğrudan etkileşmez. Oksijenin +2 değerlikli demire bağlanmasını stabilize eder. Böylece Fe+2 çok az okside olarak oksijenin geri dönüşümlü bağlanması sağlanır. Miyoglobinin hem grubundaki Fe2+, O2 ile reversibl olarak bağlanabilir Miyoglobinin oksijene affinitesi, hemoglobinin oksijene affinitesinden fazladır Ancak ağır egzersizden sonra oksijenin azaldığı durumlarda kas dokusunun pO2’si 5 mmHg’ya kadar düşebilir ve miyoglobin kas mitokondrisinde ATP’nin oksidatif sentezi için kendisine bağlı oksijeni derhal serbest bırakır miyoglobin, kasta bir çeşit oksijen deposu olarak işlev görür Hemoglobin kırmızı kan hücrelerinde (eritrositler) yer alan oksijen taşıyıcı proteindir. Omurgalıların hemoglobini her biri bir molekül oksijen bağlayan birer hem grubu içeren ikişer alt birimden (toplam 4 altbirimden) oluşur. Erişkin insanlardaki hemoglobinin büyük bir kısmı 2 2 altbirimi içeren Hemoglobin A (HbA)’dır. Ayrıca %2 oranında Hemoglobin A2 (HbA2) (2+2delta zinciri içerir) bulunur. Hemoglobin bileşikleri • • • • • • • Oksihemoglobin (HbO2) Karbaminohemoglobin Karboksihemoglobin (HbCO) Methemoglobin Sulfhemoglobin Azotmonoksit hemoglobin Siyanhemoglobin Oksihemoglobin (HbO2) Oksihemoglobin, hemoglobin molekülündeki 4 Fe2+’e akciğerlerde birer O2 molekülü bağlanması sonucu oluşan hemoglobin bileşiğidir Hemoglobin molekülüne akciğerlerde O2 moleküllerinin bağlanması olayı, hemoglobinin oksijenasyonu olarak tanımlanır Bir hemoglobin molekülü, oksijenasyon olayı sonucunda 4 O2 molekülü bağlayabilmektedir Hemoglobinin oksijene affinitesi, oksijenin kısmi basıncına bağlıdır pO2 değişimine karşı hemoglobinin oksijenle % satürasyonunu gösteren grafiklere hemoglobinin satürasyon eğrisi veya oksihemoglobinin dissosiasyon eğrisi denir Akciğerlerde oksijenasyon olayı sonucunda hemoglobine bağlanan oksijen, diğer dokularda deoksijenasyon olayı sonucunda hemoglobinden ayrılır Oksijenize hemoglobin (oksihemoglobin) parlak kırmızı, deoksijenize hemoglobin (deoksihemoglobin) koyu kırmızıdır kanın oksijenlenmesinde bir azalma ve bunun sonucu olarak deoksijenize olmuş hemoglobinde artış, deri ve mukozalara karakteristik mavimtrak bir renk verir ki bu durum siyanoz olarak tanımlanır Karbaminohemoglobin hemoglobindeki globinin serbest -amino gruplarına reversibl olarak CO2 bağlanmasıyla oluşan hemoglobin bileşiğidir Karbamino grubu, hemoglobinin oksijene olan ilgisini azaltır ki bu etki, pH düşüşünden bağımsızdır CO2, deoksijenize hemoglobine oksihemoglobinden daha çok bağlanır ve böylece dokulardan akciğerlere hemoglobin ile taşınabilir Kandaki CO2’in %15-20’si karbaminohemoglobin bileşimindedir; %5’i plazmada serbest veya H2CO3 halindedir; %75-80’i de HCO3 şeklindedir Karboksihemoglobin (HbCO) oksihemoglobindeki O2 yerine karbonmonoksit (CO) geçmesi suretiyle oluşan hemoglobin bileşiğidir Hemoglobinin CO’e affinitesi O2’e affinitesinden 210 misli fazladır; ortamda oksijen ve karbonmonoksit eşit miktarlarda bulunduğunda hemoglobine tercihli olarak CO bağlanır ve anemik hipoksiye neden olur CO ile zehirlenmenin belirtileri, bilinç kaybı, tırnak dipleri ve mukoz membranların kiraz kırmızısı renk almasıdır CO ile zehirlenmenin tanısı için kan NaOH ile karıştırılır; normalde koyu kahverengi renk gözlendiği halde CO ile zehirlenme durumunda kiraz kırmızısı renk gözlenir Methemoglobin Methemoglobin, hemoglobindeki Fe2+ ’nin Fe3+ haline reversibl olarak oksitlenmesi sonucu oluşan kahverengi bir hemoglobin bileşiğidir hemoglobine bazı oksidan etkenlerin etkisi sonucunda oluşur. Glikoliz sırasında oluşan NADH ve spesifik bir enzim olan methemoglobin redüktaz tarafından indirgenir normalde kanda total hemoglobinin %0,5-1’i kadar methemoglobin bulunur Methemoglobin, O2 ve CO bağlayamaz; kandaki methemoglobin total hemoglobinin %10’undan fazla ise siyanoz görülür; %20’sinden fazla ise ayrıca yorgunluk, baş ağrısı, baş dönmesi, uyuklama, taşikardi gibi hipoksi bulguları ve polisitemi görülebilir Sulfhemoglobin oksihemoglobin ile H2S’ün reaksiyonlaşması sonucu oluşan yeşil-sarı renkli bir hemoglobin bileşiğidir Ölümden sonra proteinlerin kokuşması sonucu olarak dokularda H2S oluşur ki kadavraların kan toplanan yerlerinde görülen yeşil lekeler buralarda sulfhemoglobin oluşmasının sonucudur Azotmonoksit hemoglobin nitritli dumanların solunması durumlarında oluşan pembe renkli bir hemoglobin bileşiğidir Siyanhemoglobin HCN solunması sonucu oluşan bir hemoglobin bileşiğidir inorganik siyanür bileşiklerinin ağızdan alınması sonucu siyanmethemoglobin oluşur Hemoglobinin altbirimi ile miyoglobin arasında büyük benzerlik vardır. Amino asit dizileri farklı olmakla beraber yapılarındaki bu benzerlik 24 amino asidin ortak olmasından kaynaklanır. (Buradan farklı amino asit dizilerinin benzer 3 boyutlu yapılar ortaya koyduğunu ve benzer işlevler yürüttüğünü görüyoruz.) Bu ortak 24 amino asit, 3 boyutlu yapının ortaya konulmasında ve fonksiyonda doğrudan iş görmektedir. Hemoglobindeki alt birimler kendi aralarında moleküler etkileşimler kurarlar. Ayrıca bazı spesifik ve küçük moleküller fonksiyonda etkili olur. Yapıya bağlanarak aktivasyona veya inhibisyona yol açarlar. Bu tür ilişkiler hemoglobine oksijenin yanısıra CO, CO2 ve protonları da bağlayarak taşıma özelliği kazandırır. Hemoglobindeki alt birimler kooperatif etkiyle oksijen bağlanmasını sağlarlar. Bir oksijenin bağlanması, ikinci oksijenin bağlanmasını kolaylaştırır. Bu kolaylaştırıcılık, oksijenin çok bol bulunduğu akciğerlerde oksijenin hemoglobine bağlanmasını ve oksijen düzeyinin düşük olduğu dokularda da oksijenin serbest kalmasını sağlar. Hemoglobin dokulardaki karbondioksiti de akciğerlere taşıyarak dışarı atılmasını sağlar. Hemoglobine CO2 bağlanması Metabolizma sırasında oluşan CO2’nin çoğu suyla birleşerek bikarbonat iyonu oluşturur. Ancak bir kısmı hemoglobinin yüksüz amino gruplarına bağlanarak taşınır: Hb-NH2 + CO2 HbNHCOO- + H+ Hemoglobine CO bağlanması Hemoglobindeki Fe atomuna karbon monoksit (CO) bağlanırsa: Karbonmonooksihemoglobin (HbCO) oluşur. Dokulara O2 taşıma yeteneği azalır. (CO zehirlenmesinin temeli !) Hemoglobinin CO’ne olan ilgisi O2’ne olan ilgisinden 220 kat fazla! Onun için ortamdaki çok küçük miktardaki CO bile kanda toksik konsantrasyonda HbCO oluşmasına neden olur. %60’ın üzerinde HbCO ÖLDÜRÜCÜDÜR !!! CO zehirlenmelerinde O2 tedavisi uygulanır. Prostetik gruba en iyi örneklerden biri miyoglobin ve hemoglobine yer alan oksijen bağlayan hem (Fe-protoporfirin IX) grubu verilebilir. Hem grubu Hemoprotein Binding and release of ligands induces a conformational (structural) change in hemoglobin. Here, the binding and release of oxygen illustrates the structural differences between oxy- and deoxyhemoglobin, respectively. Nükleoprotein kompleksleri Structure of the Oxytricha nova telomere end binding protein complexed with single strand DNA. The a subunit is shown in purple and green and the b subunit is shown in blue. (A) The single strand DNA, shown with black bases, orange phosphorous atoms, and red phosphate oxygens, binds to a deep cleft between the N-terminal domain of a and the 28 kDa core domain of b. The 12ntd 5'-GGGGTTTTGGGG-3' DNA also forms a G-quartet linked DNA dimer, shown with orange bases, which is the focus of another poster (see poster Gquartets in a telomere protein-DNA complex). (B) Detailed view of one proteinDNA contact. The base of nucleotide G10 is stacked between the guanidinium group of arginine 140 from theb subunit and the phenol group of tyrosine 239 from the a subunit. Additional hydrogen bonds, shown in green, are likely important for sequence specific recognition of this base. Glikoprotein Hücre zarındaki glikoproteinler Lipoprotein TG: Trigliserit CE: Kolesterol esterleri Metalloprotein One-third of all proteins are "metalloproteins", chemical combinations of protein atoms (carbon, nitrogen, oxygen, hydrogen, sulfur) with ions of metals such as iron, calcium, copper, and zinc. The rusticyanin copper binding site shows the copper, the liganding residues and the supporting secondary structural elements. The Type II b-turn and the 310 helix may represent a region of structural rigidity that helps define and support the distorted coordination geometry. SOD CuZn bovine superoxide dismutase. (a) Ribbon diagram of native dimer showing positions of Cu (blue) and Zn (orange) atoms and their ligands and (b) a close up of the metal sites and the bridging His61.