atomun yapısı - WordPress.com
advertisement

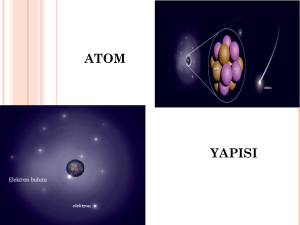
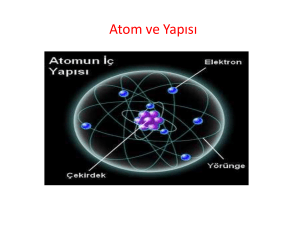
ATOMUN YAPISI •Boşlukta yer kaplayan, hacmi, kütlesi ve eylemsizliği olan her şeye madde denir. •Maddeyi oluşturan ve maddenin kendi özelliğini taşıyan en küçük yapı birimin atom denir. •Atom küre şeklindedir ve elektrikli yapıya sahiptir. •Atom, bir maddenin sahip olduğu bütün özellikleri taşır. Bu nedenle maddenin kütlesi varsa atomun kütlesi de vardır. Madde sürtünme, dokunma ya da etki yoluyla elektriklenirken elektron alıp verebiliyorsa atomda elektron alıp verebilir. Atom ile ilgili kavramlar: •Proton: Atomun çekirdeğinde bulunur. (+) yüklü bir parçacıktır. Kütlesi 1 akb’dir. •Nötron: Atomun çekirdeğinde bulunur. Kütlesi hemen hemen protona eşittir. Elektrik yükü taşımaz.Yani yüksüz bir parçacıktır. •Elektron: Atomun çevresinde çok büyük hızla dönen hareketli bir parçacıktır. •Atom numarası: Bir element atomunun çekirdeğinde bulunan proton sayılarının toplamına, atom numarası adı verilir. Atom numarası Z ile gösterilir.Z = p • Kütle numarası: Bir atomun çekirdeğindeki proton ve nötron sayılarının toplamı, o atomun kütle numarasını verir. Kütle numarası A ile gösterilir.Kütle numarası = Proton sayısı + Nötron sayısı A=p+n • Nötr ve Yüklü Atom: Bir atomdaki proton ve elektron sayıları birbirine eşitse bu atoma nötr atom denir. Nötr atomda (+) ve (–) yükler birbirine eşittir. Nötr atomda p = e’dir • Elektronlar çekirdek etrafında farklı enerji seviyelerinde dolanır. • Atom çekirdeğinin çapı, atom çapının 100 binde biri kadardır. Atom çekirdeğinde yüklü olarak sadece protonlar bulunduğu için, atomun çekirdek yükü daima (+) artıdır. • 1 Karbon atomunun kütlesinin 1/12’sine, 1 atomik kütle birimi adı verilmiştir. Atomik kütle birimi akb ile gösterilir. • 1 Karbon atomu = 12 akb’dir Elektron Dağılımı Elektronlar çekirdek çevresinde belli enerji seviyelerinde ve belli sayılarda dolanır. Enerji seviyeleri çekirdekten dışa doğru, 1. seviye, 2. seviye, 3. seviye şeklinde sıralanır. Bazen enerji seviyeleri, K, L,M, N… harfleriyle de gösterilir. 1. seviyede en fazla 2 elektron bulunur. 2. seviyede en fazla 8 elektron bulunur. Atomun en dış enerji seviyesinde en fazla 8 elektron bulunabilir. En dış enerji seviyesinde 8 elektron bulunduran elementlere soy gazlar denir. Bunun tek istisnası helyumdur. Helyum elementi soy gaz olduğu hâlde 2 elektronu vardır. Atomla ilgili ortaya atılan görüş ve teoriler a)Democritus Atom Teorisi : İlk görüş M.Ö. 400´de Democritus tarafından ortaya konmuştur. Maddenin taneciklerden oluştuğunu ve bu taneciklere atom adını vermiştir.Bu görüşlerini deneylere göre değil varsayımlara göre söylemiştir. Democritus´a göre; -Madde parçalara ayrıldığında en sonunda bölünemeyen bir tanecik elde edilir ve bu tanecik atomdur. -Bütün maddeler aynı tür atomlardan oluşur. -Maddelerin farklı olmasının nedeni maddeyi oluşturan atomların sayı ve dizilişi biçiminin farklı olmasıdır. -Atom görülemez. b) John Dalton: İlk bilimsel görüş 1803 –1808 yıllarında John Daltontarafından ortaya atılmıştır. Dalton´a göre; -Maddenin en küçük yapı taşı atomdur. -Atomlar parçalanamaz. -Atom içi dolu küre şeklindedir. -Bütün maddeler farklı tür atomlardan oluşmuştur. -Maddelerin birbirlerinden farklı olmasının nedeni maddeyi oluşturan atomların farklı özellikte olmasıdır. -Bir maddeyi oluşturan atomların tamamı birbirleriyle aynı özelliklere sahiptir. c) John Joseph Thomson: İlk model 1898 yılında Thomson tarafından ortaya konmuştur. Thomson atom modeli bir karpuza yada üzümlü keke benzer. Thomson´a göre; -Atom küre şeklindedir. (Çapı 10-8 cm) -Atomda (+) ve (-) yüklü tanecikler bulunur. -Thomson´a göre atom; dışı tamamen pozitif yüklü bir küre olup negatif yüklü olan elektronlar kek içerisindeki gömülü üzümler gibi bu küre içerisine gömülmüş haldedir. d) SirErnest Rutherford (*) : Atomun çekirdeğini ve çekirdekle ilgili birçok özelliğin ilk defa keşfeden bir bilim adamıdır. -Atom kütlesinin tamamına yakını merkezde toplanır, bu merkeze çekirdek denir. -Elektronlar çekirdek etrafında dairesel yörüngelerde sürekli dolanırlar. -Elektronların bulunduğu hacim çekirdeğin hacminden çok büyüktür. -Çekirdekteki yük miktarı bir maddenin bütün atomlarında ayın, farklı maddenin atomlarında farklıdır. -Çekirdekteki yük sayısı, elektron sayısına eşittir. -Çekirdekteki pozitif yüklerin kütlesi yaklaşık atom kütlesinin yarısına eşittir. d) NielsDavidBohr(*) : Bohr atom teorisi hidrojenin yayınma spektrumuna dayanılarak açıklanır. Bohr´a göre; -Elektronlar çekirdek etrafında belirli enerjiye karşılık gelen belirli uzaklıklarda bulunur. -Yüksek enerji düzeyinde bulunan elektron, düşük enerji düzeyine geçerse fotonlar halinde ışık yayarlar. -Kararlı hallerin tamamında elektronlar çekirdek etrafında dairesel yörünge izlerler. • f) De BroglieAtom Teorisi: Bohr´ın atom modeli elektronların yörüngeler arası geçişlerinin mümkün kılan“enerji ( kuvantum) sıçramalarını “ açıklamakta yetersiz kalmaktaydı .Bunun çözümü Fransız fizikçi Prens Victor De Broglie tarafından teklif edilmişti. De Broglie bilinen bazı taneciklerin uygun koşullar altında tıpkı elektromanyetik radyasyonlar gibi bazen de elektromanyetik radyasyonlara uygun şartlarda tıpkı birer tanecik gibi davrana bileceklerini düşünerek elektronlara bir sanal dalganın eşlik ettiğini öne sürerek bir model teklif etti . Bu modele göre farklı elektron yörüngeleri çekirdeğin etrafında kapalı dalga halkaları oluşturmaktaydı. • h) Born Heisenberg´in Atom Teorisi : Almanyalı kuramsal bir fizikçi olan Born Heisenberg´in ilkesini katlamakla beraber bir takım olasılık ve istatistik hesaplar neticesinde bir elektronun uzaydaki yerini yaklaşık olarak Born Schrödinger´in dalga mekaniği ile kuvantum teorisi arasında bir bağıntı kurdu. Böylece elektronun uzayın bir noktasında bulunması ihtimalinin hesaplana bilineceğini göstermiş oldu.