madde ve ısı
advertisement

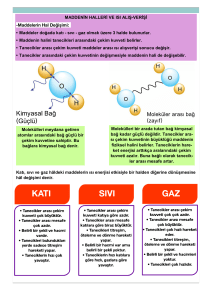
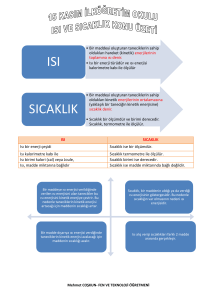
MADDE VE ISI Sıcaklık, Enerji değil sadece enerjinin varlığını gösteren bir Öz ısısı küçük olan maddelerin sıcaklığı daha hızlı ve değerdir. Termometre ile ölçülür. Birimi 0C(santigrat derece), çok artar, büyük olan maddelerin ise sıcaklığı yavaş Madde miktarına bağlı değildir. ve az artar. Yani hızlı artan hızlı azalır. Isı, Madde taneciklerinin sahip olduğu toplam enerjiye ısı denir. Isı, bir enerjidir. birimi ise joule veya kalori (cal)’dir Madde miktarına bağlıdır. Bir maddenin ısısı artarsa sıcaklığı da artar Yani doğru orantılıdır. Isı aktarımı sıcaklığın fazla Öz ısı ile sıcaklık artışı ters orantılıdır. MADDENİN HALLERİ VE ISI ALIŞ--VERİŞİ olduğu yerden sıcaklığın az olduğu yere doğru olur. 1-Aynı süre ısıtıldığında şekilde miktarı fazla olan sıvının sıcaklık artışı diğerine göre daha yavaş olur. 2-Kaplardaki sıvıları aynı sıcaklığa ğetirmek için miktarı fazla olan sıvıyı daha fazla süre ısıtmak gerekir veya ısıtıcının gücünü arttrımalıyız. TEMOMETRELER: içindeki maddenin ısı almasıyla genleşme veya büzüşmesiyle ölçüm yapar. termometre içinde kullanılan Sıvının donma ve kaynama sıcaklıkları arasındaki değerleri ölçebilir. Metal, sıvılı(civa, alkol) ve gazlı termometreler vardır. KÜTLE VE ISI İLİŞKİSİ Maddelerin sahip oldukları ısı enerjisi kütleleriyle doğru orantılıdır. Yani sıcaklıkları aynı olan aynı tür iki maddeden kütlesi büyük olanın ısısı daha fazladır. Bunun nedeni kütlesi büyük olan maddede tanecik sayısının daha fazla olmasıdır. Enerji Dönüşümü Doğada Isı, ışık, mekanik, kimyasal, nükleer enerji gibi farklı enerji türleri vardır. Toplam enerji miktarı hiçbir zaman değişmez fakat cismin sahip olduğu enerji türleri birbirine dönüşebilir. Örneğin Tost makinesi, fırın, su ısıtıcısı ve elektrik sobasında elektrik enerjisi ısı enerjisine dönüşür. Ampulün yanması sırasında elektrik enerjisi ısı ve ışık enerjisine dönüşür. Fren yapan aracın lastiklerinde mekanik enerji, ısı enerjisine dönüşür. Ellerin birbirine sürtülmesi sırasında mekanik enerji ısı enerjisine dönüşür. Besinlerin kimyasal bağlarında depolanan enerji, besinlerin solunum olayında parçalanması sonucu ısı ve kimyasal enerjiye dönüşür. Erime Katı haldeki maddenin ısı alarak sıvı hale geçmesine erime denir. Katı haldeki madde ısıtılırsa; • Madde ısı enerjisi alır. • Tanecikler enerji kazanır ve kinetik enerjisi artar. • Maddenin sıcaklığı artar. • Taneciklerin hızı artar. • Taneciklerin arasındaki çekim kuvveti azalır. • Tanecikler arasındaki boşluk artar. • Tanecikler birbirinden uzaklaşır. • Hızlanan tanecikler yer değiştirerek başka taneciklerle yeni bağlar oluşturur. • Madde sıvı hale geçer. Donma Sıvı haldeki maddenin ısı vererek katı hale geçmesine donma denir. Sıvı haldeki madde soğutulursa; • Madde dışarıya ısı enerjisi verir. • Tanecikler enerji kaybeder ve kinetik enerjisi azalır. • Maddenin sıcaklığı azalır. • Taneciklerin hızı azalır. • Taneciklerin arasındaki çekim kuvveti artar. • Tanecikler arasındaki boşluk azalır. • Tanecikler birbirine yaklaşır. • Madde katı hale geçer. Buharlaşma Sıvı haldeki maddenin ısı alarak gaz hale geçmesine buharlaşma denir. Sıvı haldeki madde ısıtılırsa; ÖZ ISI • Madde ısı enerjisi alır. • Tanecikler enerji kazanır ve kinetik enerjisi artar. Bir maddenin 1 gramının sıcaklığını 10C değiştirmek için • Maddenin sıcaklığı artar. gerekli olan ısı miktarına öz ısı denir. Öz ısı c ile • Taneciklerin hızı artar. • Taneciklerin arasındaki çekim kuvveti azalır ve yok denecek gösterilir ve her madde için farklıdır. Bu nedenle kadar azdır. maddeler için ayırt edici özelliktir. Öz ısının birimi öz ısı • Tanecikler arasındaki boşluk artar. cal/g 0C veya j/g 0C birimiyle ifade edilir. • Tanecikler birbirinden çok fazla uzaklaşır ve bağımsız Aynı kütleye sahip iki ayrı maddeye, aynı ısıyı verdiğimizde sıcaklık artışları aynı olmaz. Isıtılan bir maddenin sıcaklık artışı maddenin türüne göre değişir. hareket eder. • Madde gaz hale geçer. ERİME ve DONMA ISISI 2 ve 4. Bölgelerde madde hal değiştiriyor demektir. Madde ısı almaya devam ettiği halde sıcaklık artışı olmaz. Madde iki halde bulunur. Katı +sıvı veya sıvı +gaz şeklinde Erime ve Donma ısısı arttıkça gerekli olan ısısı da artar. Erime ısısı ile erime sıcaklığı birbirine karıştırılmamalıdır. Erime sıcaklığı = Erime noktası (su için bu 0 0C dir.) Donma sıcaklığı = Donma noktası (su için bu 0 0C dir.) Erime sıcaklığı = Donma sıcaklığı Erime ısısı = Donma ısısı Buharlaşma ısısı = Yoğuşma ısısı SOĞUMA EĞRİSİ Erime - Donma - Buharlaşma – Yoğuşma Isıları yukarıdaki formüle göre hesaplanır veya yorumlanır. Bu ısılar her madde için farklıdır yani ayırt edici özelliktir. Donma ve Kaynamayı Geciktirme Saf bir maddeye eklenen farklı cins madde, saf maddenin kaynama noktasını yükseltir donma noktasını düşürür. Örneğin suyun içine tuz atılırsa suyun kaynama sıcaklığı tuzun miktarına göre 100 0C den yukarı çıkar veya donma sıcaklığı 0 0C den aşağı iner. Soğuma eğrisi ısınma eğrisinin tam tersidir. Zamanla sıcaklık artışı görülüyorsa ısınma eğrisi, zamanla sıcaklıkta düşüş oluyorsa soğuma eğrisi demektir. ISINMA EĞRİSİ Bu tür sorularda sizden istenen sıcaklık değeri E.N den küçük ise katı E.N---K.N arasında ise sıvı K.N den büyük ise gaz halde bulunur. Termometreler içinde kullanılan sıvıların E.N ve K.N arasında ki değerleri ölçebilir. Eşit kütleli cisimlerde buharlaşma veya erime ısısı fazla olan daha çok ısı alır ya da daha uzun sürer. Doğru orantılı Kaynama tek sıcaklıkta olur. Kabın tabanında başlar 1 2 3 4 5 1, 3 ve 5. Bölgelerde madde ısı alıyor ve sıcaklık artışı gerçekleşiyordur. Bu bölgelerde sıcaklık artışı olduğundan tanecikler hızlanır, enerjiler artar. Madde tek halde bulunur. Q=m.c. t formülüne göre yorumlar yapılır. Q : alınan ısı m : kütle t : sıcaklık Buharlaşma her sıcaklıkta olur. Kabın üstünde gerçekleşir Yükseklere çıkıldıkça açık hava basıncı azalacağından bir maddenin kaynama noktası da düşer. Araştırılan özelliklerde veya kıyaslama sorularında her zaman ne isteniyorsa o değişir diğer bütün özellikler aynı olmalıdır. Formülde eşitliğin sağı ve solundaki ifadeler doğru orantılı. Eşitliğin aynı tarafında olanlar ters orantılıdır.