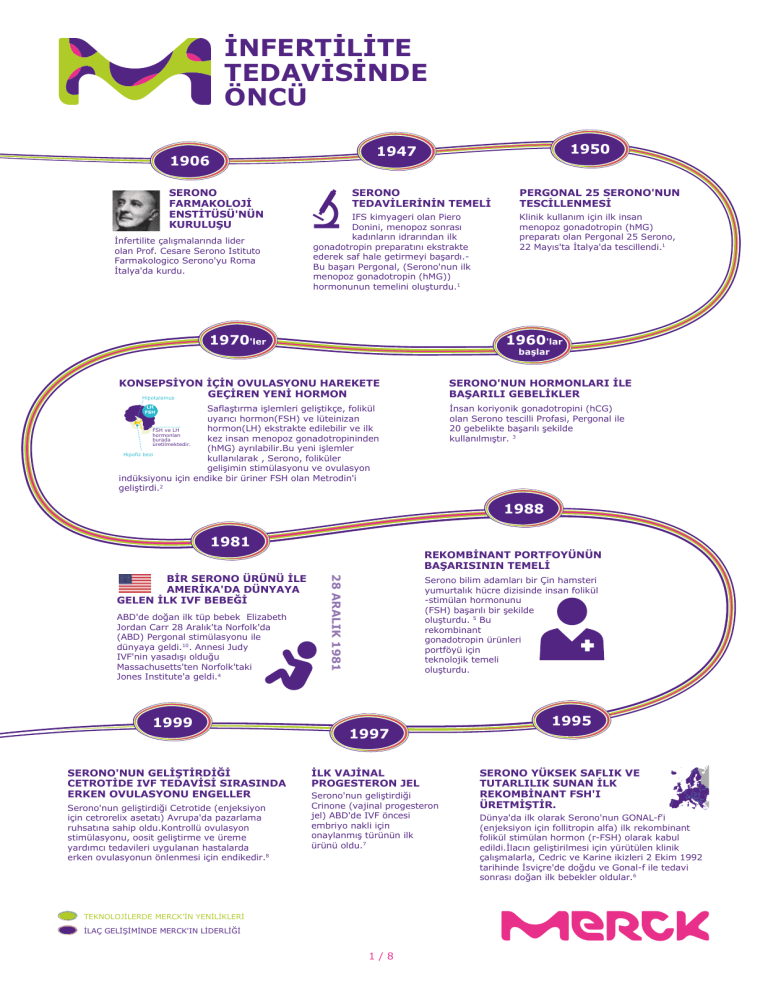
İNFERTİLİTE
TEDAVİSİNDE
ÖNCÜ
1950
1947
1906
SERONO
FARMAKOLOJİ
ENSTİTÜSÜ'NÜN
KURULUŞU
İnfertilite çalışmalarında lider
olan Prof. Cesare Serono Istituto
Farmakologico Serono'yu Roma
İtalya'da kurdu.
SERONO
TEDAVİLERİNİN TEMELİ
IFS kimyageri olan Piero
Donini, menopoz sonrası
kadınların idrarından ilk
gonadotropin preparatını ekstrakte
ederek saf hale getirmeyi başardı.Bu başarı Pergonal, (Serono'nun ilk
menopoz gonadotropin (hMG))
hormonunun temelini oluşturdu.1
1970'ler
PERGONAL 25 SERONO'NUN
TESCİLLENMESİ
Klinik kullanım için ilk insan
menopoz gonadotropin (hMG)
preparatı olan Pergonal 25 Serono,
22 Mayıs'ta İtalya'da tescillendi.1
1960'lar
başlar
KONSEPSİYON İÇİN OVULASYONU HAREKETE
GEÇİREN YENİ HORMON
Hipotalamus
SERONO'NUN HORMONLARI İLE
BAŞARILI GEBELİKLER
Saflaştırma işlemleri geliştikçe, folikül
uyarıcı hormon(FSH) ve lüteinizan
hormon(LH) ekstrakte edilebilir ve ilk
FSH ve LH
hormonları
kez insan menopoz gonadotropininden
burada
üretilmektedir.
(hMG) ayrılabilir.Bu yeni işlemler
Hipofiz bezi
kullanılarak , Serono, foliküler
gelişimin stimülasyonu ve ovulasyon
indüksiyonu için endike bir üriner FSH olan Metrodin'i
geliştirdi.2
İnsan koriyonik gonadotropini (hCG)
olan Serono tescilli Profasi, Pergonal ile
20 gebelikte başarılı şekilde
kullanılmıştır. 3
LH
FSH
1988
1981
ABD'de doğan ilk tüp bebek Elizabeth
Jordan Carr 28 Aralık'ta Norfolk'da
(ABD) Pergonal stimülasyonu ile
dünyaya geldi.10. Annesi Judy
IVF'nin yasadışı olduğu
Massachusetts'ten Norfolk'taki
Jones Institute'a geldi.4
1999
SERONO'NUN GELİŞTİRDİĞİ
CETROTİDE IVF TEDAVİSİ SIRASINDA
ERKEN OVULASYONU ENGELLER
Serono'nun geliştirdiği Cetrotide (enjeksiyon
için cetrorelix asetatı) Avrupa'da pazarlama
ruhsatına sahip oldu.Kontrollü ovulasyon
stimülasyonu, oosit geliştirme ve üreme
yardımcı tedavileri uygulanan hastalarda
erken ovulasyonun önlenmesi için endikedir.8
28 ARALIK 1981
BİR SERONO ÜRÜNÜ İLE
AMERİKA'DA DÜNYAYA
GELEN İLK IVF BEBEĞİ
REKOMBİNANT PORTFOYÜNÜN
BAŞARISININ TEMELİ
Serono bilim adamları bir Çin hamsteri
yumurtalık hücre dizisinde insan folikül
-stimülan hormonunu
(FSH) başarılı bir şekilde
oluşturdu. 5 Bu
rekombinant
gonadotropin ürünleri
portföyü için
teknolojik temeli
oluşturdu.
1997
İLK VAJİNAL
PROGESTERON JEL
Serono'nun geliştirdiği
Crinone (vajinal progesteron
jel) ABD'de IVF öncesi
embriyo nakli için
onaylanmış türünün ilk
ürünü oldu.7
TEKNOLOJİLERDE MERCK’İN YENİLİKLERİ
İLAÇ GELİŞİMİNDE MERCK'IN LİDERLİĞİ
1/8
1995
SERONO YÜKSEK SAFLIK VE
TUTARLILIK SUNAN İLK
REKOMBİNANT FSH'I
ÜRETMİŞTİR.
Dünya'da ilk olarak Serono'nun GONAL-f'i
(enjeksiyon için follitropin alfa) ilk rekombinant
folikül stimülan hormon (r-FSH) olarak kabul
edildi.İlacın geliştirilmesi için yürütülen klinik
çalışmalarla, Cedric ve Karine ikizleri 2 Ekim 1992
tarihinde İsviçre'de doğdu ve Gonal-f ile tedavi
sonrası doğan ilk bebekler oldular.6
2004
2000
2000
YENİ NESİL REKOMBİNANT
GONADOTROPİN
PREPARATI
OVULASYON UYARICI
OVIDREL/OVITRELLE
PİYASAYA SÜRÜLDÜ
Luveris (lutropin alfa) için Avrupa'da
şiddetli folikül-stimülan hormonu ve
lüteinizan hormonu (LH) yetmezliği
sorunları yaşayan yetişkin kadınlarda
folikül gelişimi stimülasyonu için rekombinant insan folikül stimülan hormonu
(r-hFSH) ile kombine olarak kullanım için
pazarlama ruhsatı verildi.9
OVIDREL/OVITRELLE (koryonik
gonadotropin alfa) (doğurganlık
tedavisi gören kadınlarda
yumurtlamayı tetiklemek için
kullanılır) ABD Gıda ve İlaç
Dairesinden (FDA) onay aldı.10
Bir yıl sonra Avrupa pazarından da
ruhsat aldı.11
2009
FERTİLİTE ALANININ
İLERLEMESİ İÇİN
ARAŞTIRMACILARI
ÖDÜLLENDİRME
Merck Serono Fertilite için Yenilik
teşvikini (GFI) hayata geçirdi ve
böylece ''ilaçların ötesinde'' çözümler
üretme ve IVF Laboratuvarı ve
teknolojilerinin önemine bağlılığı öne
çıkardı.O zamandan beri fertilite
alanında bilim ve yenilikçi
teknolojilerin gelişimini destekleyen
dönüşümsel
araştırma projeleri
için milyonlarca Euro
sağlanmıştır.17
YENİLİKÇİ CİHAZ HASTALARA
DAHA FAZLA KONFOR
GETİRİYOR
Serono'nun geliştirdiği kütle ile
doldurulan GONAL-f enjeksiyon
kalemi için (enjeksiyon için follitropin
alfa) Avrupa'da pazarlama ruhsatı
verildi.12 (sağdaki resim)Kalemin
daha sonra çıkarılan bir versiyonu
Red Dot Tasarım ödülünü
kazandı.13,14,15
2007
2007
PERGOVERİS PİYASAYA
SÜRÜLDÜ
MERCK SERONO
KURULDU
Pergoveris (rhFSH 150IU VE rhLH
75 IU) Avrupa'da pazarlama
ruhsatına sahip oldu.Şiddetli
folikül stimülan hormonu(FSH) ve
lüteinizan hormon (LH) yetmezliği
sorunları yaşayan yetişkin
kadınlarda folikül gelişimi
stimülasyonu için endikedir.16
Aile şirketi olan Merck, Serono'yu
satın alarak Merck Seronu çatısı
altında çiftlerin bebek sahibi
olmasına yardımcı olma hedefi
ile yola çıktı.
2014
2012
2011
MERCK SERONO'NUN FERTİLİTE
TEDAVİSİ İÇİN HASTANIN KENDİNE
UYGULAYABİLDİĞİ ENJEKSİYON
KALEMLERİ
Merck Serono Pens(enjeksiyon kalemleri) gibi
bir dizi ürün için Avrupa'da onay aldı. (resimde
gösterildiği gibi) Önceden doldurulmuş,
kullanıma hazır, kendi kendine uygulanabilen
üç Gonal-f enjektör uygulaması için ve bir
OVIDREL/OVITRELLE için Avrupa'da
onaylanmıştır.18
İki yıl sonra FDA ABD pazarı için GONAL-f
kalemlerini onayladı.19
EEVA TESTİ- IVF SONUÇLARINI
GELİŞTİRMEK İÇİN TASARLANDI
Şirketin ''ilaçların ötesine'' gitmek
stratejisinin bir parçası olarak Merck
Serono Eeva (Erken Embriyo Canlılık
Değerlendirilmesi) Testi
için Auxogyn ile stratejik
bir ortaklık kurduğunu
açıkladı.Merck Serono bu
ortaklıkta stratejik
bilimsel ve tıbbi destek
sağladı.20
Bu işbirliği Merck Serono'nun
kurumsal risk sermayesi fonundan
Auxogyn'e yatırım yapması ile 2010
yılında hayata geçti.
FERTİLİTE
TEKNOLOJİLERİ
BİRİMİNİN KURULMASI
Merck Serono, Fertilite serisinin
bağlılığının bir parçası olarak
hastaların daha iyi ve daha
yenilikçi olabilmeleri için
"Fertilite Teknolojileri" birimini
kurdu. Avrupa ve Kanada'da
şirket- Eeva® Testi - ilk
Fertilite Teknolojileri ürünün
ticarileştirilmesi haklarını aldı.21
2015
2015
GLOBAL FERTİLİTE BİRLİĞİ
İLAÇLARIN ÖTESİNDE BİR YENİLİK
Merck Serono, Genea ve Illumina ile
ilişkili laboratuvar süreçlerinin
geliştirme fırsatlarını belirleme ve bu
konuda çalışma konusunda Global
Fertilite Birliği kuruldu.23
Merck Serono, Genea Biomedx ile global işbirliği
anlaşması imzaladı ve fertilite tedavisinde daha iyi
sonuçlar geliştirmek amacı ile şirketin fertilite
teknolojilerindeki ürün yelpazesini genişletti. Şu anda
bu anlaşmaya Gavi, Geri ve Gems olmak üzere üç
ürün dahildir.Bununla birlikte, ortak şekilde diğer
yenilikçi teknoloji ürünleri ve hizmetleri geliştirme
anlaşması vardır.22
TEKNOLOJİLERDE MERCK’İN YENİLİKLERİ
İLAÇ GELİŞİMİNDE MERCK'IN LİDERLİĞİ
2/8
REFERANSLAR
1.
Rosenberg, E. (ed) (2013) The Human Testis: Proceedings of the
Workshop Conference Held at Positano, Italy, April 23–25, 1970. Vol.
10. New York: Springer Science & Business Media
2.
Lunenfeld, B. Historical perspectives in gonadotrophin therapy. Hum.
Reprod. Update 2004 10 (6): 453-467
3.
Ares Serono, (1996) A Tale of Two Hormones - The Story of FSH and
LH (Geneva: Imprimeries Reunies SA)
4.
Cohen, J. et al. The early days of IVF outside the UK. Hum. Reprod.
Update 2005 11 (5): 439-460
5.
Howles, C.M. Genetic engineering of human FSH (Gonal-F®). Hum.
Reprod. Update 1996 2 (2): 172-191
6.
Ares Serono, 1995. Ares-Serono’s Gonal-f is First Pharmaceutical
Product to Receive Approval in Europe Through the New Centralized
Application Procedure. [press release] 23 October 1995. Available at:
http://www.thefreelibrary.com/ARES-SERONO’S+GONAL-+IS+THE
+FIRST+PHARMACEUTICAL+PRODUCT+TO+RECEIVE...
-a017419668 Last access: August 2015
7.
8.
9.
FDA (2015). Label and Approval History Crinone. [online] Available
at: http://www.accessdata.fda.gov/drugsatfda_docs/
nda/97/020701_crinone_toc.cfm Last access: August 2015
European Medicines Agency, 2009. Cetrotide cetrorelix EPAR
summary for the public. Available at: http://www.ema.europa.eu/
docs/en_GB/document_library/EPAR_-_Summary_for_the_public/
human/000233/WC500024864.pdf Last access: August 2015
15. Merck Serono, 2015. Merck Serono Wins Two Red Dot Design
Awards 2015 for High Quality Design of Fertility Pens.
[press release] 10 June 2015. Available at: http://news.merck
de/N/0/1C2070A05A7DA9EEC1257E5F00576849/$File/Red_
Dot_2015_EN.pdf Last access: August 2015
16. Merck Serono, 2007. Merck’s Fertility Treatment Pergoveris
Approved in European Union. [press release] 29 June 2007.
Available at:http://www.merckgroup.com/en/media/extNewsDetail.
html?newsId=F9761F73C6326807C1257309002A379C&news
Type=1 Last access: August 2015
17. Grant for Fertility Innovation, (2015). What is GFI? [website]
Available at: http://www.grantforfertilityinnovation.com/en/
whatisgfi/whatisgfi.html Last access: August 2015
18. Merck Serono, 2011. Merck Received European Approval for Three
Pre-Filled, Ready-To-Use Pen Injectors for Fertility Treatment [press
release] 4 July 2011. Available at: http://merck.de/de/presse/
extNewsDetail.
html?newsId=8AF9A719C4D16B8BC12578C3002CD782&news
Type=1 Last access: August 2015
19. U.S. Food and Drug Administration, 2013. Highlights of prescribing
information for GONAL-F® RFF* REDI-JECT™. [product label]
Available at: http://www.accessdata.fda.gov/drugsatfda_docs/
label/2013/021684s036lbl.pdf Last access: August 2015
20. Merck Serono, 2012. Merck Serono and Auxogyn Announce
Collaboration on Eeva® Test [press release] 18 October 2012.
Available at: http://news.merck.de/N/0E1F441D24A968A98C1257E
9E0052307E/$File/2012-10-18_PressReleaseMS_Auxogyn_
CollaborationEeva.pdfLast access: August 2015
European Medicines Agency, 2011. Luveris lutropin alfa EPAR
summary for the public. Available at: http://www.ema.europa.eu/
docs/en_GB/document_library/EPAR_-_Summary_for_the_public/
human/000292/WC500045915.pdf Last access: August 2015
10. FDA (2016). Label and Approval History Ovidrel. [online] Available
at: http://www.accessdata.fda.gov/drugsatfda_docs/nda/2000/21149_Ovidrel.cfm Last access: August 2015
11. electronic Medicines Compendium, 2015. SPC for OVITRELLE® 250
micrograms/0.5 ml prefilled syringe. Available at: https://www.
medicines.org.uk/emc/medicine/14386 Last access: August 2015
12. Serono, 2004. Serono Annual Report 2004 [report] 2004. Available
at: http://www.annualreports.com/HostedData/AnnualReports/
PDF/sra2004.pdf Last access: August 2015
13. Red Dot Award, 2015. [website] Available at: http://red-dot.de/pd/
online-exhibition/work/?lang=en&code=26-013782015&y=2015&c=167&a=0 Last access: August 2015
14. Red Dot Award, 2015. [website] Available at: http://red-dot.de/pd/
online-exhibition/work/?lang=en&code=26-020472015&y=2015&c=167&a=0 Last access: August 2015
21. Merck Serono 2014. Merck Serono Announces Exclusive License
Agreement with Auxogyn for Eeva Test [press release] 3 April 2014.
Available at: http://news.merck.
de/N/0/53819F0DF9B5A74AC1257CAF00252E40/$File/AuxogynEng.
pdf Last access: August 2015
22. Merck Serono, 2015. Merck Serono as Pioneer in Assisted
Reproductive Treatments Takes Leading Role in Fertility Technologies
Signing a Global Collaboration Agreement with Genea Biomedx.
[press release] 28 May 2015. Available at: http://news.merck.de
/N/0/605A3ADCD7E1A3F9C1257E52006D7F0B/$File/GeneaEng.pdf
Last access: August 2015
23. Merck Serono, 2015. Merck, Illumina and Genea Form the Global
Fertility Alliance for Excellence in Assisted Reproductive Treatment.
[press release] 8 June 2015. Available at: http://news.merck.de
/N/0/612AB4D301C4780DC1257E5D006B408D/$File/
FertilityTechnologiesAllianceEng.pdf Last access: August 2015
The Eeva® (Early Embryo Viability Assessment) Test is available through Merck Serono in the UK, Spain, Canada, Ireland, Austria, France,
Germany, Italy, Portugal and the Nordics (Denmark, Finland, Norway and Sweden). The Eeva® Test was in-licensed in 2014 from Auxogyn Inc.
Progyny, Inc., formed in March 2015, is the combined entity of Auxogyn, Inc. and FertilityAuthority, LLC.
GaviTM, GeriTM and GemsTM are created by Genea Biomedx.
August 2015
2016-04-BFRK-A8XGXC
3/8
GONAL-f® 300 IU (22 mcg) / 0.5 ml,
GONAL-f® 450 IU (33 mcg) / 0.75 ml,
GONAL-f® 900 IU (66 mcg) / 1.50 ml Enjeksiyonluk çözelti içeren
kullanıma hazır dolu
enjeksiyon kalemi : Etkin madde: Herbir kartuş, etkin madde olarak
300 (450 veya 900) IU'ya eş değer 22 (33 veya 66) mikrogram follitropin
alfa (rekombinant folikül stimülan hormon (FSH) içerir.
Endikasyonlar:
Klomifen sitrat ile tedaviye cevap vermemiş kadınlarda anovulasyon
durumunda (polikistik over hastalığı dahil), in vitro fertilizasyon (IVF),
gamet intra fallopian transfer (GIFT) ve zigot intra fallopian transfer
(ZIFT) gibi yardımla üreme teknolojileri (ART) için süperovulasyon
yapılan hastalarda multifoliküler gelişmenin uyarılmasında, GONAL-f®
ve luteinizan hormon (LH) preparatı birlikte ciddi LH ve FSH eksikliği
olan kadınlarda foliküler gelişmenin uyarılması için önerilir. Klinik
çalışmalarda bu hastalar endojen serum LH düzeyi <1.2 IU/L olarak
tanımlanmıştır. GONAL-f®, doğuştan veya edinsel hipogonadotropik
hipogonadizm gösteren erkeklerde, spermatogenezi stimülasyonu için,
insan Koriyonik Gonadotropin'i (hCG) tedavisiyle birlikte endikedir.
Pozoloji ve Uygulama şekli:
GONAL-f® ile tedavi, fertilite problemlerinin tedavisinde uzman bir
hekimin gözetimi altında başlatılmalıdır. GONAL-f®’in klinik değerlendirmesi, günlük dozlarının, verilme şekillerinin ve tedavi izleme
işlemlerinin üriner FSH içeren preparatlar için halen kullanılanlardan
farklı olmaması gerektiğini göstermektedir. Karşılaştırmalı klinik
çalışmalar, üriner FSH ile karşılaştırıldığında hastaların GONAL-f® ile
daha düşük kümülatif dozlara ve daha kısa tedavi sürelerine ihtiyaç
duyduklarını göstermiştir. Bu nedenle, sadece foliküler gelişimin
optimize edilmesi için değil aynı zamanda istenmeyen ovaryen
hiperstimülasyon riskini minimuma indirmek için de, üriner FSH için
kullanılan dozlara göre, genel olarak GONAL-f® ile toplamda daha
düşük dozun verilmesinin uygun olduğu düşünülmektedir. GONAL-f®'in
monodoz preparatları ve multidoz preparatlarının eşdeğer dozlarının bio
eşdeğer olduğu gösterilmiştir. Anovulatuvar kadınlarda (PKOS dahil);
adet gören hastalarda, tedaviye menstrüasyon devresinin ilk 7 günü
içerisinde başlanmalıdır. Tedavi, ultrason ile folikül boyutunun ve / veya
östrojen salgılamasının ölçümü ile değerlendirilerek, hastanın tedaviye
bireysel olarak verdiği cevaba göre uyarlanmalıdır. Genel olarak günlük
75-150 IU FSH ile başlanır ve yeterli, ancak aşırı olmayan bir cevap
almak için, gerektiğinde 7 veya tercihen 14 günlük aralıklar ile tercihen
37.5 veya 75 IU oranında artırılır. Günlük maksimum doz genellikle 225
IU FSH'den daha yüksek değildir. Eğer hasta 4 haftalık tedaviden sonra
yeterli cevabı veremezse, o siklus bırakılmalı ve hastaya bıraktığı
siklustakinden daha yüksek bir başlama dozuyla tedaviye yeniden
başlanmalıdır. Optimal cevap alındığında, son GONAL-f® enjeksiyonundan sonraki 24-48 saat içerisinde 250 mikrogram r-hCG ya da 5000 IU
ila 10 000 IU'ya kadar tek bir hCG enjeksiyonu yapılmalıdır. Hastaya,
hCG uygulamasının yapıldığı gün ve bir sonraki gün cinsel birleşmede
bulunması tavsiye edilir. Alternatif olarak, intrauterin inseminasyon (IUI)
yapılabilir. Tedaviye aşırı cevap alındığı takdirde, tedavi durdurulmalı ve
hCG uygulanmamalıdır. Tedaviye, bir sonraki siklusta, bir önceki
siklusun dozajından daha düşük bir dozajla tekrar başlanılmalıdır. In
vitro fertilizasyon ve diğer yardımla üreme teknolojileri öncesi çoğul
foliküler gelişme için over stimülasyonu yapılan kadınlarda, siklusun 2.
veya 3. gününde başlanan günlük 150-225 IU GONAL-f® ile başlanır.
Yeterli folikül gelişimi elde edilene kadar genellikle günlük 450 IU'nun
üzerine çıkmayacak şekilde, hastanın tedaviye verdiği cevaba göre
ayarlanan dozaj ile tedaviye devam edilir. Genelde tedavinin ortalama
olarak 10. gününde (5-20 günde) yeterli folikül gelişimine ulaşılır. Kesin
foliküler olgunlaşmayı başlatmak için, son GONAL-f® enjeksiyonundan
sonraki 24 - 48 saat içerisinde 250 mikrogram r-hCG ya da 5000 IU ila
10 000 IU'ya kadar hCG tek bir enjeksiyonda yapılır. Ciddi LH ve FSH
eksikliğine bağlı anovulasyonlu kadınlarda Lutropin alfa ile birlikte
GONAL-f® tedavisinin amacı, hCG uygulandıktan sonra, yumurtlamanın
gerçekleşeceği tek bir olgun Graff folikülü geliştirmektir. GONAL-f®,
Lutropin alfa ile aynı anda günlük enjeksiyonlar halinde verilmelidir. Bu
hastalar amenoreik olduklarından ve düşük endojen östrojen salgısına
sahip olduklarından, tedaviye her zaman başlanabilir. Genel olarak
önerilen bir tedavi rejiminde tedaviye günlük 75 IU lutropin alfa 75-150
IU FSH ile başlanır. FSH dozunda artış gerektiği düşünülürse, doz
tercihen 7-14 günlük aralıklar ile ve tercihen 37.5-75 IU'luk basamaklarla
artırılır. Stimülasyon süresi herhangi bir siklusta 5 haftaya kadar
uzatılabilir. Optimal cevap alındığında, son GONAL-f® ve lutropin alfa
enjeksiyonundan sonraki 24-48 saat içerisinde 250 mikrogram r-hCG ya
da 5000 IU ila 10 000 IU'ya kadar tek bir hCG enjeksiyonu yapılmalıdır.
Hastaya, hCG uygulamasının yapıldığı gün ve bir sonraki gün cinsel
birleşmede bulunması önerilir. Alternatif olarak, intrauterin insemi-
nasyon (IUI) yapılabilir. Tedaviye aşırı cevap alındığı takdirde, tedavi
durdurulmalı ve hCG uygulanmamalıdır. Tedaviye, bir sonraki siklusta,
bir önceki siklusun dozajından daha düşük bir dozajla tekrar başlanılmalıdır. Hipogonadotropik hipogonadizm'li erkeklerde: GONAL-f® en az
4 ay boyunca haftada üç defa 150 IU dozda ve hCG ile bir arada
verilmelidir. Eğer bu dönemden sonra, hasta cevap vermemişse,
kombine tedaviye devam edilebilir; mevcut klinik deneyimler spermatogeneze ulaşmak için en az 18 aylık tedavinin gerekli olabileceğini
göstermektedir. GONAL-f® subkutan uygulama için hazırlanmıştır.
Kontrendikasyonlar:
Follitropin alfa'ya, FSH'ye veya eksipiyanlardan herhangi birine karşı
önceden aşırı duyarlılık, hipotalamus ve hipofiz tümörleri; Kadınlarda:
polikistik over hastalığından kaynaklanmayan yumurtalık büyümesi
veya kisti, etiyolojisi bilinmeyen jinekolojik kanamalar, yumurtalık, rahim
veya göğüs kanseri, gebelik ve laktasyon. GONAL-f®, aşağıdaki durumlarda etkili bir cevap alınmadığı takdirde kontrendikedir. Kadınlarda:
Primer over yetmezliği, cinsel organların gebeliğe uyumsuzluk yaratan
malformasyonları, rahmin gebeliğe uyumsuzluk yaratan fibroid
tümörleri; Erkeklerde: Primer testis yetersizliği.
Özel kullanım uyarıları ve önlemleri:
Kadınlarda GONAL-f®’in etkili ve emniyetli kullanımı, düzenli olarak
ultrason ile over cevabının izlenmesini, tercihen beraberinde serum
estradiol düzeylerinin ölçümünü gerektirir. Kadınlarda ve erkeklerde
tedavi amacına uygun, etkili en düşük doz kullanılmalıdır. Hastanın
GONAL-f®’i kendi kendine uygulaması, ancak yeterince eğitilmiş
hastalarda ve uzman tavsiyesine uyulması ile gerçekleşebilir. Hastanın
kendine uygulamasının eğitimi esnasında kullanıma hazır kalemin
kullanımı için verilen talimatlara özenle dikkat gösterilmelidir.
GONAL-f®'in ilk enjeksiyonu medikal gözetim altında yapılmalıdır.
Kadınlarda tedavi: Tedaviye başlamadan önce, hastalar özellikle
hipotiroidizm, adrenokortikal bozukluklar, hiperprolaktinemi ve hipofizer
veya hipotalamik tümörler açısından değerlendirilmeli ve uygun tedavi
verilmelidir. Anovulatuvar infertilite ya da ART prosedürleri tedavisi
olarak, foliküler gelişme için stimülasyon tedavisi uygulanan hastalar, bir
hiperstimülasyon gelişimi veya yumurtalık büyümesine maruz kalabilir.
Klinik çalışmalarda, Lutropin alfa ile birlikte uygulandığında, GONAL-f®’e
karşı over hassasiyetinde artma görülmüştür. Ovaryen hiperstimülasyon
sendromu (OHSS) riskli hastalar yakından takip edilmelidir. Eğer ciddi
OHSS meydana gelirse, gonadotropin tedavisi kesilmeli, şayet hâlâ
devam ediyorsa hasta hospitalize edilmeli ve OHSS için özel tedavi
başlatılmalıdır. GONAL-f® ile ovulasyon indüksiyonu yapılan hastalarda,
çoğul gebelik insidansı, doğal gebelikle karşılaştırıldığında artmıştır.
Tedaviye başlamadan önce hastalar potansiyel çoğul gebelik riski
konusunda uyarılmalıdır. Ovulasyon indüksiyonu veya ART için foliküler
gelişimin stimüle edildiği hastalarda düşük gelişmesi sonucu gebelik
kaybının oranı, normal gebelik kayıplarından daha fazladır. Tubal
hastalık hikayesi olan kadınlarda, dış gebelik riski vardır. Üreme sistemi
neoplazilerin bazal riskini artırıp artırmadığı henüz saptanmamıştır.
ART'tan sonra konjenital malformasyonların sıklığı, spontan gebeliğe
göre biraz daha yüksek olabilir. Bunun parental özelliklerin farklılığına
(anne yaşı, sperm özellikleri vs.) ve çoğul gebeliklere bağlı olduğu
düşünülmektedir. Tromboembolik olaylar için kişisel veya aile öyküsü
gibi genellikle bilinen risk faktörleri olan kadınlarda, gonadotropin tedavisi bu riski artırabilir. Erkeklerde tedavi: Yüksek endojen FSH düzeyleri
primer testis yetersizliğinin işaretidir. Böyle hastalar GONAL-f®/hCG
tedavisine cevap vermezler. Tedavinin başlangıcından 4-6 ay sonra,
cevabı değerlendirmek için sperm analizi yapılması önerilir.
Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri: GONAL-f®
ovulasyonu stimüle eden diğer ilaçlarla (Ör. hCG, Klomifen sitrat) birlikte
kullanıldığında foliküler cevapta artış gözlenebilir, bunun yanında,
hipofizer desensitizasyonu indüklemek için GnRH agonisti ya da
antagonisti ile birlikte kullanılması, yeterli derecede over cevabı almak
için ihtiyaç duyulan GONAL-f® dozajını artırabilir. GONAL-f® tedavisi
esnasında klinik olarak belirgin başka ilaç etkileşimi bildirilmemiştir.
Gebelik esnasında kullanım endikasyonu yoktur. Gonadotropinlerle
klinik kullanımda, kontrollü ovaryen hiperstimülasyonu takiben hiç
teratojenik risk bildirilmemiştir. Gebelikte bu ilaca maruz kalındığında,
bu güne kadar malformasyona yol açtığını gösterir bir etki rapor
edilmemiştir. Laktasyon dönemi: GONAL-f®, emzirme döneminde
kullanılmaz.
Araç ve makine kullanmaya etkileri üzerine çalışma yapılmamıştır.
İstenmeyen etkiler:
Enjeksiyon yerinde reaksiyonlar (ağrı, kızarıklık, morarma, enjeksiyon
yerinde şişlik ve / veya irritasyon), baş ağrısı, ve abdominal ağrı, bulantı,
kusma ve ishal, abdominal kramplar ve şişkinlik gibi gastrointestinal
4/8
semptomlar bildirilmiştir. Kadınlarda tedavi GONAL-f® ile tedavi esnasın
da, over kistleri, yumurtalığın hiperstimülasyonu, tromboembolik olay
gelişme olasılığı göz önünde bulundurulmalıdır. Seyrek olarak over
torsiyonu, çok seyrek olarak da hafif sistemik allerjik reaksiyonlar (eritem,
döküntü, yüzde şişlik, ürtiker, ödem, nefes darlığı), astım alevlenmesi
görülebilir. Ayrıca anafilaktik reaksiyonları da içeren ciddi allerjik reaksiyonlar rapor edilmiştir. Erkeklerde tedavi jinekomasti, varikosel, akne,
enjeksiyon yeri reaksiyonları (ağrı, kızarıklık, morarma, enjeksiyon
yerinde şişlik ve / veya irritasyon) ve kilo artışı görülebilir.
Doz aşımı:
GONAL-f®’in aşırı doz etkileri bilinmemektedir, yine de ovaryen
hiperstimülasyon sendromunun oluşması beklenebilir.
Farmakodinamik Özellikler:
“Yardımla üreme teknolojileri ve ovülasyon indüksiyonunda, r-hFSH
(follitropin alfa) ve üriner FSH'yı karşılaştıran klinik çalışmalarda,
GONAL-f®, üriner FSH'ya göre foliküler olgunlaşmanın tetiklenmesi için daha
düşük toplam doz ve daha kısa tedavi süresi ile sonuç alındığından daha yüksek
etkili bulunmuştur.” Yardımla üreme teknolojilerinde, Gonal-f®, üriner FSH ile
karşılaştırıldığında, daha düşük toplam dozda ve daha kısa tedavi periyodunda
daha yüksek sayıda oosit elde edilmesini sağlamıştır. Saklamaya yönelik özel
tedbirler: 2°C - 8°C'de buzdolabında saklayınız. Dondurmayınız. Raf ömrü içinde,
buzdolabının olmadığı durumlarda ürün 25°C ya da altında 3 aya kadar saklanabilir.
3 ay içinde kullanılmazsa atılmalıdır.
Ambalajın niteliği ve içeriği:
300 IU (22 mikrogram)/0.5 ml ambalajında 1 adet kullanıma hazır dolu enjeksiyon
kalemi ve uygulama için kalem ile kullanılacak 5 iğne. 450 IU (33 mikrogram)/0.75
ambalajında 1 kullanıma hazır dolu enjeksiyon kalemi ve uygulama için kalem ile
kullanılacak 7 iğne. 900 IU (66 mikrogram) /1.5 ml ambalajında 1 kullanıma hazır
dolu enjeksiyon kalemi ve uygulama için kalem ile kullanılacak 14 iğne.
Dozaj ve uygulama:
Luveris tedavisi, doğurganlık sorunlarının tedavisinde uzmanlaşmış bir
doktorun denetimi altında başlatılmalıdır. Kendi kendine uygulama
sadece, iyi motive edilmiş, yeterli eğitimi almış ve uzman tavsiyesi
alabilecek hastalar tarafından gerçekleştirilmelidir. Böbrek ve karaciğer
fonksiyon bozukluğu olan hastalarda güvenlilik, etkililik ve farmakokinetik özellikleri belirlenmemiştir.
Luveris, FSH ile birlikte günlük enjeksiyonların ardından verilmelidir.
Tedavi herhangi bir zamanda başlayabilir.
Luveris subkutan uygulama için planlanmıştır. Luverisin ilk enjeksiyonu
doğrudan tıbbi gözetim altında gerçekleştirilmelidir. Toz kullanımdan
hemen önce sağlanan çözücü ile sulandırılmalıdır.
Tedavi, ayrı ayrı hastaların verdiği tepkiye göre şekillendirilecektir.
Önerilen rejim 75-150 IU FSH ile günde bir kez 75 IU lutropin alfa ile
başlar. (yani bir Luveris flakonu).
Luverisin follitropin alfaya karşı over duyarlılığını artırdığı gösterilmiştir.
Bir FSH doz artışı uygun görülürse, doz adaptasyonu tercihen 7-14 gün
aralıklarla ve tercihen 37,5 IU - 75 IU artışla olmalıdır. Herhangi bir
siklusun stimülasyon süresini 5 haftaya kadar uzatmak uygun olabilir.
Optimal bir cevap alındığı zaman, son Luveris ve FSH enjeksiyonlarından 24-48 saat sonra 250 mikrogramlık tek bir r-hCG enjeksiyonu
veya 5,000 IU'dan 10,000 IU'ya kadar hCG enjeksiyonu uygulanmalıdır.
Hastanın hCG uygulamasının yapıldığı gün veya ertesi günü cinsel
ilişkiye girmesi tavsiye edilmektedir. Alternatif olarak intrauterin inseminasyonu (IUI) uygulanabilir.
Ovülasyondan sonra luteotrofik aktiviteli (LH/hCG) maddelerin eksikliği
korpus luteumun prematür yetmezliğine yol açacağından luteal faz
desteği göz önüne alınmalıdır.
Aşırı cevap alınırsa, tedavi durdurulmalı ve hCG kesilmelidir. Tedavi bir
sonraki siklusta bir önceki siklustan daha düşük bir FSH dozunda tekrar
başlamalıdır.
Ruhsat sahibi: Merck İlaç Ecza ve Kimya Tic. A.Ş.
Rüzgarlıbahçe Mah. Kavak Sok. No 16/18 Kavacık Ticaret Merkezi B.
Blok Kat: 4-5-6
34810 Kavacık - Beykoz / İstanbul
Tel:+90 216 578 77 84 Fax : +90 216 469 09 22
www.merck.com.tr e-mail: [email protected]
Ruhsat no: 119/27, (119/28, 119/26)
Ruhsat tarihi: 08.02.2006
KÜB onay tarihi: 08.04.2015
Perakende satış fiyatı: KDV dahil,
GONAL-f® 450 IU 1 FLAKON 382.27 TL,
GONAL-f® 1050 IU 1 FLAKON 765,83 TL,
GONAL-f® 75 IU (5,5 mcg) 1 FLAKON 62.68 TL,
GONAL-f® 300 IU (22 mcg) kullanıma hazır dolu enjeksiyon kalemi
237,34 TL,
GONAL-f® 450 IU (33 mcg) kullanıma hazır dolu enjeksiyon kalemi
344,64 TL,
GONAL-f® 900 IU (66 mcg) kullanıma hazır dolu enjeksiyon kalemi
660,51 TL
Kontraendikasyonlar:
Gonadotrofinlere ve herhangi bir yardımcı maddeye aşırı duyarlılık; over
veya meme kanseri; hipotulamus ve hipofiz bezi tümörleri; polikistik
ovaryen sendroma bağlı olmayan ve bilinmeyen menşeli ovaryen
büyüme veya kist; bilinmeyen menşeli jinekolojik hemoraj.
Normal gebelik mümkün olmadığında kullanmayın (ör. primer over
yetmezliği, gebelikle uyumsuz cinsel organların malformasyonu veya
gebelikle uyumsuz uterusun fibroid tümörleri).
Tedbirler:
Porifirialı veya porifiria aile geçmişi olan hastalarda Luveris akut atak
riskini arttırabilir. Bozulma veya bu koşulun ilk ortaya çıkışı tedavinin
kesilmesini gerektirebilir.
Tedaviye başlamadan önce çiftin infertilitesini değerlendirin ve hamilelik
için öngörülen kontra endikasyonları değerlendirin. Hipotiroidizm,
adrenokortikal yetersizlik ve hiperprolaktinemi açısından değerlendirin
ve uygun özel tedavi uygulayın. İlk enjeksiyon doğrudan tıbbi gözetim
altında gerçekleştirilmelidir.
(26.06.2016). Reçete ile satılır.
Daha geniş bilgi için firmamıza başvurunuz.
LUVERIS 75 IU, enjeksiyonluk çözelti tozu ve çözücüsü lutropin
alfa.
Sunum:
Bir flakonda 75 IU lutropin alfa bulunur (rekombinant insan lüteinleyici
hormon, r-hLH).
Endikasyonlar:
Şiddetli LH ve FSH yetmezliği olan erişkin kadınlarda folikül gelişimi
stimülasyonu için Folikül Stimülan Hormon (FSH) preparatlı ile ilişkili
Luveris önerilir.
Kontrollü over stimülasyonuna tabi tutulan kadınlarda belirli bir dereceye
kadar over büyümesi
beklenir ancak aşırı büyüme over
hiperstimülasyon sendromu (OHSS) ile ilişkilidir ve ciddi bir tıbbi olay
olabilir. OHSS için risk faktörleri gençlik, zayıf vücut kütlesi, polikistik
ovaryen sendrom, yüksek eksojen gonadotrofin dozları, yüksek mutlak
veya hızla artan serum estradiol seviyesi ve OHSS geçmişi, yüksek
sayıda gelişen ovaryen foliküller ve ART siklusunda elde edilen oosit.
Hafif veya orta derecede OHSS genellikle kendiliğinden iyileşir. Ciddi
vakalarda gonadotropin tedavisinin sonlandırılması ve hastanın hastaneye yatırılması önerilir.
OHSS veya çoklu gebelik riskini minimize etmek için stimülasyon tedavisi sırasında ultrason tarama hem de estradiol ölçümleri önerilmektedir.
Önerilen Luveris ve FSH dozajına ve uygulama rejimine uygunluk ve
tedavinin dikkatle izlenmesi ovaryen hiperstimülasyon ve çoklu gebelik
riskini minimize edebilir.
Ovülasyon indüksiyonu uygulanan hastalarda çoklu gebelik ve doğum
insidansı doğal konsepsiyon ile karşılaştırıldığında artar. Çoklu konsep-
5/8
siyonun çoğunluğu ikizdir. Çoklu gebelik, özellikle ikiden fazla olanlar,
artan bir advers maternal ve perinatal sonuç riski taşır.
enjeksiyona alerjik/psödo-alerjik reaksiyonu olmadığından emin olmak
için hastanın 30 dakika tıbbi gözetim altında tutulması tavsiye olunur.
Düşükle ve kürtajla gebelik kaybı ovülasyon indüksiyonu için foliküler
büyüme stimülasyonuna uğrayan hastalarda doğal konsepsiyonun
ardından olandan daha yüksektir.
CETROTIDE alt karın duvarına subkutan olarak enjekte edilir. Ürünün
hızlı emilimini kolaylaştırmak için, ürün yavaş hızda enjekte edilerek
enjeksiyon yeri reaksiyonları azaltılabilir. Sabah uygulaması: CETROTIDE ile tedaviye over stimülasyonunun 5. veya 6. gününde (over
stimülasyonu başladıktan 96 ila 120 saat sonra) üriner veya rekombinant gonadotropin ile birlikte başlanmalı ve ovülasyonun indüksiyon
günü dahil gonadotropin tedavisi boyunca devam edilmelidir. Akşam
uygulaması: CETROTIDE ile tedaviye over stimülasyonunun 5.
gününde (over stimülasyonu başladıktan 96 ila 108 saat sonra) üriner
veya rekombinant gonadotropin ile birlikte başlanmalı ve ovülasyonun
indüksiyon gününden bir gece öncesine kadar gonadotropin tedavisi
boyunca devam edilmelidir.
Tübal hastalığı geçmişi olan kadınlar ektopik gebelik riski altındadır.
Fertilite tedavisi için çok sayıda döngüden geçmiş kadınlarda hem iyi
hem de kötü huylu üreme sistemi neoplazmaları rapor edilmiştir.
Gonadotrofin tedavisinin, infertil kadınlardaki riski artırıp artırmadığı
bilinmemektedir.
ART'den sonra konjenital malformasyon prevalensi, parental faktörler
ve çoklu gebelik nedeniyle kendiliğinden gebe kalmalardan biraz yüksek
olabilir.
Gonadotrofinlerle tedavi risk altında olduğu tespit edilmiş kadınlarda
tromboembolik olay riskini artırabilir. Ancak, gebeliğin kendisi ve OHSS
de taşınan tromboembolik olay riskini artırır.
Luveris gebelik ve emzirme esnasında kullanılmamalıdır.
Yan Etkileri:
Yaygın advers ilaç etkileşimleri enjeksiyon bölgesi reaksiyonları, baş
ağrısı, mide bulantısı, kusma, abdominal ağrı/rahatsızlık, diyare, pelvik
ağrı, hafif veya orta derecede ovar iyen hiperstimülasyon sendromu ve
ilişkili semptomlar, ovariyen kist, göğüs ağrısı.
Nadir adneksiyal torsiyon ve hemoperitoneumun olasılığı.
Çok seyrek: Anafilaktik reaksiyonlar ve şok dahil olmak üzere hafif ila
şiddetli aşırı duyarlılık reaksiyonları Tromboembolizm
Reçete yazanlar diğer yan etkilerle ilgili olarak Kısa Ürün Bilgisine
bakmalıdır.
Legal kategori:
POM.
Temel NHS Fiyatı:
1 flakon paket boyutu 60,29 £.
Pazarlama Ruhsatı Sahibi ve Rakamlar:
Merck Serono Europe Ltd, 56 Marsh Wall, London, E14 9TP;
EU/1/00/155/004.
Fiyat bilgileri dahil daha fazla bilgi için bağlantı kurun:
İngiltere: Merck Serono Ltd, Bedfont Cross, Stanwell Road, Feltham,
Middlesex, TW14 8NX. Tel: 020 8818 7373.
İrlanda Cumhuriyeti: Merck Serono, 4045 Kingswood Road, Citywest
Business Campus, Dublin 24. Tel: 01 4687590.
Hazırlama tarihi: Mayıs 2015.
İş Torba No: LUV15-0001
CETROTIDE® 0.25 mg enjeksiyonluk çözelti için toz ve çözücü
Kalitatif ve kantitatif bileşim: Herbir flakon 0.25 mg setroreliks içerir.
Beraberinde verilen çözücü ile sulandırdıktan sonra, herbir ml çözelti
0.25 mg setroreliks içerir.
Terapötik endikasyonlar:
Kontrollu ovaryen stimulasyonu takiben, oosit toplanması ve yardımla
üreme teknolojileri uygulanan hastalarda prematüre ovulasyonun
engellenmesi için kullanılır. Klinik çalışmalarda CETROTIDE insan
menopozal gonadotropin (HMG) ile birlikte kullanılmıştır, ancak, sınırlı
sayıda olmakla beraber rekombinant folikül uyarıcı hormonla (FSH)
birlikte kullanıldığında da benzer etki gözlenmiştir.
Pozoloji ve uygulama şekli:
CETROTIDE yalnız bu alanda deneyimli uzmanlar tarafından reçete
edilmelidir. İlk CETROTIDE uygulaması bir hekimin gözetimi altında ve
olası alerjik/psödo-alerjik reaksiyonların tedavisinin mevcut olduğu
şartlar altında yapılmalıdır. Ardından yapılacak olan enjeksiyonlar,
hastanın aşırı duyarlılık reaksiyonlarını gösteren semptomlar ve belirtiler konusunda bilgilendirilmesi ve bu olayların acil tıbbi girişim gerektireceğini anlamış olması durumunda, kendi kendisine uygulanabilir.
Uygulama şekli:
Bir flakon içeriği (0.25 mg setroreliks) sabah ya da akşam olmak üzere
24 saat aralıklarla, günde bir defa uygulanır. İlk uygulamayı takiben,
Özel popülasyonlara ilişkin ek bilgiler:
Orta derecede veya şiddetli renal ve hepatik yetmezliği olanlarda
kullanılmamalıdır. Pediatrik populasyonda uygulanmaz. Menopoz
sonrasında uygulanmaz. Kontrendikasyonlar: Etkin maddeye veya
gonadotropin salıverici hormonun (GnRH) yapısal analoglarından
herhangi birine, ekstrinsik peptid hormonlara veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık, gebelik ve laktasyon,
menopoz sonrası kadınlar, orta derecede veya şiddetli renal ve hepatik
yetmezliği olan hastalar.
Özel kullanım uyarıları ve önlemleri:
Hikayesinde alerjik eğilim bilinen veya aktif alerjik durum belirtileri olan
kadınlarda özel önlem alınmalıdır. CETROTIDE ile tedavi aşırı alerjik
durumdaki kadınlara tavsiye edilmez.Over stimülasyonu sırasında veya
onu takip eden günlerde ovaryen hiperstimülasyon sendromu görülebilir. Bu olay gonadotropinlerle stimülasyon prosedürünün bir riski olarak
değerlendirilmelidir. Ovaryen hiperstimülasyon sendromu semptomatik
olarak tedavi edilmelidir, örn. istirahat, intravenöz elektrolitler/ kolloidler
ve heparin tedavisi. Luteal faz desteği üreme sağlığı merkezlerinin kendi
protokollerine göre yapılmalıdır. Tekrarlanan bir over stimülasyon
prosedürü sırasında CETROTIDE uygulaması ile ilgili henüz sınırlı bir
deneyim vardır. Bu nedenle tekrarlayan sikluslarda CETROTIDE
sadece dikkatli bir risk/yarar değerlendirmesinden sonra kullanılmalıdır.
Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri:
İn vitro incelemeler, sitokrom P450 ile metabolize edilmiş veya bazı
diğer yollar ile glukuronize veya konjuge edilmiş ilaçlarla etkileşmenin
olası olmadığını göstermiştir. Ancak, yaygın olarak kullanılan tıbbi
ürünler, gonadotropinler ya da histamin salıverilmesini indükleyen ilaçlar
ile ilaç etkileşim bulgusu olmamasına rağmen, etkileşim olasılığı
tamamen gözardı edilemez.
Gebelik ve laktasyon:
Gebelikte kullanım kategorisi X'dir. CETROTIDE gebelik döneminde
uygulandığı taktirde ciddi doğum kusurlarına yol açmaktadır. Çocuk
doğurma potansiyeli olan kadınlar tedavi suresince etkili doğum kontrolu
uygulamak
zorundadırlar.
CETROTIDE
gebelik
döneminde
kontrendikedir. Setroreliks’in insan sütüyle atılıp atılmadığı bilinmemektedir. CETROTIDE emzirme döneminde kontrendikedir.
İstenmeyen etkiler:
Sistemik allerjik/psödo alerjik reaksiyonlar (hayatı tehdit edebilecek
anaflaksi dahil), başağrısı, bulantı, stimülasyon prosedürünün riski
olarak, hafif-orta şiddette ovaryen hiperstimülasyon sendromu (WHO
derece I ya da II) görülebilir, ciddi ovaryen hiperstimülasyon sendromu
(WHO derece III), enjeksiyon yerinde eritem, kaşınma ve şişme gibi
lokal reaksiyonlar (Bunlar genellikle hafif yoğunlukta ve geçicidir. 0.25
mg setroreliks’in çoklu enjeksiyonlarını takiben, klinik çalışmalarda
rapor edilen sıklık %9.4 dür.). Doz aşımı ve tedavisi: İnsanlarda doz
aşımı, etki süresinin uzaması ile sonuçlanabilir, ancak akut toksik
etkilerin gelişme olasılığı bulunmamaktadır. Kemiricilerde yapılmış akut
toksisite çalışmalarında, farmakolojik olarak etkili subkutan dozun 200
katından yüksek setroreliks dozlarının periton içine uygulanmasından
sonra spesifik olmayan toksik semptomlar gözlenmiştir. Raf ömrü: Raf
ömrü 24 aydır. Çözelti hazırlandıktan sonra hemen kullanılmalıdır.
Saklamaya yönelik özel tedbirler:
25ºC’nin altındaki oda sıcaklıklarında ve kutusunda saklayınız.
Ambalajın niteliği ve içeriği:
Kauçuk tıpa ile kapalı Tip I cam flakonlarda 1'lik yada 7'lik ambalajlarda
mevcuttur.
4/8
6
Perakende Satış Fiyatı: 70,11 TL (22.02.2016).
Ruhsat tarih ve no: 22.09.2003-114/72
Ruhsat Sahibi: Merck İlaç Ecza ve Kimya Tic. A.Ş., Rüzgarlıbahçe
Mah. Kavak Sokak. No: 16-18 Kavacık Ticaret Merkezi Kat: 4-5-6
PK.34810, Kavacık – Beykoz/İstanbul
Üretici: Baxter Oncology GmbH, Almanya Referans KÜB onay tarihi:
08.04.2015
Reçete ile satılır. Daha ayrıntılı bilgi için firmamıza başvurunuz.
OVITRELLE® 250 mikrogram / 0,5 ml, önceden doldurulmuş
kalemde enjeksiyonluk çözelti koriogonadotropin alfa.
Sunum:
Bir önceden doldurulmuş kalemde 0,5 ml çözeltide (yaklaşık 6.500 IU
eşdeğeri) 250 mikrogram koriogonadotropin alfa bulunur.
Endikasyonlar:
(i)
İn vitro fertilizasyon (IVF) gibi yardımcı üreme tekniklerinden önce
süperovülasyon tedavisi gören erişkin kadınlar: Ovitrelle foliküler
büyümenin stimülasyonunun ardından nihai foliküler matürasyon
ve luteinizasyonu tetiklemek için verilir,
(ii)
Anovulatuar veya oligo-ovulatuar yetişkin kadınlar: Ovitrelle
anovülatuar veya oligo-ovülatuar hastalarda foliküler büyüme
stimülasyonunun ardından ovülasyonu ve luteinizasyonu
tetiklemek için verilir.
Nadiren; hemoperitoneum, akut pulmoner distres, over torsiyonu ve
tromboembolizm nedeniyle şiddetli OHSS komplike hale gelebilir.
Önerilen Ovitrelle dozajına, uygulama rejimine uyma ve tedavinin
dikkatli izlenmesi OHSS riskini ve çoklu gebeliği minimize edecektir.
Ovülasyon indüksiyonu uygulanan hastalarda çoklu gebelik ve doğum
insidansı doğal konsepsiyon ile karşılaştırıldığında artar. Çoklu konsepsiyonun çoğunluğu ikizdir. ART'nin ardından çoklu gebelik riski konulan
embriyo sayısıyla ilişkilidir.
Hem anovülatuar hastalarda ve ART uygulanan kadınlarda düşük oranı
normal popülasyonda bulunandan daha yüksek fakat diğer fertilite
problemleri olan kadınlarda benzerdir.
Tübal hastalığı geçmişi olan kadınlar ektopik gebelik riski altındadır.
Destekli Üreme Tekniklerinden (ART) sonra konjenital malformasyon
insidansı, parental faktörler ve çoklu gebelik nedeniyle kendiliğinden
gebe kalmalardan biraz yüksek olabilir.
Ciddi advers olaylar anafilaktik reaksiyonlar dahil alerjik reaksiyonlar ve
şok ve şiddetli ovaryen hiperstimülasyon sendromudur.
Dozaj ve uygulama:
Subkütan uygulama için.
Tromboembolizmde nadir olasılık.
Ovitrelle tedavisi, doğurganlık sorunlarının tedavisinde uzmanlaşmış
bir doktorun denetimi altında yapılmalıdır. Maksimum doz 250
mikrogramdır.
hCG uygulamasından sonra ektopik gebelik, over torsiyonu ve diğer
komplikasyonlar bildirilmiştir ve ART ile ilişkili eş zamanlı etki olarak
kabul edilir. Reçete yazanlar diğer yan etkilerle ilgili olarak Kısa Ürün
Bilgisine bakmalıdır.
Legal kategori:
POM.
Aşağıdaki dozlama rejimi uygulanmalıdır:
(i)
Destekli üreme tekniklerinde OHSS riski > 3.000 pg/ml (11.000 pmol/l)
serum estradiol seviyesiyle ve çapı 11 mm veya daha fazla olan 18'den
fazla folikülle artar. Estradiol seviyesi > 5.500 pg/ml (20.000 pmol/L)
olduğunda ve/veya toplamda 30 veya daha fazla folikül olduğunda hCG
uygulamasının kesilmesi önerilir.
Destekli üreme tekniklerinden önce süperovülasyon tedavisi
gören kadınlar: Bir önceden doldurulmuş Ovitrelle (250
mikrogram) kalemi FSH veya hMG preparatının son
uygulanmasından sonra 24 - 48 saatte uygulanır, yani optimal
folliküler büyüme stimülasyonu elde edildiğinde.
Temel NHS Fiyatı:
1 önceden doldurulmuş kalem - 31,38 £.
Pazarlama Ruhsatı Sahibi ve Rakamlar:
Merck Serono Europe Ltd, 56 Marsh Wall, London, E14 9TP;
EU/1/00/165/008.
(ii)
Anovulatuar veya oligo-ovulatuar kadınlar:
Bir önceden doldurulmuş Ovitrelle (250 mikrogram) kalemi optimal
folliküler büyüme stimülasyonu elde edildikten sonra 24 - 48 saatte Fiyat bilgileri dahil daha fazla bilgi için bağlantı kurun:
uygulanır. Hastanın Ovitrelle enjeksiyonunun yapıldığı gün veya
İngiltere: Merck Serono Ltd, Bedfont Cross, Stanwell Road, Feltham,
ertesi günü cinsel ilişkiye girmesi tavsiye edilmektedir.
Middlesex, TW14 8NX. Tel: 020 8818 7373.
İrlanda Cumhuriyeti: Merck Serono, 4045 Kingswood Road, Citywest
Kontraendikasyonlar:
Business Campus, Dublin 24. Tel: 01 4687590.
Hipotulamus ve hipofiz bezi tümörleri, etkin madde veya herhangi bir
yardımcı maddeye aşırı duyarlılık, polikistik ovaryen sendroma bağlı Hazırlama tarihi: Mayıs 2015.
İş Torba No: OVI15-0001
olmayan ve
bilinmeyen menşeli ovaryen büyüme veya kist, etiyolojisi bilinmeyen
jinekolojik hemoraj, ovaryen, üterin veya meme kanseri, önceki 3 ayda Gonadotrofinlerle tedavi risk altında olduğu tespit edilmiş kadınlarda
ekstrauterin gebelik, aktif tromboembolik rahatsızlıklar.
tromboembolik olay riskini artırabilir. Ancak, gebeliğin kendisi ve OHSS
de taşınan tromboembolik olay riskini artırır.
Ovitrelle etkili bir cevap alınamıyorsa erkeklerde kullanılmamalıdır.
Ovitrelle uygulaması yanlış pozitif gebelik testi sonuçlarına götüren
Tedbirler:
serum veya üriner hCG'nin immünolojik tespitini engelleyebilir (10 güne
Ovitrelle'nin kendi kendine uygulanması sadece, yeterli eğitimi almış ve kadar).
danışabileceği uzman olan hastalar tarafından gerçekleştirilmelidir.
Tedavi sırasında minör tiroid stimülasyonu mümkündür. Ovitrelle
Tedaviye başlamadan önce çiftin infertilitesini değerlendirin ve hamilelik gebelik ve emzirme esnasında kullanılmamalıdır.
için öngörülen kontra endikasyonları değerlendirin. Hipotiroidizm,
adrenokortikal yetersizlik, hiperprolaktinemi ve pituiter veya hipotalamik Yan Etkileri:
tümörleri açısından değerlendirin ve uygun tedavi verilir. Böbrek ve Yaygın advers ilaç reaksiyonları enjeksiyon bölgesi reaksiyonları, baş
karaciğer fonksiyon bozukluğu olan hastalarda güvenlilik, etkililik ve ağrısı, yorgunluk, kusma/mide bulantısı, abdominal ağrı, hafif veya orta
farmakokinetik özellikleri belirlenmemiştir.
derecede ovaryen hiperstimülasyon sendromudur.
Over stimülasyonu uygulanan hastalarda over hiperstimülasyon
sendromu (OHSS) geliştirme riski artar. OHSS ciddi bir tıbbi olay olabilir
ancak hCG kesilerek önlenebilir.
OHSS riskini minimize etmek için stimülasyon tedavisi sırasında ve
öncesinde ultrason tarama hem de estradiol ölçümleri önerilmektedir.
Anovülasyonda OHSS riski > 1.500 pg/ml (5.400 pmol/l) serum estradiol
seviyesiyle ve çapı 14 mm veya daha fazla olan 3'ten fazla folikülle artar.
CRİNONE® %8 vajinal jel
Formülü:
Her vajinal aplikatör aktif madde olarak 90 mg progesteron ve koruyucu
madde olarak sorbik asit içerir.
Endikasyonlar:
1. Estrojen replasman uygulamalarında ek tedavi. 2. Olası hormonal
7/8
dengesizliğe bağlı bozukluklar - Premenstrual sendroma bağlı rahim
krampları ve anormal / ağrılı kasılmalar. - Organik patoloji yokluğunda
disfonksiyonel rahim kanaması - Estrojen tedavisi görenlerde sekonder
amenore 3. İnfertilite tedavisi Progesteron eksikliği dokümante edilmiş
veya progesteron eksikliğinden şüphelenilen kadınlarda, Yardımcı
Üreme Teknikleri (ART) uygulamalarının bir bölümü olarak progesteron
takviyesi veya progesteron replasmanı.
Kontrendikasyonları:
1. Göğüste veya genital organlarda bilinen veya şüphelenilen malignansi. 2. Missed abortion (atlanmış düşük). 3. Teşhis edilmemiş rahim
kanaması. 4.Aktif tromboflebit veya tromboembolik bozukluklar veya
hormona bağlı bir tromboflebit veya tromboembolik bozukluklar geçmişi.
5. Karaciğer fonksiyon bozukluğu veya karaciğer hastalığı. 6. Crinone
formülasyonunun bileşenlerinden herhangi birine karşı bilinen hipersensitivite.
Uyarılar/önlemler:
Crinone ile trombotik bozukluklar bildirilmemiştir. Bununla birlikte, bazı
araştırmalarda, hormon replasman tedavisine bağlı olarak tromboflebit
ve/veya tromboembolik bozukluklarda bir artış riski bildirilmiştir. Hormon
replasman tedavisi sırasında hekim, trombotik bozukluklar (tromboflebit,
retinal tromboz, serebral embolizm ve pulmoner embolizm dahil)
olasılığına karşı dikkatli olmalı ve bunların erken belirtilerine karşı hazır
bulunmalıdır. Bunlardan herhangi birinin meydana gelmesi veya
şüphelenilmesi halinde hormon replasman tedavisi hemen kesilmelidir.
Trombotik bozukluklara ilişkin risk faktörü taşıyan hastalar dikkatle
gözlenmelidir. Tedavi öncesi ve sırasında periyodi muayenelerde tıbbi
anamnez ve fiziki
muayenede özellikle göğüsler ve pelvik organlar
üzerinde durulmalı ve bir Papanicolaou smear alınmalıdır. Progestojenler bir ölçüde sıvı tutulmasına neden olabilecekleri için bu faktörden
etkilenebilecek epilepsi, astım, migren ve kalp veya böbrek fonksiyon
bozukluğu gibi hastalıkları olan kadınların dikkatle gözlem altında
tutulması gerekir. Bütün düzensiz vajinal kanama vakalarında olduğu
gibi ara kanama vakalarında, organik hastalığın bulunup bulunmadığını
değerlendirmek üzere diyagnostik uygulamalar gerekli olabilir. Depresyon geçmişi olan hastalar dikkatle gözlenmeli ve depresyon ciddi bir
ölçüde tekrar ortaya çıkarsa Crinone kesilmelidir. Progestojenlerle
tedavi, postmenopozal semptomların ortaya çıkışını maskeleyebilir.
Progestojenlerin endometriyum gibi organların yapısında ve patolojisindeki etkisi nedeniyle ilgili numuneler verilen patologlara, progestojen
tedavisi uygulandığı söylenmelidir. Progestojenler önceden mevcut
porfirya
belirtilerini kötüleştirebilir. Bu nedenle, bu gibi hastalarda
Crinone kullanılması önerilmez.
Yan etkiler/advers etkiler:
Crinone genellikle iyi tolere edilmektedir. Klinik araştırmalarda, Crinone
tedavisi sırasında aşağıdaki advers etkiler bildirilmiştir: Bütün vücutta karın, sırt, eklem, bacak ağrısı veya perineal ağrı; şişkinlik, göğüslerde
şişkinlik/hassasiyet, yorgunluk, sıcak basması, laktasyon, su tutulması.
Gastrointestinal sistem - konstipasyon, diyare, dispepsi, geğirti,
flatülans, mide ağrısı, mide bulantısı, kusma. Genitoüriner sistem cinsel arzunun azalması, dismenore, disparoni, sık idrara çıkma, lökore,
noktüri, vajinal kaşıntı/ iritasyon, vajinal kanama ve lekelenme, vajinal
sekresyonda artma. Sinir sistemi - baş dönmesi, depresyon, ruhsal
durumda değişkenlik, başağrısı, uykusuzluk, iritabilite, sinirlilik,
somnolans. Cilt - akne, genital prürit. Yukarıdaki bütün olaylarla Crinone
tedavisinin ilişkisi bilinmemektedir. Çoğu yan etki hafif ve geçicidir ve
Crinone tedavisinin sürdürülmesi ile ortadan kalkmaktadır.
uygulamaya devam edin. Önerilen günlük dozdan fazlasını uygulamayın. Olağan Doz Aralığı:
Crinone %4 (45 mg) veya Crinone %8 (90 mg). Dozaj programında, bir
menstruel siklusun veya estrojen sikluslarının 28 gün olduğu ve 1.
günün, kanamanın veya siklik estrojen tedavisinin ilk günü olduğu kabul
edilmektedir. ESTROJEN REPLASMAN UYGULAMALARINDA EK
TEDAVİ: 28 günlük her bir estrojen tedavisinin son 12 gününde, gün
aşırı (6 uygulama) bir vajinal Crinone uygulaması. OLASI HORMONAL
DENGESİZLİKLERLE İLGİLİ BOZUKLUKLAR: Estrojen verilerek
hazırlanmış kadında, tercihen sabahları olmak üzere toplam 6 doza
kadar gün aşırı bir vajinal Crinone uygulaması. İNFERTİLİTE TEDAVİSİ
- ART UYGULAMASINDA PROGESTERON TAKVİYESİ VEYA
REPLASMANI: Progesteron eksikliğinden şüphelenilen, normal olarak
ovülasyon görülen kadınlarda progesteron takviyesi olarak, dokümante
edilen ovülasyondan sonra başlamak üzere günde bir veya iki kez
Crinone %8 (90 mg) uygulaması. Çoğu kadında günde 90 mg ile cevap
alınır. Gebelik meydana gelirse tedavi 12 haftaya kadar devam edebilir.
Luteal faz eksikliği gibi bir progesteron eksikliğinden şüphelenilen,
normal olarak ovülasyon görülen kadınlarda daha düşük dozlar
kullanılabilir. Bir ART rejiminin bir bölümü olarak endometrial takviye için
günde bir veya iki kez Crinone %8 (90 mg) ile uygulamaya başlanır.
Çoğu kadında günde 90 mg ile cevap alınır. Bununla birlikte bazı
kadınlarda günde iki kez 90 mg gerekli olabilir. Gebelik kesinleşirse, 12
haftaya kadar Crinone %8 (90 mg)'a devam edilir. Crinone %8 (90 mg)
her gün aynı zamanda uygulanmalıdır. %4'lük jelden doz artışının,
ancak %8'lik jel kullanılarak gerçekleştirilebileceği unutulmamalıdır.
Uygulanan %4'lük jelin hacminin artırılması, absorbe olan progesteron
miktarını artırmamaktadır.
Saklama koşulları:
25°C'nin altındaki oda sıcaklığında saklayınız.
Ticari takdim şekli: Crinone v %8, 15 aplikatör içeren ambalajlarda
sunulmaktadır.
Ruhsat sahibi: Merck İlaç Ecza ve Kimya Tic. A.Ş., Rüzgarlıbahçe
Mah. Kavak Sokak. No : 16-18, Kavacık Ticaret Merkezi, Kat : 4-5-6,
PK. 34810, Kavacık – Beykoz/İstanbul
İmal yeri: Central Pharma Ltd. İngiltere
Ruhsat tarihi: 10.11.2000
Ruhsat no: 109/16
Referans prospektüs onay tarihi: 08.04.2015
Perakende satış fiyatı: 63.42 TL. (26.06.2016).
Reçete ile satılır. Daha geniş bilgi için firmamıza başvurunuz.
İlaç etkileşmeleri ve diğer etkileşmeler:
Diğer ilaçlarla hiç bir etkileşim bildirilmemiş olmakla birlikte Crinone'un
diğer intravajinal preparatlarla birlikte kullanılması önerilmemektedir.
Hastaya intravajinal antifungal bir tedavi uygulanıyorsa oral tedaviye
geçilmesi önerilir. Laboratuvar testleri etkileşimleri: Crinone'un laboratuvar testleri üzerinde herhangi bir etkisinin olup olmadığı bilinmemektedir.
Kullanım şekli ve dozu:
Crinone ile intravajinal tedavi, spesifik endikasyona ve her hastanın
terapötik cevabına göre ayarlanmalıdır. En düşük etkin doz uygulanmalıdır. Crinone'un, endometriyumda sekretuar bir transformasyonu
endüklemek üzere vajinal yoldan uygulanması ancak endometriyum
endojen veya eksojen estrojen ile yeterli ölçüde hazırlanmışsa endikedir. Bu gibi vakalarda, gebelik meydana gelmemişse Crinone tedavisinin
kesilmesinden sonraki 3-7 gün içinde kesilme kanaması meydana gelir.
Crinone, temin edilen aplikatörle intravajinal olarak uygulanır. Crinone
her gün aynı zamanda uygulanmalıdır. Bir Crinone dozunu unuttuğun
hatırlar hatırlamaz, o dozu hemen uygulayın ve önceki programa göre
8/8









