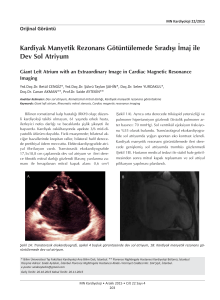
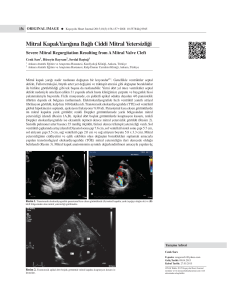
T.C. SAĞLIK BAKANLIĞI KARTAL KOŞUYOLU YÜKSEK İHTİSAS
advertisement

T.C. SAĞLIK BAKANLIĞI KARTAL KOŞUYOLU YÜKSEK İHTİSAS EĞİTİM VE ARAŞTIRMA HASTANESİ Kardiyoloji Kliniği Mitral Darlığı Hastalarında Efora Pulmoner Basınç Yanıtına Anjiyotensin II Reseptör Blokerlerinin Etkisinin Hemodinamik, Biyokimyasal ve Ekokardiyografik Parametrelerle Değerlendirilmesi Uzmanlık Tezi Dr. Hekim Karapınar Tez danışmanı Doç. Dr. Ali Metin Esen Klinik şefi Doç. Dr. Cevat Kırma Aralık 2007 1 İçindekiler ÖZET ............................................................................................................... 4 1. GİRİŞ VE AMAÇ.............................................................................................. 5 2. GENEL BİLGİLER ........................................................................................... 6 2.1 MİTRAL KAPAĞIN YAPISI VE MİTRAL DARLIĞI ................................................................. 6 2.2 ETİYOLOJİ-ROMATİZMAL KARDİT .................................................................................. 7 2.3 MİTRAL DARLIĞININ DOĞAL SEYRİ................................................................................ 8 Tablo 1. Önemli MD’de doğal seyir ............................................................................... 9 2.4 MİTRAL DARLIĞININ TANISI VE DEĞERLENDİRİLMESİ ........................................................ 9 2.4.A Fizik Muayene Bulguları ...................................................................................... 9 2.4.B Elektrokardiyografi, Konvansiyonel Tele kardiyogram ve Laboratuar Bulguları............. 10 2.4.C Transtorasik Ekokardiyografi, Transözefajiyal Ekokardiyografi Bulguları ve Diğer Ekokardiyografik Yöntem Bulguları.................................................................................... 10 2.4.D Efor Testi ve Stres Doppler Ekokardiyografi........................................................... 11 2.4.E Yeni Tetkikler................................................................................................... 12 2.5 MİTRAL DARLIĞININ TEDAVİSİ ................................................................................... 12 2.5.A Tıbbi Tedavi .................................................................................................... 12 2.5.B Girişimsel ve Cerrahi Tedavi............................................................................... 14 2.6 MİTRAL DARLIĞI, PULMONER HİPERTANSİYON VE RAS İLİŞKİSİ ......................................... 15 Tablo 2. Pulmoner Hipertansiyonun Tanısal sınıflaması.................................................... 17 Şekil 1. PHT gelişiminin şematik özeti .......................................................................... 18 Şekil 2. Pulmoner vasküler remodelling’i engelleyen ilaçların etki yerleri ............................. 18 2.7 MİTRAL DARLIĞI VE PULMONER HİPERTANSİYON TAKİBİNDE KULLANILAN LABORATUAR BELİRTEÇLERİ ................................................................................................................... 19 2.8 MİTRAL DARLIĞI VE PULMONER HİPERTANSİYONDA KULLANILAN KONVANSİYONEL VE YENİ EKOKARDİYOGRAFİK PARAMETRELER ..................................................................................... 21 3. YÖNTEM .................................................................................................... 22 3.1 ÖRNEKLEM SEÇİMİ ................................................................................................... 22 Tablo 3. Dışlama kriterleri ......................................................................................... 22 Tablo 4: hasta alım diyagramı..................................................................................... 23 3.2 EKOKARDİYOGRAFİK İNCELEME VE VERİLERİN ANALİZİ ................................................... 23 3.3 EFOR KAPASİTESİ DEĞERLENDİRMESİ ........................................................................... 23 3.4 STRES EKO VE DOPPLER PARAMETRELERİNİN ELDE EDİLMESİ VE ANALİZİ ............................ 24 3.5 KAN ÖRNEKLERİNİN ELDE EDİLMESİ, SAKLANMASI VE ÇALIŞILMASI ................................... 24 3.6 TEDAVİ TAKİP VE DEĞERLENDİRİLMESİ ........................................................................ 25 3.7 VERİLERİN İSTATİKSEL DEĞERLENDİRİLMESİ ................................................................. 26 4. BULGULAR .................................................................................................. 27 4.1 HASTALARIN KLİNİK VE DEMOGRAFİK ÖZELLİKLERİ, TAKİP SONUÇLARI .............................. 27 Tablo 5a: Hastaların demografik ve tedavi öncesi ekokardiyografik özellikleri ...................... 27 Tablo 5b: Hastaların demografik ve tedavi öncesi ekokardiyografik özellikleri ...................... 28 Tablo 6: örneklemin genel özellikleri ............................................................................ 29 4.2 EKOKARDİYOGRAFİ, DOPPLER VE STRES DOPPLER SONUÇLARI........................................... 29 Şekil 3.................................................................................................................... 29 Şekil 4.................................................................................................................... 29 Şekil 5 ................................................................................................................... 30 Şekil 6.................................................................................................................... 30 Şekil 7.................................................................................................................... 31 Şekil 8.................................................................................................................... 31 Şekil 9.................................................................................................................... 32 2 4.3 EFOR TESTİ SONUÇLARI ............................................................................................ 32 Şekil 10 .................................................................................................................. 33 Tablo 7. Efor testi sonuçları........................................................................................ 33 4.4 BİYOKİMYA SONUÇLARI ............................................................................................ 34 Şekil 11 .................................................................................................................. 34 Tablo 8................................................................................................................... 35 Şekil 12 .................................................................................................................. 35 Şekil 13 .................................................................................................................. 36 5. TARTIŞMA................................................................................................... 36 6. SONUÇ ........................................................................................................ 39 7.KAYNAKLAR ................................................................................................ 39 KISALTMALAR: 1. MD- Mitral darlığı 2. PHT- Pulmoner hipertansiyon 3. ARA- Akut romatizmal ateş 4. RAS- Renin-anjiyotensin sistemi 5. ARB- Anjiyotensin reseptör blokeri 6. ACEİ- Anjiyotensin dönüştürücü enzim inhibitörleri 7. TTE- Transtorasik ekokardiyografi 8. TÖE- Transözefajiyal ekokardiyografi 9. DD- Doku Doppler incelemesi 10. PMBV- Perkütan mitral balon valvüloplasti 11. MKD- Mitral kapak değişimi 12. MKA(BYZ) i.- Mitral kapak alan indeksi(Basınç yarılanma zamanı ile ölçülmüş) 13. MKA(Plan.) i.- Mitral kapak alan indeksi(Planimetrik) 14. Maks.Gr.- Mitral maksimum gradyent 15. Ort.Gr.- Mitral ortalama gradyent 16. PAB- Pulmoner arter basıncı, s-sistolik 17. SoA i.- Sol Atriyum indeksi 18. SoVSSÇ- Sol ventrikül sistol sonu çapı 19. SoVDSÇ- Sol ventrikül diyastol sonu çapı 20. MY- Mitral yetersizliği 21. TY- Triküspit yetersizliği 22. AY- Aort yetersizliği 23. SaA- Sağ Atriyum 3 24. SaV- Sağ Ventrikül ÖZET Giriş: Mitral darlığı morbidite ve mortalitesi yüksek bir hastalıktır. Pulmoner hipertansiyon gelişimi hastalığın morbiditesini artıran önemli bir komplikasyondur. Pulmoner hipertansiyon gelişiminde mitral kapak seviyesinde olan yapısal darlık sebebiyle oluşan pasif göllenme bir etkenken, buna eklenen aktif pulmoner vazokonstriksiyon ve vasküler yapısal değişiklikler diğer etkenlerdir. Vasküler seviyede sonradan gelişen bu darlığın giderilmesi pulmoner hipertansiyon gelişimi ve ilişkili komplikasyonların oluşmasını engelleyebilir. Amaç: Anjiyotensin II reseptör blokeri olan Valsartan’ın mitral darlıklı hastalarda eforla gelişen pulmoner basınç artışına etkisi ve bu etkiyi belirleyen değişkenlerin tespit edilmesidir. Yöntem: Hafif-orta, orta derecede mitral darlığı (kapak alanı 1,0-2,0 cm²) olan 22 hasta çalışmaya alındı. Önemli ek kapak hastalığı, ileri mitral yetersizliği, koroner arter hastalığı, hipertansiyonu, diyabeti, akciğer hastalığı, bağ doku hastalığı, sol-sağ şantı olan hastalar çalışmaya alınmadı. Tüm hastalara standart ekokardiyografik inceleme, semptom sınırlı egzersiz testi yapıldı. Bisiklet ergometri ile stres Doppler incelemesi yapıldı. Hem dinlenme hem de mitral ve triküspit lateral anulusundan atım Doppler ile doku Doppler kayıtları alındı. Dinlenme sırasında ve efor testi bitiminde periferik venöz kan alındı, NT-proBNP, MMP-2 ve MMP-9 çalışılmak üzere serumu ayrılarak -80º derecede saklandı. Ondört hafta, günde bir kez 160 miligram Valsartan peroral verildi. Tedavi süreci bitiminde dinlenme ve stres ekokardiyografik incelemesi, semptom sınırlı egzersiz testi tekrar yapıldı. Doku Doppler ölçümleri belirtildiği şekilde tekrar elde edildi. Dinlenme ve efor sonrası kanları tekrar alındı. Ölçümlerin ortalamaları, standart sapmaları ve minimum-maksimum değerleri verildi. Tedavi öncesi ve sonrası dinlenme değerleri kendi aralarında, efor değerleri kendi aralarında tekrarlı ölçümler varyans analizi ile karşılaştırıldı. Sonuçlar p<0,05 anlamlılık düzeyine göre değerlendirildi. 4 Sonuçlar: Bir hastada takipte Ankilozan Spondilit tespit edilmesiyle çalışmadan dışlandı. Üç hasta sebep bildirmeksizin takipten çıktı. Onsekiz hasta çalışmayı tamamladı. Hiçbir hastada komplikasyon izlenmedi. Hastaların dinlenme pulmoner arter basınçlarında anlamlı değişiklik olmazken (39 mmHg’dan 36 mmHg’ya p=0,48), efor pulmoner arter basınçları anlamlı azaldı (73 mmHg’dan 56 mmHg’ya p<0,001). Doku Doppler hızlarında anlamlılık düzeyine ulaşan bir değişiklik izlenmedi. Efor süresi tedaviyle anlamlı arttı (786 saniyeden 846 saniyeye, p=0,044). NT-proBNP seviyeleri başlangıçta sol atriyumu büyük olanlarda anlamlı olarak daha yüksekken bu farklılık tedaviyle kayboldu (tedavi öncesi dinlenme p=0,034, tedavi sonrası p=0,53). MMP-9 seviyelerinde anlamlı değişiklik izlenmedi. MMP-2 seviyeleri hastaların çoğunda ölçülemeyecek kadar düşük bulunduğu için değerlendirlemedi. Sonuç: Valsartan tedavisi eforla pulmoner basınç artışını anlamlı olarak azaltmıştır. Efor süresi anlamlı olarak artmıştır. Ancak bu azalma tüm hastalarda aynı seviyede olmamıştır. Mitral darlığının hemodinamik önemini gösteren sol atriyum büyüklüğüne göre ayarlanmış NT-proBNP seviyelerinin başlangıçta anlamlı farklı iken tedaviyle farkın kaybolması, özellikle hemodinamik sonucu olan mitral darlığı hastalarının tedaviden daha fazla yarar gördüğünü düşündürmektedir. Ancak hasta sayısının sınırlı olması sonuçların başka çalışmalarla desteklenmesini gerektirmektedir. 1. GİRİŞ VE AMAÇ Mitral darlığı hemen her zaman romatizmal kardit sonrası gelişen önemli hemodinamik, tromboembolik, aritmik sonuçları olan çok boyutlu bir hastalıktır. Geçtiğimiz yüzyıl boyunca sıklığı azalsa da halen kardiyoloji pratiğinde sıkça karşılaştığımız bir patolojidir. Asemptomatik hastada rutin fizik muayenede diyastolik üfürüm duyulması ile tanı konulabildiği gibi, çoğu zaman eforla gelen nefes darlığı, çarpıntı gibi şikâyetlerle, daha az olarak da akut akciğer ödemi, hemoptizi, serebrovasküler olay, periferik emboli, birden ölüm gibi dramatik belirti ve bulgularla kendini belli edebilmektedir. Tıbbi tedavisi daha çok normal sinüs ritminin korunması, trombüs oluşumunun engellenmesi, hız kontrolü ile diyastol süresinin uzatılması üzerine yoğunlaşmaktadır. İleri olgularda cerrahi veya girişimsel yöntemlerle darlığın giderilmesi tedavinin esasını oluşturmaktadır. Primer korunmada Grup A Streptokok sebepli enfeksiyonların erken ve etkin tedavisi, sekonder korunmada ise profilaktik antibiyotik kullanımı kabul edilmiş yöntemlerdir. 5 Romatizmal ateş ve romatizmal mitral darlığı iyi tanımlanmış olmasına rağmen mevcut tıbbi tedavi araçları ile hastalığın kontrolü sınırlıdır ve pek çok hasta tam da üretken çağlarında bu hastalığın komplikasyonları ile karşı karşıya kalmaktadır. Bu komplikasyonlar supraventriküler ritim bozuklukları, sol atriyal trombüs formasyonu gibi mitral darlığının doğasından kaynaklananları olduğu gibi, hastalığın güncel tedavisi olan mitral kapak değişimi (MKD) ilişkili mekanik kapak trombüsü, enfeksiyonu ve antikoagülan tedaviyle ilişkili olanları da içermektedir. Önemli mitral darlığı kardiyak debiyi kısıtlamasının yanında pulmoner vasküler yatakta göllenmeye sebep olarak önce pasif, ileri ki evrelerde ise farklı nöröhormonal mekanizmaların tetiklenmesiyle aktif vazokonstiksiyon olarak pulmoner hipertansiyon gelişimine yol açmaktadır. Zamanla vasküler yatakta yapısal değişiklikler meydana gelmektedir. Bu evreden sonra mitral darlığı giderilse dahi pulmoner hipertansiyonun gerilemesi sınırlı kalmakta, hasta pulmoner hipertansiyonun bilinen sonuçlarından kalıcı olarak etkilenebilmektedir. Bu yüzden MD’de istirahatta veya eforla gelen pulmoner hipertansiyon gelişimi, cerrahi veya girişimsel tedavi için endikasyon olarak kabul edilmiştir. Bu komplikasyonun gelişiminde kapak alanı, ortalama gradiyent ve yaşın etkili olduğu bilinmesine rağmen yine de kişisel farklılıklar izlenmekte, farlılıkları açıklamakta bilinen faktörler yetersiz kalmaktadırlar. PHT gelişimini işaretleyen değişkenlerin tespiti ve PHT gelişimini geciktirmek için ne yapılabileceği halen araştırmaların odak noktasıdır. Son yıllarda hastalıkların oluşumu ve değişik tedavilere yanıtlarındaki kişisel farklılığının temelini araştıran birçok genetik araştırma yapılmış ancak çoğunda klinik uygulamada faydalılık sağlayacak noktaya gelinememiştir. Buna bağlı olarak halen hastanın farklı tedavi alternatiflerine vereceği yanıt kestirilememekte, ancak deneyip görerek sonuca varılabilmektedir. Tez çalışmamın amacı pulmoner vasküler yatakta da etkin olan renin anjiyotensin sisteminin (RAS) kontrol altında tutulmasının PHT gelişimi üzerine etkisini ve etkiyi öngördüren-işaretleyen değişkenlerin tespitidir. Bunun için sol kalp yetersizliği, koroner arter hastalığı ve sistemik hipertansiyon tedavisinde yaygın kullanımı ile etkinliği ve güvenilirliği tespit edilmiş olan olan, Valsartan etken maddesi kullanılmıştır. 2. GENEL BİLGİLER 2.1 Mitral Kapağın Yapısı ve Mitral Darlığı 6 Mitral kapak ön ve arka yapraklar, kapakları kalbin fibröz iskeletine bağlayan anulus, kapakların uçlarından papiller kaslara uzanan korda tendinealar ve papiller kas yapılarından oluşur. Kapaklar makroskopik olarak ince, yarı saydam, düzgün ve parlak görünümlüdür. Aynı özelliklere sahip kordalar ile anterolateral ve posteromedyal papiller kaslara tutunurlar. Mikroskobik olarak fibröz yapı üzeri endokard ile kaplıdır. Mitral kapak normalde sistol sırasında ventrikül içi basınç artışı ile tam koapte olarak sol atriyuma kanın geri kaçmasını engeller. Diyastol sırasında da ventrikül içerisine doğru serbestçe salınarak 4-6 cm² ‘lik geçiş alanı oluşturur. Böylece ventrikül doluşuna, bir kısıtlama olmaksızın, izin verir. MD’de ise kapak hareketleri kısıtlanmıştır ve atriyum ile ventrikül arasında diyastolik basınç farkı oluşumuna yol açar. Basınç farkını kapak alanı, atriyal ventriküller kompliyans, kalp hızı, eşlik eden mitral yetersizliği belirler. Darlık bazı başka az görülen sebeplere bağlı gelişebilse de klinik uygulamada daha çok karşılaşılan romatizmal olanıdır. Romatizmal MD de tutulumun şiddetiyle ilişkili olarak, uçlardan anulusa doğru şiddeti azalarak, kapaklar kalın, kalsifik, hareketleri kısıtlı, subvalvüler yapılar olarak adlandırılan kordalar kalın, kısa ve birbirlerine yapışık izlenir. Kapaklar birbirlerine komissürlerinden yapışıktır ve tipik “balık ağzı” görünümünü oluşturur. Diyastol sırasında kapak hareketleri kısıtlandığı için en dar yerini çoğu zaman kapak uçlarının, daha az olarak da kalınlaşıp kısalmış kordaların oluşturduğu, tabanını ise anulusun oluşturduğu bir huni şekli izlenir. Kapağı oluşturan bu yapıların her birinin ne derece etkilendiği; hastalığın morbiditesinde ve tedavi yönteminin seçiminde belirleyici olduğu için ayrıca önemlidir. 2.2 Etiyoloji-Romatizmal Kardit Akut romatizmal ateş (ARA) bağ doku hastalığı veya kollajen vasküler hastalık olarak sınıflandırılan, edinilmiş kalp hastalığının çocuk ve gençlerde en sık sebebi olan bir patolojidir. Gelişmekte olan ülkelerde 100.000 de 100, gelişmiş ülkelerde 100.000 de 2 gibi bir sıklıkta görülür. 5 yaşından önce görülmesi nadirken, en sık 5-18 yaşlarında görülür. Grup A streptokok enfeksiyonundan (tonsillofarenjit ya da kızıl şeklinde) 3 hafta sonra ortaya çıkar. Ateş, halsizlik, kilo kaybı gibi yapısal şikâyetlerle başlar. Deri, santral sinir sistemi, eklem ve kalp bağ dokusunu tutarak eksudatif ve proliferatif enflamasyona yol açar. Kalp dışındaki dokularda kalıcı bir hasar oluşmazken, özellikle mitral ve aort kapakta kalıcı hasara yol açabilmektedir. Kapak tutulumu ile akut fazda kapaklar kalınlaşır, şişer. Kapak uçlarında, koaptasyon bölgesinde verrü olarak adlandırılan 1 mm çaplarında inci tanesi gibi çıkıntılar oluşur. Uzun dönemde ise kapaklar kalınlaşır, 7 komissürlerden birbirlerine yapışır, hareketleri kısıtlanır. Kordalar aynı şekilde kalınlaşır, kısalır, birbirlerine yapışırlar. Zamanla kapak yapılarında distrofik kalsifikasyon meydana gelerek kapak hareketleri iyice kısıtlanır. Bu değişiklikler akut dönemde kapaklarda yetersizlik yapabilir. Akut hastalık sırasında kapak yetersizliği veya myokardite bağlı akut kalp yetersizliği gelişebilmektedir. Eğer bu akut evre atlatılırsa uzun dönemde hem yetersizlik hem de darlık gelişebilmektedir. Klinik hastalığın oluşması genellikle yıllar sonra olmakta ve hastaların yarısından ARA öyküsü alınamamaktadır. Tonsillofarenjit’in erken ve etkin tedavisi ile ARA gelişiminin önlenebileceği, antibiyotik proflaksisi ile de tekrar atak gelişiminden korunulabileceği gösterilmiş ve uygulanması önerilen yöntemlerdir. (1,2,3) 2.3 Mitral Darlığının Doğal Seyri MD de klinik tablo çok farklı şekillerde ortaya çıkabilir. Doğal seyrinde kardiyak debinin sınırlanması ve kanın sol atriyumda birikmesiyle ilişkili olarak oluşur. Orta-ileri derece darlıklarda eforla kardiyak debinin artırılamaması ile çabuk yorulma şikâyetine yol açarken, ileri darlıkta istirahat sırasında halsizlik şikâyetinden sorumludur. Diğer bir tablo akut atriyal fibrilasyonla birden ortaya çıkan nefes darlığı, bazı ileri olgularda hemoptizi ile seyreden daha dramatik olanıdır. Kanın sol atriyumda(SoA) birikmesiyle basınç artar, basıncı azaltmak için SoA hacminde artış olur. Bu değişiklikler AF gelişimine yatkınlıkla sonuçlanır. Akut AF klinik bozulmanın en yaygın sebebidir. Hızlı ventrikül yanıtı sebebiyle pulmoner venöz basınçta hızlı artışla akciğer ödemine, kapiller yırtılmalarla hemoptiziye yol açabilir. MD-AF birlikteliği sistemik emboli gelişimi için en yüksek risk grubunu oluşturur. Antikoagülan tedavi almayan hastalarda %13-26 'sında sistemik emboli bildirilmiştir(4-6). Böylece akut periferik nabız kaybı, myokard enfarktüsü, geçici iskemik atak veya serebrovasküler olay nedeni olarak karşımıza çıkabilmektedir. Ayrıca pulmoner emboli gelişme riski de artmıştır. SoA içinde biriken kanın miktarı arttıkça hacim ve basınç yükü pulmoner vasküler yatağa doğru iletilir. Akut evrede akciğer ödemi, hemoptizi şeklinde, kronik dönemde vasküler yapıdaki değişiklikler ile PHT, en sonunda da sağ kalp yetersizliği kliniği ile karşımıza çıkabilmektedir. ARA geçirildikten sonra, semptomatik MD gelişiminden önce 16 ile 40 yıl süren sessiz bir dönem vardır(1). Kapakta bir kez darlık oluşunca, kapak üzerinde meydan gelen fiziksel etkiyle kapak daha fazla travmatize olur ve darlık ilerler. Normalde 4-6 cm² MKA, 8 2,5 cm² ‘ye düşene kadar anlamlı gradiyent oluşturmaz. Önemli kişisel farklılıklarla birlikte MKA’nın yılda ortalama 0,1 cm² azaldığı bildirilmiştir(7-8). Hafif semptomatik birinin ileri semptomatik olması için ortalama 9,2±4,3 yıl geçtiği bildirilmiştir(1). Ancak bir kez semptomlar başladıktan sonra hastanın prognozu belirgin olarak bozulur ve 7- 10 yıl içinde semptomlar belirgin artar(1,2). NYHA sınıfı ilerledikçe hastaların sağkalımı belirgin olarak düşer. 271 hastanın takip edildiği bir çalışmada 10 yıllık sağkalım NYHA sınıf I den III e doğru sırasıyla %80, %69, %33 bulunmuş, sınıf IV hastaların ise tamamı ölmüştür. 20 yıllık takipte ise sınıf II 'lerin sadece %49 u sağkalmış, sınıf III 'lerin ise tamamı ölmüştür. Atriyal fibrilasyon morbidite ve mortalitenin bağımsız göstergesi olarak tespit edilmiştir(9). İleri PHT olması yine mortalitenin bağımsız göstergesidir(10). MD hastalarında mortalitenin %60 'ından sağ kalp yetersizliği ve AC ödemi sorumlu bulunmuştur(5-6). Mortalitenin ikinci en önemli nedeni embolilerdir(11). Önemli MD de gebelik de mortalite ve morbiditeyi artıran bir etkendir. Tablo 1. Önemli MD’de doğal seyir * Önemli MD’de hastalığın doğal seyri ve prognozu Semptomlar 10 yıllık sağkalım(%) 84 34-42 40 0 42 10 NYHA sınıf I NYHA sınıf II NYHA sınıf II-III NYHA sınıf IV 1 yıllık 5 yıllık *(kaynak 12) 2.4 Mitral Darlığının Tanısı ve Değerlendirilmesi 2.4.A Fizik Muayene Bulguları Hastaların genel görünüşünde özellik nadiren görülür. Malar kızarıklık ile peri oral morluk bildirilmiştir, ancak güncel uygulamada pek karşılaşılmaz. Bu bulgu düşük debi ve periferik vazokonstrüksiyonla oluşur. NSR varlığında nabız özellikli değildir. Prekordiyumun inspeksiyon ve palpasyonu genellikle önemli bir bulgu vermez. Ancak sol dekubit pozisyonda apikal diyastolik tril hissedilebilir. S1 serttir, ancak kapak hareketleri çok kısıtlıysa hafif duyulabilir. Diyastolik rulman MD için karakteristiktir(ancak patognomonik değil), ancak önemli MD varlığında, özellikle de sol dekubit pozisyonunda duyulabilir. MD derecesi arttıkça üfürüm başlangıcı S2 ye yaklaşır, süresi uzar. Üfürüm en iyi apekste duyulur, koltuk altına yayılır ve şiddeti nefes alıp vermekle değişmez. AF 9 varlığında şiddeti vurudan vuruya değişebilir. Açılma sesi sternum sol kenarı ortasında veya apekste duyulabilir. Eşlik eden kaçak, ek kapak hastalığı varsa onlara ait üfürümler duyulabilir. Şiddetli MD 'nin iki önemli bulgusu S2- açılma sesi süresinin kısa olması ve holodiyastolik rulman duyulmasıdır. Kronik dönemde PHT gelişimi ile P2 de sertleşme, fonksiyonel TY ye bağlı sistolik üfürüm duyulabilir. (1-2) Juguler venöz basınç yüksek olabilir. AC muayenesinde peribronşiyal staza bağlı ekspiryumda uzama, ileri ki evrelerde alveolar ödeme bağlı yaş raller duyulabilir. Özellikle hızlı ventrikül yanıtlı AF, sinüs taşikardisi gibi diyastolik doluş süresini bozan durumlarda AC ödemi, hemoptizi izlenebilir. Zamanla sağ kalp yetersizliği bulguları; asit, periferik ödem, karaciğer büyümesi, subkostal hassasiyet izlenebilir. (1-2) AF sık görülür. Ayrıca tromboemboliye sebep olarak periferik nabız kaybı, geçici veya kalıcı iskemik serebrovasküler olay, akut batına yol açabildiği bu hastalarda da MD akla getirilmelidir.(1-2) 2.4.B Elektrokardiyografi, Konvansiyonel Tele kardiyogram ve Laboratuar Bulguları Konvansiyonel tele kardiyogramda sol atriyal büyümesine ait bulgular, AC alanlarında göllenme bulguları izlenebilir. Göllenme SoA basıncıyla uyumludur; 18 mmHg’da konjesyon, 25 mmHg’da interstisyel ödem, 35 mmHg’da alveolar ödem bulguları izlenebilir. Eşlik eden bir patoloji olmadığında kalp-toraks oranı normaldir. EKG’de sol atriyum büyüme bulgusu olan D II’ de çentikli p dalgası görülebilir. İleri PHT gelişen hastalarda SaV hipertrofi bulguları, inkomplet sağ dal bloğu izlenebilir. Ancak en sık görülen bulgu AF’dir. Rutin biyokimyasal testlerde özellik izlenmez. Bu hastalarda araştırılmış-araştırılmakta olan birçok biyokimyasal parametre vardır, ancak hiçbiri tanı ve tedavi takibinde rutin olarak kullanılmamaktadır. Hemogramda ancak yoğun hemoptizi ve kanama diyatezi gelişmesi halinde ilişkili olarak hemoglobin ve hematokrit değerlerinde düşüklük izlenebilir. Koagülasyon parametrelerinde ancak ileri PHT gelişmesi halinde karaciğer stazına bağlı bozulma olur. Bu durumda karaciğer enzimlerinde artış izlenebilir.(1-3) 2.4.C Transtorasik Ekokardiyografi, Transözefajiyal Ekokardiyografi Bulguları ve Diğer Ekokardiyografik Yöntem Bulguları Ekokardiyografi MD tanı ve takibinde en önemli araçtır. 2B EKO ile kapakların kalınlığı, kalsifikasyonu, subvalvüler yapıların durumu, hareketlerinde kısıtlılık semi kantitatif olarak değerlendirilebilir. SoA, SoV ve sağ kalp boyut ve fonksiyonları 10 değerlendirilebilir. Eşlik eden kapak patolojileri değerlendirilebilir. Kalp boşlukları içerisinde, özellikle de SoA içinde trombüs varlığı, büyüklüğü, yerleşim yeri vb. özellikleri kolaylıkla değerlendirilebilir. Renkli Doppler ile MY ve diğer kapak kaçakları, intrakardiyak şantlar, darlığın oluşturduğu türbülan akımlar ve PİSA değerlendirilebilir. Özellikle yetersizlik akımlarının uzunluğu, alanı, süresi, oluşturduğu türbülansın değerlendirilmesi kaçak miktarının belirlenmesinde önemlidir. MD’de CW ve PW Doppler'in kullanımı da özellikle önemlidir. Zirve ve ortalama basınç farkları, basınç yarılanma zamanı(BYZ) ve devamlılık eşitliği ile MKA invaziv yöntemlerle ölçülen değerlere çok yakın olarak elde edilebilmektedir. Ayrıca bu tekniklerin ortak kullanımı ile sistolik pulmoner arter basıncı(PAB), ortalama PAB, diyastolik PAB, pulmoner ve sistemik vasküler rezistans, kardiyak debi, SoV ve SaV dolum basınçları hesaplanabilmektedir. Doku Doppler(DD), Strain ve Strain Rate(SR) görüntülemenin de SoV ve SaV sistolik ve diyastolik fonksiyonlarını değerlendirmede kullanılabileceğini gösteren pek çok çalışma vardır. Görece yeni olan bu tekniklerin önemi halen yaygın olarak araştırılmaktadır. Son zamanlarda teknik gelişmelerle birlikte 3B ve 4B Eko’nun da özellikle mitral kapak yapısını değerlendirmede etkin olduğuna dair yazılar çıkmaktadır. Ancak halen yaygın kullanılmamaktadır. TTE’nin yetersiz kaldığı sol atriyal trombüs değerlendirilmesi ve kapak yapısının PMBV’ye uygunluk değerlendirilmesinde TÖE etkin olarak kullanılabilir. TÖE, TTE görüntüsünün yetersiz olduğu her durumda kullanılabilir. Modern TÖE problarında renkli Doppler, CW-PW Doppler, DD imkânı bulunmaktadır. Böylece TTE sırasında yapılan incelemelerin aynısını TÖE’de de yapabiliriz. İntrakardiyak EKO da TÖE kalitesinde mitral kapak inceleme imkânı vermesine rağmen invaziv bir yöntem olması nedeniyle yaygın kullanılmamaktadır. (1-2, 13) 2.4.D Efor Testi ve Stres Doppler Ekokardiyografi MD hastalarında semptomlar genellikle efor sırasında görülmektedir. Bu yüzden dinlenme sırasında alınan Eko ve Doppler ölçümlerinin hastalığın ciddiyetini göstermedeki değerleri sınırlıdır. Efor kapasitesi girişimsel veya cerrahi tedavi kararı verirken esas ölçüdür ve objektif olarak belirlenmesi çok önemlidir. Efor kapasitesi değerlendirmesi için hastanın fonksiyonel kapasitesine göre farklı protokol ve yöntemler tanımlanmıştır. İskemi değerlendirilmesinde en sık kullanılan Bruce protokolü ile koşubandının, basamaklar arasındaki keskin geçiş nedeniyle, efor kapasitesinin değerlendirilmesindeki değeri sınırlıdır. Naugton protokolü ile koşubandı veya altı dakika yürüme testi ise belirgin semptomatik olan hastalarda kısıtlılığın derecesini belirlemede kullanılmaktadır ve şüpheli 11 semptomatik hastaların değerlendirilmesi için gerekli iş yüküne ulaşmakta yetersiz kalmaktadır. Modifiye Bruce protokolünde basamaklar arası geçiş keskin değildir ve hafiforta derecede efor kısıtlaması olan hastaların değerlendirilmesinde daha başarılıdır. MD’de egzersiz sırasında PAB’ın 60 mmHg’nın üzerine çıkması girişim ve ya cerrahi endikasyonu olarak kabul edilmiştir (2006 ACC/AHA kılavuzuna göre sınıf IIA endikasyon)Önemli darlığı olan ancak asemptomatik olan veya semptomları ile dinlenme ölçümleri uyumsuz olan hastalarda stres Doppler çalışması gerekli görülmüştür(sınıf I endikasyon) . Egzersizle ortalama gradyentin 15 mmHg, sistolik PAB’ın 60 mmHg üzerine çıkması girişimden fayda görecek hastayı işaretler. Gradyentte belirgin artma olmadan PAB artmışsa PHT’ye sebep olabilecek diğer hastalıkların araştırılması önerilmiştir. Birkaç farklı yöntem bildirilmiştir. İlki koşubandı ile maksimum egzersiz yapıldıktan sonraki 3 dakika içinde hastanın yatırılıp ölçümlerinin yapılmasıdır. Bu teknik uygulamasında ölçümlerde gecikmeye bağlı efor PAB’ı olduğundan düşük ölçülebilmektedir. Diğer bir yöntem dobutamin stres ekodur. Hasta pozisyonu sabit olduğu için test boyunca ölçüme izin vermektedir. Ancak dobutaminin pulmoner vasküler yatak üzerindeki vazodilatatör etkisi sebebiyle fizyolojik eforla aynı hemodinamik sonucu oluşturamayabilir. Bir diğer yöntem olan ve MD’de stres Doppler eko için en çok tercih edilen yöntem bisiklet ergometridir. Supin veya başyukarı (head up) pozisyonda yapılabilir. Hemodinamik olarak fizyolojik efora daha çok benzemesi ve test boyunca kayıt almaya uygun olması tercih sebebidir. (1-3, 14-17) 2.4.E Yeni Tetkikler Kardiyak MR görüntüleme ve çok kesitli BT’nin kapak değerlendirilmesinde, sistolik fonksiyonların değerlendirilmesinde kullanılabileceğine dair yayınlar olsa da yüksek maliyet ve ulaşılabilirliğin kısıtlı olması nedeniyle yaygın kullanım alanı bulamamışlardır. Ayrıca MD’li hastalarda koagülasyon sistemi, fibrinolitik sistem ve trombositlerin daha aktif olduğu, endotel disfonksiyonu izlendiği bildirilmiştir. MD’nin giderilmesiyle ilgili parametrelerde düzelme olduğu bildirilmiştir.(18-19) 2.5 Mitral Darlığının Tedavisi 2.5.A Tıbbi Tedavi MD’de tıbbi tedavinin birkaç yönü vardır. İlki sinüs ritminin(SR) korunmasını amaçlar. SR MD’de kardiyak debinin sağlanmasında kritik öneme sahiptir. SR’nin kaybı genellikle semptomların başlangıcını oluşturur. Hem atriyal kasılmanın kaybı hem de çoğu 12 zaman görülen hızlı ventrikül yanıtı nedeniyle diyastol süresinin kısalması hemodinamiyi bozarak, akut AC ödemi, hemoptizi gibi dramatik tablolara yol açar. Bu yüzden SR’nin korunması, kaybı halinde mümkünse döndürülmesi esas olarak kabul edilmiştir. Korunması için uzun etkili beta blokerler (metoprolol süksinat, bisoprolol, atenolol, vb.) ilk basamak olarak verilebilir. Gerekli olması durumunda Amiodorone da düşünülebilir. SR’ye döndürmek için intravenöz beta blokerler, Amiodorone kullanılabilir. Kalsiyum kanal blokerleri AF’li hastalarda hız kontrolü için sıkça kullanılmaktadır, ancak SR’ye döndürmek için önerilmemişlerdir. Diğer antiaritmiklerin SR koruyucu etkisi sınırlıdır veya MD’de kontrendikedir. ACE inhibitörleri, ARB’ler ve statinlerin değişik hasta gruplarında AF gelişimini azalttığını gösteren istatiksel veriler olsa da bu konudaki etkinlikleri ispatlanmamıştır. Hız kontrolü özellikle AF varlığında semptomların kontrolünde önemli bir faktördür. Diyastol süresini uzatarak ventrikülün yeterince dolmasına imkân sağlar. SR olan hastalarda etkindir ve semptomatik hastalarda başlangıç tedavisinde önerilir. SR olan hastalarda beta bloker ilaçlar tercih edilirken, AF’li hastalarda KKB’leri daha iyi hız kontrolü sağlayabilir. Digoksin’in hız kontrolü sağlayıcı etkisinin eforda yetersiz kaldığı bildirilmiştir. Kontrolde güçlük çekilen hastalarda tek başına veya diğer antiaritmiklerle beraber Amiodarone’da verilebilir. MD’de tıbbi tedavinin diğer bir amacı da tromboemboliden korunmaktır. MD’de SoA içinde bir göllenme vardır. Göllenme zamanla basınç artışına, SoA’da büyümeye, fonksiyonlarında bozulmaya yol açar. Bu değişiklikler AF gelişimine yatkınlık oluşturur. AF gelişmesi bu değişiklikleri artırır, böylece bir kısır döngü oluşur. MD ve AF varlığı SoA trombüs oluşumu için en yüksek risk grubunu oluşturur. Yıllık emboli sıklığı %7-15 olarak bildirilmiştir. Akut AF’de Heparin’le, kronik tedavide ise Coumadin’le etkin antikoagülasyon mutlaka yapılmalıdır. AF gelişmemiş daha hafif MD olgularında Aspirin ile antitrombotik tedavi yeterli olabilir. Antikoagülasyon için düşük molekül ağırlıklı heparin de kullanılabilir. AF gelişmiş hastalarda pulmoner emboli riski de unutulmamalıdır. (1-3, 20-23) MD’nin önemli bir komplikasyonu olan pulmoner veya sistemik konjesyon tedavisi için diüretik tedavi gerekli olabilir. Akut pulmoner ödem tablolarında parenteral loop diüretikler tercih edilirken, kronik olgularda Tiazidler, potasyum tutucu veya oral loop diüretikler kullanılabilir. Tercihte belirleyici olan volüm yükünün miktarı, gelişme hızı, kan elektrolit seviyeleri ve diğer hastalıkların varlığıdır. Bu amaçla ACEİ’lerde 13 verilebilmektedir. MD’de ACEİ veya ARB kullanımının güvenliğini araştıran çalışmalarda yapılmış, ileri MD’de bile ACEİ kullanımının güvenli olduğu gösterilmiştir(24-26). MD’nin en önemli morbidite sebeplerinden olan PHT gelişimi için halen klinikte ispatlanmış etkin bir tıbbi tedavi yoktur. Yakın zamana kadar primer olanı da dahil PHT’nin etkin, güvenilir bir tedavisi yoktu. Ancak son yıllarda prostoglandin analogları, fosfodiesteraz-5 inhibitörleri ve endotelin-1 reseptör antagonistleri ile önemli bir açılım sağlanmıştır. Bu grup ilaçlar pulmoner arteryel hipertansiyon ve Eisenmenger sendromu gelişmiş NYHA sınıf III-IV hastalarda endikasyon almıştır. Diğer hastalıklara, özellikle sol kalp hastalıklarına sekonder gelişen PHT tedavisindeki yerleri kesin değildir ve halen araştırılmaktadır. (27-32) 2.5.B Girişimsel ve Cerrahi Tedavi MD ilerleyici bir hastalıktır ve genelde kapak alanı 1,5 cm2 altına düşünce fiziksel kısıtlamaya yola açar. MKA 1,0 cm2 altında olan tüm hastalarda, 1.0-1.5 cm2 arasında olan hastalarda ise fiziksel kısıtlılık, AF gelişimi, PHT gelişimi veya girişim gerektiren ek kardiyak patoloji varlığında girişimsel tedavi düşünülmelidir. Kapak yapısı uygun, önemli MY’si ve sol atriyal trombüsü olmayan izole MD’li hastalarda ilk tercih edilecek girişimsel yöntem PMBV’dir. Günümüzde kullanılan Innou tekniği ile tecrübeli merkezlerde güvenle yapılabilmektedir. İşlem başarısı %95, hastaneiçi mortalite % 0,3-1,9, hastaneiçi operasyon (kapak değişimi) %3,3 olarak bildirilmiştir. Kısa dönemde %89 hastada iyi sonuçlar elde edilmiştir. Bir seride 7 yıllık takipte hiç ölüm izlenmezken tekrar işlem veya operasyon gerekliliği %10 olarak bildirilmiştir. (33) başka bir seride ise ortalama 4,2+/-3,7 yıllık takipte(0,5-15 yıl) %13 mortalite, %27,7 kapak değişimi, %6,4 tekrar PMBV bildirilmiştir(34). %10 hastada interatriyal septumda defekt geliştiği ancak çoğunun girişim gerektirmeksizin uzun yıllar takip edilebildiği bildirilmiştir. SoA fonksiyonlarını düzelttiği, supraventriküler aritmi sıklığını azalttığı, PAB’ı akut fazda kısmen ve kronik dönemde ise daha belirgin düşürdüğü gösterilmiştir. Cerrahi tedavide kapalı komüssirotomi, açık komüssirotomi ve kapak değişimi(MKD) alternatifleri vardır. Kapalı komüssirotomi, ilk uygulanan cerrahi tekniktir. Kardiyopulmoner bypass teknik ve imkânlarının gelişmesi ile artık yapılmamaktadır. Açık komüssirotomi PMBV’ye uygun ancak PMBV’nin kontrendike olduğu olgularda tercih edilen yöntemdir. SoV fonksiyonları üzerine olumsuz etkileri kapak değişimine göre daha azdır ve hemodinamik sonuçları daha iyidir. Ek bir endikasyon yoksa antikoagülasyon gerektirmez. Ancak sonuçları cerrahi tecrübeyle çok yakından ilgilidir. Peroperatif TÖE ile 14 başarının değerlendirilmesi, orta dereceden fazla MY gelişmesi halinde MKD’ye dönülmesi önerilmiştir. MKD, teknik olarak daha kolay ancak uzun dönemde morbiditesi ve mortalitesi daha yüksek bir yöntemdir. Operasyon mortalitesi %2-7, protez ilişkili yıllık mortalite %2-3, morbidite %2-6 olarak bildirilmiştir. SoV fonksiyonlarında bozulmaya yol açabildikleri için, özellikle düşük EF’li hastalarda dikkat gerektirir. MKD’ de biyoprotez ve mekanik kapak alternatifleri vardır. Biyoprotezlerin %60’ının 10 yılda dejenere olduğu bildirilmiştir.(3, 35-36) Bu nedenle sadece; gebelik planlayan kadın hastalarda, antikoagülan tedavi riski yüksek hastalarda veya 70 yaş üstü hastalarda önerilmektedir. Biyoprotez MKD’ de tromboemboliye karşı ilk üç ayda antikoagülasyon sonrasında antitrombotik tedavinin yeterli olacağı bildirilmiştir. Ancak SoV fonksiyonlarında azalma, dev SoA veya antitrombotik tedavi altında geçirilmiş emboli öyküsü varsa sürekli antikoagülasyon gereklidir. Mekanik kapaklar daha uzun süre dayanırlar. Ancak bunlarda sürekli antikoagülasyon gereklidir. Tüm MKD’ ler infektif endokardit için yüksek risk grubuna girer ve bakteriyemiye yol açan girişimlerde proflaksi endikasyonu vardır. Proflaksiye rağmen, infektif endokardit MKD’yle ilişkili mortalite ve morbiditenin önde gelen sebeplerinden biridir. Ayrıca sistemik emboliye bağlı serebrovasküler olaylar, mikotik anevrizma, renal infarkt, myokard enfarktüsü görülebilmekte, immün reaksiyonla akut glomerülonefrit gelişebilmektedir. Mekanik kapak trombozu morbidite ve mortalitenin bir diğer önemli sebebidir. İE’dekine benzer sistemik emboli komplikasyonlarının yanında darlık oluşturan trombozlarda AC ödemi, düşük debi kliniği gelişebilmekte, mortalite yüksek seyretmektedir. Bu ve ifade etmediğimiz daha az görülen komplikasyonlarla birlikte MKD ayrı bir hastalık olarak karşımıza çıkmakta, halen en son tercih edilmesi gereken yöntem olarak kabul edilmektedir. 2.6 Mitral Darlığı, Pulmoner Hipertansiyon ve RAS İlişkisi Pulmoner arter basıncını belirleyen faktörler Ohm kanuna göre akım ve dirençtir. Basınç değişimi = akım x direnç PABo - PVB = Q x PVD PABo = (Q x PVD) + PVB (PABo: ortalama PAB, PVBo: ortalama pulmoner venöz basınç, PVD: pulmoner vasküler direnç, Q:kardiyak debi) PVBo kapiller kama basıncı ile tahmin edilebilir. PABo = (Q x PVD) + kapiller kama basıncı 15 Bu formülden PABo’nun sağ kalp debisi ve pulmoner vasküler rezistans ve ortalama pulmoner venöz basınç tarafından belirlendiği anlaşılır. Değişik hastalıklarda bu değişkenler özerinden PHT gelişimi meydana gelir. Pulmoner hipertansiyon değişik etiyolojilere bağlı gelişebilen morbiditesi ve mortalitesi yüksek bir hastalıktır. Daha önceden primer ve sekonder olarak sınıflandırılırken 2003 yılında Dünya Sağlık Örgütü tarafından etiyolojiye göre 5 sınıfa ayrılmıştır (Tablo 2). PHT çok farklı patolojilerin ortak sonucu olmakla birlikte en sık sol kalp hastalıklarına sekonder olarak gelişir. PHT gelişiminde rol alan mekanizmalar başlangıçta farklı olabilse de, ortak mekanizmalar aracılığı ile son noktaya ilerler. Şüphesiz bu mekanizmalar birden fazladır ve henüz hepsi açıklığa kavuşmamıştır (Şekil 1). Şekilde görüldüğü gibi genetik yatkınlık varlığında trombositler, endotel, düz kas hücreleri, makrofaj ve T lenfositlerin aracılığı ile pulmoner arter yatağında vazokonstriksiyon, intima-medya tabakalarında hücre çoğalması ve interstisyel kollajen birikimi ile duvarlarda kalınlaşma meydana gelir. Vazokonstriksiyon tetikleyen etkenin ortadan kaldırılmasıyla veya vazodilatatör ajanlarla geriletilebilir. Daha ileri aşama olan intima medya kalınlaşması, hücre çoğalması ve bağ doku birikimiyle daha uzun süreçte gelişir. Yapısal değişiklikler daha yavaş gelişmesine rağmen aktif bir süreçtir ve sürekli yapım-yıkımlarla devam eder.(37) Aktif vazokonstriksiyon ve yeniden şekillenme evrelerinde rol oynayan mekanizmalardan biri de ‘RAS’dır. RAS vücudda yaygın olan, vasküler kompartmanda başlıca sıvı ve elektrolit dengesinden sorumlu, ancak doku düzeyinde de yaygın ve etkin olan bir sistemdir. Esansiyel hipertansiyon, renovasküler hipertansiyon, kalp yetersizliği, ateroskleroz ve kardiyak ‘remodelling’ de kritik öneme sahip olduğu gösterilmiştir. Bu hastalıkların tedavisinde RAS’a etkili ilaçlar olan ACEİ’lerin ve ARB’lerin etkinliği ve güvenilirliği ispatlanmıştır ve yaygın olarak kullanılmaktadır(38-41).RAS üzerine etki eden ilaçlar güncel kardiyoloji uygulamasının köşe taşları olarak ifade edilebilir. Kapak hastalıkları da dahil tüm sol kalp kaynaklı PHT’de ilk aşama pulmoner ven basıncında yükselmedir. Buna cevap olarak pulmoner ven endotel hücreleri bazal membranı kalınlaştırarak cevap verirler. Basınç yükünün devam etmesiyle interstisyel ödem, zamanla da alveol çevresindeki fibröz dokuda kalınlaşma olur. Basınç artışı daha fazla olursa bazal mebran yırtılır ve eritrositler alveollere geçer. Vazokonstriksiyon ve fibröz dokuda daha fazla artışla vasküler direnç artırılır. Böylece pulmoner kapiller yatağa gelen kan miktarı azaltılarak basınç düşürülmeye çalışılır. Bazı hastalarda vasküler tonüsdeki artış daha belirgindir ve vazodilatatör tedaviye cevap vermeye meyillidir. 16 Tablo 2. Pulmoner Hipertansiyonun Tanısal sınıflaması.* 1-Pulmoner arteryel hipertansiyon İdyopatik Ailesel Aşağıdaki hastalıklarla ilişkili olarak Kollajen vasküler hastalık Konjenital sol-sağ şant Portal hipertansiyon HİV enfeksiyonu İlaç ve toksinler Diğer durumlar† Var olan venöz veya kapiller hastalıkla ilişkili Pulmoner venöz tıkayıcı hastalık Pulmoner kapiller hemanjiyomatöz Yeni doğanın kalıcı pulmoner hipertansiyonu 2-Sol kalp hastalığı ile ilişkili pulmoner hipertansiyon Sol atriyal veya ventriküler hastalık Sol kalp kapak hastalığı 3-Akciğer hastalığı ve/veya hipoksemi ile ilişkili Pulmoner hipertansiyon KOAH İntertisyel akciğer hastalığı Uyku apne-hipopne(Sleep-disordered breathing) Alveolar hipoventilasyon bozuklukları Sürekli yüksek rakıma maruziyet Gelişimsel anomaliler 4-Kronik tromboz ve/veya emboliye bağlı pulmoner hipertansiyon Proksimal pulmoner arterlerin tromboembolik tıkanıklığı Distal pulmoner arterlerin tromboembolik tıkanıklığı Trombotik olmayan pulmoner embolilere bağlı(tümör, parazit, yabancı cisim) 5-Diğer sebepler Sarkoidoz, pulmoner Langerhans hücreli histiyositoz, lenfanjiyomatöz, pulmoner arterlere dışarıdan bası(adenopati, tümör ve fibröz medyastinit) †tiroit hastalıkları, tip 1 glikojen depo hastalığı, Gaucher hastalığı, herediter myeloproliferatif bozukluklar, hemoglobinopatiler, splenektomi *kaynak 42 den düzenlenerek alıntı yapılmıştır 17 ACEİ’ler Anjiyotensin I’in Anjiyotensin II’ye dönüşümünü engelleyerek, ARB’ler ise Anjiyotensin II’nin reseptörlerine bağlanmasını engelleyerek etkinlik gösterirler. Anjiyotensin II reseptörlerinin iki alt grubu vardır; AT1 ve AT2 reseptörleri. Mevcut ARB’ler selektif olarak AT1 reseptörünü bloke ederler. AT1 birçok dokuda yaygın olarak bulunur ve hemodinamik etkilerin çoğundan sorumludur. AT2 intrauterin hayatta hücre çoğalmasında görevli olduğu bildirilmiştir. Ancak yetişkinde ki fonksiyonları tam bilinmemektedir. Pulmoner vasküler yatakta anjiyotensin II reseptörlerinin varlığı, bu reseptörlerin aktivasyonunun PHT gelişiminde etkin olduğu bilinmektedir(44-46, şekil 2) Ancak PHT gelişiminde etkin olduğu gösterilmiş başka nöröhormonal mekanizmalarında olduğu gösterilmiştir(endotelin, büyüme faktörleri, sitokinler, serotonin gibi). Şekil 1. PHT gelişiminin şematik özeti * *kaynak 43 den alıntı yapılmıştır Şekil 2. Pulmoner vasküler remodelling’i engelleyen ilaçların etki yerleri (kaynak 47 den alıntı yapılmıştır) 18 Endotelin (ET) antagonistleri ve ECE inhibitörleri 1-ACE inhibitörleri ve anjiyotensin reseptör antagonistleri, 2-Nitrozoksit (NO) ve Fosfodiesteraz5 inhibitörleri, 3-Prostasiklin, 4-Ca+2 kanal antagonistleri, 5-Heparin, 6-Serin elastaz inhibitörleri, 7-Mitogen-activated protein kinase (MAPK) inhibitörleri, 8- 5-HT reseptör antagonistleri, 9-İnterlökin reseptör antagonistleri Bu bilgiyle PHT gelişimini engellemek için ve tedavi amacıyla ACEİ ve ARB’lerle yapılmış birçok hayvan deneyi mevcuttur. Bu çalışmaların sonuçları genellikle olumlu olmakla birlikte tedaviye beklenen cevap sınırlıdır ve tüm deneklerde aynı değildir. Klinikte ise ACEİ’lerin ilk örneği olan Kaptopril’in etkinliği denenmiş ancak çelişkili sonuçlar elde edilmiştir(48,49). Doku seviyesinde aktivitesi yüksek yeni ACEİ’ler ve ARB’ler ile yapılmış çalışmalar sınırlıdır. Çoğunluğu hayvan deneyleridir ve çalışma popülasyonları sınırlıdır(50-58). PHT’nin birçok hastalıkta olduğu gibi genetik yatkınlık varlığında tetikleyici çevresel faktörlerin etkisiyle oluştuğunu işaret eden birçok bulgu elde edilmiştir. BMPR2, Kv ve %HT gen mutasyonunun idyopatik ve ailesel PHT gelişimindeki rolü tespit edilmiştir(42,5961). Hipoksi, sol ventrikül sistolik ve/veya diyastolik disfonksiyonu, bağ doku hastalıkları, mitral darlığı ve/veya yetersizliği PHT gelişimine yol açtığı iyi bilinen hastalıklardır. Sol kalp bozukluğuna bağlı PHT gelişimi: Sırasıyla pasif pulmoner venöz konjesyon, kapiller konjesyon, alveolar konjesyon gelişir. Hipoksi ve konjesyona tepki olarak pulmoner arteryel yatakta vazokonstriksiyon gelişir. Bunda endotelden ve trombositlerden salınan vazoaktif peptidler, RAS aktivasyonu rol oynar. Zamanla arterde intima-medya tabakasında kalınlaşma olur. interstisyel alanda bağ doku arıştı olur. Ancak ne bilinen gen mutasyonlarının varlığı tek başına PHT’a yol açmaktadır, ne de PHT’a yol açtığı bilinen yukarıdaki hastalıkları bulunan benzer klinik özelliklerdeki hastalarda aynı derecede PHT gelişmektedir(60). Bu kişisel farklılıklar tedaviye cevap noktasında da görülmektedir. Bu farklılıkların nedeni halen araştırma konusudur. MD’nin klinik seyrinde PHT gelişimi önemli bir problemdir ve derecesi cerrahi veya perkütan girişim zamanını belirlemede önemli bir parametredir. Bu hastalarda da PHT gelişimi hastadan hastaya belirgin farklılık gösterir. Aynı kapak alanına sahip MD olan hastalarda değişik derecelerde PHT gelişimini belirleyen klinik ve biyokimyasal parametreler halen kesin değildir ve araştırılmaya devam etmektedir(42). 2.7 Mitral Darlığı ve Pulmoner Hipertansiyon Takibinde Kullanılan Laboratuar Belirteçleri 19 Atriyal natriüretik peptid (ANP),brain natriüretik peptid (BNP) ve C-tip natriüretik peptid (CNP) atriyumlar, ventriküller ve vasküler endotelyal hücrelerden salınan bir hormon grubudur. Üç tip reseptörü tanımlanmıştır: tip A ANP ve BNP için spesifik, tip B CNP ve ANP için spesifik ve temizleme reseptörleri(clearance receptor). Matür BNP daha çok ventriküller tarafından salgılanır ve yüksek molekül ağırlıklı öncüsü olan proBNP’den oluşturulur. BNP insan kalp dokusunda daha çok BNP-32 olarak, daha az da proBNP olarak depo edilir. Dolaşımdaki BNP ise BNP-32(tam tanımlanamamıştır), BNP fragment ve amino-terminal proBNP(NT-proBNP) olarak bulunur. BNP’nin, ANP’ye benzer, diüretik, natriüretik ve hipotansif etkileri vardır. Natriüretik peptidler, RAS, vazopressin ve sempatik aktiviteyle birlikte sıvı ve elektrolit dengesinde görev alırlar. NT-proBNP salınımı mekanik gerilim ile başlatılmaktadır ve en az iki yolakla devam etmektedir. Birincisi AT II ve endotelin aracılıklı otokrin-parakrin yol, ikincisi ise hücrede direk strain ile tetiklenen gen ekspresyon artışına bağlı olanıdır (62). BNP seviyelerinin AT II ve adrenerjik uyarı ile yükseldiği, RAS inhibisyonu ve β-bloker tedaviyle seviyelerinin düştüğü ve prognozun iyileştiği gösterilmiştir (63). PHT’de BNP değerlerinin ortalama PAB, PVR, SaA basınç, SaV diyastol sonu basıncı ve SaV kitlesi ile doğru orantılı, SaV EF’si ve kardiyak debi ille ters orantılı olarak yükseldiği gösterilmiştir (64). PHT’de hastalığın ciddiyeti ile orantılı değiştiği, seri takibinin tedaviyi düzenlemede yardımcı olabileceği gösterilmiştir (65). MD’de seviyelerinin arttığı başarılı PMBV ile azaldığı bildirilmiştir(66). Saf MD’de SoV diyastol sonu basınçları normaldir. MD’de olan BNP artışları muhtemelen SaV kaynaklıdır ve SaV ardyükünün azaltılması ile düşmesi beklenebilir. NT-proBNP’in çeşitli sebeplere bağlı gelişen PHT’de önemini işaret eden çalışmalar vardır(67-69). Ancak halen hafif-orta PHT’de klinik gidişi değerlendirmek için kullanılan bir biyokimyasal parametre bulunmamaktadır. PHT’a yatkınlığı belirlemek için hem genetik farklılıkların hem de daha kolay tetkik edilebilir diğer laboratuar parametrelerinin araştırılması gerekmektedir. Matriks Metalloproteinazlar, ekstrasellüler matriks proteinlerini yıkan çinko-bağımlı bir endopeptidaz ailesidir. MMP’ler birçok biyolojik aktiviteyle ilişkilidirler. Organ gelişimi ve patolojik süreçlerde rol oynamaktadırlar. MMP’ler grup olarak, fibriler ve nonfibriler kollajenlesin, fibronektin, laminin, bazal membran ve interstisyel stroma glikoproteinlerinin de içinde bulunduğu ekstrasellüler matriks proteinlerinin metabolizmasında kilit enzimdirler. Yara iyileşmesi, gebelik ve anjiyogenez gibi fizyolojik olaylarda doku yeniden şekillenmesi sırasında matriks proteinlerinin yıkılmasında görev alırlar. 20 MMP-9, 92 kDa ağırlığında, matriks yeniden şekillenmesinde, enzim modülasyonunda ve sitokin-büyüme faktörü aktivasyonunda görevli bir glikoproteindir. Jelâtini yıkabilmesi nedeniyle Jelatinaz B olarak da isimlendirilir. Kollajenlere (IV, V, VII, X ve XIV); jelatine; entaktine; agrekana; elastine; fibronektine; osteonektin; plasminojene; MBP’e; IL1beta’ya etkilidir. Matriks Metalloproteinaz-2 (MMP-2 Jelatinaz A, Jelatinaz Tip IV Kollajenaz) ve Matriks Metalloproteinaz-9 (MMP-9) seviyelerinin primer PHT’de yükseldiği, özellikle interstisyel alandaki yapısal değişikliklerde rollerinin olduğu bildirilmiştir. MD‘yle ilişkili PHT’deki yerleri, tedaviye yanıtta işaretleyici rollerinin olup olmadığını bildiren bir kaynak yoktur. 2.8 Mitral Darlığı ve Pulmoner Hipertansiyonda Kullanılan Konvansiyonel ve Yeni Ekokardiyografik Parametreler Ayrıca halen güncel uygulamada kullandığımız ekokardiyografi ve Doppler ölçümleri (MKA, PAB, PVR, Kapak Rezistansı, AV kompliyans) bu cevabı öngörmede yetersizdir. Kolay, tekrarlanabilir ekokardiyografi ve Doppler parametrelerine ihtiyaç vardır. Bu amaçla konvansiyonel parametreler yanında, önyükten ve ardyükten daha az etkilendiği gösterilen doku Doppler parametreleri incelendi. Bu çalışmalar ışığında ACEİ’i ve benzer hemodinamik etki gösteren ARB’lerin MD ile ilişkili hafif-orta PHT’de etkinliğini çalışmayı planladık. PHT, MD’ye çoğu zaman MD’nin düzeyine bağlı olarak ama bazen de MD düzeyi ile uyumlu olmaksızın eşlik etmektedir. Orta ve ileri düzeyde MD’ye istirahatte 50 mmHg ve üzerinde pulmoner arter basıncı (PAB)’nın eşlik etmesi fonksiyonel kapasiteden bağımsız bir şekilde girişimsel tedaviler için önemli bir endikasyon oluşturmaktadır. Pulmoner hipertansiyon mitral darlığında pasif pulmoner venöz hipertansiyon olarak başlamakta daha sonra lokal ve sistemik nöröhormonal faktörlerin etkinleştiği ve bronkovasküler kompartmanda reaktif yanıtlarla seyreden bir süreç olarak gelişmektedir. Özellikle egzersizle belirgin hale gelen pulmoner hipertansiyon hafif mitral darlıklı hastalarda bile egzersiz dispnesi olarak kendini göstermektedir. PHT gelişiminin geciktirilmesi veya geriletilebilmesini sağlayacak tedavi araçlarına gereksinim vardır. Pulmoner vasküler yatakta oluştuğu gösterilmiş olan anjiyotensin II yine pulmoner vasküler yatakta bulunan anjiyotensin II reseptörleri aracılığıyla etkinlik göstermektedir. Dolayısıyla anjiyotensin II oluşumunun önlenmesi veya reseptör düzeyinde bloke edilmesinin teorik olarak pulmoner hipertansiyon oluşumunu önlemede veya gelişmiş olan pulmoner hipertansiyonu 21 geriletmede etkili olabileceği düşünülmektedir. Bu amaçla anjiyotensin II reseptör antagonisti olan Valsartan'ın pulmoner hipertansiyon üzerine etkisini incelemeyi amaçladık. 3. YÖNTEM 3.1 Örneklem Seçimi Hastanemiz Ekokardiyografi laboratuarına Ağustos 2006-Nisan 2007 arasında başvuran, hafi-orta derecede(kapak alanı 1,0-2,0 cm2) mitral darlığı olan, normal sinüs ritminde olan, ardışık 26 hasta çalışmaya alındı. Tablo 3’de belirtilen dışlama kriterlerinden herhangi birisine sahip olan hastalar çalışma dışı bırakıldı. Bir hasta gebelikten etkin korunamayacağı için, 1 hastada yeterli triküspit kaçak jeti olmaması, 2 hasta da eforla triküspit kaçak jetinin kaybolması nedeniyle çalışmaya alınmadı. Tüm aday hastalar anemi, hipertirodi, hipotiroidi, aktif enfeksiyon, elektrolit dengesizliği, kronik ek hastalık yönünden değerlendirildi. EKG’leri ritim ve ileti bozukluğu yönünden değerlendirildi. Tele kardiyogramları incelendi. Ekokardiyografi ile rutin incelemenin yanında, olası şant önemli ek kapak hastalığı, segmenter hareket kusuru, perikardiyal efüzyon ve yeterli triküspit kapak kaçak jeti için özellikle değerlendirildi. Tablo 3. Dışlama kriterleri Dışlama kriterleri: 1- Girişim endikasyonu olan mitral darlığı 2- Normal sinüs dışı ritimler 3- Orta-ileri mitral yetersizliği 4- Orta-ileri aort yetersizliği 5- Aort akım hızı 2 metre/saniyeyi geçen 6- Ejeksiyon fraksiyonu %50 den az olan 7- Koroner arter hastalığı 8- Sol-sağ şant(intrakardiyak-ekstrakardiyak) 9- Diabetes mellitus 10- Hipertansiyon 11- Hipertrofik/restriktif kardiyomyopati 12- Obstrüktif/restriktif/parankimal akciğer hastalığı 13- Bağ dokusu hastalığı-vaskülit 22 14- Yetersiz ekokardiyografik görüntü, yetersiz triküspit kaçak jeti 15- 18 yaşından küçük, 50 yaşından büyük olanlar 16- Gebelikten etkin korunamayacak hastalar 17- Aydınlatılmış onam vermeyenler Hasta alımı tablo 4’de gösterildiği gibi gerçekleşti. Tablo 4: hasta alım diyagramı -1 hasta gebelikten korunamayacağı, -1 hastada TY jetinin yeterli olmaması, -2 hastada TY jetinin eforla kaybolması nedeniyle çalışmaya alınmadı -1 hastada takipte Ankilozan Spondilit tespit edilmesi, -3 hasta ise sebep bildirmeksizin kendi istekleriyle takipten ayrıldı 3.2 Ekokardiyografik İnceleme ve Verilerin Analizi Tüm ekokardiyografik(Eko) incelemeler GE Vingmed system 5 (Horten, Norway) ile yapıldı. Tüm Eko incelemeleri EKG monitörizasyonu eşliğinde yapıldı. Dinlenme ekokardiyografik incelemesi sol dekubit pozisyonda ilgili kılavuzlara uygun olarak yapıldı (kılavuz). Tüm hastaların parasternal uzun ve kısa eksen, apikal dört boşluk, apikal iki boşluk ve apikal üç boşluk pencerelerinden iki boyutlu Eko, renkli Doppler incelemeleri yapıldı. Akım hızları uygun olanından seçilerek atım(pulse) veya sürekli(continue) dalga Doppler ile incelendi. Apikal dört boşluk penceresinden görüntü elde edildikten sonra açı, kazanım(gain) ve derinlik olabildiğince azaltılarak; mitral lateral anulus ve triküspit lateral anulustan atım dalga doku Doppler(DD) kaydı alındı. DD’de sistolik(S), erken diyastolik(e') ve geç diyastolik dalga(a') hızları ölçüldü. Yapılan incelemeler dijital olarak kayıt edildi. Analizler Echopac 6.5 (Echopac Mac, GE) ile dinlenme incelemesi için işlem sırasında yapıldı. 3.3 Efor Kapasitesi Değerlendirmesi 23 Efor kapasitesi değerlendirmesi Quinton treadmill egzersiz cihazı ile Modifiye Bruce protokolüne göre yapıldı. Test sırasında sistemik arteryel tansiyon brakiyal yoldan ölçüldü. Egzersiz semptom gelişmesi veya öngörülen maksimum kalp hızına ulaşılması ile sonlandırıldı. 3.4 Stres Eko ve Doppler Parametrelerinin Elde Edilmesi ve Analizi Stres Doppler incelemesinde supin bisiklet ergometri cihazı kullanıldı. İşlem sırasında hasta supin pozisyonda yaklaşık %45º olacak şekilde hazırlandı. Bisiklet çevirme denemesi yapıldıktan sonra sırasıyla 3 dakikada bir basamak artırarak 25, 50 ve 75 watt işyükü verecek şekilde hastanın cinsiyet, yaş ve ağırlına göre cihaz ayarı yapıldı. Egzersiz sırasında sürekli triküspit kaçak jet hızı ve mitral kapak giriş akım hızı görüntülemesi yapıldı. Sınırı en düzgün belirlenen jetlerden dijital kayıt alındı. Ayrıca maksimum egzersiz sırasında mitral ve triküspit lateral anuluslarından atım dalga DD kayıtları alındı. Egzersize hasta yorulana kadar veya kalp hızı 140/dakika üzerine ulaşana kadar devam edildi. Yapılan incelemeler dijital olarak kayıt edildi. Analizler Echopac 6.5 (Echopac Mac, GE) ile işlemden hemen sonra(off-line) yapıldı. 3.5 Kan Örneklerinin Elde Edilmesi, Saklanması ve Çalışılması Hastalardan antekubital venden dinlenme halinde ve efordan sonraki 15 dakika içerisinde alınan kan örnekleri jelsiz kuru tüpe konuldu, 3000 devirde 10 dakika çevrildi. Elde edilen serumlar pipetle alındıktan sonra 3 ayrı porsiyona ayrıldı. Çalışılacağı zamana kadar saklanmak üzere, alındıktan sonraki 1 saat içerisinde -80ºC derin dondurucuya konuldu. Serumların tekrar tekrar eriyip dondurulmasından sakınıldı. Projede kullanılan tüm biyokimyasal parametrelerin çalışılması Okmeydanı Eğitim ve Araştırma Hastanesi Biyokimya laboratuarında Doç. Dr. Sembol Türkmen ve Uz. Dr. Serkan Doğan tarafından yapıldı. Serumlar inceleneceği gün oda ısısında eritildi. Üretici firmanın tarifine göre aşağıdaki şekilde çalışıldı. Çalışmamızda N-terminal pro-BNP değerlendirilmesi için “BI-20852 BNP Fragment EIA” (Enzyme Immunoassay For The Quantitative Determination of Fragment in Biological Fluids, Biomedica, www.bmgrp.com/fileadmin/countries/bmgrp.com/pdfs/BI20852_BNP_Fragment_PI.pdf) kiti kullanılmıştır. Ayıraçlar oda ısına getirildi. Ayıraçlar ve örnekler tarif edilen şekilde hazırlandı. Plaka üzerindeki boş olarak işaretlenmiş çukurcuklara ASYBUF(ayıraç sıvısı) eklendi. Boş olarak işaretlenenler hariç çukurcuklara standart/dilüe edilmiş örnekler/kontrol eklendi. Boş olarak işaretlenenler hariç kojugat 24 eklendi, hafifçe karıştırıldı. 4ºC de karanlık ortamda 24 saat inkübe edildi. Seyreltilmiş WASHBUF(yıkama sıvısı) ile çukurcuklar 5 kez yıkandı. Çukurcuklar kağıt havlu ile kurulandı. SUB(substrat) eklendi. Oda ısısında, karanlık bir ortamda 20 dakika bekletildi. STOP(durdurma solüsyonu) eklendi. Renk yoğunluğu 450 nm’de ölçüldü. Sonuçlar fmol/ml olarak verildi. Çalışmamızda matriks metalloproteinaz -9 değerlendirilmesi için “The RayBio® Human MMP-9 ELISA” (Enzyme-Linked Immunosorbent Assay) kiti kullanılmıştır(www.raybiotech.com/manual/ELISA/ELH-MMP9-001.pdf). Kit MMP-9’un pro ve aktif formlarını serum, plazma, hücre kültür süpernatantlarında ve idrarda in vitro olarak kantitatif ölçmek için hazırlanmıştır. Kitte bulunan insan MMP-9’u için özel hazırlanmış antikor kaplı 96 çukurcuk içeren plakaya standartlar ve örnekler pipetle konuldu. Standart ve örnek içeriğindeki MMP-9 çukurcuklara sabitlenmiş antikorlara bağlandı. Çukurcuklar yıkandıktan sonra, biotinilize anti-Human MMP-9 antikorları eklendi. Tekrara yıkanarak bağlanmamış biotinilize antikorlar uzaklaştırıldıktan sonra HRP-conjugated streptavidin çukurcuklara eklendi. Çukurcuklar tekrar yıkandı, TMB substratlı solüsyon eklendi. Böylece bağlı MMP-9 miktarına göre renk meydana geldi. Solüsyon eklenmesi renk maviden sarıya dönünce sonlandırıldı. Renk yoğunluğu 450 nm’de ölçüldü. Sonuçlar pg/ml olarak verildi. Çalışmamızda matriks metalloproteinaz-2 değerlendirilmesi için “The RayBio® Human MMP-2 ELISA” (Enzyme-Linked Immunosorbent Assay) kiti kullanılmıştır (www.raybiotech.com). Kit MMP-2’nin serum, plazma, hücre kültür süpernatantlarında ve idrarda in vitro olarak kantitatif ölçmek için hazırlanmıştır. Kitte bulunan insan MMP-2 için özel hazırlanmış antikor kaplı 96 çukurcuk içeren plakaya standartlar ve örnekler pipetle konuldu. Standart ve örnek içeriğindeki MMP-2 çukurcuklara sabitlenmiş antikorlara bağlandı. Çukurcuklar yıkandıktan sonra, biotinilize anti-Human MMP-2 antikorları eklendi. Tekrara yıkanarak bağlanmamış biotinilize antikorlar uzaklaştırıldıktan sonra HRP-conjugated streptavidin çukurcuklara eklendi. Çukurcuklar tekrar yıkandı, TMB substratlı solüsyon eklendi. Böylece bağlı MMP-2 miktarına göre renk meydana geldi. Solüsyon eklenmesi renk maviden sarıya dönünce sonlandırıldı. Renk yoğunluğu 450 nm’de ölçüldü. Sonuçlar pg/ml olarak verildi. 3.6 Tedavi Takip ve Değerlendirilmesi Çalışmaya Ekim 2006’da başlandı. En son hasta Nisan 2007’de alındı. Toplam 22 hastada Valsartan tedavisine başlandı. Takip sırasında 3 hasta sebep bildirmeksizin 25 çalışmadan ayrıldı. Bir hasta takipte Ankilozan Spondilit tanısı konması sebebiyle çalışmadan çıkarıldı. Toplam 18 hasta 14 haftalık tedavi sürecini komplikasyonsuz olarak tamamladı. Tüm hastalar günlük tek doz 160 miligram Valsartan kullandı. Hastalara olası hipotansif etkiden dolayı ilacı ilk hafta yarım (80 mg/gün), sonra tam (160 mg/gün ) almaları söylendi. Yine aynı sebeple ilacı akşamları almaları söylendi. Tüm hastalara olası yan etkiler ve karşılaşılabilecek sorunlarda iletişim kurmaları için mobil telefon numarası verildi. Hastaların ilaç kullanımına uyumunu takip için 4 haftada bir kontrole çağrıldı. 3.7 Verilerin İstatiksel Değerlendirilmesi Sürekli değişkenler ortalama±standart sapma, minimum ve maksimum değerler olarak verildi. Tedavi öncesi ve sonrası ölçümleri karşılaştırmak için tekrarlı ölçümlerin iki yönlü varyans analizi yapıldı. 26 4. BULGULAR 4.1 Hastaların Klinik ve Demografik Özellikleri, Takip Sonuçları Tedavi başlanan 22 hastanın biri takipte Ankilozan Spondilit tanısı konmasıyla çalışmadan çıkarıldı. 3 hasta sebep bildirmeksizin takipten ayrıldı. Toplam 18 hasta 14 haftalık tedavi sürecini komplikasyonsuz tamamladı. Tedavi sürecinde ilaçla ilişkilendirilebilecek bir şikayet bildirilmedi. 18 hastanın 15’i kadın 3’ü erkekti. Ortalama yaşları 38,7(±7,33, 23 ile 50 yaş arası)’ydi. 6 hasta NYHA sınıf II, diğer hastalar sınıf I idi. Hastaların tek tek başlangıç bulguları tablo 5’de, örneklem ortalamaları tablo 6’da verilmiştir. Tablo 5a: Hastaların demografik ve tedavi öncesi ekokardiyografik özellikleri Hasta Cins Yaş KH TA NYHA MKA(BYZ) i. MKA(Plan.) i. Maks. Gr. Ort. Gr. 1 K 29 99 110/65 2 0,72 0,72 21,58 14,97 2 K 42 80 120/80 1 0,80 0,95 11,20 7,80 3 K 44 98 115/75 2 0,83 0,77 18,90 10,48 4 K 34 74 120/75 1 0,65 0,88 14,38 7,65 5 E 42 60 120/83 1 0,78 0,83 12,89 5,91 6 K 39 75 117/78 2 0,84 0,70 21,13 12,69 7 E 50 75 128/83 1 0,63 0,63 15,20 7,21 8 K 46 76 125/80 2 0,82 0,86 13,55 7,04 9 K 28 67 110/70 1 0,94 0,94 18,00 7,00 10 K 34 75 115/75 1 1,30 1,29 8,91 4,93 11 K 43 68 120/80 2 0,70 0,70 31,00 17,00 27 12 K 38 72 113/76 1 0,80 0,80 11,00 6,00 13 K 35 76 110/70 1 0,98 1,04 13,80 6,96 14 K 48 65 128/85 1 0,84 0,83 9,31 4,51 15 K 45 66 130/85 2 1,14 1,14 10,00 5,00 16 K 23 70 110/70 1 0,81 0,84 15,80 6,00 17 K 42 90 115/75 1 1,15 1,12 15,70 8,90 18 E 35 74 115/76 1 0,53 0,53 17,00 10,00 Tablo 5b: Hastaların demografik ve tedavi öncesi ekokardiyografik özellikleri Hasta PABs SoA i. SoVSSÇ SoVDSÇ MY TY Aort hızı AY 1 43,82 2,84 2,90 4,54 Eser 2 1,10 1 2 25,00 2,80 3,66 5,47 Yok Eser 0,96 Eser 3 38,09 2,68 2,23 3,82 Yok Eser 1,13 1 4 34,52 2,80 3,30 4,90 Eser Eser 1,40 Eser 5 33,40 2,34 3,20 4,80 1 Eser 1,40 Eser 6 42,64 3,10 3,05 4,26 1 1 1,30 Eser 7 37,61 2,57 3,54 5,34 2 1 1,95 1-2 8 46,31 2,71 2,91 4,57 2 2 1,50 2 9 52,65 2,59 2,94 4,90 Eser 1 1,39 Eser 10 34,94 2,37 2,90 4,30 2 Eser 1,70 2 11 43,00 2,00 2,50 4,00 Yok Eser 1,20 Yok 12 30,18 2,28 3,31 4,92 Yok Eser 1,50 Eser 13 45,80 1,96 2,96 4,73 Eser Eser 1,94 Eser 14 43,96 2,53 3,06 4,62 2 1 1,20 1 15 31,79 1,97 2,65 4,36 Eser Eser 1,60 Eser 16 33,40 2,23 2,70 3,82 Eser Eser 1,30 1 17 37,10 2,44 2,75 4,26 Eser Eser 1,91 2 18 30,00 2,42 3,50 5,02 Eser Eser 1,48 1 28 Tablo 6: örneklemin genel özellikleri Ortalama Yaş (yıl) Kalp hızı Tansiyon arteryel (mmHg) MKA(BYZ) indeksi (cm2/m2) MKA(Plan) indeksi (cm2/m2) Dinlenme ortalama gradyent (mmHg) Efor ortalama gradiyent (mmHg) Dinlenme sistolik PAB (mmHg) Efor sistolik PAB (mmHg) SoA indeksi (cm/m2) Kapak rezistansı(dyne.sn.cm-5) Atım hacmi(ml/dk) NT-proBNP (fmol/ml) MMP-9 (pg/ml) 38,72 76,11 117,8 / 76,7 0,849 0,866 8,34 18,09 38,01 70,64 2,479 52,22 70,85 56,65 34363,6 Standart sapma 7,33 11,91 6,5 / 5,6 0,194 0,191 3,49 4,02 7,10 11,03 0,319 26,26 21,31 27,76 3341,2 Minimum Maksimum 23 59 110 / 65 0,53 0,53 4,5 4,5 25,0 51,2 1,9 27,5 34,6 28 26910 50 100 130 / 85 1,30 1,29 17,0 27,0 52,6 87,3 3,1 128,1 106,3 104 38750 4.2 Ekokardiyografi, Doppler ve Stres Doppler Sonuçları Hastaların ortalama planimetrik mitral kapak alan indeksi 0,866 cm2/m2, basınç yarılanma zamanı ile hesaplanan MKA indeksi ise 0,849 cm2/m2’ydi. Dinlenme sırasında ve efor sırasında ortalama mitral kapak gradyenti, sırasıyla, 8,3 mmHg ve 18,1 mmHg olarak gerçekleşti. Tedavi sonrasında ise sırasıyla dinlenme ve efor ortalama gradyentler 8,3 mmHg ve 17 mmHg olarak gerçekleşti. Öncesine göre tedavi sonrası gradyentleri ne dinlenmede ne de eforda anlamlı farklı değildi (şekil 3). Şekil 3 Dinlenme sırasında ölçülen sistolik PAB tedavi öncesi-sonrasında anlamlı farklı değilken, efor sırasında ölçülen PABs anlamlı farklıydı (şekil 4). Şekil 4 29 Hesaplanan kapak rezistansı tedavi sonrasında anlamlı artarken, atım hacmi(strok volüm) anlamlı azaldı (şekil 5) Şekil 5 DD ile hem sol ventrikülden hem de sağ ventrikülden dinlenme ve efor sırasında ölçülen sistolik(S), erken diyastolik(e') ve geç diyastolik(a') dalga hızları kendi aralarında anlamlı korele olabilirken (r 0,02 ile 0,85 arasında), tedavi öncesi sonrasında anlamlı farklı değildi(two tailed p>0,05). Şekil 6 30 Şekil 7 Şekil 8 31 Şekil 9 4.3 Efor Testi Sonuçları 32 Tedavi öncesi ve sonrası efor süresi, işyükü(METS olarak), maksimum kalp hızı ve hedef kalp hızına ulaşma oranları tablo 7’de verildi. Tedavi öncesi- sonrası değerleri arasında efor süresi açısından anlamlı fark bulundu (şekil 10). Şekil 10 Tablo 7. Efor testi sonuçları tedavi öncesi Hasta tedavi sonrası 1 efor süresi (saniye) 909 MET S 10,10 maks. KH 200 yüzde KH 105 efor süresi 790 MET S 10,10 maks. KH 182 yüzde KH 95 2 986 12,80 169 92 987 12,80 169 95,4 3 662 7,00 158 85 730 7,00 142 81 4 737 7,00 164 89 788 10,10 166 96 5 868 10,10 153 86 938 10,10 149 84 6 751 7,00 185 102 660 7,00 179 99 7 855 10,10 163 102 907 10,10 155 97 8 551 4,60 149 87 569 4,60 145 84 9 768 10,10 178 93 778 10,10 174 91 10 832 10,10 175 94 848 10,10 170 92 11 750 10,10 151 85 751 10,10 150 85 12 714 10,10 173 94 785 10,10 169 93 13 845 10,10 176 94 885 10,10 175 94 14 621 7,00 146 86 820 9,90 157 92 33 15 619 7,00 150 85 825 9,90 159 90 16 833 9,90 188 95 921 10,10 182 92 17 785 10,10 197 110 939 10,10 171 97 18 885 10,10 173 94 913 10,10 178 96 785,6 9,1 170,7 94,2 846,4 9,5 164,2 91,7 4.4 Biyokimya Sonuçları Tedavi öncesi dinlenmede alınan biyokimyasal parametre sonuçları tablo 8’de gösterildiği gibi gerçekleşti. Bir hastanın kan örnekleri hemolize olduğu için değerlendirilemedi. NT-proBNP ve MMP-9 sonuçları bir aralıkta dağılırken MMP-2 değerleri çoğu hastada ölçülemeyecek kadar düşük bulundu. NT-proBNP seviyeleri hem tedavi öncesinde hem de tedavi sonrasında eforla azalmasına karşın bu anlamlı bulunmadı. Tedavi ile dinlenme ve efor NT-proBNP değerlerinde anlamlı değişiklik olmadı (şekil 11). Ancak SoA çapına göre hastaları SoA’u büyük ve küçük olarak (parasternal uzun eksenden ön-arka çap 40 milimetreden küçük ya da büyük)iki gruba ayrıldığında tedavi öncesinde NT-proBNP seviyeleri SoA çapı büyük olanlardan anlamlı olarak daha fazlaydı. Bu anlamlı farkın tedavi sonrası kaybolduğu izlendi (şekil 12). Şekil 11 34 Tablo 8 Hasta NT-proBNP (fmol/ml) MMP-9 (pg/ml) MMP-2 (pg/ml) 104 35461 23539 1 104 29660 22336 2 100 30378 23023 3 58 33727 313 4 52 38750 0 5 45 37315 0 6 37 26910 0 7 hemolize hemolize hemolize 8 46 38272 0 9 30 38331 0 10 30 32232 0 11 32 35581 0 12 32 35401 0 13 33 32830 0 14 75 34983 0 15 28 33787 0 16 79 37793 0 17 78 32770 0 18 Şekil 12 35 MMP-9 seviyeleri hem dinlenmede hem de eforda artma eğilimi gösterse de anlamlı değişiklik gözlenmedi(şekil 13). Şekil 13 5. TARTIŞMA Post kapiller PHT sık karşılaşılan bir problemdir. Birçok sol kalp hastalığına eşlik ederek hastalığın morbiditesini artırmaktadır. MD’de sık görülen tedavi gerekliliğini ve 36 şeklini belirleyen bir durumdur. Pasif göllenmeyle başlar ve aktif vazokonstriksiyon ile devam eder. Zamanla yapısal değişiklikler gelişerek geri dönmesi zorlaşmakta, gecikmekte ve bazense tam olamamaktadır. Esasında bu üç süreç aynı zamanda başlayıp devam etmekte, ancak sonuçlarının ortaya çıkması üç süreç için farklı olduğu için böyle bir görece sıralama yapılmaktadır. PHT gelişiminde farklı mekanizma süreçlerinin sonuçlarının ortaya çıkmasında zamansal farklılık olduğu gibi tedaviye cevapta da aynı farklılık beklenir. Yani MD’nin giderilmesiyle göllenmede ani bir çözülme olurken aktif vazokonstriksiyonda bu süre daha uzundur. Yapısal değişikliklerin geri dönmesi ise aylaryıllar içinde olmakta bazense tam olamamaktadır. Vazokonstriksiyon özellikle egzersizle hem sistemik, hem de pulmoner vasküler yatakta tetiklenmektedir. RAS’ın hem aktif vazokonstriksiyonda hem de yeniden yapılanmada etkili olduğu gösterilmiştir. Vazokonstriksiyon üzerine olan etkilerinin sonuçları kısa sürede ortaya çıkarken yapısal değişiklikler üzerine olan etkilerinin sonuçlarının ortaya çıkması daha uzun sürelere gereksinim duymaktadır. Çalışmada kullanılan Valsartan, ATII reseptörlerini bloke ederek bir kısım RAS etkilerini engellemektedir. Çalışmada dinlenme PAB’ı tedavi öncesi ve sonrasında anlamlı farklılık göstermezken, egzersiz PAB’ının anlamlı azaldığı gözlendi (p<0,001). Bu bulgu MD’de Valsartan kullanımının pulmoner vasküler yatakta meydana gelen aktif vazokonstriksiyonu engellediği şeklinde yorumlanabilir. Dinlenme PAB’ının belirgin değişmemesi ise daha çok pasif göllenme ve yapısal değişikliklere bağlı geliştiğinin bir göstergesi olarak değerlendirildi. Yıllar içinde gelişen yapısal değişikliklerin 14 haftalık tedavi ile tam olarak düzelmemesi makul bir sonuçtur. Ayrıca yapısal değişiklikler üzerine etkili tek mekanizma RAS değildir ve Valsartan da yalnızca ATII reseptörleri üzerine etkilidir. Akım bağımlı bir formülle hesaplanan mitral kapak direncinin artmış olması, pulmoner vasküler yatakta direncin azalması ile akım önündeki engelin mitral kapağa kadar ötelenmesinin bir bulgusu olarak değerlendirilebilir. Atım hacmi ise tedavi ile azalmıştır. Bu sabit bir darlık olan MD’nin değişmemesine karşın toplam kan hacminin azalmasına bağlı gelişmiş olabileceği kabul edildi. Ancak hastalardan hiçbirinde halsizlik-yorgunluk gibi bir şikayete sebep olmadı. DD ile elde edilen doku hızlarından hiçbirisi tedaviyle anlamlı değişiklik göstermedi. Bu SoV ve SaV’den, dinlenme ve eforda elde edilen değerlerin tümünde izlendi. Eforla elde edilen doku hızlarında tedaviye cevabı iyi olan hastalarda belirgin farklılık izlenmesine rağmen, bu değişiklik tüm hastalar beraber değerlendirildiğinde istatiksel olarak gözlenmedi. 37 Efor süresi tedaviyle ortalama 59,85 saniye arttı. Bu artış istatiksel olarak anlamlı bulundu. Tedavinin hemodinamik faydalılığını destekleyen bir bulgu olarak değerlendirildi. BNP seviyeleri diyastol sonu basınç ile doğru orantılı olarak artmaktadır. MD’de BNP seviyelerinin arttığı gösterilmiştir ve bu artış daha çok SaV diyastol sonu basıncının artışıyla ilişkilendirilmiştir. MD’de eforla BNP değişimine dair bilgi sınırlıdır. NTproBNP içinde benzer sonuçlar bildirilmiştir. Çalışmada SoA’u büyük olanlarla olmayanların ayrıca değerlendirildiği bir alt grup analizde tedavi öncesi SoA’u büyük olanlarda NT-proBNP seviyelerinin anlamlı olarak yüksek olduğu saptandı. Bu durum SoA’da hemodinamik etkilenmenin fazla olduğu durumlarda NT-proBNP düzeylerinin yüksek olduğu anlamına gelmektedir. Dahası 14 haftalık Valsartan tedavisi sonrası bu anlamlı farkın ortadan kalktığı hem istirahatte hem de egzersiz sırasında gösterildi. MD’de SoA’daki dilatasyon derecesinin klinik olaylar, fonksiyonel kapasite ve AF ile ilişkisi anımsanacak olursa Valsartan tedavisi ile elde edilen NT-proBNP azalmasının uzun dönemde atriyal yeniden şekillenme üzerine olumlu etki yapacağının da bir işareti olarak kabul edilebilir. Bir çalışmada Valsartan tedavisinin AF’nin sinüs ritmine döndürülmesi ve sinüs ritminin korunmasında olumlu etkilerinin gösterilmiş olması benzer bir etkinin MD’deki hastalarda da sağlanabileceği şeklinde yorumlanabilir. Hasta grubumuzun KAH, HT, sol ventrikül sistolik disfonksiyonu gibi sol ventrikül diyastol sonu basıncını, dolayısıyla da ortalama SoA basıncını artırıcı ek patolojilere sahip olmaması SoA büyüklüğü değişkeni dışlandığında(yani SoA’u büyük olanlarda) tedavi öncesi ve sonrası NT-proBNP düzeylerinde anlamlı değişme olmamasının sebebi olarak kabul edildi. MMP-9 seviyesinde tedavi öncesinde ve sonrasında eforla anlamlı değişiklik olmadı. Aynı şekilde tedaviyle ne dinlenme ne de efor MMP-9 seviyelerinde anlamlı değişiklik izlenmedi. Prekapiller PHT’de arttığı bildirilen MMP-2 seviyesi çalışma hastalarının çoğunda tespit edilemeyecek kadar düşük bulundu. “Post kapiller PHT’de MMP-2’nin rolü sınırlı mıdır?” sorusunu akıla getirse de ölçülebilen değer sayısı sınırlı olduğu için çalışma verileriyle bunu değerlendirmek mümkün değildir. 38 6. SONUÇ Tez çalışmasında eforla PAB’daki artışa Valsartan tedavisinin etkisi farklı yöntemlerle araştırıldı. Bu araştırmada değişik ekokardiyografik yöntemler kullanıldı. Hastaların fonksiyonel kapasiteleri koşubandı egzersiz metoduyla karşılaştırıldı. Ayrıca NT-proBNP, MMP-2 ve MMP-9 biyokimyasal belirteçleri incelendi. Valsartan’ın eforla PAB’da meydana gelen artışı anlamlı olarak azalttığı bisiklet ergometrisi kullanılan stres ekokardiyografi testiyle saptandı. Pulmoner arter sistolik basıncında Valsartan tedavisinin olumlu etkisini gösteren ilk çalışma olması nedeniyle preliminer özellik gösteren bu çalışmanın farklı çalışmalarla desteklenmesi gerekmektedir. İkinci olarak Valsartan tedavisinin hastaların egzersiz sürelerini anlamlı olarak artırdığının tespit edilmesi pulmoner arter basıncındaki azalma ile uyumlu bir sonuç olarak değerlendirildi. Bu olumlu fizyolojik ve fonksiyonel düzelme biyokimyasal parametrelerle desteklenemedi, ancak hastaların asemptomatik olması ve ekokardiyografik olarak da normal sol ventrikül fonksiyonlarına sahip olması özellikle NT-proBNP seviyelerinde beklenen azalmanın görülmemesinin sebebi olabileceği düşünüldü. Sol atriyum büyüklüğüne göre yapılan alt grup analizde sol atriyumu normalden büyük olanlarla olmayanlar arasında başlangıçta BNP düzeylerinde görülen anlamlı farkın Valsartan tedavisiyle azaldığı ve bu azalmanın hemodinamik yük altındaki sol atriyumu büyük olan hastalarda gerçekleştiği gözlendi. 7.KAYNAKLAR 39 1. Braundwald E. Valvular heart disease. In: Braundwald E, ed. Heart Disease. Philadelphia, Pa: W.B. Saunders; 1984:1063–1135. 2. Fuster V et all. Hurst’s The Heart. McGraw-Hill. 2002 3. Bonow, RO, Carabello, BA, Chatterjee, K, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing committee to revise the 1998 guidelines for the management of patients with valvular heart disease). J Am Coll Cardiol 2006; 48:e1. 4. Wood, P. An appreciation of mitral stenosis. I. Clinical features. Br Med J 1954; 4870:1051. 5. Rowe, JC, Bland, EF, Sprague, HB, White, PD. The course of mitral stenosis without surgery: ten- and twenty-year perspectives. Ann Intern Med 1960; 52:741 6. Selzer, A, Cohn, KE. Natural history of mitral stenosis: a review. Circulation 1972; 45:878. 7. Sagie, A, Freita, N, Padial, LR, et al. Doppler echocardiographic assessment of long-term progression of mitral stenosis in 103 patients: Valve area and right heart disease. J Am Coll Cardiol 1996; 28:472. 8. Gordon, SP, Douglas, PS, Come, PC, Manning, WJ. Two-dimensional and Doppler echocardiographic determinants of the natural history of mitral valve narrowing in patients with rheumatic mitral stenosis: implications for follow-up. J Am Coll Cardiol 1992; 19:968. 9. Rowe, JC, Bland, EF, Sprague, HB, White, PD. The course of mitral stenosis without surgery: ten- and twenty-year perspectives. Ann Intern Med 1960; 52:741. 10. Olesen, KH. The natural history of 271 patients with mitral stenosis under medical treatment. Br Heart J 1962; 24:349. 11. Abernathy, WS, Willis, PW III. Thromboembolic complications of rheumatic heart disease. Cardiovasc Clin 1973; 5:131. 12. Kawanishi DT, Rahimtoola SH. Mitral Stenosis. In: Rahimtoola SH, ed. Atlas of Heart Disease. Valvular Heart Disease. Vol XI. Philadelphia, Pa: Current Medicine; 1997:8.1–8.24. 13. Oh JK, Seward JB, Tajik AJ, et all.The Echo Manual. Philedalphia, PA. Lipincott Williams-Wilkins. 1999 14. Wu W, Aziz G, Sadaniantz A. The use of stress echocardiography in the assessment of mitral valvular disease. Echocardiography 2004;21:451-8. 40 15. Voelker W, Jaksch R, Dittman H, Schmitt A, Maiuser M,Karsch K. Validation of continuous-wave Doppler measurement of mitral valve gradients during exercise: a simultaneous Doppler-catheter study. Eur Heart J 1989;10:737-46. 16. Aviles R, Nishimura R, Pellikka P, Andreen K, Holmes D.Utility of stress Doppler echocardiography in patients undergoing percutaneous mitral balloon valve valvotomy. J Am Soc Echocardiogr 2001;14:676-81. 17. Hecker S, Zabalgoitia M, Ashline P, Oneschuk L, O’Rourke R, Herrera C. Comparison of exercise and dobutamine stres echocardiography in assessing mitral stenosis. Am J Cardiol 1997;80:1374-7. 18. Plasma level of soluble P-selectin in patients with rheumatic mitral stenosis and sinus rhythm undergoing percutaneous mitral balloon valvuloplasty. Topaloglu S, Aras D, Ergun K, Geyik B, Ayaz S, Cay S, Cagirci G, Tufekcioglu O, Korkmaz S. J Thromb Thrombolysis. 2007 Jun;23(3):199-204. Epub 2006 Nov 28. 19. Decreased platelet activation and endothelial dysfunction after percutaneous mitral balloon valvuloplasty. Yetkin E, Erbay AR, Turhan H, Ileri M, Ayaz S, Atak R, Senen K, Cehreli S. Int J Cardiol. 2003 Oct;91(2-3):221-5. 20. Chiang, CW, Lo, SK, Ko, YS, et al. Predictors of systemic embolism in patients with mitral stenosis. Ann Intern Med 1998; 128:885. 21. Casella, L, Abelmann, WH, Ellis, LB. Patients with mitral stenosis and systemic emboli; hemodynamic and clinical observations. Arch Intern Med 1964; 114:773. 22. Coulshed, N, Epstein, EJ, McKendrick, CS, et al. Systemic embolism in mitral valve disease. Br Heart J 1970; 32:26. 23. Rowe, JC, Bland, EF, Sprague, HB, White, PD. The course of mitral stenosis without surgery: ten- and twenty-year perspectives. Ann Intern Med 1960; 52:741. 24. Chockalingam A, Venkatesan S, Dorairajan S, Chockalingam V, Subramaniam T, Jaganathan V, Elangovan S, Alagesan R, Gnanavelu G, Arul AS. Safety and efficacy of enalapril in multivalvular heart disease with significant mitral stenosis-SCOPE-MS. Angiology 2005 Mar-Apr;56(2):151-8. 25. Zmudka K, Dubiel JP, Brzostek T, Horzela T. Influence of a single dose of captopril on pulmonary haemodynamics and right ventricular function in mitral stenosis with pulmonary hypertension. Eur J Clin Pharmacol 1988;35(5):455-9. 26. Sebastian VJ, Bhattacharya S, Ray S, Jaafar SM. Beneficial effects of ACE inhibitors in severe mitral stenosis. Med J Malaysia 1989 Dec;44(4):291-5. 41 27. Orrange S, Kawanishi D, Lopez B, et al. Severe mitral stenosis with valve area _1.0 cm2? Eur Heart J. 1998;19(suppl):1531. Abstract. 28. Kawanishi DT, Rahimtoola SH. Mitral Stenosis. In: Rahimtoola SH, ed. Atlas of Heart Disease. Valvular Heart Disease. Vol XI. Philadelphia, Pa: Current Medicine; 1997:8.1–8.24. 29. Fuster V, Ryden LE, Asinger RW, et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. J Am Coll Cardiol. 2001;38:1231– 1265. 30. Cheng TO, Holmes DR Jr. Percutaneous balloon mitral valvuloplasty by the Inoue balloon technique: the procedure of choice for treatment of mitral stenosis. Am J Cardiol.1998;81:624–628. 31. Wallace AG. Pathophysiology of cardiovascular disease. In: Smith LH Jr, Thier SO, eds. Pathophysiology: The Biological Principles of Disease. The International Textbook of Medicine. Philadelphia, Pa: W.B. Saunders; 1981:1192. 32. Kawanishi DT, Rahimtoola SH. Catheter balloon commissurotomy for mitral stenosis: complications and results. J Am Coll Cardiol. 1992;19: 192–195. 33. Iung B, Garbarz E, Michand P, et al. Late results of percutaneous mitral commissurotomy in a series of 1024 patients: analysis of late clinical deterioration: frequency, anatomic findings, and predictive factors. Circulation. 1999;99:3272– 3278. 34. Palacios IF, Sanchez PL, Harrell LC, et al. Which patients benefit from percutaneous mitral balloon valvuloplasty? Prevalvuloplasty and postvalvuloplasty variables that predict long-term outcome. Circulation. 2002; 105:1465–1471. 35. Hammermeister K, Sethi GK, Henderson WG, et al. Outcomes 15 years after valve replacement with a mechanical vs. bioprosthetic valve: final report of the VA randomized trial. J Am Coll Cardiol. 2000;36: 1152–1158. 36. Kirklin JW, Barratt-Boyes BG. Mitral valve disease: with or without tricuspid valve disease. In: Rahimtoola SH, ed. Cardiac Surgery. 2nd ed. New York, NY: Churchill Livingstone; 1999:425–489. 37. Rabinovitch M. Pathobiology of pulmonary arterial hypertension. Extracellular matrix. Clin Chest Med 2001; 22:433–449. 38. The SOLVD İnvestigators: Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 327:685-691, 1992. 42 39. Pfeffer JM, Pfeffer MA, Braunwald E. Hemodynamic benefits and prolonged survival with long-term captoril therapy in rats with myocardial infarction and heart failure. Circulation 75:1149-1155, 1987. 40. Jasmin JF, Calderone A, Leung TK, Villeneuve L, Dupuis J. Lung structural remodeling and pulmonary hypertension after myocardial infarction: complete reversal with irbesartan. Cardiovasc Res 2003 Jun 1;58(3):621-31. 41. McMurray JJ, Ostergren J, Swedberg K, Granger CB, Held P, Michelson EL, Olofsson B, Yusuf S, Pfeffer MA, for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet 2003; 362: 767–771. 42. Simonneau G, Galie N, Rubin LJ, et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004;43:Suppl S: 5S-12S. 43. Humbert M, Morrel N, Archer SL, et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J AM Coll Cardiol 2004;43:13S-24S. 44. Morrell NW, Morris, KG, Stenmark, KR. Role of angiotensin-converting enzyme and angiotensin II in development of hypoxic pulmonary hypertension. Am J Physiol 1995 Oct;269(4 Pt 2):H1186-94. 45. Schuster DP, Crouch EC, Parks WC, Johnson T, Botney MD. Angiotensin converting enzyme expression in primary pulmonary hypertension. Am J Respir Crit Care Med. 1996 Oct;154(4 Pt 1):1087-91. 46. Morrell NW, Upton PD, Higham Maet al. Angiotensin II stimulates proliferation of human pulmonary artery smooth muscle cells via the AT1 receptor. Chest 1998;114(suppl 1):90S-91S. 47. Jeffery TK, Wanstall JC. Pulmonary vascular remodeling: a target for therapeutic intervention in pulmonary hypertension. Pharmacology&Therapeutics 92 (2001) 120. 48. Alpert MA, Pressly TA, Mukerji V, Lambert CR, Mukerji B. Short- and long-term hemodynamic effects of captopril in patients with pulmonary hypertension and selected connective tissue disease. Chest 1992 Nov;102(5):1407-12. 49. Leier CV, Bambach D, Nelson S, Hermiller JB, Huss P, Magorien RD, Unverferth DV. Captopril in primary pulmonary hypertension. Circulation 1983 Jan;67(1):155-61. 43 50. Cargill RI, Lipworth BJ. Lisinopril attenuates acute hypoxic pulmonary vasoconstriction in humans. Chest 1996;2:424-429. 51. Kiely DG, Cargill RI, Lipworth BJ. Acute hypoxic pulmonary vasoconstriction in man is attenuated by type 1 angiotensin II receptor blockade. Cardiovasc Res 1995;30:875-880. 52. Kiely DG, Cargill RI, Wheeldon NM, Coutie WJ, Lipworth BJ. Hemodynamic and endocrine effects of type 1 angiotensin II receptor blockade in patients With Hypoxaemic cor pulmonale. Cardiovasc Res 1997;33:201-208. 53. Maekawa K, Fujimoto T, Uemura S, Kanauchi M, Dohi K. Successful treatment for pulmonary hypertension with angiotensin 1 converting enzyme inhibitor in a patient with mixed connective tissue disease. Nihon Rinsho Meneki Gakkai Kaishi 1997 Feb;20(1):79-85. 54. Nong Z, Stassen J-M, Moons L, Collen D, Janssens S. Inhibition of tissue angiotensin-converting enzyme with quinapril reduces hypoxic pulmonary hypertension and pulmonary vascular remodeling. Circulation 1996 Oct 15;94(8):1941-7 55. Rondelet B, Kerbaul F, Van Beneden R, Hubloue I, Huez S, Fesler P, Remmelink M, Brimioulle S, Salmon I, Naeije R. Preventıon of pulmonary vascular remodellıng and of decreased bmpr-2 expressıon by losartan therapy in shuntınduced pulmonary hypertensıon. Am J Physiol Heart Circ Physiol 2005 Jul 15; 56. Clozel JP, Saunier C, Hartemann D, Fischli W. Effects of cilazapril, a novel angiotensin converting enzyme inhibitor, on the structure of pulmonary arteries of rats exposed to chronic hypoxia. J Cardiovasc Pharmacol 1991 Jan;17(1):36-40. 57. Okada K, Bernstein ML, Zhang W, Schuster DP, Botney MD. Angiotensinconverting enzyme inhibition delays pulmonary vascular neointimal formation. Am J Respir Crit Care Med 1998 158, pp. 939–950. 58. Jeffery TK, Wanstall JC. Perindopril, an angiotensin converting enzyme inhibitor, in pulmonary hypertensive rats: comparative effects on pulmonary vascular structure and function. Br J Pharmacol 1999 Dec;128(7):1407-18. 59. West J, Fagan K, Steudel W, et al. Pulmonary hypertension in transgenic mice expressing a dominant-negative BMPRII gene in smooth muscle. Circ Res 2004;94:1109-1114. 60. Du L, Sullivan CC, Chu D, et al. Signaling molecules in nonfamilial pulmonary hypertension. N Engl J Med 2003;348:500-9. 44 61. Belgi A, Yalcinkaya S, Umuttan D, Golbasi I, Kabukcu M, Sancaktar O, Tuzuner FE. Echocardiographic predictors of hemodynamic response and significance of dyspnea development in patients with mitral stenosis during dobutamine stress echocardiography. J Heart Valve Dis 2003 Jul;12(4):482-7. 62. Liang F, Gardner D (1998) Autocrine/paracrine determinants of strain-activated brain natriuretic peptide gene expression in cultured cardiac myocytes. J Biol Chem 273:14612–14619 18. Liang F, Gardner D (1999) Mechanical strain activates BNP gene transcription through a p38/NF-kappaB-dependent mechanism. J Clin Invest 104:1603–1612) 63. Hartmann F, Packer M, Coats A et al (2004) Prognostic impact of plasma Nterminal pro-brain natriuretic peptide in severe chronic congestive heart failure: a substudy of the Carvediolol Prospective Randomized Cumulative Survival (COPERNICUS) trial. Circulation 110:1780–1786 58. Anand I, Fisher L, Chiang Y et al (2003) Changes in brain natriuretic peptide and norepinephrine over time and mortality and morbidity in the Valsartan Heart Failure Trial (Val-HeFT). Circulation 107:1278–1283) . 64. Nagaya N; Nishikimi T; Okano Y; Uematsu M; Satoh T; Kyotani S; Kuribayashi S; Hamada S; Kakishita M; Nakanishi N; Takamiya M; Kunieda T; Matsuo H; Kangawa K. Plasma brain natriuretic peptide levels increase in proportion to the extent of right ventricular dysfunction in pulmonary hypertension. J Am Coll Cardiol 1998 Jan;31(1):202-8.) 65. Leuchte HH; Holzapfel M; Baumgartner RA; Ding I; Neurohr C; Vogeser M; Kolbe T; Schwaiblmair M; Behr J Clinical significance of brain natriuretic peptide in primary pulmonary hypertension. J Am Coll Cardiol 2004 Mar 3;43(5):764-70.) 66. Arat-Ozkan A, Kaya A, Yigit Z et al (2005) Serum N-terminal pro-BNP levels correlate with symptoms and echocardiographic findings in patients with mitral stenosis. Echocardiography 22:473–478) 67. Souza R, Bogossian HB, Humbert M, Jardim C, Rabelo R, Amato MBP and Carvalho CRR. N-terminal-pro-brain natriuretic peptide as a haemodynamic marker in idiopathic pulmonary arterial hypertension. Eur Respir J 2005; 25:509513. 68. Mukerjee D, Yap LB, Holmes AM, et al. Significance of plasma N-terminal probrain natriuretic peptide in patients with systemic sclerosis-related pulmonary arterial hypertension. Respir Med 2003;97:1230-6. 45 69. Galiè N, Grigioni F, Bacchi-Reggiani L et al. Relation of endothelin-1 to survival in patients with primary pulmonary hypertension. Eur J Clin Invest 1996;26:273. 70. Pfeffer JM, Pfeffer MA, Braunwald E. Hemodynamic benefits and prolonged survival with long-term captoril therapy in rats with myocardial infarction and heart failure. Circulation 75:1149-1155, 1987. 71. Jasmin JF, Calderone A, Leung TK, Villeneuve L, Dupuis J. Lung structural remodeling and pulmonary hypertension after myocardial infarction: complete reversal with irbesartan. Cardiovasc Res 2003 Jun 1;58(3):621-31. 72. McMurray JJ, Ostergren J, Swedberg K, Granger CB, Held P, Michelson EL, Olofsson B, Yusuf S, Pfeffer MA, for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet 2003; 362: 767–771. 73. Kaye AD, Nossaman BD, Smith DE, Ibrahim IN, Anwar M, Kadowitz PJ.Analysis of responses to angiotensin I (3-10) and Leu3 angiotensin (3-8) in the pulmonary vascular bed of the cat. Am J Ther. 1998 Sep;5(5):295-302. 46
![[EP-027] MULTİPL PULMONER NODÜL ETİYOLOJİSİ: MİTRAL](http://s1.studylibtr.com/store/data/004054413_1-dc4981d11cd256313b021da607338ff8-300x300.png)