kimyanın sembolik dili
advertisement

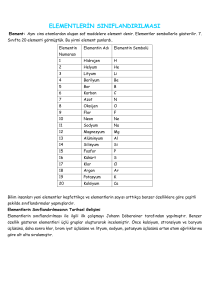
3. KİMYANIN SEMBOLİK DİLİ BÖLÜM Günümüzde kullandığımız element terimine ait bilgiler eski çağlara kadar uzanmaktadır. Empedokles’e göre canlılar toprak, su, hava ve ateşten oluşuyordu. Element sözcüğü ilk olarak Atinalı Platon tarafından kullanılmıştır. Platon dört elementi simgesel olarak ifade etmiştir. Platon’a göre her elementin belirli bir biçimi vardı. Ateş tetrahedron (dört yüzlü), su ikozahedron (yirmi yüzlü), hava oktahedron (sekiz yüzlü) ve toprak hekzahedron (altı yüzlü — küp) şeklindeydi. Empedokles’in Dört Öge Kuramı’ndan esinlenen Aristo’ya (MÖ 384-322) göre birbirine zıt olan dört özellik (sıcak, soğuk, ıslak ve kuru) ikişer ikişer karşılıklı olarak uygun bir biçimde birleşerek dört elementi oluşturuyordu (Şekil 1.2). Aristo’ya göre her bir element diğer üçüne dönüşebiliyordu. Örneğin ateş kuru-sıcak, hava ise sıcak-nemli olduğundan ateşteki kuruluk özelliği nemlilik özelliğine dönüştürülürse ateş de havaya dönüşmüş oluyordu. Dört Element Kuramı, Orta Çağ’da Türk İslam bilginleri tarafından üç element (cıva, kükürt ve tuz) daha eklenerek genişletilmiştir. Rönesans Dönemi ile birlikte Avrupalı bilginler 8-12. yüzyıllar arasında Türk-İslam bilginlerinin sahip oldukları bilgi birikiminden faydalanmışlar ve deneyler yapmaya başlamışlardır. 17. yüzyıldan itibaren yeni tekniklerin geliştirilmesiyle birlikte birçok element keşfedilmiştir. Bileşik ve minerallerin ısıtılmasıyla ya da farklı kimyasal tekniklerle ayrıştırılmasıyla elementler saf olarak elde edilmiştir. Ancak bu devirdeki element anlayışı tam olarak bilimsel değildi. Çünkü o günün şartlarında parçalanamayan maddeler element olarak tanımlanıyordu. Mesela o zamanlarda parçalanamayan tuzlar element olarak düşünülmüştür. Aristo’nun ortaya attığı dört element felsefesi geçerliliğini Robert Boyle’un elementi tanımlamasına kadar korumuştur. Robert Boyle yaptığı deneyler sonucunda bazı kimyasal maddelerin daha basit maddelere ayrıştığını, bazılarının ise ayrışmadığını tespit etmiştir. Bunun sonucunda da elementi maddenin parçalanamayan yapı taşı olarak tanımlamıştır. Halbuki günümüzde Robert Boyle’un tanımı geçerliliğini yitirmiş; elementlerin atomlardan oluştuğu ve bu atomların da proton, nötron ve elektronlardan meydana geldiği anlaşılmıştır. Günümüzde çok yüksek enerji kullanıldığında elementleri oluşturan atomlar parçalanabilmekte, daha küçük elementlere ve parçacıklara dönüşebilmektedir. ATEŞ Sıcak Kuru HAVA TOPRAK Nemli Soğuk SU Şekil 1.2: Aristo’ya göre elementler Uyarı Aristo’nun Dört Element Kuramı’nda belirtilen hava, su, toprak ve ateş aynı isimle doğada var olan maddelerle özdeş değildir. 21 Kimyada Kullanılan Semboller Tablo 1.1: Eski Yunan ve Roma’da gezegenler ve metaller arasındaki sembolik bağ Gezegen Metal Güneş Altın Ay Gümüş Mars Demir Merkür Cıva Jupiter Kalay Venüs Bakır Satürn Kurşun Simge Kimyada sembollerin kullanıldığına dair ilk yazılı belgelere eski Çin ve Mısır kaynaklarından ulaşılmaktadır. Daha sonraki sembolik gösterimler Eski Çinliler ve Eski Mısırlılardan etkilenmiştir. Eski çağlarda farklı bileşimlerdeki karışımları ve maddenin farklı biçimlerini göstermek için çeşitli semboller kullanılmıştır. Zamanla gezegenler de sembollerle ilişkilendirilmiştir. Örneğin Mısırlılar altını Güneş ile, gümüşü de Ay ile sembolize etmişlerdir. Eski Yunan ve Roma’da bilinen yedi gezegen ve bunlarla ilişkilendirilen metaller arasındaki sembolik bağ Tablo 1.1’de gösterilmiştir. Lavoisier’den önce belirli sayıda semboller ve formüllerden oluşan bir simya dili kullanılıyor ve bunlar gereksinime göre birleştiriliyordu. O zaman var olan sembollerle ifade edilemeyen kavramlar ise sözcüklerle betimleniyordu. Yaklaşık 30.000’den fazla simge kullanılıyordu. Eğer o zamanlarda kullanılmış olan sembolik dil günümüzde de kullanılmış olsaydı bilinen madde ve bileşik sayısı kadar çok simge kullanma durumunda kalınacaktı. Bu nedenle Lavoisier, kimyanın anlaşılır bir dille yeni bir adlandırmaya ihtiyacı olduğunu belirledi. 18. yüzyılın sonlarına doğru Lavoisier, kimyasal değişimleri daha cebirsel bir dille yazmak üzere sembolik gösterim üzerine çalışmalar yürütmüştür. Lavoisier ve arkadaşlarının ortak çalışmaları sonucunda “Kimyasal Adlandırma Yöntemleri” adlı bir eser ortaya çıkmıştır. Bu eserde, yaşam havası yerine oksijen, yanar gaz yerine hidrojen, vitriyol asiti yerine sülfürik asit ve hava asiti yerine karbonik asit isimleri önerilmiştir. Ayrıca bu eserde, alkaliler için üçgenler, metaller için daireler, asit kökleri için kareler, basit maddeler için Latince adlarının ilk ya da uygun iki harfinin içine alındığı uygun geometrik şekiller ve bileşikler için ise yan yana yazılan iki sembol kullanılmıştır. Tablo 1.2: Altın, cıva ve kurşun sembollerinin tarihsel gelişimi Altın 1500’ler 1600’ler 1700’ler 1800’ler Berzelius 22 Cıva Kurşun John Dalton’un (Con Dalton, 1760-1844) yaşadığı dönemde keşfedilen stokiyometri yasaları yeni bir sembolik dilin kullanımını gerektirmiştir. Dalton, atomları göstermek için daire kullanmıştır. Örneğin karbon, içi dolu dairelerle gösterilmiştir. Ama Dalton’un simgelemesinde karmaşık moleküllerin formülünü yazmada güçlükler yaşanıyordu. Dalton, hidrojenin en küçük bağıl ağırlığa sahip olduğunu kabul ederek ona “1” temel değerini vermiş ve ağırlık oranlarından yola çıkarak bazı elementlerin bağıl atom ağırlıklarının listesini oluşturmuştur. Stokiyometri konusunda çalışmalar yapmış olan Jöns Jakob Berzelius (Cans Cekıb Berzelyus), stokiyometrik ilişkileri sunmada Dalton’un kullandığı sembollerin yeterli olmadığı kanısına varmış ve 1813 yılında yeni bir sembol listesi hazırlamıştır. Bu sembollerin bir kısmı bugün hâlâ kullanılmaktadır. Berzelius sembolik gösteriminde harfi ya da işareti çevreleyen daire gibi şekiller kullanmamış, aynı sembole sahip başka bir atom olmayacak şekilde, her atomu Latince adının ilk harfini ya da ilkiyle birlikte uygun bir ikinci harfini alarak göstermiştir. Örneğin oksijeni O, demiri Fe sembolü ile göstermiştir. Kimyanın gelişim sürecinde bazı elementlerin sembolik gösterimi Tablo 1.2’de verilmektedir. Elementler Elementler, tek tür atomlardan oluşan saf maddeler olup kimyasal ayrıştırma yöntemleriyle kendisinden daha basit ve farklı özellik gösteren maddelere ayrılmaz. Örneğin bir altın yüzük içindeki tüm atomlar birbirinin aynıdır. Aynı şekilde bir bakır telin içerisindeki atomlar da aynı türdendir. Fakat altın yüzük ve bakır tel içerisindeki atomlar birbirinden farklıdır. Elementler eski çağlardan beri insan hayatında önemli bir yere sahiptir ve günlük hayatta birçok alanda kullanılmaktadır. Günümüzde bilinen 118 element vardır. Bunların 90 kadarı doğal kaynaklardan elde edilebilirken, geri kalanları sadece laboratuvarlarda oluşturulabilir. Her elementin bir ismi ve sembolü vardır. Günümüzde yaygın olarak kullanılan elementler ve bu elementlerin sembolleri Tablo 1.3’te verilmiştir. Faydalı Bilgi Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC), kimyasal maddelerin adlandırılmasında ve kullanılan sembollerin veya formüllerin belirlenmesinde öncülük yaparak kimyacılar arasında iş birliği sağlayan bir kuruluştur. Tablo 1.3: Gündelik hayatta karşılaşılan elementler ve sembolleri Element Sembolü Element Sembolü Element Sembolü Element Sembolü Hidrojen H Neon Ne Potasyum K Brom Br Helyum He Sodyum Na Kalsiyum Ca Gümüş Ag Lityum Li Magnezyum Mg Krom Cr Kalay Sn Berilyum Be Alüminyum Al Mangan Mn İyot I Bor B Silisyum Si Demir Fe Baryum Ba Karbon C Fosfor P Kobalt Co Altın Au Azot N Kükürt S Nikel Ni Cıva Hg Oksijen O Klor Cl Bakır Cu Kurşun Pb Flor F Argon Ar Çinko Zn Platin Pt Elementlerin bazılarına keşfeden kişinin ismi verilirken (Einstenium) bazı elementlere şehir veya ülke (Polonyum, Amerikyum, Kaliforniyum) ismi verilmiştir. Elementler genellikle bir veya iki harften oluşan bir kimyasal sembol ile gösterilir ve bu sembolün ilk harfi her zaman büyük yazılır. Sembollerde genellikle elementin İngilizce veya Latince adının ilk harfi kullanılır. Örneğin hidrojen elementi “H”, azot elementi “N” sembolü ile gösterilir. Eğer aynı harfle başlayan birden çok element varsa elementin İngilizce veya Latince adının ilk harfi ile ikinci veya üçüncü harfi sembol olarak seçilir. Örneğin klor elementi “Cl” sembolü ile krom elementi “Cr” sembolü ile gösterilir. Elementler çeşitli şekillerde sınıflandırılmıştır. Elementler fiziksel hâllerine göre katı, sıvı ve gaz olarak sınıflandırılabilir. Örneğin bakır katı, cıva sıvı, azot oda koşullarında gaz hâlinde bulunur (Resim 1.22). Elementler kimyasal özellikleri dikkate alınarak metaller, ametaller, yarı metaller ve soy gazlar (asal gazlar) şeklinde de sınıflandırılabilir. Doğada bulunan elementlerin büyük çoğunluğu metaldir. Metaller sadece ametallerle, ametaller ise hem kendi aralarında hem de metallerle bileşik oluşturabilir. Tamamı renksiz gaz hâlinde bulunan soy gaz elementleri kararlı bir yapıda oldukları için genellikle bileşik oluşturmaz. Bazı elementlerin özelliklerinin bir kısmı metallerinkine, bir kısmı da ametallerinkine benzer. Örneğin silisyum bir yarı metaldir. Resim 1.22: Doğada katı, sıvı, ve gaz hâlde bulunabilen elementler vardır. Uyarı Elementler hakkında detaylı bilgi 2. ünitede yer almaktadır. 23 Şekil 1.3: Atomik yapıdaki altın elementi bir metaldir. Bazı elementler atomik yapıda (Şekil 1.3) bulunurken bazı elementler moleküler yapıda bulunur. Atomik yapıdaki elementlerde aynı cins atomlar doğada tek başlarına bulunur. Bu tür elementlerin sembolü atomun sembolü ile aynıdır. Örneğin bakır, magnezyum, çinko ve demir atomik yapıdaki elementlerdendir. Moleküler yapıdaki elementlerin ise yapısında birbirine kimyasal bağlarla bağlı iki ya da daha fazla aynı cins atom gruplar hâlinde bulunur. Örneğin flor elementi (Şekil 1.4) iki flor atomundan oluşan moleküller (F2), kükürt elementi sekiz kükürt atomundan oluşan moleküller (S8) hâlinde doğada bulunur. Bileşikler İki ya da daha fazla element atomunun belirli oranda birleşmesiyle oluşan saf maddelere bileşik adı verilir. Doğada sınırlı sayıda element olmasına rağmen milyonlarca farklı madde bulunur. Element atomları alfabemizdeki harflere benzetilebilir. Alfabemizde 29 harf olmasına rağmen dilimizde bu harflerle oluşturulan çok fazla kelime vardır. Atomlar da harfler gibi bir araya gelerek birbirinden farklı bileşikler oluşturur. Metaller elektron vererek (+) yüklü iyonları (katyonları), ametaller ise elektron alarak (—) yüklü iyonları (anyonları) oluşturur. Anyonların ve katyonların birbirlerini elektrostatik kuvvetlerle çektikleri bileşiklere iyonik bileşikler, farklı cins ametal atomları arasında elektronların ortaklaşa kullanıldığı bileşiklere de kovalent bileşikler denir. Bileşikler formüllerle gösterilir. Bileşik formülleri, bileşiği oluşturan elementlerin neler olduğu ve element atomlarının birleşme oranları hakkında bilgi verir. Bileşikteki her elementin bağıl atom sayısı Hidrojen Oksijen elementin sağına yazılan alt indisle gösterilir. sembolü sembolü Eğer bileşikteki atomun sayısı bir ise 1 sayısı alt indisle gösterilmez. Örneğin yanda verilen 2 suyun formülünde, elementler sembolleri ile 1 oksijen atomu 2 hidrojen gösterilmiş, atomların bağıl sayıları alt indis atomu şeklinde yazılmıştır. Bileşiklerin adlandırılmasında bazı temel kurallar vardır. Belirgin bir sistematiğe göre adlandırma olmasaydı milyonlarca bileşiğin yaygın adlarını öğrenmek pek mümkün olmazdı. H O Şekil 1.4: Moleküler yapıdaki flor elementi bir ametaldir. Bileşiklerin Adlandırılmasında Temel Kurallar 1. Metal ve ametalden oluşan iyonik bileşikler, genellikle metalin adından sonra ametalin adına —ür eki getirilerek isimlendirilir. ÖRNEK Ad değiştirilmez. Sodyum klorür NaCl Sonuna —ür eki getirilir. yalım Cevapla Elementlerin ve bileşiklerin adlarını bilmemiz bizlere ne gibi faydalar sağlar? 24 Ametal oksijense oksit, azotsa nitrür, kükürtse sülfür şeklinde yazılır. İki veya daha fazla değerliği olan katyonların oluşturduğu iyonik bileşikler, katyonun değerliği (I, II, III) şeklinde yazılarak adlandırılır. İkiden fazla element bulunan iyonik bileşiklerde çoğunlukla anyon bir kök yani atomlar grubudur (NO3— gibi). Bazen de katyon bir köktür (NH4+ gibi). Bu tür iyonik bileşikleri adlandırmak için kökleri tanımak gerekir. İyonik bileşiklerin adlandırılması için yaygın olarak kullanılan anyonların ve katyonların bilinmesi gereklidir (Tablo 1.4 ve Tablo 1.5). Tablo 1.5: Bazı anyonlar ve okunuşları Tablo 1.4: Bazı katyonlar ve okunuşları Katyon Okunuşu Katyon Okunuşu Li+ Lityum Al3+ Alüminyum Na+ Sodyum Fe2+ Demir (II) K+ Potasyum Fe3+ Demir (III) Ag+ Gümüş Cu+ Bakır (I) Mg2+ Magnezyum Cu2+ Bakır (II) Ca2+ Kalsiyum Pb2+ Kurşun (II) Zn2+ Çinko NH4+ Amonyum Tablo 1.6: Bazı iyonik bileşiklerin formülleri ve okunuşları Okunuşu Bileşik Formülü CaO Kalsiyum oksit NH4Cl Amonyum klorür Na3N Sodyum nitrür NaOH Sodyum hidroksit MgS Magnezyum sülfür CaCO3 Kalsiyum karbonat CuO Bakır(II) oksit NaHCO3 Sodyum bikarbonat Cu2O Bakır(I) oksit Al2(SO4)3 Alüminyum sülfat Okunuşu F— Florür — Klorür — Br Bromür I— İyodür O2— Oksit S2— Sülfür N3— Nitrür OH¯ Hidroksit NO3— CO32— HCO3— PO43— SO42— Nitrat Cl Tablo 1.6’da bazı iyonik bileşiklerin adlandırılmasına örnek verilmiştir. Bileşik Formülü Anyon Karbonat Bikarbonat Fosfat Sülfat Okunuşu 2. İki ametalin oluşturduğu bileşikler, genellikle ilk ametalin adından sonra ikinci elementin adına —ür eki getirilerek isimlendirilir. Eğer bir ametal başka bir ametalle birden fazla kovalent bileşik oluşturuyorsa bu bileşiklerin adlandırılmasında element isimlerinin önlerine atom sayılarını belirten Latince ekler yazılır (Tablo 1.7). Ancak birinci element için mono- ön eki kullanılmaz. Bazı kovalent bileşiklerin formülleri okunuşları ile birlikte Tablo 1.8’de verilmiştir. Tablo 1.8: Bazı kovalent bileşiklerin formülleri ve adları Bileşik Formülü Okunuşu Bileşik Formülü HCl Hidrojen klorür NO Azotmonoksit HF Hidrojen florür NO2 Azotdioksit CO Karbonmonoksit N2O Diazotmonoksit CO2 Karbondioksit N2O5 Diazotpentaoksit CCl4 Karbontetraklorür SO2 Kükürtdioksit Tablo 1.7: Latince ön ekler ve anlamları Ön ek Anlamı mono- 1 di- 2 tri- 3 tetra- 4 penta- 5 hekza- 6 Okunuşu 3. Bazı bileşiklerin sistematik adlandırılmasında element adları kullanılmaz. Bu tür bileşikler için özel sistematik adlandırmalar geliştirilmiştir. Bu özel durumları ileride detaylı olarak öğreneceksiniz. Tablo 1.9’da asitlerin sistematik adlandırılmasına örnekler verilmiştir. Tablo 1.9: Bazı asitlerin sistematik adlandırılması Bileşik Formülü Okunuşu HNO3 Nitrik asit H2SO4 Sülfürik asit H3PO4 Fosforik asit CH3COOH Asetik asit 25 Alıştır ma 4. Bazı bileşikler geleneksel olarak sistematik olmayan adlarıyla adlandırılırlar. Su (H2O) ve amonyak (NH3) gibi birçok bileşiğin yaygın Aşağıda formülleri verilen bileşiklerin okunuşunu yazınız. Bileşik Formülü adları o kadar yerleşmiştir ki sistematik adları hemen hemen hiç kullanılmaz. Bu tür bileşiklere Tablo 1.10’da örnekler verilmiştir. Okunuşu Tablo 1.10: Bazı bileşiklerin geleneksel adları Fe(OH)3 MgF2 Bileşik Formülü Geleneksel Adı Bileşik Formülü Geleneksel Adı Al2S3 HCl Tuz ruhu HNO3 Kezzap Pb(NO3)2 NaCl Sofra tuzu H2SO4 Zaç yağı NO NaOH Sud kostik CH3COOH Sirke ruhu CaCO3 Kireç taşı NaHCO3 Yemek sodası Ca(OH)2 Sönmüş kireç NH4Cl Nişadır H2S N2 O 5 SO2 1. Etkinlik Elementlerin Adlarını Yazalım Aşağıda sembolleri verilen elementlerin adlarını örnekteki gibi bulmacadaki yerlerine yazınız. 1 2 3 4 6 19 5 F O S F O R 7 8 10 12 13 9 11 20 14 15 Yukarıdan aşağıya 16 17 18 26 1. P 3. B 4. Al 6. Cl 7. O 10. Ne 12. Mg 13. F 20. He Soldan sağa 2. C 5. S 8. K 9. Ar 11. Na 14. H 15. Li 16. Be 17. Ca 18. Si 19. N