ders plânı - fendersi.gen.tr
advertisement
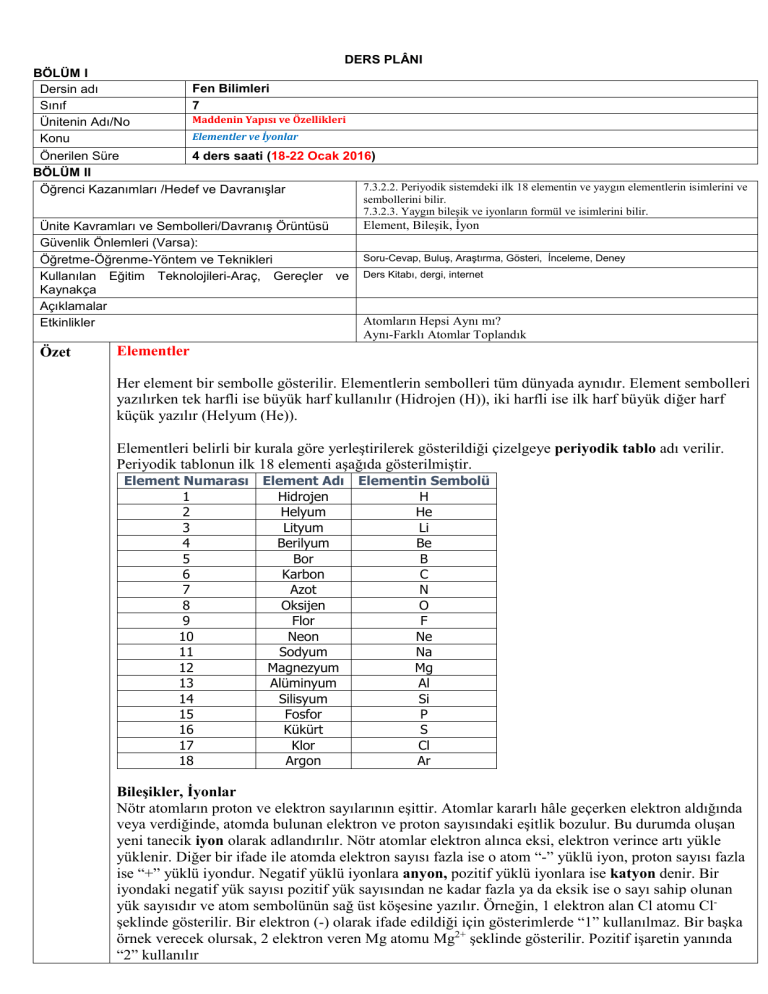
DERS PLÂNI BÖLÜM I Fen Bilimleri Dersin adı 7 Sınıf Maddenin Yapısı ve Özellikleri Ünitenin Adı/No Elementler ve İyonlar Konu 4 ders saati (18-22 Ocak 2016) Önerilen Süre BÖLÜM II 7.3.2.2. Periyodik sistemdeki ilk 18 elementin ve yaygın elementlerin isimlerini ve Öğrenci Kazanımları /Hedef ve Davranışlar sembollerini bilir. 7.3.2.3. Yaygın bileşik ve iyonların formül ve isimlerini bilir. Ünite Kavramları ve Sembolleri/Davranış Örüntüsü Güvenlik Önlemleri (Varsa): Öğretme-Öğrenme-Yöntem ve Teknikleri Kullanılan Eğitim Teknolojileri-Araç, Gereçler ve Kaynakça Açıklamalar Etkinlikler Özet Element, Bileşik, İyon Soru-Cevap, Buluş, Araştırma, Gösteri, İnceleme, Deney Ders Kitabı, dergi, internet Atomların Hepsi Aynı mı? Aynı-Farklı Atomlar Toplandık Elementler Her element bir sembolle gösterilir. Elementlerin sembolleri tüm dünyada aynıdır. Element sembolleri yazılırken tek harfli ise büyük harf kullanılır (Hidrojen (H)), iki harfli ise ilk harf büyük diğer harf küçük yazılır (Helyum (He)). Elementleri belirli bir kurala göre yerleştirilerek gösterildiği çizelgeye periyodik tablo adı verilir. Periyodik tablonun ilk 18 elementi aşağıda gösterilmiştir. Element Numarası 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Element Adı Hidrojen Helyum Lityum Berilyum Bor Karbon Azot Oksijen Flor Neon Sodyum Magnezyum Alüminyum Silisyum Fosfor Kükürt Klor Argon Elementin Sembolü H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar Bileşikler, İyonlar Nötr atomların proton ve elektron sayılarının eşittir. Atomlar kararlı hâle geçerken elektron aldığında veya verdiğinde, atomda bulunan elektron ve proton sayısındaki eşitlik bozulur. Bu durumda oluşan yeni tanecik iyon olarak adlandırılır. Nötr atomlar elektron alınca eksi, elektron verince artı yükle yüklenir. Diğer bir ifade ile atomda elektron sayısı fazla ise o atom “-” yüklü iyon, proton sayısı fazla ise “+” yüklü iyondur. Negatif yüklü iyonlara anyon, pozitif yüklü iyonlara ise katyon denir. Bir iyondaki negatif yük sayısı pozitif yük sayısından ne kadar fazla ya da eksik ise o sayı sahip olunan yük sayısıdır ve atom sembolünün sağ üst köşesine yazılır. Örneğin, 1 elektron alan Cl atomu Clşeklinde gösterilir. Bir elektron (-) olarak ifade edildiği için gösterimlerde “1” kullanılmaz. Bir başka örnek verecek olursak, 2 elektron veren Mg atomu Mg2+ şeklinde gösterilir. Pozitif işaretin yanında “2” kullanılır. Çok Atomlu İyonlar Bazı anyon ve katyonlar tek atomlu, bazıları ise çok atomludur. Birden fazla atom grup hâlinde negatif veya pozitif yüke sahip olabilir. Böyle gruplara çok atomlu iyon denir. (!) Çok atomlu iyonlarda iyon yükü grubun iyon yüküdür. Yalnızca üzerinde bulunan atoma ait değildir. Aşağıdaki tabloda bazı tek atomlu ve çok atomlu iyonlar verilmiştir. Bileşikler ve Formülleri Doğada özellikleri birbirinden farklı çok sayıda madde vardır. Bu maddelerin çok azı doğada element olarak bulunurken pek çoğu bileşik ve diğer maddeler hâlindedir. Farklı atomlar bir araya gelerek yeni maddeleri oluştururlar. Bu oluşum sırasında bir kısım atomlardaki bağlar birbirinden ayrılır ve yeni bağlar oluşur. Farklı elementlere ait atomların belli oranlarda bir araya gelip bağ yapmasıyla oluşan yeni özellikteki saf maddelere bileşik denir. Örneğin su, hidrojen ve oksijenden oluşmuş bir bileşiktir. Hidrojen ve oksijen elementleri su bileşiğinden farklı özellikte iki maddedir. Sodyum iyodür bileşiği sodyum ve iyot elementlerinden oluşmuş bir bileşiktir. Formülü NaI’dır. Sodyum iyodür bileşiği sodyum ve iyot elementlerinden farklı özelliktedir. Sodyum elementi yalnız sodyum atomlarından, iyot elementi de yalnız iyot moleküllerinden oluşur. Sodyum gri renkli bıçakla kesilebilecek kadar yumuşak bir madde, iyot siyah renkte katı bir maddedir. Sodyum iyodür ise beyaz renkli katı bir maddedir. Bileşikler çok sayıda atomun bir araya gelmesiyle de oluşabilir. Basit şeker molekülü karbon, hidrojen ve oksijenden oluşan bir bileşiktir. Formülü C6H12O6’dır. Üç tür atomun belirli bir oranda birleşmesiyle oluşmuştur. Elementlerin bir kısmı iyot, hidrojen ve oksijen gibi moleküllü yapıda, bir kısmı da sodyum, demir, bakır gibi atomik yapıdadır. Bileşikler de moleküllü yapıda olabildiği gibi moleküllü yapıda olmayabilirler. Amonyak(NH3), karbondioksit(CO2), kükürtdioksit(SO2), Hidrojen klorür(HCl) moleküler yapıdaki bileşiklere örnektir. Sodyum klorür(NaCl) (yemek tuzu), sodyum iyodür(NaI) gibi bileşikler molekül yapıda değildir. Bileşiklerin formülüne bakarak her bileşiği oluşturan elementleri ve element atomlarının sayısını belirleyebileceğimiz gibi bileşik formüllerini yazarken de elementlere ve bunların bileşik oluşurken bir araya gelen atom sayılarına bakarak yazarız. Örneğin; SO2 formülü bize bileşiğin bir kükürt ve 2 oksijen atomlarından oluştuğunu ve toplam üç atom içerdiğini söylüyor. Burada bir kükürt atomu, iki oksijen atomu ile bir araya gelerek kükürt dioksit bileşiğini oluşturmuştur. BÖLÜM III Ölçme-Değerlendirme • Bireysel öğrenme etkinliklerine yönelik Ölçme Değerlendirme • Grupla öğrenme etkinliklerine yönelik Ölçme Değerlendirme • Öğrenme güçlüğü olan öğrenciler ve ileri düzeyde öğrenme hızında olan öğrenciler için ek Ölçme-Değerlendirme etkinlikleri Dersin Diğer Derslerle İlişkisi 1.1 Atom, molekül, element, bileşik, saf madde ve karışım kavramları 6. sınıfta edinilmiş olup bu kazanım, bir hatırlatma olarak düşünülmelidir. BÖLÜM IV Planın Uygulanmasına İlişkin Açıklamalar www.fendersi.gen.tr FEN BİLİMLERİ ÖĞRETMENİ www.fendersi.gen.tr OKUL MÜDÜRÜ





















