atom yapisi
advertisement

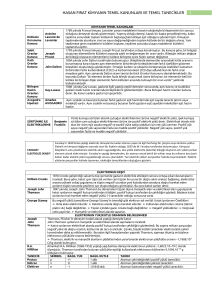
Atomun yapisi
Atom cekirdegi
Protonlar(p+)
ATOM
elektron seviyesi
Elektronlar(e-)
Neutronlar(no)
Supstanslarin en kucuk tanecigine atom
derler.atom cekirdeginden ve elektron
sargilarindan olusmustur.cekirdekten pozitif yuklu
proton ve neutral,neutronlardan
olusmustur.sargilarda ise negatif yuklu elektronlar
bulunur.kucuklugune ragmen ozelliklerini tasir
:atom en kucuk taneciktir ama yine de kutlesi
var.cekirdekte bulunan protonlar ve neutronlar bu
kutleyi verir.
Atom cekirdegi
Atom çekirdeği, atomun merkezinde toplanmış olan proton ve nötronların
oluşturduğu yapıya denir. artı elektrik yükü ile yüklüdür. Atom çekirdeği çok
önemlidir. Atom çekirdeği, "proton, nötron ve pi-mezonları denilen
kuvvetler"den oluşmuyor: nötron ve proton adlı parçacıklardan oluşuyor.
('Kuvvet’, 'parçacık'tan farklı bir kavram.)
Protonlar
Nötral bir atom veya molekülden bir veya daha çok elektron koparıldığında
geriye kalan tanecik koparılan elektronların tolam eski yüküne eşit miktarda
artı yük kazanır.Bir neon atomundan bir elektron koparıldığında geriye kalan
tanecik koparılan elektronların toplam eksi yüküne eşit miktarda artı yük
kazanır.Bir neon atomundan bir elektron koparıldığında bir Ne(+) iyonu
oluşur.Bir elektriksel deşarj tüpünde katot ışınları tüpün içinde bulunan gaz
atomlarından ve moleküllerinden elektronların çıkmasına sebep oldukları
zaman , bu tür artı yüklü tanecikler oluşur.Bu artı yüklü iyonlar eksi yüklü
elektroda doğru hareket ederler.Eğer katot delikli bir levhadan yapılmışsa artı
yüklü iyonlar bu deliklerden geçerler.katot ışınlarının elektronları ise ters
yönde hareket ederler.
Notronlar
Atomlar elektrik yükü bakımından nötral olduklarından bir atomun içerdiği
proton sayısı elektron sayısına eşit olmalıdır.Atomun toplam kütlesini
açıklayabilmek için 1920 de Ernest Rutherford atomda yüksüz bir taneciğin var
olduğunu savundu.Bu tanecik yüksüz olduğundan onu incelemek ve
tanımlamak zordu.Fakat 1932 de James Chadwick nötronun varlığını kanıtlayan
çalışmalarını sonuçlarını yayınladı.Chadwick , nötronların oluştuğu bazı
nükleer tepkimelerin verilerinden nötronun kütlesini hesaplayabildi.Bu
tepkimelerde kullanılan ve oluşan bütün taneciklerin kütlelerini ve enerjilerini
göz önüne alarak Chadwick nötronun kütlesini hesapladı.Bu kütle protonun
kütlesinden biraz daha büyüktü.
Günümüzde daha birçok atom altı tanecik bulunmuştur.Fakat bu
taneciklerin atom yapısı ile olan ilişkisi çok iyi bilinmemektedir.Kimyasal
çalışmalar için atomun yapısı elektron , proton ve nötronun varlığına dayanarak
yeterince açıklığa kavuşturulmuştur.
elektronlar
Vakumdan elektrik akımının geçirildiği deneyler 1859 da Julius Plücker
katod ışınlarını bulmasına yol açtı.Katot ışnları elde etmek için havası iyice
boşaltılmış bir cam tüpün uçlarına iki elektrod yerleştrilir.Bu elektrodlara
yüksek gerilim uygulandığında katot adı verilen negatif elektroddan ışınlar
çıkar.Bu ışınlar negatif yüklüdür doğrusal yol izler ve katodun karşısındaki tüp
çeperlerinin ışık saçmasına sebep olur. 19.yüzyılın son yıllarında katot ışınları
ayrıntılı olarak incelendi.Birçok bilim adamının deneyleri sonucunda katot
ışınlarının hızla hareket eden eksi yüklü parçacıklar olduğu ortaya çıktı ve bu
parçacıklar daha sonra Stoney’in önerdiği gibi elektron adı verildi.
Elektron seviyeleri
İzole atom ve moleküller kesikli enerji seviyeleri gösterirler, şekil 12.1-1 ‘den
şekil 12.1-4 ‘e kadar olan şekilleri inceleyin. Katılar için atomlar, iyonlar veya
moleküller birbirlerine oldukça yakındır ve birbirlerini etkilerler böylece basit
bir şekilde izole atom olarak göz önüne alamayız bundan dolayı çok parçacık
sistemi olarak ele almamız gerekir.
İzole atom ve üç cins katının enerji seviyeleri şekil 12.1-5 ‘de gösterilmiştir.
Katılardaki düşük enerji(bu örnek için 1s, 2s ve 2p ‘deki seviyeler) izole
atomunkine benzerlik gösterir. Bunlar çok genişlememiştir, çünkü bunlar dolu
kor elektronlarıdır ve diğer komşu atomlara karşı perdelenmiştir. Buna karşın
yüksek seviyeli kesikli atomik seviyeler bir band oluşturmuştur. Bu band
aslında birbirine çok yakın kesikli enerji düzeyleridir. En yüksek kısmi dolu
bandı iletkenlik bandı ve onun altındaki valans bandı olarak isimlendirilir.
Bunlar birbirlerinden Eg kadar enerji ile ayrılmıştır ve yasak band aralığı olarak
isimlendirilir. İlk başta en düşük enerji seviyesi tamamen doludur.
Izotoplar
Atom elektron neutral taneciktir. Elektronlarin
sayisi her zaman protonlarin sayisina
esittir.Neutronlarin sayisi her zaman protonlarin
sayisina esit deldir.Oyle ki ayni tur atom farkli
kutleli olabilir buna ragmen farkli ozelliklere sahip
olacak ve bunlara izotoplar derler.Cogu
supstanslarda izotoplar vardir.
Ornek:karbon (C),hodrojen(H),lityum(Li) vb
6
3
3
7
3
3
8
3