Balıklarda Viral Enfeksiyonlara Karşı İmmun Sistemin
advertisement

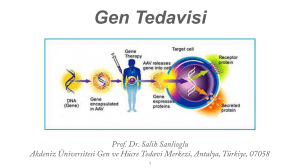
Atatürk Üniversitesi Vet. Bil. Derg. 2016; 11(3): 355-363 Derleme/Review DOI:10.17094/ataunivbd.282995 Balıklarda Viral Enfeksiyonlara Karşı İmmun Sistemin İşleyişi Yüksel DURMAZ1, Harun ALBAYRAK2 1. Veteriner Kontrol Enstitüsü, Balık Hastalıkları Laboratuvarı, Samsun, TÜRKİYE. 2. Ondokuz Mayıs Üniversitesi, Veteriner Fakültesi, Viroloji Anabilim Dalı, Samsun, TÜRKİYE. Geliş Tarihi/Received 14.09.2015 Kabul Tarihi/Accepted 12.08.2016 Yayın Tarihi/Published 31.12.2016 Öz: Balıklarda lenfoid doku ve organlar, primer ve sekonder olmak üzere iki bölüme ayrılır. Primer lenfoid doku ve organları timus, böbrek, dalak, sekonder olanları ise karaciğer, deri ve bağırsaklar oluşturur. Balıklarda kemik iliği ve lenf düğümleri bulunmamakla birlikte immun sistem ile immun organ ve hücrelerinin çoğu memeliler ile aynı yapı ve işleve sahiptir. Balıklarda da immun sistemin doğal ve kazanılmış olmak üzere iki farklı yanıtı vardır. Doğal bağışıklık, enfeksiyondan sonra hızlı bir şekilde uyarılır, immünolojik belleğin yokluğu ile karakterizedir. Antijene spesifik uyarı olmayıp, genler ile kodlanmış moleküller tarafından modüle edilir. Kazanılmış bağışıklık mükemmel bir spesifiteye ve hafızaya sahiptir; anahtar humoral parametre ise B lenfositlerin reseptörleri tarafından eksprese edilen antikorlardır. Patojenler doğal savunma mekanizmasını aştıklarında kazanılmış bağışıklık sistemi aktivasyona başlar ve spesifik lenfositler çoğalarak uzun dönem hafıza hücreleri ve plazma hücrelerine farklılaşırlar. Organizma bu patojenlere bir sonraki maruz kalmalarda hızlı ve etkili immun yanıt gösterecektir. Balıkların viral patojenlere karşı savunmasında hem doğal hem de kazanılmış bağışıklık sistemi birbirleri ile etkileşim içinde çalışmaktadırlar. Bu derlemede balıkların lenfoid organ ve dokuları, immun sistem hücre ve medyatör molekülleri ile viral enfeksiyonlarda immun sistemin işleyişi hakkında bilgi verilmiştir. Anahtar Kelimeler: Balık, İmmun sistemin işleyişi, Viral enfeksiyon. Regulation of The Immune System of Fish to Viral Infections Abstract: In fish, lymphoid tissues and organs are divided into two groups as primary and secondary. The primary lymphoid tissues and organs consist of thymus, kidney, spleen while secondary ones consist of liver, skin and intestines. Although bone marrow and lymph nodes do not exist in fish, most of immunological organs and cells along with immune system have the same structure and function as the mammals. In fish, there are also two different responses of immune system as natural and acquired. Natural immunity is stimulated expeditiously following the infection, it is characterized with absence of immunologic memory. It is not antigen specific stimulus but is modulated by the molecules encoded with genes. Acquired immunity has an excellent specifity and memory; the key humoral parameter is the antibodies expressed by the receptors of B lymphocytes. When the pathogens pass over the natural defence mechanism, the acquired immune system begins activation and specific lymphocytes proliferate and differentiate into long term memory cells and plasma cells. The organism would exhibit a rapid and effective immune response upon subsequent exposures to these pathogens. In the defence of fish against viral pathogens, both natural and acquired immune system work interactively. In this review, the information about the lymphoid organs and tissues of fish, their immune system cells and mediators and functioning of immune system in case of viral infections are reported. Keywords: Fish, Regulation of the Immune System, Viral infection. Yüksel DURMAZ Veteriner Kontrol Enstitüsü, Balık Hastalıkları Laboratuvarı, Samsun, TÜRKİYE. e-posta: [email protected] Balıklarda Viral Enfeksi... Durmaz ve Albayrak GİRİŞ B BALIKLARDA İMMUN SİSTEMİN YAPISI alık çiftliklerinde önemli ekonomik kayıplara neden olan hastalıkların çoğunluğu viral Lenfoid Organlar ve Dokular etiyolojiye sahiptir. Viral enfeksiyonlarda tedavi olasılıkları sınırlı olup, yeni ortaya çıkan hastalıklar Balıklarda lenfoid organlar ve dokular primer için oldukça yüksek bir risk mevcuttur. Kültürü ve sekonder olmak üzere iki kategoriye ayrılırlar. yapılan balık türlerinden somon (som balığı) üretimi Primer lenfoid organları timus, böbrek, dalak, ağırlıklı olarak Norveç, Şili, İngiltere ve Kanada’da; sekonder lenfoid organları ise karaciğer, deri gökkuşağı alabalığı Şili, İran, Türkiye, Norveç, ABD, bağırsaklar ve mukoza ile ilişkilendirilmiş lenfoid Danimarka ve Fransa’da; Pasifik salmon üretimi dokular oluşturur. Primer lenfoid doku ve organlar, Şili’de yapılmaktadır. Yüzgeçli balıkların önemli viral lenfositler hastalıklarının etiyolojik etkenlerinden çift iplikçikli bulunduğu, RNA virusları; infeksiyöz pankreatik nekrozis virus geldikleri bölgelerdir (5). Memelilerde kan hücreleri (IPNV, pissine kemik iliğinde üretilirken, balıklarda kemik iliği ve reovirus (PRV) yeni ismi ile atlantik salmon lenf düğümleri bulunmaz (6,7). Timus, operkulumun reovirusdur dorsalinde, yutağın epitel dokusu altına yerleşmiş iki Negatif Aquabirnavirus, (ASRV, polariteli Birnaviridae), Aquareovirus, tek ve lenfositlerin progenitör hücrelerin immunkompetan hale lobdan oluşan bir organdır (Şekil 1). Makrofajların infeksiyöz hematopoetik nekrozis virus (IHNV, toplanma yeri olarak bilinir. Timus T hücrelerinin Novirabdovirus, Rhabdoviridae), viral hemorajik üretilmesinden sorumludur (7,8). Balık böbreği septisemi Novirabdovirus, anterior ve posterior olmak üzere iki kısımdan Rhabdoviridae), pozitif polariteli tek iplikçikli RNA oluşur. Vücut boşluğunun üst kısmına yerleşmiş, virusları; kanın yapılması, antijenlerin tutulması, antikor salmonid Togaviridae), RNA kök virusları; virus iplikçikli Reoviridae). için (VHSV, alfavirus negatif (SAV, tek üretimi, kortikosteroidler ve diğer hormonların iplikçikli RNA virusları; infeksiyöz salmon anemi virus salınımı yönünden görevli bir organdır. Böbrek (ISAV, Isavirus, Orthomyxoviridae) ve DNA virusu; küçük yapıda endokrin bezleri de içermektedir. Bu epizotik (EHNV, bezler, solungaçlardan kalsiyum absorbsiyonunu Ranavirus, Iridoviridae) (1). Sazanların bahar viremi durduran teleokalsin hormonu salgılarlar. Böbreğin virusu (SVCV), IHNV ve VHSV Dünya Hayvan Sağlığı anterior kısmının renal bir fonksiyonu yoktur. Örgütü (OIE) tarafından balıklarda ihbari mecburi Balıklarda bu bölüm lenf düğümünün analoğu olup olarak bildirilen 3 viral enfeksiyondur (2). hemopoiezis için özelleşmiştir. Posterior böbrek hematopoetik polariteli Alfavirus, segmentli nekrozis virus Balıkların viral patojenlere karşı savunmasında hem renal hem de hemopoetik görevi üstlenmiştir. hem doğal hem de edinsel bağışıklık sistemi Dalak midenin gerisinde ince bağırsak duvarına birbirleri ile etkileşim içinde çalışmaktadır. Doğal tutunmakta olan bir organdır. Balıklarda dalak, immun sistem, viruslara karşı ilk savunma hattı olup, eritrositlerin edinsel bağışıklık sisteminin aktivasyonuna kadar reaktivasyonunda, Viral patojenlerin immun kaçış mekanizmaları gibi metotları kullanarak korumada her zaman antijen sunumunda, adaptif immun yanıtın başlatılmasında ve kan hücrelerinin replikasyon oluşumunda görevlidir (5,7,9). Karaciğerin balık sağlayabilmeleri nedeni ile doğal immun, sistem balıkları makrofajların antijenleri fagosite etmelerinde, immun sistemin geçen sürede viral replikasyonu sınırlandırmaktadır. bazı parçalanmasında, vücuduna dışarıdan giren yabancı molekülleri yeterli yakalama görevi vardır. Deri ve mukus tabakası, olamamaktadır. Edinsel bağışıklık sistemi etkilidir balığın sahip olduğu birincil korunma kalkanıdır. fakat bağışıklık gelişmesi uzun zaman almaktadır (2- Mukus solungaçlar ve derideki goblet hücreleri 4). 356 Balıklarda Viral Enfeksi... Durmaz ve Albayrak tarafından sürekli salgılanarak balık vücudu üzerine sitokinler, patojen kolonizasyonunu faktörlerin üretilmesinden sorumludurlar (2,7,10). engellemektedir. Mukus, proteinler, glikoproteinler, Sitokinler ve kemokinler immun sistemin çözülebilir proteoglikanlar, immunoglobulinler, komplement, habercileri olup inflamatuvar özelliktedirler. İmmun lizozim, lektin ve antibakteriyel peptitler gibi yanıtın savunma faktörlerini içerir. Gastrointestinal kanal, düzenlenmesini, immun hücrelerin enfeksiyon ile sahip olduğu düşük pH, tripsin, ve pepsin gibi yaralanma bölgelerine göçü ve yapışmasını, immun sindirim enzimleri ve safra etkisi ile invazyonlar için aktivasyonun yenilenmesini sağlarlar (7). Balık bariyer oluşturur Bazı balıklarda bağırsakla ilişkili antikorları lenfoid doku (GALT) benzeri folliküller mevcuttur. partiküllerinin yüzeyine yapışarak onları nötralize Balıklarda kısmı ederler. Bu antikorlar B lenfositler tarafından bölgedir. üretilirler, spesifik immun sistem aktivasyonunun etkenlerin bağırsağın posterior makromoleküllerin emildiği Makromoleküllerin emilimi ana ve kemokinler ve başlatılması diğer ve çözünebilir amplifikasyonun (immunglobulinler, Ig) virus antijenlerin başlatılması, lenfositlerin çoğalması ve aktive sindirilmeden dolaşım sistemine ve hemopoetik olmalarında görevlidirler. Serum, doku sıvısı, organlara transferi balıklar için immunolojik önem sindirim kanalı ve mukus içinde bulunurlar (6). IgD, taşımaktadır (8-11). IgM ve IgT gibi immunglobulinlerin kemikli balıklarda varlığı bildirilmiştir. IgM ve IgD izotipi solungaç yüzeylerini koruyucu özelliğe sahiptir (13,14). Komplement sistemi viruslara karşı doğal immuniteye katkıda bulunur, humoral savunma ile yangısal reaksiyonlarda görevlidir, muhtemelen balıkların farklı organlarının gelişiminde de rol almaktadır (3,8,11). Antiviral peptitler (katelisidin, defensin, heptisidin, pissidin), lektinler, inhibitörler, interferon (IFN), myxovirus (Mx) proteinleri, ribozomal proteinler, transferrin, seruloplazmin, Şekil 1. Kemikli Balıkların İmmun sistem organları (12). Figure 1. Immune system organs in teleost fish (12). metallotiyonin ve histon türevleri hayvanlar ile bitkilerin doğal savunma mekanizmasında yer alırlar. Bu maddeler humoral ve hücresel doğal parametrelerin üretimi ve ekspresyonunu çoğaltır İmmun Sistem Hücreleri ve Medyatör Moleküller veya regüle ederler ve bazı antikor türleri için gen Doğal sitotoksik hücreler (NK), sitotoksik T kodlarının aktivasyonunu sağlarlar (7,9). Balıklarda hücreleri (Tc) ile sitotoksik lenfositlerinin (CTL) major gelişimi tamamlanana kadar konağın enfeksiyon molekülleri etkenlerinden ve tümör hücrelerinden korunmasını işlenmesi ve sunulmasında görev alarak edinsel sağlarlar. Enfekte hücreleri yıkımlarlar, antiviral immun yanıt oluşumuna katkı sağlarlar (14). yanıtın diğer parçasını harekete geçirmek için histokompatibility yabancı kompleks peptitler ile (MHC) antijenlerin DOĞAL İMMUN YANIT anahtar sitokinlerin üretilmesini uyarırlar (2,3). Balıkların immun yanıtında makrofajlar, nötrofiller, Doğal bağışıklık, enfeksiyondan sonra hızlı bir mast hücreleri, eozinofiller, dentritik hücreler ve şekilde uyarılır ve immunolojik belleğin yokluğu ile lenfositler karakterizedir. Antijene spesifik uyarı olmayıp, gibi lökositler makrofajlara ilişkin görevlidir. melanin, Balıklarda lipofuksin ve genler ile kodlanmış moleküller tarafından modüle hemosiderin pigmentleri vardır. Makrofajlar ve edilir. nötrofiller fagositoz yaparlar. Lökositler, antikorların mekanizmasının hızlı uyarılması viral replikasyonun üretilmesinden, antijenlerin sunulmasından, patojen önlenmesi partiküllerin mekanizması hem humoral hem de hücresel immun indirgenmesinden, nitrik oksit, 357 Vertebralılarda için kritiktir. doğal Doğal savunma immun yanıt Balıklarda Viral Enfeksi... Durmaz ve Albayrak yanıtları kapsamaktadır. Bu immun yanıtlar enfekte asemptomatik taşıyıcı oldukları saptanmıştır. Bu hayvanlardaki virusları direkt ve seçkin bir şekilde vakada VP5 geninin kaçırma ve yayılma stratejisi, elimine eder (2). virusun makrofajların içinde kalmasını sağlamıştır Balıklarda viruslara karşı savunmanın ilk hattı, (20,21). Pro-inflamator faktörü IL8’in uyarılması deri, solungaç ve bağırsak gibi dokular ile dış çevre antiviral yanıt olarak görülmektedir. Alabalıklarda arayüzünde dendritik hücrelerin varlığı elektron mikroskopu ile gerçekleşir (8). Yüzgeç tabanları virusların başlıca giriş bölgeleridir (15). Solungaçlar morfolojik yapılarının incelenmesi sonucunda ve deriden salgılanan mukus salgısı bir tür savunma belirlenmiştir. Başlıca antijen sunumu ile ilişkili olan bariyeri oluşturur. Mukus salgısının biyokimyasal dendritik hücreler güçlü tip I IFN uyarıcılarıdır ve kompozisyonunda lizozim, proteaz, katepsin B, viruslara karşı doğal immun sistemin aktif hücresel alkaline fosfataz gibi moleküllerin bulunduğu tespit bileşenleridirler (22). NK hücreleri bir sitotoksik edilmiştir (2,11). hücre grubudur. Enfekte hücreleri granzim merkezli Viral enfeksiyonlarda immun yanıtın etkinliği ozmotik lizis ve apoptozis aracılığıyla yıkımlama için inflamasyon kritik ve etkili bir reaksiyondur. Bu fonksiyonları vardır (2). Bu hücreler antiviral yanıtın reaksiyonlar spesifik sitokinlerin sistemik yolla diğer parçasını harekete geçirmek için anahtar serbest bırakılması ile aktive olmaktadır. Örneğin; sitokinlerin üretilmesini uyarırlar (3). interleukin (IL)1β, tümör nekroz faktör(TNF)-α, Balıkların plazmasında birkaç tür protein vardır. kemokinler ve IL8 aracılığı ile nötrofiller, makrofajlar Bu proteinlerin konsantrasyonu IPN ve IHN gibi viral kemotaksik yol ile inflamasyon bölgesine göç enfeksiyonlardan ederler. sisteminin aktive olmasına neden olur. Gökkuşağı Sitokinlerin balıklarından çoğunluğu identifiye edilmiştir salmonid (16). VHS aşısı β1, ve komplement genleri ön böbrekte uyarılmaktadır. Yine gökkuşağı alabalıklarının VHS enfeksiyonlarında komplement geninde net bir enfeksiyonundan 3 gün sonra IL1- β1, TNF-α1 ve düşüş gözlemlenmiş, aktif komplement faktörleri C7 TNF-α2 uyarıldığı ve Df’nin baskısı yoluyla viral komplementin kaçışı saptanmıştır. Alfavirus ve rabdoviruslara karşı gözlemlenmiştir (23,24). Komplement proteinleri salmonidlerde inflamasyonun güçlü erken savunma varlığında salmonid balıkların antikorları IHNV ve mekanizması olduğu görülmüştür (17). Atlantik VHSV de dahil olmak üzere zarflı virusları nötralize salmonlarının SAV3 enfeksiyonlarında IL8/CXCL8-L1 etme yeteneğine sahiptir (8). güçlü ekspresyonu, dalak β3 ile ekspresyonunu geninin IL1- komplement uyarabilmektedir. Gökkuşağı alabalıklarında IHNV gen β2 artarak alabalıklarında IPNV (VP2) proteini kodlayan DNA enfeksiyonları, erken pro-inflamator sitokinleri IL1IL1- sonra bir ve şekilde kalp dokusunda Potansiyel olarak her çekirdekli hücre virus infiltrasyon ile inflamasyon hücrelerinin artışına varlığını reseptörler aracılığı ile çift iplikçikli RNA neden olmuştur. (18). molekülü, özelleşmiş intraselüler reseptörler, Makrofajlar virus ve bakterilere karşı etkili olan retinoik asit indüklenebilir protein I (RIG-I) ve pro-inflamator (IL1β ve TNF-α), yardımcı T1 hücre melanoma farklılaşma ilişkili gen 5 (MDA5) varlığı ile (Th1) sitokinleri, interferonlar ve diğer çözünebilir RNA viruslarının replikasyonunu araştırarak yapar faktörleri sonradan kazanılan immun sistemin (2). aktivasyonu için üretirler (19). Salmonların SAV moleküllerini tanımakta olup bu genin IHNV enfeksiyonlarında lökosit fagositik aktivitesinde artış enfeksiyonlarından sonra gökkuşağı alabalıklarının ve rekombinant virus ile enfeksiyonlarında ise dokularında lökositozu uyardığı saptanmıştır (25). Toll-Like reseptörleri (TLR)-3 dsRNA böbrek makrofajlarının solunum aktivitesi ile azot İnterferon üretimi viral enfeksiyonlara karşı oksit üretiminde artış olduğu saptanmıştır. Bazı IPNV düşük molekül ağırlığında Ph-rezistans sitokinler vakalarında makrofajlar enfekte edilebilmekte, fakat tarafından uyarılır (3). Antiviral özelliklere 50’nin virusu elimine etmek mümkün olamamaktadır. Post üzerinde IFN uyaran genin ve interferonların katkısı smolt atlantik salmonların makrofajlarından IPN olduğu düşünülmektedir. IFN aktivitesi IPNV ve SAV virusu enfeksiyonlarına tekrar izole edilmiş ve bu balıkların 358 karşı balık hücrelerini Balıklarda Viral Enfeksi... Durmaz ve Albayrak korumaktadır. Tip II IFN fonksiyonu viruslara karşı yolları kullanarak kaçabilmektedirler. Bu kaçış edinsel hücresel bağışıklık ile ilgilidir (26). IFN mekanizması konağın viral enfeksiyona verdiği yanıt molekülü kodlayan ilk genin balık türlerinden ile aynı zamanda olmaktadır. Protein sentezinin izolasyonu Akabinde durdurulması, enfekte hücrelerin bir bölümünde atlantik salmonlarda ilk kez 2 IFN geni olan Sasa IFN- antiviral yanıtı engelleyebilir veya virus için bir kaçış α1 ve Sasa IFN-α2 izole edilmiş, IFNa1-3, b1-4 ve c1- mekanizması olabilir. Salmon hücrelerinde viral 5 olarak gruplandırılan 11 genin keşfi yapılmıştır. enfeksiyonları Gökkuşağı alabalıklarından 4 adet IFN geninin IPNV’nin raportör gen seviyesi düşürülerek IFN izolasyonu yapılarak 2 alt grupta, rtIFN1 ve rtIFN2 sinyallerinin (grup 1) ile rtIFN3 ve rtIFN4 (grup2) olarak bildirilmiştir. Viral partiküllerin hazır hale getirilip gruplandırılmışlardır. Gökkuşağı alabalıklarında IFN, hücreden serbest bırakılmasına kadar geçen sürede ön 2003 böbrek, yılında ve inhibe IFN’nin edildiğine baskılandığı dair ve raporlar tarafından apoptozisin inhibisyonu yolu ile enfekte hücrelerin canlı kalması bir kaçış stratejisi olarak viruslar genler ve bunların fibroblastik hücre hatlarının tarafından kullanılmaktadır. IPNV VP5 proteinin başlıca katkılarının, IHNV, VHSV ve IPNV ye karşı yapay yollarla hücreler içerisinde aşırı derecede direnç oluşturulması olduğu saptanmıştır (26). eksprese proteinleri bağışıklıkta karaciğer takiben uyarılmaktadır (2,8). Balıklarda IFN, IFN uyaran Mx dalak yapılmıştır. viruslara önemli karşı hücresel apoptotik özellik gösterdiği belirlenmiştir (2,31). Antimikrobiyal peptidler her iki humoral ve enfeksiyonları takiben interferonlar ile uyarılarak hücresel parametrelerin üretimi ve ekspresyonunu hücrelerin sitoplazma veya çekirdeğinde birikirler çoğaltır veya regüle ederler fakat burada immun (27). VHSV enfeksiyonları ile uyarılan endoplazmik bellek olmadığından aynı patojen ile ikinci kez retikulum ilişkili virus inhibisyon proteinini (VIG-1) karşılaşmada kazanılmış immun yanıtta görüldüğü kodlayan gen ilk kez gökkuşağı alabalıklarında izole gibi edilmiş ve viperin olarak isimlendirilmiştir. Protein mukusunda bulunan antimikrobiyal peptidler viral kinaz R (PKR), virus uyarıcı üçlü motif içeren TRIM replikasyonu proteini ve ubiquitin like proteini (ISG15) kodlayan (CATH-1, -2), defensin (DB-1, -2, -3), heptisidin gen, salmonid türü balıklardan identifiye edilmiş ve (heptisidin LEAP-1, -2) ve pissidin hızlı antibakteriyel antiviral savunmada görevli oldukları bildirilmiştir. ve antiviral aktiviteleri olan peptitler olup, bazı TRIM antikor türleri için gen kodlarının aktivasyonunu bazı üstlenirler. anti Viral ailesinin rol edilmesinin üyeleri IFN’ler yoluyla güçlü bir yanıt inhibe olmayacaktır etmektedirler. Katelisidin sağlarlar. partiküllerinin indirekt kültürlerinde viral mimik poly I:C, katelisidin ve b- regülasyonu gibi çok yönlü antiviral etkileri bulunan defensin genlerinin ekspresyonunu uyarmaktadır bir grup molekül topluluğu olarak bilinirler (2,8,28). (2,8). IFN’nin alabalığı Balık uyarılmakta ve kapsit içerisinde transkripsiyon, virus toplanması, Gökkuşağı (4). primer lökosit Apoptozis ya da programlı hücre ölümleri Tuz, sıcaklık, oksijen seviyesi gibi çevresel viruslara karşı bir savunma mekanizmasıdır. Enfekte faktörler viruslar ve stres ile etkileşerek balıkların hücrelerin erken yıkımlanması ile patojenin konak bağışıklık sistemini indirekt olarak etkilemektedirler içerisinde yayılması sınırlandırılır (8,29). Apoptozis (32). Viruslar replikasyonda, dar sıcaklık aralıklarını inaktif kaspazların aktive edilmesiyle uyarılmaktadır. kolay tolere edebilmekte ve replikasyon ile immun Kaspazlar internükleozomal yanıtın kinetiği arasındaki denge viral hastalıkların aralıklarını kırarak apoptozisi gerçekleştirirler. IPNV ortaya çıkışını belirlemektedir (33). Salmonlarda ile alabalıklarında antiviral peptid poly I:C’ ye karşı IFN yanıtı düşük apoptozisin, virus replikasyonunun gerçekleştiği sıcaklıklarda daha uzun sürelidir. VHSV ye karşı Mx karaciğer, iskelet ve kalp kası ile solungaçların protein sekonder lamellerde etkin olduğu görülmüştür (30). geciktirilmektedir. doğal Bazı hücre enfekte viruslar DNA’sının gökkuşağı immun sistemden protein balıklarda translasyonu, IFN ve apoptozis için kullanılan özel indüksiyonu düşük Oksijen enfeksiyondan sıcaklıklarda konsantrasyonu sonraki viral yükü etkilemektedir. Gökkuşağı alabalıklarının “herbisit 359 Balıklarda Viral Enfeksi... Durmaz ve Albayrak pendimetalin” gibi kirlilik oluşturan maddelere maruz kalması sonucunda VHSV’den Hücresel İmmünite dolayı İntraselüler enfeksiyonların eliminasyonunda mortalite oranlarında yükselme gözlemlenmiştir. virüs ile enfekte hücrelerin hücresel immunite Stres, immunite, virülens ve immun yanıtın viral yoluyla imhası en önemli strateji olarak kabul patojenlere göre değişimi arasında bir etkileşim edilmektedir (37). Balıklarda CD4 ve CD8 T hücre bulunmaktadır (34,35). yanıtları hücresel immunitede görev üstlenirler. EDİNSEL İMMUN YANIT Edinsel immun CD8+ T hücreleri virus ile enfekte hücrelerin sitolitik sistem mükemmel öldürme işlemlerini yerine getirir. CD4+ T hücre bir alttipleri ise immun sistemin diğer hücrelerine MHC spesifiteye ve hafızaya sahiptir (6). Eğer bir patojen II moleküllerinden eksprese edilen antijenlerin doğal savunma mekanizmasını aşarsa bundan sonraki dönemde edinsel bağışıklık tanınmasında yardımcı olurlar (14). T-lenfositler sistemi sadece mikrobik antijenleri tanımalarına karşın, B aktivasyona başlar ve bağışıklığın antijene spesifik lenfositlerin ürettiği antikorlar protein, karbonhidrat lenfositleri klonal genişleme gösterirler. Organizma ve lipit içeren yabancı pek çok değişik molekül tipini bir sonraki patojene maruz kalmalarda hızlı ve etkili de tanırlar. T hücreleri antijen ile indirekt ilişki immun yanıt gösterir. İki tip edinsel immünite vardır. kurarak onları yıkımlarlar. CD8 + katil T hücreleri Bunlar humoral ve hücresel immünitedir (7,11). kanser hücrelerini kontrol ederler. CD4 + Yardımcı T Humoral İmmünite hücreleri B hücrelerine antikor üretiminde yardımcı olurlar ve CD4+CD25 + düzenleyici T hücreleri Humoral immunitenin aktif görevli hücreleri B otoimmun yanıtları önlerler (7,9,37). Farklı CD4 lenfositlerdir. Bu hücreler memelilerde kemik yardımcı T hücrelerinin alt tipleri tarafından iliğinde, kanatlılarda bursa fabrisiyusta ve balıklarda salgılanan sitokinler salmonlarda tanımlanmıştır böbreklerde üretilirler (4-6). B lenfositler ürettikleri (14). GATA-3 sitokinleri humoral immun yanıtın antikorlar aracılığıyla cevap oluşturlar ve hücre dışı oluşturulmasında ve sürdürülmesinde görevli olup, mikrobik antijenleri tanırlar. Bu antikorlar dolaşıma ve mukoza sıvılarına salgılanarak bu kanda, sitokinlerin ekspresyonu Th1 sitokin kromatinlerinin Th2 sitokin salgılayan hücrelere gastrointestinal kanalda ve solunum yolları gibi dönüşmesine mukoza içeren organların lümenlerinde bulunabilen neden olur. GATA-3 kinetiği aşılamalarda oluşan antikor yanıtı üzerine de etki patojenleri veya bunların toksinlerini etkisiz hale etmektedir. getirirler (3,4). B hücreleri plazma ve bellek IPNV ye karşı aşılanan atlantik salmonlarda aşılamadan önce tespit edilen antikor hücrelerini oluştururlar. Plazma hücreleri hem seviyeleri ve GATA-3 ekspresyonu arasında pozitif antikorları üretirler hem de antijen sunumunda bir korelasyon bulunmuştur (36). Enfekte balıklarda görev alırlar. Gökkuşağı alabalıklarında IgM ve GATA-3 artışı ile virus yokluğu veya düşük virus IgD’nin solungaç yüzeylerini koruyucu bir role sahip titresi arasında negatif bir korelasyon bulunmuştur. olduğu bildirilmiştir. Balıkların serumunda en çok Bu genin yukarı regüle edilmesi balıklarda IPNV bulunan Ig izotipi IgM’dir. Bu Ig türleri sistemik enfeksiyonlarına karşı koruma sağlamaktadır (14). enfeksiyonlara bağışıklık Balıklarda B hücreleri ve baskılayıcı T- hücreleri 4 kazandırmada önemli rol oynarlar. IgM serum haftalık olduklarında fonksiyonel hale gelirlerken haricinde yüzeylerinde, yardımcı T hücreleri ve bellek hücreleri ise 8 haftalık bağırsaklarda ve solungaç epitellerinde de tespit olduktan sonra fonksiyonel hale geçerler (38). Virusa edilmiştir. IgT izotipi bağırsaklar, deri ve mukozal spesfik korunma ile ilişkili olup mukus ve mukozal balıklarında ve IPNV ile enfekte CFS hücre hatlarında yüzeylerdeki titresi, serumda tespit edilenden 100 gösterilmiştir. Balıklarda CD8+ T hücreleri ile ilişkili kat daha yüksektir (14,36). birçok karşı derinin koruyucu mukozal 360 hücresel gen merkezli klonlanarak sitotoksisite tanımlanmıştır. sazan Akut Balıklarda Viral Enfeksi... Durmaz ve Albayrak enfeksiyon süresince granzim-A ekspresyonu ile viral göstermekle birlikte türe spesifik farklılıkları da yükün artışı arasında yüksek oranda korelasyon içermektedir. Balıklarda kemik iliği ve lenf düğümleri bulunmuştur (36). Salmonlarda IPNV enfeksiyonları, bulunmaz. Böbreğinin ön kısmı omurgalılardaki lenf CD8+gen ekpresyonunu ve naif CD8 T hücrelerinin düğümlerinin efektör CTLs dönüşümünü uyarmaktadır (14). böbreğinden, işlevini görmektedir. solungaçlardan Balık kalsiyum absorbsiyonunu durduran teleokalsin hormonu MUKOZAL İMMUN YANITLAR salgılanır. Solungaçlar ve deriden salgılanan mukus Balıkların mukozal yüzeyleri olan deri, bağırsak, salgısı ile bağırsaklardaki GALT folliküllerinin viral solungaçlar ve üro-genital sistem yapısı ilk savunma immunitede görevleri vardır. Balıklarda bağırsağın hattıdır. arka Su ortamında mukozalar sürekli kısmı makro patojenlerle etkileşim halindedirler (14). Yaygın sindirilmeden olarak immunolojik kullanılan intraperitoneal balık aşılama enjeksiyon yöntemleri; (i.p.), moleküllerin organlara öneme emilimi transferi sahiptir. ve yönünden NK hücreleri, sitokinler, interferonlar, antiviral peptitler, Mx, VIG- intramuskular enjeksiyon (i.m.), immersiyon (banyo/sprey) ve oral 1, aşılama yöntemidir. Balıklarda İ.p. ve i.m. aşı proteinler, uygulamaları ile sadece internal immun yanıtlar metallotiyonin ve histon türevleri balık hücrelerini oluşurken, immersiyon yöntemi ile aşılar deri, korurlar ve antiviral savunma mekanizmasında solungaç ve bağırsaklardan emildikten (içildikten) görev alırlar. Bazı balık virusları makrofajları enfekte sonra lokal yanıtları da uyarmaktadırlar. İmmersiyon edilebilmekte ve konağın viral enfeksiyona verdiği aşılaması yanıt ile eş zamanlı olarak immun sistemden ile oluşan hiperozmotik streslerin PKR, TRIM, ISG15 lektinler, proteinleri, inhibitörler, transferrin, çoğunlukla mukozal yüzeylerde yüksek seviyede kaçabilmektedirler. yanıtlar oluşturduğu rapor edilmektedir. Balıklarda sentezinin durdurulması, oral taşınarak apoptozisin inhibisyonu segment) mekanizması olabilmektedir. Çeşitli balık türlerinde ulaştırılır ve yeterli miktarda antijen bu segmente IgM, IgD ve IgT/Z izotiplerinin varlığı saptanmıştır. ulaştırılırsa hem lokal hem de sistemik antikor yanıtı IgM ve IgD solungaç yüzeyleri, IgT izotipi bağırsaklar, uyarılır (11,39). IgM, IgT/Z ve IgD’nin çok çeşitli balık deri ve mukozal korunma ile ilişkilidir. Balık IgT/Z’si türlerinde ile yolla uygulanan bağırsakların son antijenler segmentine varlığı (2.ci bildirilmiştir. IgT mukozal memeli Konak ribozomal IgA’sı IFN’nin virus baskılanması, için fonksiyonel bir kaçış benzerlikler immuniteden sorumlu başlıca immunglobulin tipidir. İntestinal IgM ve IgT’ler B hücrelerinden köken antikorların almaktadırlar. Balık IgT/Z’si ile memeli IgA’sı birçok belirlenmiştir. Tuz, sıcaklık, oksijen seviyesi Ph ve fonksiyonel benzerlikler içermektedir (11). Bazı balık bulanıklık gibi çevresel faktörler viral immunite türlerinde maternal ve üzerine indirekt etki ederek mortalite oranlarında yavrulara geçtiği Maternal yükselmelere neden olmaktadır. Suyun oksijen antikorların birincil yumurta belirlenmiştir. görevi yumurtaları balık protein içermektedir. antikorların Bazı hücrede yumurta türlerinde ve maternal yavrulara geçtiği konsantrasyonu balıklarda enfeksiyondan sonraki belirli patojenler için vertikal bulaşmaya karşı korumaktır. viral Maternal balıkların immunitenin aydınlatılması konusunda moleküler yumurtadan çıktıktan sonraki ilk gelişme evrelerinde tekniklerin keşfi ile büyük ilerlemeler kaydedilmiş fagositozis ancak henüz tam olarak aydınlatılamamıştır. IgM’ler veya muhtemelen komplement sisteminin aktivasyonuna da yardımcı olmaktadırlar (8,13). 1. mekanizmaları korunma yüksek vertebralılara benzerlik viral Crane M., Hyatt A., 2011. Viruses of fish: An 2025-2046. yanıt ve mukozal immun yanıt mekanizmaları antiviral Balıklarda overview of significant pathogens. Viruses, 3, Balıklarda doğal immun yanıt, edinsel immun Balıkların etkilemektedir. KAYNAKLAR SONUÇ mevcuttur. yükü 2. Collet B., 2014. Innate immune responses of salmonid fish to viral infection. Developmental 361 Balıklarda Viral Enfeksi... 3. 4. Durmaz ve Albayrak and Comparative Immunology, 43, 160-173. Giovannini Adedeji BO., Onianwa O., Okerentugba PO., Bioluminescence imaging of live infected Okonko IO., 2012. Immune response of fish to salmonids reveals that the fin bases are the viral infection. Nature and Science, 10, 70-76. major portal of entry for novirhabdovirus. Magnadóttir B., 2010. Immunological control of Journal of Virology, 80, 3655-3659. fish diseases. Marine Biotechnology, 12, 3615. 6. 7. 9. Bremont M., 2006. 16. Mikalsen AB., Haugland O., Rode M., Solbakk 379. IT., Evensen O., 2012. Atlantic salmon reovirus Bozkurt M., Eren Ü., 2009. Balıklarda lenfoid infection causes a CD8 T cell myocarditis in organlar. Veteriner Hekimler Derneği Dergisi, atlantic salmon (Salmo salar L.). PLoS One, 7, 1- 80, 13-18. 11. Kav K., Erganiş O., 2008. Balıklarda bağışıklık 17. Van Der Aa LM., Chadzinska M., Tijhaar E., sistemi. Atatürk Üniversitesi Veteriner Bilimleri Boudinot P., Verburg Van Kemenade BML., Dergisi, 24, 97-106. 2010. CXCL8 chemokines in teleost fish: two Kum C., Sekkin S., 2011. The immune system lineages with distinct expression profiles during drugs in fish: immune function, immunoassay, early phases of inflammation. PLoS One, 5, 1- drugs. In “Recent Advances in Fish Farms ”, Ed., 13. F Aral, 1st ed., 169-216, InTech Europe,Rijeka, 8. M., 18. Reyes Cerpa S., Reyes Lopez FE., Toro Ascuy D., Croatia. Ibanez J., Maisey K., Sandino AM., Imarai M., Uribe C., Folch H., Enriquez R., Moranı G., 2011. 2012. IPNV modulation of pro and anti Innate and adaptive immunity in teleost fish: a inflammatory cytokine expression in Atlantic review. Veterinarni Medicina, 56, 486-503. salmon might help the establishment of Altınterim B., 2011. Balık İmmünolojisi, bitkisel infection and persistence. Fish and Shellfish ve kimyasal immünostimulantlar. Iğdır Immunology, 32, 291-300. Üniversitesi Fen Bilimleri Enstitüsü Dergisi, 1, 19. Liu 69-76. Yang H., 2013. Modulation of macrophage activation and programming in 10. Ocak F., 2006. Balıklarda Lenfoid organlar ve immunity. Journal of Cellular Physiology, 228, immun sistemin özellikleri. Erciyes Üniversitesi 502-512. Vetereiner Fakültesi Dergisi, 3, 61-66. 20. Tafalla C., Sanchez E., Lorenzen N., Dewitte-Orr 11. Rombout JHWM., Yang G., Kiron V., 2014. Adaptive G., immune responses at SJ., Bols NC., 2008. Effects of viral hemorrhagic mucosal septicaemia virus (VHSV) on the rainbow trout surfaces of teleost fish. Fish and Shellfish (Oncorhynchus mykiss) monocyte cell line RTS- Immunology, 40, 634-643. 11. Molecular Immunology, 45, 1439-1448. 12. Johnson S., 2014. Living in Water. In “Texas 21. Hong JR., Gong HY., Wu J., 2002. IPNV VP5 a Aquatic Science”, Ed., RA Rosen, 1st ed., 162- novel anti apoptosis gene of the Bcl 2 family 208, Texas A & M University Press, Corpus regulates Mcl 1 and viral protein expression. Christi. Virology, 295, 217-229. 13. Zhang YA., Salinas I., Oriol-Sunyer J., 2011. 22. Bassity E., Clark TG., 2012. Functional Recent findings on the structure and function identification of dendritic cells in the teleost of teleost IgT. Fish and Shellfish Immunology, model rainbow trout (Oncorhynchus mykiss). 31, 627-634. PLoS One, 7, 1-14. 14. Munang’andu MH., Mutoloki S., Evensen Q., 23. Jorgensen HB., Sorensen P., Cooper GA., 2014. Acquired immunity and vaccination Lorenzen E., Lorenzen N., Hansen MH., Koop against infectious pancreatic necrosis virus of BF., Henryon M., 2011. General and family salmon. specific gene expression responses to viral Developmental and Comparative Immunology, 43, 184-196. 15. Harmache A., Leberre hemorrhagic septicaemia virus infection in M., Droineau S., rainbow 362 trout (Oncorhynchus mykiss). Balıklarda Viral Enfeksi... Durmaz ve Albayrak Molecular Immunology, 48, 1046-1058. 32. Robertsen B., 2011. Can we get the upper hand 24. Reid A., Young KM., Lumsden JS., 2011. Rainbow trout (Oncorhynchus on viral diseases in aquaculture of Atlantic mykiss) salmon. Aquaculture Research, 42, 125-131. ladderlectin, but not intelectin, binds viral 33. Collet B., Urquhart K., Noguera P., Larsen K., hemorrhagic septicemia virus IVb. Diseases of Lester K., Smail., Bruno DA., 2013. Method to Aquatic Organisms, 95, 137-143. measure an indicator of viraemia in Atlantic 25. Iliev DB., Skjæveland I., Jørgensen JB., 2013. salmon using a reporter cell line. Journal of CpG oligonucleotides bind TLR9 and RRM Virological Methods, 191, 113-117. containing proteins in Atlantic salmon (Salmo 34. Danion M., Lefloch S., Castric J., Lamour F., salar). BMC Immunology, 14, 1-12. Cabon J., Quentel C., 2012. Effect of chronic 26. Sun B., Skjæveland I., Svingerud T., Zou J., exposure to pendimethalin on the susceptibility Jørgensen J., Robertsen B., 2011. Antiviral of rainbow trout, Oncorhynchus mykiss L. to activity of salmonid gamma interferon against viral infectious Ecotoxicology and Environmental Safety, 79, pancreatic necrosis virus and salmonid alphavirus and its dependency on hemorrhagic septicaemia virus. 28-34. type I interferon. Jornal of Virology, 85, 9188- 35. Gadan K., Marjara IS., Sundh H., Sundell K., 9198. Evensen Q., 2012. Slow release cortisol 27. Tafalla C., Chico V., Perez L., Coll JM., Estepa A., implants result in impaired innate immune 2007. In vitro and in vivo differential expression responses and higher infection prevalence of rainbow trout (Oncorhynchus mykiss) Mx following isoforms in response to viral haemorrhagic infectious pancreatic necrosis virus in Atlantic septicaemia virus G gene, poly I: C and VHSV. salmon (Salmo salar) parr. Fish and Shellfish Fish and Shellfish Immunology, 23, 210-221. experimental challenge with Immunology, 32, 637-644. 28. Seo JY., Yaneva R., Cresswell P., 2011. Viperin: 36. Munang’andu HM., Fredriksen BN., Mutoloki S., a multifunctional, interferoninducible protein Dalmo RA., Evensen O., 2013. The kinetics of that regulates virus replication. Cell Host CD4+ and CD8+ T-cell gene expression correlate Microbe, 10, 534-539. with protection in atlantic salmon (Salmo salar 29. Sepulcre MO., Munoz I., Roca FJ., Lopez Munoz L.) vaccinated against infectious pancreatic A., Mulero V., 2010. Molecular strategies used necrosis. Vaccine, 31, 1956-1963. by fish pathogens to interfere with host 37. Nakanishi T., Toda H., Shibasaki Y., Somamoto. programmed cell death. Developmental and T., 2011. Cytotoxic T cells in teleost fish. Comparative Immunology, 34, 603-610. Developmental and Comparative Immunology, 30. Toplu N., Albayrak H., Aydoğan A., Ekipmen ET., 35, 1317-1323. Metin N., 2010. Gökkuşağı alabalıklarında (Oncorhynchus mykiss Walbaum, enfeksiyöz pankreatik patogenezisinde apoptozisin 38. Zapata A., Diez B., Cejalvo T., Guiterrrez de 1792) Frias C., Cortes A., 2006. Ontogeny of the nekrozun immune system of fish. Fish and Shellfish rolü. Ankara Immunology, 20, 126-136. Üniversitesi Veteriner Fakültesi Dergisi, 57, 39. Kim SH., Jang YS., 2014. Antigen targeting to M 191-196. 31. Paulmann Heitmann cells for enhancing the efficacy of mucosal D., L., Magulski Flehmig T., B., Schwarz R., vaccines. Vallbracht A., Medicine, 46, 1-8. Dotzauer A., 2008. Hepatitis A virus protein 2B suppresses beta interferon (IFN) gene transcription by interfering with IFN regulatory factor 3 activation. Journal of General Virology, 89, 1593-1604. 363 Experimental and Molecular