atomun yapısı - WordPress.com
advertisement

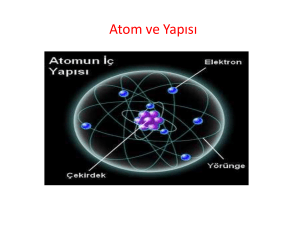
ATOMUN YAPISI ATOMUN YAPISI ATOM Elementlerin özelliğini taşıyan, en küçük yapı taşına, atom diyoruz. veya, fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamayan, maddenin en küçük birimine atom denir. ATOMUN YAPISI Helyum’un özelliğini taşıyan en küçük madde, He’ atomu, Karbon’un özelliğini taşıyan en küçük madde, C’ atomu, Demir’in özelliğini taşıyan en küçük madde, Fe’ atomu dur. ATOMUN YAPISI ATOMUN ÖZELLİKLERİ 1.Elementlerin özelliğini taşıyan en küçük yapıtaşlarıdır. 2. Atomlar fiziksel ve kimyasal yöntemlerle daha basit birimlerine ayrıştırılamazlar. (Ancak nükleer yöntemlerle parçalanabilirler.) 3.Atomlar çekirdek ve yörüngelerden oluşmuşlardır. Çekirdekte proton ve nötronlar; yörüngelerde de, elektronlar bulunur. 3.Atomun kütlesi, yaklaşık çekirdeğin kütlesine eşittir. Elektronların kütleleri çok küçük olduğumdan ihmal edilir. 4.Bir elementi oluşturan tüm atomların, proton sayıları, dolayısıyla kimyasal özellikleri, bir birinin aynıdır. 5.Bir elementi oluşturan tüm atomların, nötron sayıları, dolayısıyla fiziksel özellikleri, bir birinin aynı olmaya bilir. (Bu tür atomlara izotop atomlar denir. ATOMUN YAPISI PROTON: Atomun çekirdeğinde bulunan, + yüklü taneciklere denir. Özellikleri: 1- Atomun çekirdeğinde bulunurlar. 2- + yüklü taneciklerdir. (Atomun çekirdek yükünü belirler. ) ( Ps=Çy ) 3- Atomun cinsini belirler. (Ps=An) 4-Nötr atomlarda, elektron sayısına eşittir. (Ps=An=Çy=Es) 5- Atomun kütlesine etki ederler. (1p = 1 akb = 1.67 x 1024 g) ATOMUN YAPISI • NÖTRON: Atomun çekirdeğinde bulunan yüksüz taneciklere denir. Özellikleri: 1.Atomun çekirdeğinde bulunurlar. 2.Yüksüz taneciklerdir. (Atomun çekirdek yüküne etki etmezler.) 3.Atomun kimyasal özelliklerine, etki etmezler. 4.Kararlı atomlarda Ps Ns dır. 5.Atomun kütlesine etki ederler. (1 p = 1n) ATOMUN YAPISI ELEKTRON: Atomun çekirdeğinin etrafında hareket eden - yüklü taneciklere denir. Özellikleri: 1.Atomun çekirdeğinin etrafında hareket ederler. 2. – yüklü taneciklerdir. (Atomun yüküne etki ederler.) 3.Bilhassa değerlik elektronları, atomun kimyasal özelliklerine etki eder. 4. Nötr atomlarda Ps = Es dır. 5. Atomun kütlesine etkileri ihmal edilir. (1p= 1840 e-) ATOMUN YAPISI • DALTON ATOM MODELİ • İngiliz bilgin John DALTON, 1803 yılında bu teoriyi ortaya atmış ve geliştirmiştir. • Bu modele göre: Maddelerin en küçük yapıtaşı atomdur. Atomlar içi dolu yüksüz tanecikler(küreler)dir. Atomlar parçalanamazlar. Aynı cins elementlerin atomları, büyüklük ve kütlece birbirinin aynıdır. Farklı cins elementlerin atomları da farklıdır. Bir bileşiği oluşturan atomların kütleleri arasında basit tam sayılarla ifade edilen bir oran vardır. ATOMUN YAPISI THOMSON ATOM MODELİ 1897 yılında Joseph John THOMSON katot ışınlarıyla yaptığı deneylerde, “yüksek voltaj uygulanan katot ışınlarının, negatif kutup tarafından iletildiğini ve pozitif kutba doğru çekildiğini belirledi.” Bu deney sonucuna göre, katot ışınları negatif olmalıydı. Negatif yüklü bu taneciklere elektron denir. Thomson, yapmış olduğu deneyler sonucuna göre elektronun yükünü ve kütlesini hesaplayamamış ancak yük/kütle oranını hesaplamıştır. ATOMUN YAPISI • RUDERFORD ATOM MODELİ Atomda pozitif yük ve kütle, atom merkezinde çekirdek olarak adlandırılan çok küçük bir hacimde toplanmıştır. Atomun yarıçapı 10-8 cm, çekirdeğin yarı çapı 10-13 cm civarındadır. Çekirdekteki pozitif yük miktarı bir elementin bütün atomları için aynı ve diğer atomlarınkinden farklıdır. Pozitif yük sayısı atom kütlesinin yaklaşık yarısına eşittir. Yani kütleye etki eden başka bir tanecikte vardır. Atomların nötrlüğünü sağlamak üzere, proton sayısına eşit sayıda elektron, çekirdek etrafında bulunur. Atom hacminin büyük bir bölümü, çok hızlı hareket eden elektronlar tarafından doldurulur. ATOMUN YAPISI BOHR ATOM MODELİ Elektronlar çekirdek çevresinde yarıçapı belli dairesel yörüngelerde bulunabilir. Bu yörüngelere enerji düzeyi de denir. Yörüngeler çekirdeğe yakınlık sırasına göre ya K, L, M... gibi harflerle, ya da 1, 2, 3, ...n gibi tam sayılarla gösterilir. Her enerji düzeyinin belirli bir enerjisi vardır. Çekirdeğe en yakın enerji seviyesinin enerjisi en küçüktür. Çekirdekten uzaklaştıkça yörüngelerin enerjisi artar. Hidrojen atomunda bir elektron en düşük enerjili yörüngede bulunur. Bu yörüngelerden birinde bulunan elektron kendiliğinden enerji yaymaz. Elektronu olası en düşük enerjili yörüngelerde bulunan atomun elektron dizilişine temel hal elektron dizilişi denir. Atom dışarıdan enerji kazanırsa elektron aldığı enerjinin değerine bağlı olarak daha yüksek enerjili bir düzeye sıçrar. Böyle elektronlara uyarılmış elektron, atomlara da uyarılmış atom denir. ATOMUN YAPISI Modern Atom Teorisi Bohr atom modeli, tek elektronlu atomların davranışlarının açıklanmasında başarılı olmakla birlikte, çok elektronlu atomların davranışlarını açıklamada yetersiz kalmıştır. Modern atom teorisine göre , Bohr atom teorisindeki gibi elektronları yörüngelerde sabit hızla dönen tanecikler olarak düşünmek yanlıştır. Çünkü elektronun hızı ve yeri için kesin bir şey söylenemez. Elektronun bulunma olasılığının olduğu yerlerden bahsedilir.