KIM148 Genel Kimya Laboratuvarı Ders Notları
advertisement

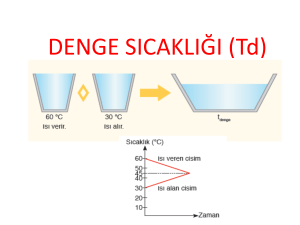
ALTINCI HAFTA Deney No: 6 Reaksiyon Isısının Hesaplanması Deney No:6 Reaksiyon Isısının Hesaplanması Teori: Deneyde reaksiyon ısısı, molar ısı kapasite, spesifik ısı ve kalorimetre kavramlarını irdelenecek ve bir reaksiyon ısısı hesaplanacaktır. Termodinamik, fiziksel ve kimyasal olaylara eşlik eden enerji değişimlerini inceler. Kimyasal termodinamiğin yasaları, belirli koşullarla belirli bir kimyasal tepkimenin kuramsal olarak oluşup oluşmayacağını önceden tahmin etmemizi sağlar. Tepkime ısısı, sabit sıcaklık ve sabit basınçta yürüyen bir kimyasal tepkimede sistem ile çevresi arasında alınıp verilen ısı miktarıdır. Tepkime ısıları deneysel olarak kalorimetre denilen ve ısı miktarını ölçen aletlerle belirlenir. Bir tepkime yalıtılmış bir sistemde gerçekleşirse yani çevresi ile madde ve enerji alışverişinde bulunmazsa, tepkime sistemin ısısal enerjisinde değişme meydana getirir ve sıcaklık artar yada azalır. Deney No:6 Yaratılmış bir sistemde sıcaklık artışına neden olan yada yalıtılmamış bir sistemde çevreye ısı veren bir tepkimeye ekzotermik tepkime denir. Ekzotermik bir tepkimede, tepkime ısısı negatif (qtep<0) bir büyüklüktür. Yalıtılmış bir sistemde sıcaklığın azalmasına neden olan yada yalıtılmamış bir sistemde çevreden ısı alan bir tepkimeye de endotermik tepkime denir. Bu durumda tepkime ısısı pozitif (qtep>0) bir büyüklüktür. Isı, sıcaklık farkından ileri gelen enerji alışverişidir. Sıcak bir cisimden soğuk bir cisme enerji aktarımı ısı şeklinde olur. Bir sistemin sıcaklığını bir derece değiştirmek için gerekli ısı miktarına o sistemin ısı kapasitesi denir. Sıcaklık değişimi: Burada Ts son sıcaklık, Ti ilk sıcaklıktır. Deney No:6 Sistemin sıcaklığı artarsa Ts>Ti dir ve ΔT pozitiftir. q nun pozitif olması ısısın soğurulduğunu, ada sistem tarafından kazanıldığını belirtir. Sistemin sıcaklığı azalırsa (Ts<Ti) ΔT negatiftir. Negatif q ısı açığa çıktığını yada ısı kaybedildiğini gösterir. Termodinamiğin birinci yasası enerjinin korunumu yasasıdır. Sistem ve çevresi arasındaki etkileşimlerde toplam enerji sabit kalır. Diğer bir deyişle evrenin toplam enerjisi sabittir. Bu yasa aşağıdaki gibi formülle edilebilir. qsistem + qçevre = 0 Buna göre, sistemin kaybettiği ısı çevresi tarafından kazanılır, çevrenin kaybettiği ısı sistem tarafından kazanılır. Yani: qsistem = - qçevre Deney No:6 Reaksiyon Isılarının Ölçülmesi: Isı miktarını hesaplayabilmek için ısı kapasitesinin bilinmesi gerekir. Isı kapasitesi faz geçişlerinin olmadığı sıcaklık aralıklarında iki türlü tanımlanır. 1) Molar ısı kapasitesi: Bir mol maddenin sıcaklığını 1 K veya 1ºC yükseltmek için gerekli olan ısı miktarıdır. Birimi J/Kmol dür. 2) Spesifik ısı: Bir gram maddeyi 1 K veya 1ºC yükseltmek için gerekli olan ısı miktarıdır. Birimi J/Kg dır. ΔT=Ts-Ti (1) Bu durumda bir cismin aldığı veya verdiği ısı iki farklı şekilde hesaplanabilir. Isı(q) = mol sayısı × molar ısı kapasitesi × ΔT (2) Isı(q) = kütle × spesifik ısı × ΔT (3) Deney No:6 Kalorimetreler: Reaksiyon ısıları ölçmek için kullanılan aletlerdir. Gerek sabit hacimde (kapalı kaplarda), gerek sabit basınçta (açık kaplarda, atmosfer basıncında) reaksiyon ısıları ölçülerek ΔE (iki halin iç enerjileri arasındaki fark) veya ΔH (entalpi değişimi) deneysel olarak hesaplanabilir. Her iki halde de önce kalorimetrenin ısı kapasitesi deneysel olarak belirlenmelidir. Kalorimetrenin kazandığı ısı:q(J) = kalorimetre ısı kapasitesi (J/K) ×ΔT(K) (4) bağıntısı kullanılarak kalorimetrenin ısı kapasitesi hesaplanır. Bu hesap yapıldıktan sonra kalorimetre ısı kapasitesi yerine konarak reaksiyon ısıları sadece kalorimetre içindeki sıcaklık yükselmesi (veya azalması) okunarak bulunur. Çözelti kalorimetre laboratuarda bir termos yada alüminyum yaprakla ağzı örtülmüş beherlerden yapılabilir. Deney No:6 Deneyin Yapılışı: 1.Isı kapasitesi tayini: Kalorimetrenin ısı kapasitesi tayini için beher tipi kalorimetre kullanılır. (ağzı alüminyum folyo ile kapatılmış 250mL’lik beher içinde beher) Önceden tartılan Cu parçası(mCu) 30 dakika 100ºC deki etüvde ısıtılır. 250mL lik behere 100gram saf su (msu) konyulur. Bu suyun sıcaklığı bir termometre yardımı ile okunur ve kaydedilir (t1). 30 dakika sonra bakır parçası etüvden alınır ve bakırın ısısını kaybetmemesi için hemen kalorimetre kabına yerleştirilip son sıcaklığı kaydedilir (t2). (7) nolu bağıntıyı kullanılarak ısı kapasitesi hesaplanır. 2.Reaksiyon ısısının hesabı: 1. kısımda kullanılan beher boşaltılır ve kurutulur. Bu defa reaksiyon ısısı ölçülecek karışımlar koyulur. Behere 100 gram seyreltik HCl çözeltisi koyulur ve çözeltinin sıcaklığı okunarak kaydedilir (t1). Deney No:6 Önceden tarttılan magnezyum parçası çözeltiye atılarak reaksiyon tamamlanınca sıcaklık okunur (t2). (8) nolu bağıntı kullanılarak reaksiyon ısısı hesaplanır. Aşağıdaki reaksiyonun reaksiyon ısısı hesaplanacaktır: Hesaplamalar: 1) Termodinamiğin birinci kanununa göre kaybedilen ısı kazanılan ısıya eşit olmalıdır. Bir başka değişle kazanılan ve kaybedilen ısıların toplamı sıfır olmalıdır. q bakırın kaybettiği = q suyun kazandığı + q kalorimetrenin kazandığı (6) mCu × CCu* × (100-t2) = msu × Csu*(t2-t1) + Isı kapasitesi*(t2-t1) (7) * : CCu = 0,385 J/Kg * : Csu = 4,18 J/Kg Deney No:6 Reaksiyon ısısı = Isı kapasitesi × (t2-t1) + çözeltinin kütlesi × Cçözelti × (t2-t1) (8) Cçözelti = 4,21 J/Kg Sonuçlar: Beherin ısı kapasitesi:......................................................... Reaksiyon ısısı: ................................................................