HETEROKROMATİN YAPININ OLUŞUMUNDA
advertisement
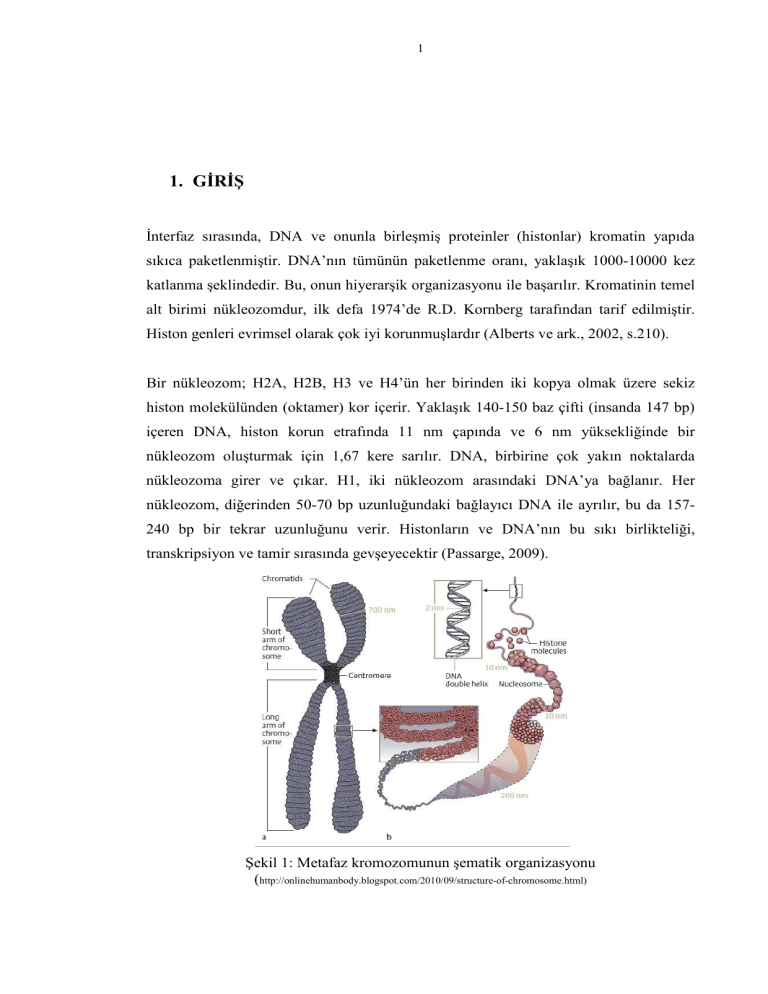
1 1. GİRİŞ İnterfaz sırasında, DNA ve onunla birleşmiş proteinler (histonlar) kromatin yapıda sıkıca paketlenmiştir. DNA’nın tümünün paketlenme oranı, yaklaşık 1000-10000 kez katlanma şeklindedir. Bu, onun hiyerarşik organizasyonu ile başarılır. Kromatinin temel alt birimi nükleozomdur, ilk defa 1974’de R.D. Kornberg tarafından tarif edilmiştir. Histon genleri evrimsel olarak çok iyi korunmuşlardır (Alberts ve ark., 2002, s.210). Bir nükleozom; H2A, H2B, H3 ve H4’ün her birinden iki kopya olmak üzere sekiz histon molekülünden (oktamer) kor içerir. Yaklaşık 140-150 baz çifti (insanda 147 bp) içeren DNA, histon korun etrafında 11 nm çapında ve 6 nm yüksekliğinde bir nükleozom oluşturmak için 1,67 kere sarılır. DNA, birbirine çok yakın noktalarda nükleozoma girer ve çıkar. H1, iki nükleozom arasındaki DNA’ya bağlanır. Her nükleozom, diğerinden 50-70 bp uzunluğundaki bağlayıcı DNA ile ayrılır, bu da 157240 bp bir tekrar uzunluğunu verir. Histonların ve DNA’nın bu sıkı birlikteliği, transkripsiyon ve tamir sırasında gevşeyecektir (Passarge, 2009). Şekil 1: Metafaz kromozomunun şematik organizasyonu (http://onlinehumanbody.blogspot.com/2010/09/structure-of-chromosome.html) 2 Epigenetik değişimler, belirli genlerin ekspresyonunu DNA dizisini değiştirmeden etkileyen, kalıtılabilir değişikliklerdir. Epigenetik terimi 1939’da C.H. Waddington tarafından kullanılmıştır (Speybroeck, 2002). Ökromatinde genler transkripsiyona açıktır, heterokromatinde değildir. Kromatinin mevcut yapısı epigenetik bir durumdur. Bu, kromatin yeniden şekillendirme denilen çeşitli mekanizmalarla geridönüşümlü olarak değiştirilebilir. Kromatin yeniden şekillendirilmesi, DNA molekülünde histonların yerini değiştirerek genleri transkripsiyona açık hale getiren, aktif ve geridönüşür bir süreçtir (Lewin, 2004). Kromatinin yeniden şekillenmesinde; aktivatör proteinler heterokromatindeki “gen kapalı” durumunu geri çevirebilir. Bunlar, kromatinde DNA’ya bağlanan, çoklu protein komplekslerle etkileşebilen, özgül kontrol elemanlarıdır. Aktivatör proteinler bir aracı proteine bağlanır, sonuçta kromatin gevşer ve gen “gen açık” durumunu alır. Genel transkripsiyon faktörleri ve RNA polimeraz promotörde bir araya gelir ve transkripsiyonu başlatır. Baskılayıcı proteinler kontrol elemanına bağlanınca bu süreç tersine döner ve RNA polimeraz’ın transkripsiyonu başlatması engellenir (Passarge, 2009). 3 2. HETEROKROMATİN YAPININ OLUŞUMUNDA TRANSKRİP_ SİYON VE RNA ENGELLENMESİ Ökaryotik DNA, gen ekspresyonu ve kromozom hareketini düzenleyen farklı yapısal domenlere organize olur. Epigenetik olarak kalıtılabilen bu heterokromatik domenler; geniş kromozom alanlarının ekspresyonunu ve yapısal kontrolünü sağladığı gibi hücre bölünmesi sırasında kromozomların düzgün ayrılması için de gereklidir. Yapılan çalışmalar, heterokromatin oluşumunda pek çok enzim ve yapısal proteinin birlikte çalıştığını ortaya koymuştur. Heterokromatin yapının oluşum süreci, kromatin fiber boyunca yaygın olan susturucu komplekslerin (“silencing complexes”) spesifik olarak modifiye olmuş histonların amino-terminal uçlarıyla etkilişime girerek, adım adım gerçekleşen histon modifikasyonunu (self-oligomerizasyon) kapsar. RNA interferans ve kodlamayan RNA moleküllerinin de epigenetik kromatin domenlerinin oluşumunda rol aldığı ortaya çıkarılmıştır (Grewal, 2003). Kromozomlar, ökromatin ve heterokromatin olmak üzere iki yapıdan oluşurlar. Heterokromatik alanlar (domenler), DNA’ya bağlanan faktörlerin geçişine izin vermediği için transkripsiyonel açıdan sessizdirler. Buna karşın ökromatik kısımlar, genomda sıklıkla erişilebilen aktif transkripsiyonel alanlar olarak tanımlanırlar. Heterokromatinin büyük kısmı sentromer ve telomerler gibi fonksiyonel kromozom yapılarını çevrelerken, daha küçük heterokromatik alanlar kromozom boyunca dağılmış şekilde bulunur (Grewal, 2002). Heterokromatin proteinleri, sentromerlerin çevresindeki DNA tekrarlarıyla ilişkili olup kardeş kromatidlerin birbirleriyle bağlanabilmesi ve kromozomların düzgün ayrılabilmeleri için gereklidir. Heterokromatin yapı aynı zamanda homolog tekrarlar arasında rekombinasyonu engelleyerek; sentromer, telomer ve genomdaki diğer tekrarlı DNA dizilerinin stabilizasyonunu sağlar (Grewal, 1997; Guarente, 2000). 4 Şekil 2.1.: Heterokromatin dağılımı ve sentromerik kromatin organizasyonu 1. Nature Reviews Genetics 9, 923-937 (2008) 2. http://www.studyblue.com/notes/note/n/chapter-4-dna-chromosomes-and-genomes/deck/1404309 Heterokromatin yapı genom stabilitesini sağlamasının yanısıra, gelişim ve hücresel farklılaşma süresince gen ekspresyonunun düzenlenmesinde de merkezi rol oynar. Heterokromatin benzeri yapılar, gelişimsel düzenleyicilerin inaktivasyonunda yer alırlar. Bu düzenleyicilere Drosophila ve memelilerde homeotik gen kümeleri (homeotic gene clusters), mantarlarda eşleşme tipi (mating-type) genleri örnek verilebilir. Bunun dışında, dişi memelilerde dozaj dengelemesine bağlı olarak somatik hücrelerdeki iki X kromozomundan biri heterokromatik inaktivasyona uğrar (Avner, 2001). Heterokromatik durumun özelliklerinden biri, farklı gelişimsel ve çevresel koşullar altında pek çok hücre bölünmesi sırasında epigenetik olarak kalıtılmasıdır. İkincisi, heterokromatin yapının oluşum mekanizması ve heterokromatinin başlangıç bölgesinden (nucleation site) çevreleyen DNA bölgelerine yayılması, dizi-spesifik genetik kontrolden dizi-bağımsız epigenetik kontrole geçişi gerektirir. 5 2.1. Heterokromatin Yapının Oluşumundaki Faktörler Mayalardan memelilere kadar değişik organizmalarla yapılan çalışmalar, histonların ve translasyon sonrası histon modifikasyonlarının heterokromatin oluşumunda kilit rol oynadığını göstermiştir. Ökaryotlarda DNA, herbiri iki molekülden oluşan dört histonun (H2A, H2B, H3, H4) oluşturduğu oktamerik kompleksin etrafında yaklaşık iki tur sarılarak nükleozomu oluşturmak üzere histonlarla bir araya gelir (Şekil 2.2.). Histonların amino uçları (N-), çeşitli posttranslasyonel modifikasyonları içerir (Jenuwein, 2001). Bunlar arasında en çok rastlananları, H3 ve H4 histonlarının yüksek korunmuşluk gösteren amino uçlarındaki “lizin” birimlerinin asetilasyonu ve metilasyonudur (Şekil 2.2.). Şekil 2.2.: Nükleozomun şematik gösterimi ve histon uçlarında asetilasyon ve metilasyon bölgeleri (Grewal, 2003). (A) Nükleozom; kromatinin temel birimi. 147 bp genomik DNA molekülünün oldukça korunmuş histon oktamer kompleksinin etrafında iki kez sarılmasıyla oluşur. (B) Yeşil bayraklar, H3 ve H4 histonlarının amino uçlarındaki / globüler domenlerindeki asetil histon modifikasyonlarının yerleşimini; Kırmızı işaretlerde aynı histon bölgelerindeki metil histon modifikasyonlarının yerleşimini göstermektedir. 6 “Artmış asetilasyon” durumu transkripsiyonel aktiviteyle ilişkiliyken, “azalmış asetilasyon” transkripsiyonel baskılanma durumu ile ilişkilidir. Bu yüzden, hemen hemen tüm organizmalarda heterokromatik yapı, histonların hipoasetilasyonuyla bağlantılıdır (Moazed, 2001) (Şekil 2.3.). Şekil 2.3.: Ökromatik ve Heterokromatik bölgelerin özellikleri (Grewal, 2007). Histon hipoasetilasyonunun dışında bölünen maya, Drosophila ve memelilerde histon H3’ün 9. pozisyondaki Lizin (H3 Lys9) biriminin metillenmesi de heterokromatin oluşumuyla ilişkilidir. Bu birim korunmuş bir metiltransferaz tarafından metillenir (Drosophila’da “Su(var)3-9”, insanda “SUV39H1”, bölünen maya S. pombe’ de “Clr4”) (Rea, 2000; Nakayama, 2001). Bu “H3 Lys9” metiltransferazlar da başka bir korunmuş proteinle ilişkilidir ( bölünen maya da “Swi6”, Drosophila ve insanda “HP1”). Swi6 ve HP1 proteinleri de, Clr4 / Suv39h enzimleri tarafından 9. pozisyondaki lizin birimleri metillenmiş H3 histon kuyruklarına spesifik olarak bağlanırlar (Bannister, 2001; Lachner, 2001) (Şekil 2.4). 7 Şekil 2.4: Kromatin domenlerinde sessizleşmenin oluşumu (Grewal, 2003). DNA’ya direkt bağlanan proteinler ya da RNA’lar yoluyla hedeflenen spesifik bir heterokromatin bölgesinde nukleasyon başlatılır. Deasetilaz ve metiltransferazlar gibi histon modifiye eden enzimler (E), sessizleştirici faktörlerin (SF, “Silencing Factors) bağlanabileceği yer oluşturmak için histon kuyruklarını modifiye ederler. Bu nukleasyon aşamasından sonra, Swi6/HP1 ya da Sir3 gibi sessizleştirici faktörlerin birbiriyle etkileşimi sonucu yan yana bulunan histonların modifikasyonu gerçekleştirilerek SF’ler için bağlanma bölgeleri oluşturulur. Birbirini izleyen modifikasyon ve bağlanma sonucunda, sessizleştirici kompleksin nukleozomal DNA boyunca aşamalı şekilde yayıldığı gözlenir. Sessizleştirici komplekslerin yayılması, sınır elementlerinin (BE, “Boundary Element”) varlığıyla bloke edilir. En alttaki resim, bölünen maya heterokromatininde (soldaki) ve ökromatininde (sağdaki) amino uçlarından modifiye olan H3 histonlarını göstermektedir. H3 Lys9 deasetilasyonu ve metilasyonı, H3 Lys14 deasetilasyonunu takip ederek Swi6 sessizleştirici faktör için bağlanma bölgesi yaratır. 8 2.2. Heterokromatin Nukleasyonunda (Başlamasında) Sessizleştirici (Silencers), Tekrarlar (Repeats) ve RNA’ların Rolü Öncelikli soru: Heterokromatin kompleksler spesifik bir kromozomal bölgeye nasıl hedeflenirler? Heterokromatin nukleasyonunda “sessizleştiriciler” ve “dizi-spesifik DNA bağlanma proteinleri” gibi spesifik düzenleyici bölgelerin rolü anlaşılmış olsa da; tekrarlı DNA elementleri (repetitive DNA elements) ve kodlamayan RNA (noncoding RNAs) moleküllerinin de heterokromatin komplekslerinin bölgesel hedeflenmesinde yer aldıkları gösterilmiştir (Henikoff, 2000; Hsieh, 2000). Heterokromatik dizilerin büyük bir fraksiyonunu kapsayan satellit tekrarları ve transpozonların, yakındaki genlerin sessizleştirilmesine yol açarak heterokromatin mekanizmayı görevlendirdiği düşünülmektedir. Değişik boyutlarda meydana gelen kodlamayan RNA molekülleri, kromozomal davranışın düzenlenmesinde büyük rol üstlenir. Örneğin; Drosophila ve memelilerde dozaj ayarlamasında (Park, 2001), yine memelilerde genomik damgalanma (“genomic imprinting”) (Sleutels, 2002) gibi kromatini modifiye eden aktivitelerde RNA moleküllerinin kromozoma özgü lokalizasyonları önemlidir. RNA interferans (RNAi) yolunun post-transkripsiyonel (transkripsiyon sonrası) gen sessizleştirilmesindeki rolü iyi anlaşılmış olmakla birlikte (Hannon, 2002), tekrarlı DNA bölgelerinde heterokromatin yapının oluşumunda da yer aldıkları bildirilmiştir (Hall, 2002; Volpe, 2002) (Şekil 2.5; Şekil 2.6). RNAi mekanizmasının bileşenleri; PAZ/Piwi ailesinin üyelerinden Argonaute (ago1), RNazIII-benzeri enzim Dicer (dcr1) ve RNA’ya bağlı RNA polimeraz (rdp1)’den oluşmaktadır. Bu bileşenlerin S. pombe’de heterokromatin oluşumunda ve H3 Lys9 metilasyonunun hedeflenmesinde gerekli olduğu gösterilmiştir (Hall, 2002; Volpe, 2002). 9 Şekil 2.5: Heterokromatin yapının başlamasındaki mekanizmalar (Grewal, 2003). Heterokromatik yapılar, sessizleştirici “silencer” denilen DNA bağlanma proteinleri tarafından tanınan “cis-acting” diziler ile başlatılabilir (soldaki resim). Genomda transpozonlar gibi tekrarlı DNA elementlerinin, heterokromatin oluşumunda sinyal görevi gördükleri düşünülmektedir (sağdaki resim). Tekrarlı DNA tarafından oluşturulan transkriptler; RNA-bağımlı RNA polimeraz (RdRP), Dicer ve Argonaute proteinleri gibi RNAi mekanizmasının bileşenleri tarafından shRNA (“küçük heterokromatik RNA)’lara dönüştürülürler. Şekil 2.6: RNAi mekanizmasına ait bir model (Duggan, 2010). Hücre içerisinde gen sessizleşmesi; sentetik RNA’lar, replikasyon yapay virüsler ya da nuklear genlerden transkripsiyonla oluşan çift zincirli RNA (dsRNA) moleküllerinin oluşumuyla tetiklenir. Bu moleküller Dicer denilen enzim tarafından tanınarak küçük müdahaleci RNA (siRNA)’lara dönüştürülür. Çift zincirli siRNA’ların RISC kompleksine (“RNA-induced silencing complex”) dahil olmasıyla kompleksin aktivasyonu ve RNA dupleksinin (çift sarmalın) çözülmesi gerçekleşir. Aktive olmuş RISC kompleksleri gen ekspresyonunu farklı düzeylerde düzenleyebilir. Bu kompleksler çoğunlukla RNA yıkımını teşvik ederek translasyonal inhibisyona yol açarlar. Bunun dışında, benzer komplekslerin kromatinin yeniden şekillendirilmesinde görev aldıkları bilinmektedir. Ayrıca bu yolun, çeşitli genetik hastalıklarla ilişkili genleri kodlayan spesifik dizilerin hedeflenmesinde kullanılabilecek potansiyel terapi yöntemlerinden biri olabileceği bildirilmiştir (Hannon, 2002). 10 2.3. RNAi ve Heterokromatin Pre-mRNA Birleştirici (Splicing) Faktörleri Sentromer yakınında heterokromatin oluşumu; tekrarlı DNA dizileri ve DNA bağlanma proteinlerine gereksinim duymasına rağmen, Robin Allshire’ın laboratuvarında RNAi mekanizmasındaki düzenleyici proteinlerin bölünen maya hücrelerinde kromatin sessizleştirilmesinde gerekli olduğu keşfedilmiştir (Duggan, 2010). Düzenleyici proteinlerin, pre-mRNA’dan olgun mRNA'nın oluşumunda intronları uzaklaştıran proteinler olan birleştirici faktörlerin (“splicing factors”) oluşumunda yer alabileceği bildirilmiştir. Son yıllarda yapılan çalışmalarda, pek çok “splicing” faktörün in vivo olarak sadece RNAi mekanizmasıyla etkileşim halinde olmadığı, aynı zamanda perisentromerik bölgelerde RNAi-yönlendirilmiş heterokromatin oluşumunda gerekli olduğu kaydedilmiştir (Bayne, 2008; Tang, 1998). Bu yüzden, “splicing” faktörlerin mayalarda heterokromatin oluşumunu sağlayan RNAi mekanizmasının düzenleyicisi olduğu bildirilmiştir (Şekil 2.7). Şekil 2.7: RNA aracılı gen susturulması (Hannon, 2010, Nature, 418, 244-251). Çift iplikli RNA (dsRNA) molekülleri, ilgilenilen genlerin susturulması için deneysel olarak hücreye aktarılabilmektedir. Gen susturulması; bitkilerde genetik mühendisliği aracılığıyla RNA virüsleri kullanılarak, kurtlarda dsRNA enjeksiyonu ya da besin yoluyla tetiklenebilmektedir. Her iki sistemde de RNAi aracılı gen susturulması, sistemik ve organizma boyunca yayılan şekilde gerçekleşmektedir. A) Susturucu sinyal, bitkinin damarlarından yaprak dokusunun içine doğru hareket etmektedir. Yeşil: GFP (Green Fluorescence Protein), Kırmızı: GFP geni üzerinde susturucu etkisi olan klorofil floresans proteini temsil etmektedir. B) C. elegans genetik mühendisliğiyle hücre nukleuslarında GFP proteinini eksprese edecek şekilde değiştirilmiştir. Sağdaki resimde kontrol dsRNA ile muamele edilmişken; soldaki resimde GFP dsRNA kullanılmıştır. C) ORC6 genine karşı siRNA ile muamele edilen HeLa hücrelerinde tubulinin yeşil, DNA’nın kırmızı boyanması. ORC6’nın azalması, multinukleuslu hücrelerin artışına yol açmıştır. D) Yetişkin Drosophila’da RNAi teşvikiyle “white” geninin homoloğu olan siRNA ekspresyonu (soldaki resim), wildtype ile karşılaştırıldığında pigmentsiz gözün oluşumu (Sağdaki resim). 11 Heterokromatinle yakın ilişkili bölgelerde genlerin susturulmasına yönelik farklı bir fonksiyonda, “yayılan (spreading)” özellikte susturmanın bir kromozomal bölgeden diğerine aktarılmasıdır. Bu tip heterokromatik sessizleştirme PEV (“position effect variegation”, pozisyon etkisine bağlı çeşitlilik) olarak tanımlanır. PEV, gelişmekte olan Drosophila gözüne ait hücrelerde mozaik formda sessizleştirme şeklinde gözlenmiştir (Huisinga ve Elgin, 2009) (Şekil 2.8). Şekil 2.8: Drosophila ve bölünen mayada PEV “position effect variegation” (Volpe, 2011). Drosophila’da “white” geni w(m4h)’ın heterokromatin tarafından sessizleştirilmesi sonucu gözde beyaz bölümlerin yerini kırmızı rengin alması gösterilmektedir. Sessizleştirme erkek sineklerde geliştirilmektedir. Bölünen mayada, hetekromatik dizilerin yakınına integre edilen ade6’nın sessizleştirilmesine bağlı kayıp, kırmızı koloniler üzerinde beyaz bölümlerin oluşmasına neden olmaktadır. Ökaryotlarda kromatinin yüksek yapıda düzenlenmesi, genetik bilginin bütünlüğü ve ekspresyonun düzenlenmesiyle ilişkilidir; aynı zamanda genlerin, kromozomların, genomların ve organizmaların evriminde büyük öneme sahiptir. DNA’nın heterokromatine paketlenmesinde birçok önemli biyolojik süreçte epigenetik kontrol kullanılır. Yapılan çalışmalar sonucu epigenetik kromatin oluşumlarının nasıl gerçekleştiği, kromozom domenlerinde değişikliklere yol açan histonlar üzerinde nasıl bir mekanizma çalıştığına yönelik soruların cevaplanması açısından bir devrim gerçekleşmiştir. Bunun dışında heterokromatin oluşumunda RNAi mekanizmasının yer aldığının keşfiyle, kromozom yapısının bölgesel kontrolünde RNA’nın rolü büyük 12 heyecan yaratmıştır. Yeni yapılacak çalışmalarla; kromatin domenlerinin oluşumunda ve ilerlemesinde etkili olan, bunların oluşumda rol alan RNA molekülünün farklı rollerinin keşfedilmesiyle epigenetik mekanizmalar hakkında daha detaylı bilgiler edinilebileceği düşünülmektedir.









