Periyodik Sistem
advertisement

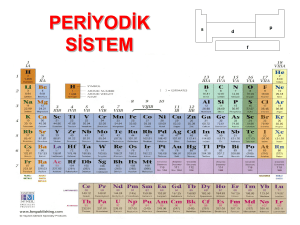
1. ELEMENTLERİN SINIFLANDIRILMASI Bilim insanları, yeni elementler keşfettikçe ve elementlerin sayısı arttıkça benzer özelliklerine göre elementleri çeşitli şekillerde sınıflandırmışlardır. Günümüzde kullanılan modern periyodik sistemin temeli; atom altı parçacık olan protonun keşfine dayanmaktadır. Henry Moseley adlı bilim insanı, elementleri, element atomlarının proton sayısına (atom numarasına) göre düzenlemiştir. Elementlerin numarası element atomlarının proton sayısına, proton sayısı da atom numarasına karşılık gelmektedir. Moseley’in elementleri proton sayısının artışına göre sıralamasından sonra, son değişiklik Glenn Seaborg tarafından gerçekleştirilmiştir. Glenn Seaborg bu tablonun altına iki sıra daha ekleyerek periyodik sisteme son şeklini vermiştir. Periyodik Çizelge (Periyodik Tablo) Periyodik tabloda temal amaç, elementleri benzer özelliklere göre sınıflandırmaktır. grup grup periyot periyot Periyodik tablodaki yukarıdan aşağıya doğru olan düşey sütunlar grup olarak adlandırılır. Soldan sağa doğru olan yatay satırlar ise, periyot olarak adlandırılır. Periyodik sistemde element atomları proton sayılarına göre sıralanırken benzer özellik gözteren elementler alt alta gelecek şekilde yerleştirilmiştir. Her grup ve periyot boyunca elementlerin özellikleri genellikle sistematik bir biçimde değişiklik gösterir. Aynı grupta olan elementler sertlik, parlaklık, iletkenlik gibi özellikleri ve elektron almaya/vermeye olan yatkınlıkları bakımından birbirine benzerdir. Elementler Metaller Ametaller Yarı Metaller Soygazlar Metaller Metaller, periyodik cetvelin 1A, 2A ve 3A grubunda bulunur. Önemli Metaller Lityum: Berilyum: Sodyum: Magnezyum: Alüminyum: Potasyum: Kalsiyum: Demir: Bakır: Kurşun: Altın: Gümüş: Metallerin Özellikleri İşlenebilme özelliğine sahiptir. Elektrik ve ısıyı iyi iletirler. Oda sıcaklığında yani 25 derecede civa hariç hepsi katı halde bulunur. Yüzeyleri parlaktır. Alüminyum, altın, gümüş gibi metaller parlaktır. Elektron dizilimi yapıldığında son katmanında 1, 2 veya 3 elektron olan elementler genelde metaldir. Ancak, Hidrojen son katmanında 1 elektron bulundurmasına rağmen metal değil, ametaldir. Metallerin kararlı iyonları pozitif (+) yüklüdür. Çoğu sağlam yapılı olabilmesine rağmen metaller işlenerek tel ve levha haline getirilebilir. Yemek pişirme kapları iyi ısı iletkeni olan alüminyum metali veya bir metal karışımı olan çelikten yapılır. Ametaller Ametaller, periyodik cetvelin 5A, 6A ve 7A gruplarında genelde ametaller bulunur. Önemli Ametaller Hidrojen: Azot: İyot: Oksijen: Flor: Klor: Fosfor: Kükürt: Ametallerin Özellikleri Kırılgan bir yapıya sahip olduklarından işlenmeleri zordur.. Dolayısıyla büyük çoğunluğu tel ve levha haline getirilemezler. Elektrik ve ısıyı ya iletmezler ya da çok az iletirler. O yüzden, daha çok yalıtım malzemesi olarak kullanılırlar. Oda sıcaklığında katı, sıvı veya gaz halinde olabilirler. Katı olanların yüzeyleri mattır. Son katmanında 5, 6 veya 7 elektron olan elementler genelde ametaldir. Son katmanında 1 elektron olan hidrojen, 4 elektron olan karbon ametal özelliği gösteren istisna elementlerdendir. Ametallerin kararlı iyonları negatif (-) yüklüdür. Yarı Metaller Yarı Metal Element Örnekleri Yarı Metallerin Özellikleri Görünüşleri parlak veya mat olabilir. Elektrik ve ısıyı ametallerden iyi, metallerden daha kötü iletirler. Metaller gibi kırılgan olmayan bir yapıya sahiptir. Dövülerek işlenebilir. Tel ve levha haline getirilebilirler. Bilinen yarı metallerin hepsi oda sıcaklığında katı haldedir. Soygazlar (Asal Gazlar) Önemli Soygazlar Helyum: Neon: Argon: Uçan balonlarda helyum, renkli reklam panolarında neon, sanayi kaynaklarında argon kullanılır. Soygazların Özellikleri Oda sıcaklığında soygazların tamamı gaz halinde bulunur. Elektrik ve ısıyı iletmezler. Son katmanları tam dolu olduğundan elektron alışverişi yapmazlar. Yani iyon ve bileşik oluşturmazlar. Periyodik cetvelin 8A grubunda bulunur.