Elektron Kabukları
advertisement

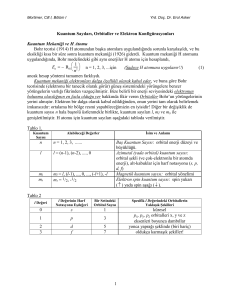
Elektron Kabukları Modern atom teorisine göre elektronlar çekirdek çevresinde belli yörüngelerde değil elektron bulutları halindedir. Elektronların bulunma ihtimallerinin yüksek olduğu bu bölgelere ‘‘orbital’’ denir. Atomda bir elektronun durumu kuantum sayıları denilen 4 sayı ile belirlenir. Bunlar; a) b) c) d) Baş Kuantum Sayısı (n) Orbital Kuantum Sayısı (L) Manyetik Kuantum Sayısı (ML) Spin Kuantum Satısı (MS) Baş Kuantum Sayısı; Elektron bulutunun çekirdeğe olan uzaklığı ile ilgili olup 0’dan farklı tam sayılardır. Bunlar atomun enerji seviyelerini gösterir ve bu enerji seviyelerine elektron kabukları denir. Elektron kabukları n=1 için K, n=2 için L, n=3 için M, n=4 için N… şeklinde adlandırılır. Baş kuantum sayısının belirli değerleri için bu kabuklarda bulunabilecek farklı durum sayısı ve dolayısıyla en fazla elektron sayısıda belirlidir. Bu sayı n arttıkça artmaktadır. Baş kuantum sayısı n olan bir kabukta en fazla bulunabilecek elektron sayısı 2n2 dir. Buna göre; K kabuğunda (n=1) en fazla 2n2=2 elektron L kabuğunda (n=2) en fazla 2n2=8 elektron M kabuğunda (n=3) en fazla 2n2=18 elektron N kabuğunda (n=4) en fazla 2n2=32 elektron Q kabuğunda (n=n) ………. elektron bulunabilir. Baş kuantum sayısı arttıkça elektronların o kabukta bulunma sayıları artar. NOT: Uyarılmış herhangi bir atomda elektronlarn sayılı kabuklara yerleşir. Bu kabuk dolmadan başka bir kabuğa lektron yerleşemez. ÖRNEK: 29 elektronluuyarılmış bir bakır atomunda elektronların kabuklara dağılımını gösteriniz. Orbital Kuantum Sayısı ; Atomlarda elektron bulutlarının oluşturduğu elektrik alanlarının birbirleriyle veya bunların bir dış elektrik alanla etkileşmesi sonucu enerji seviyelerinde ayrılmalar olur. Bu ayrılmaların ve elektron bulutunun ne şekilde olacağını göstermek için kullanılan orbital kuantum sayısı (L), elektronun açısal momentumunun büyüklüğünü belirler. Orbital kuantum sayısı (L)=0,1,2,3,4......(n-1) sayılarını alabilir. Böylece bir kabuk içerisinde ayrılma sonucu oluşan enerji seviyelerini yani alt kabukları sırasıyla s,p,d,f,g harfleriyle gösterilir. Bu alt kabuklar s orbitalleri küresel olduğu halde diğerleri küresel değildir. Baş kuantum sayısı n=4 için L=0,1,2,3 olabilir. Manyetik Kuantum Sayısı; Elektronun çekirdek çevresinde dolanması ile küçük bir akım çevresi oluşturduğunu ve böylece bir manyetik alan meydana geldiğini düşünebiliriz. Bir elektronun açısal momentumu bir dış manyetik alanla etkileşerek enerji seviyelerinde yeniden ayrılmalar olur. Bu durumda orbitallerde manyetik alanda bölünmeye uğrar ve bu bölünmeyi belirten sayılara manyetik kuantum sayıları denir. (ML) ile gösterilir. Verilen bir L değeri için ML ‘nin alacağı değerler ML = -L,…,-1,0,1,…L dir. Manyetik kuantum sayısı bir alt kabuktaki orbital sayısını gösterir. L nin bir değeri için orbital sayısı yani ML’nin alacağı değerler 2L+1 dir. ÖRNEK: L=0,1,2,3 değerlerine karşılık orbital sayılarını bularak ML değerlerini hesaplayarak bir tabla düzenleyiniz. Alt Kabuk s p d f L Orbital Sayısı 0 1 1 3 2 5 3 7 ML 0 -1,0,1 -2,-1,0,1,2 -3,-2,-1,0,1,2,3 Spin Kuantum Sayısı; Çekirdek etrafında dönen elektron aynı zamanda bir topaç gibi kendi etrafında spin hareketi saat ibreleri yönünde veye buna zıt yönde olabilir. Spin değerleri +1/2 ve -1/2 olarak bunu belirtmek için MS ile gösterilen bir spin kuantum sayısı tanımlanır. Elektron spinlerinin uzayda 2 yönü vardır. Bu yönler aşağı doğru bir ok(↓) ve bunun tersi bir ok(↑) ile gösterilir. Spin manye k kuantum sayısının -1/2 ve +1/2 gibi yalnız 2 değer alması bir orbitalde en çok 2 elektronun bulunabileceğini gösterir. Pauli Prensibi Temel haldeki bir H atomunun tek elektronu çekirdeğe en yakın yörüngede bulunur. Acaba temel haldeki çok elektronlu atomlarda da durum böyle midir? Çok elektronlu atomlarda elektronların çekirdek çevresindeki dağılımı 1925 yılında Pauli bir prensip olarak ortaya koymuştur. Bu prensibe göre; Bir atomdan kuantum sayıları birbirinin aynı olan 2 elektron yoktur şeklindedir. Bu prensibe göre atomda 2elektron n, L, ML, MS kuantum sayılarına hiçbir zaman sahip olamaz. Bu sayılardan en fazla 1’ i farklı olmalıdır. Elektronlar dizilirken önce en küçük enerjili orbitalleri doldurur. En küçük enerjili orbitaller dolmadan diğer orbitallere elektron giremez. Bu prensibe göre n ile belirtilen belli bir enerji düzeyinde kaç tane elektron olabileceği L, ML ve MS yardımıyla hesaplanır. Orbitallerin Gösterilmesi; Baş kuantum sayısı n olan bir temel enerji düzeyinde bulunan orbital sayısı 2L+1 ve bulunabilecek en fazla elektron sayısı 2n2 dir. s,p,d,f…. Orbitalleri gösterilirken esas enerji düzeyinin kuantum sayısı orbiti gösteren harfin önüne yazılır. N=2 düzeyindeki s orbiti 2s, p orbiti 2p… ve buna benzer yazılır. Bir orbitteki elektron sayısı da orbiti gösteren harfin sağ üst köşesine yazılır. 2s orbitalinde 1 elektron varsa 2s1, 3p orbitalinde 5 elektron var ise 3p5 biçiminde yazılır. Söz gelimi 11 elektronu olan Na atomu 2 si K kabuğundadır. Bunlar 1s2 diye gösterilir. L kabuğundaki 8 elektronun ikisi 2s orbitalinde ve 6sı 2p orbitalinde olduğundan bunlar 2s22p6 olarak yazılır. Geriye kalan 1 tanesi de M kabuğunda 3s orbitalindedir. O da 3s1 diye yazılır. Buna göre Na atomunun elektronik yapısı; Aynı enerji düzeyindeki orbitaller birer e- almadan orbitallerden biri ikinci bir e- alamaz. Bu kurala ‘‘Hunt Kuralı’’ denir e- düzenleri yazılırken Pauli ilkesi ve Hunt kuralı göz önüne alınır. Elektronlar en düşük enerji seviyelerini önce dolduracak şekilde yerleştirilir.