PowerPoint Sunusu - Erzurum Teknik Üniversitesi
advertisement

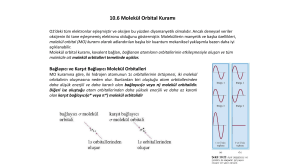
ELEKTROFOREZ SDS-PAGE ARŞ. GÖR. F. NECMİYE KACI, ERZURUM TEKNİK ÜNİVERSİTESİ, 2017 ELEKTROFOREZ Yüklü moleküllerin elektriksel alanda ayrılmaları temeline dayanan bir tekniktir. Elektroforezde katedilen mesafe, net yük ile doğru ; molekül büyüklüğü ve elektroforetik ortamın viskozitesi ile ters orantılıdır. Proteinler izoelektrik noktalarının (pI) üzerindeki pH değerlerinde (-) yüklüdürler ve elektriksel alanda anoda göç ederler; izoelektrik noktanın altındaki pH değerlerinde ise (+) yüklüdür ve katoda göç ederler. Elektroforez için dört şeye ihtiyaç vardır: -iyonların hareket edebileceği uygun bir ortam (destek ortamı) -uygun pH’da bir tampon çözelti -elektriksel alanı oluşturmak için doğru akım sağlayacak güç kaynağı -birbirinden ayrılan bantları kantitatif olarak değerlendirebilen dansitometre. ELEKTROFOREZ YÖNTEMLERİ • Poliakrilamid Jel Elektroforezi • Agaroz Jel Elektroforezi • Değişken Alanlı (Pulsed Field ) Jel Elektroforezi • İzoelektrik Odaklanma • İki Boyutlu Elektroforez • Kılcal (Kapiller) Elektroforez • İmmünoelektroforez • İmmünfiksasyon Elektroforezi Poliakrilamid Jel Elektroforezi En yaygın kullanım alanı olan elektroforez tipidir. Proteinlerin elektroforetik ayrımında nişasta, agaroz ve selüloz asetat gibi çeşitli jeller kullanılmakla birlikte, genelde en iyi ayrışımın sağlandığı PAGE tekniği uygulanır. PAGE; serum proteinlerinin, proteinlerin genetik varyasyonlarının ve izoezimlerin analizinde en iyi sonuç veren elektroforez tipidir. Poliakrilamid jellerle yapılan elektroforez, örnekteki bileşenlerin daha iyi ayrışmasına yol açar. Çünkü ayırım hem moleküler elekleme, hemde elektroforetik harekete dayanır. Jelin ayrıştırma gücü ve molekül boyutu aralığı akrilamid ve bis (N, N’-metilen –bis – akrilamid) akrilamid konsantrasyonuna bağlıdır. İki maddenin polimerizasyonu ile (kovalent bağ oluşumu) jelde porlar oluşur. Düşük konsantrasyonda daha büyük porlar oluşur ve yüksek molekül ağırlıklı moleküllerin analizi yapılabilir. Yüksek konsantrasyonlarda ise küçük porlar oluşur ve düşük molekül ağırlıklı moleküllerin analizi yapılır. Polimerizasyon ya kimyasal ya da fotokimyasal yolla gerçekleştirilir. Polimerizasyon başlatıcı olarak: kimyasal yöntemde: Amonyum persülfat fotokimyasal yöntemde: Riboflavin N,N,N’,N’-tetrametilenetilendimin (TEMED) her iki uygulamada da katalizör işlevi görür. PAGE, tüp veya düzlemsel(slab) jellerde gerçekleştirilir. Düzlemsel(slab) jeller, aynı anda çok sayıda örneğin destek ortamında analiz edilebilmesine imkan verdiği için tüp jellere göre daha geniş çapta kullanılırlar. %T ve %Cbis DEĞERLERİ %T:total akrilamid %’si (w/v) %Cbis :bis’in monomere oranı (w/w) %T= Akrilamid (g) + Bis (g) x 100 Hacim (ml) %Cbis= Bis (g) x 100 Akrilamid (g) +Bis (g) • %T arttıkça por çapı küçülür. • Herhangi bir %T oranında %5 bis optimum por büyüklüğünün oluşmasını sağlar. %5’in altındaki veya üstündeki %Cbis değerleri por büyüklüğünü artırır. Çeşitli Akrilamid Konsantrasyonlarında Ayrımı Yapılabilecek Polipeptid Ağırlıkları Akrilamid Konsantrasyonu (%) Polipeptidin Molekül Ağırlığı (kD) 15 12-43 10 16-68 7.5 36-94 5 57-212 Poliakrilamid jel elektroforezi: ND (non denature edici PAGE) SDS PAGE (denature edici PAGE) Proteinlerin doğal (intakt) yapılarını bozucu ajanlar kullanmadan yapılan PAGE yöntemidir. Doğal jelde proteinin molekül ağırlığı hakkında kesin bilgi edinmek mümkün değildir, çünkü molekül büyüklüğü yanında molekül şekli ve yükü de ayrımı etkiler. SDS-PAGE ile proteinler, net yük ve şekillerine göre değil, sadece molekül büyüklüklerine göre, birbirinden ayrılırlar. SDS’in ( Sodyum dodesil sülfat) bağlanmasıyla , doğal yapısını kaybeden proteinler, aynı şekil ve yük/kütle oranına sahip olurlar. Böylece elektriksel alan içinde proteinlerin hareketi sadece molekül ağırlıklarına bağlıdır. Daha küçük olanlar, daha hızlı sürüklenir. (SDS: Polipeptitlerin ana iskeletini çevreleyerek proteinleri denature eden anyonik bir deterjandır. Moleküle negatif yük kazandırır.) SDS-PAGE Elektroforez Tampon Sistemleri A) Kesiksiz (Continuous): Tek bir ayırıcı jel ve tek bir tampon kullanılır. Tanklarda ve jelde aynı tampon kullanılır. B) Kesikli (Discontinuous): Jel farklı tamponlarla hazırlanmış iki kısımdan oluşur: 1) büyük porlu yükleme (stacking) jeli ( örneğin, % 5 total akrilamid içerir.) 2) Küçük porlu ayırma (seperating) jeli ( örneğin % 10 total akrilamid içerir.) 1) JELİN HAZIRLANMASI A)AYIRMA JELİ Hazırlanan jel sistemi SU ile temizlenir. Alkol jel yapısına zarar vereceği için kullanılmamalıdır. Hazırlanan jel hava kalmayacak şekilde pipetle yavaşça sisteme dökülür. Üzeri hemen 2- propanol ile kapatılır. HAVA ile teması önlenir. %10’LUK AYIRMA JELİ 4X Separating buffer tamponu…………….1,25 ml %30 Akrilamid Karışımı………………….….…..1,65 ml dH2O……………………………..…………………………..2,05 ml %10 APS……………………………………..…………..…75 µl TEMED………………………………..………………….… 5 µl Verilen maddeler bu sıra ile konulur. B) YÜKLEME JELİ Polimerizasyon tamamlandıktan sonra üst yüzeydeki 2- propanol dökülür. Jel yüzeyi saf su ile birkaç kez yıkanır. Hava boşluğu kalmayacak şekilde 2ml kadar yükleme jeli dökülür. %10’LUK YÜKLEME JELİ 4X Stacking jel buffer tamponu………….1,25 ml %30 Akrilamid Karışımı………………….….…..850 µl dH2O……………………………..…………………………..2,85 ml %10 APS……………………………………..…………..…75 µl TEMED………………………………..………………….… 5 µl Verilen maddeler bu sıra ile konulur. Notlar: Akrilamid: Nörotoksik bir maddedir. Karanlıkta, +4ᵒC’de saklanır. Bromofenol blue: Proteinle reaksiyon vermez. Β-merkapto etanol: Proteinlerdeki disülfit bağlarını koparır. EDTA: Fe, Ca gibi metal iyonlarının şelatörüdür. pH:8’de çözünür. Glisin: SDS-PAGE, running buffer bileşenidir. pH‘ın korunmasını sağlar, elektroforez sırasında örneğin korunmasını sağlar. APS(amonyum per sülfat): TEMED’in katalizörüdür. Oksijen free radikalleri oluşturur. TEMED: Reaksiyon başlatıcı ajandır. SDS: Polipeptitlerin ana iskeletini çevreleyerek proteinleri denature eden anyonik bir deterjandır. Moleküle negatif yük kazandırır. 2) ÖRNEKLERİN YÜKLENMESİ Yüklenecek tüm protein örnekleri aynı konsantrasyona sahip olmalıdır. 4X LAEMLİ Buffer SDS-PAGE Gel Loading Buffer %10’u β-merkapto ethanol olacak şekilde hazırlanır. 60 µl 4X Laemli buffer 6 µl β-merkapto ethanol Bu oran kullanılarak protein örneği sayısına göre hazırlanır. Genellikle 20 µl yükleme yapılır. Protein: boya= 3:1 olmalıdır. Totalde bir protein örneği için: 15 µl ................ Protein 5 µl ..................Boya (Gel loading Buffer) Denature edilecek protein karışımı hazırlanır. 95 derecede 5 dk bekletilir. 5 dk sonunda örnekler doğrudan buza alınır. 70 voltta 3-4 saat boyunca yürütme yapılır. Jele yükleme yapılır. 3) MARKER YÜKLENMESİ Hemoglobin: 64.000 Dalton: 64 kDa 4) PROTEİNLERİN GÖRÜNÜR HALE GETİRİLMESİ Marker Coomassie brillant blue ile boyama yapılır. Boya arginin gibi bazik amino asitlere ve bazı aromatik amino asitlere daha kolay bağlanır. Jelin alt kısmı yürümenin sonlandığı noktayı gösterir. 5) PROTEİNLERİN MOLEKÜL AĞIRLIKLARININ BELİRLENMESİ Proteinlerin molekül ağırlıklarının logaritması ile jeldeki rölatif göç hızları arasında doğrusal bir ilişki vardır. Molekül ağırlığı bilinmeyen proteinin Rf değeri = proteinin ayrıştırma jelinde ilerleme yolu/ayrıştırma jelinin toplam uzunluğu= 4.2/8.4=0.5 Standart markerdeki herbir protein bandının molekül ağırlığı grafiğin y eksenine, Rf değerleri de x eksenine yazılır.Ve bu grafikten elde edilen eğride verilen denklem kullanılarak istenilen proteinin molekül ağırlığı bulunabilir (istenilen proteinin de ilerleme yolu yükleme boyasının toplam yoluna bölünerek Rf değeri hesaplanır). 6) POLİPEPTİTLERİN RF DEĞERLERİNE AİT STANDART GRAFİK (kalibrasyon eğrileri) Molekül ağırlığının saptanmasında kullanılan standart grafik. Araştırmacı, kullanacağı kalibrasyon grafiğini, kendi çalışmasına göre tekrar düzenlemelidir.