MBKY II-8 Enzimatik Analiz ve Aktivitenin Ölçülmesi
advertisement

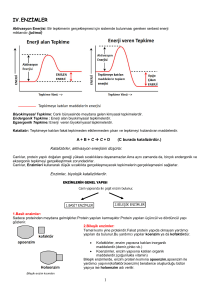
ENZİMATİK ANALİZ VE AKTİVİTE TAYİNLERİ • Enzim Tanımı • Sınıflandırma • Üç Boyutlu Yapı • Etkime Şekli Enzimler biyolojik katalizörlerdir, yani biyokimyasal reaksiyonları hızlandıran biyolojik kökenli maddelerdir. Hemen hemen tüm enzimler protein yapıdadır. Enzimlerin en önemli özellikleri: katalitik etkinlik, spesifiklik ve regülasyondur. Katalitik etkinlik • Enzimler reaksiyonları yaklaşık 1 milyon kat hızlandırırlar. Normalde biyolojik sistemlerde bu reaksiyonlar gerçekleşir, fakat çok daha yavaş bir şekilde… • Bilinen en hızlı enzim karbonik anhidraz saniyede 105 CO2 molekülü bağlayabilir (dokulardan kana CO2 taşır). Reaksiyonu 107 kat hızlandırır. Spesifiklik Regülasyon SINIFLANDIRMA • Bilinen tüm enzimler hem reaksiyon özgüllükleri hem de substrat özgüllükleri dikkate alınarak “ Enzim Komisyonu (E.C.) ” tarafından 6 Temel sınıfa ayrılmıştır. 1. Oksidoredüktazlar 2. Transferazlar 3. Hidrolazlar 4. Liyazlar 5. İzomerazlar 6. Ligazlar Enzimler şu şekilde numaralandırılmaktadır: W X Y Wà 6 büyük sınıf X à Alt sınıflar Y à Alt-alt sınıf Z à Enzimin seri numarası Z Laktat dehidrogenaz (1.1.1.27) 1.1.1.27 Oksidoredüktaz CH-OH grubu elektron donörü NAD(P)+ elektron alıcısı Seri no Üç boyutlu yapı? Üreaz (EC 3.5.1.5) Her enzimin en yüksek aktivite gösterdiği bir optimum pH değeri vardır. Her enzimin en yüksek aktivite gösterdiği bir optimum sıcaklık derecesi vardır. GENEL REAKSİYON: Enzim (E), reaksiyonda değişikliğe uğrayacak madde(ler) (Substrat, S) ile reaksiyona girer, reaksiyon tamamlandığında ürün (Ü)(ler) oluşurken enzim tekrar ilk şekline döner. E + S D ES " Ü1 + Ü2 + E Enzimlerin • • • • • • Varlıklarını Etkinliklerini Dokuda/hücrede bulundukları yeri Kataliz mekanizmasını Miktarlarını Saflıklarını belirlemenin en etkin yolu; AKTİVİTE ÖLÇÜMÜDÜR. ENZİM AKTİVİTESİNİN ÖLÇÜLMESİ ve HESAPLANMASI Enzimlerin doku ve hücrelerdeki konsantrasyonu son derece düşük olduğundan miktarlarını ölçmek çok güçtür. En iyi ölçme yöntemi enzimin katalitik aktivitesini ölçmektir. UV-­‐VIS ABSORPSİYON SPEKTROFOTOMETRİSİ FLUORESANS SPEKTROFOTOMETRİSİ RADYOAKTİF YÖNTEMLER SPEKTROFOTOMETRİK YÖNTEMLERLE ENZİM AKTİVİTESİNİ ÖLÇMEK: Belli bir zaman aralığında enzimin kataliz etkinliği sonucu oluşan DEĞİŞİMİ saptamaktır. ÜRÜN OLUŞUMU Enzim miktarı, genelde, enzim konsantrasyonu ile doğru orantılı olarak meydana gelen ürün miktarı ölçülerek saptanır. SUBSTRAT EKSİLMESİ Başlangıç Hızı "Initial rate": vo • Aktivite ölçümü, henüz reaksiyon hızında bir düşmenin olmadığı kısa zaman aralığında yapılır. Bu dönemde güvenilir bir ölçüm için: • Enzim ve substrat derişimi reaksiyonun optimum hızda gerçekleşmesine yetecek şekilde ayarlanmalı, • Sıcaklık kontrol altında tutulmalı, • Ölçüm yapılan karışımın homojen olması sağlanmalı, • Çok sağlıklı yapılmalıdır. kör ve kontrol ölçümleri KÖR (BLANK) Çalışılan dalga boyundaki ışını absorplayacak maddeyi içermeyen reaksiyon ortamı KONTROL(LER) Reaksiyon ortamındaki etkinliği şüpheli olan bileşenler (ör. Koenzimler) Reaksiyonun başında değişim DOĞRUSAL, sonra ürün oluşumunda meydana gelen azalma nedeniyle doğrusallık bozulur. NEDENLERİ: • Substratın tükenmesi (Substrat bitince reaksiyon durur. Ölçüm sırasında bitmemesi için yüksek substrat konsantrasyonunda çalışılır.) • İki yönlü reaksiyonlarda dengeye yaklaşılması (Reaksiyonun geri dönmesi ile üründen substrat oluşmaya başlar. Bunu önlemek için ürün ortamdan uzaklaştırılır. Ortama, ürünü substrat olarak kullanacak 2. bir enzim veya bağlayacak bir madde eklenir.) • Ürün İnhibisyonu (Ürün enzimi inhibe ediyorsa aktivite kaybolur. Bu nedenle ürün ortamdan uzaklaştırılır.) • Enzimin veya reaksiyon bileşenlerinin (substrat, kofaktörler, aktivatörler, reaktifler) stabilitesini kaybetmesi (Her bir bileşenin stabilitesi ön deneylerle saptanmalıdır.) • pH değişimi (Reaksiyon sırasında hızlı bir pH değişimi meydana geliyorsa bu da aktiviteyi hızla düşürür. Ortam çok iyi tamponlanmalı, reaksiyonun başında ve sonunda pH kontrolü yapılmalıdır.) İŞLEMLER • Spektrofotometre ölçümden 10-­‐15 dak önce çalıştırılır; çalışma ortamının sıcaklığı ayarlanır; doğru ve temiz küvetler seçilir. • Reaksiyonu başlatacak bileşen hariç diğer tüm bileşenler küvete (çift ışınlı aletlerde her iki küvete) konulur. Alet sıfırlanır ("Auto-­‐Zero"). • Reaksiyonu başlatacak bileşen eklenir ve etkin bir şekilde karışması sağlanarak ölçüm yapılır. TEKNİK OLARAK DİKKAT EDİLECEK NOKTALAR • Yüksek Km değeri söz konusu ise aktivite ölçümünde substrat konsantrasyonu yüksek tutulmalıdır. • Olanaklar el verdiği ölçüde saf enzimle çalışmakta yarar vardır. • Çözelti şeklinde saklanan enzimlerde zamanla aktivite kaybı olacağı unutulmamalıdır. Liyofilize halde saklamak daha elverişlidir. • Ölçümlerde kullanılan kimyasalların saf olması şarttır. Kalite ne kadar yüksek olursa, hata payı o kadar azalır. • Cam eşyaların temiz olması, deterjan artığı bulunmaması, saf suyun yüksek kalitede olmasına özen gösterilmelidir. • Reaksiyon karışımına katılacak maddelerin pH'ları elverişli olmalıdır. ENZİM AKTİVİTESİNİN HESAPLANMASI: Birimler ve Spesifik Aktivite Absorpsiyon (Ekstinksiyon) Katsayısı Spektrofotometrik ölçümün dayandığı Beer-­‐Lambert yasasına göre Absorbans (A; ya da Optik Dansite, O.D.), absorpsiyon yapan maddenin derişimi (c) ve ışının katettiği yol (d) ile doğru orantılıdır: Buna göre: A=ελcd A c = ελ A c = ε λd 1 cm old. A=ελcd 1M 1 cm Derişimi 1 M olan bir kromoforun ışık yolu 1 cm olan bir spektrofotometrede ortaya koyduğu absorbans Molar Absorpsiyon (Ekstinksiyon) Katsayısı (ελ) olarak tanımlanır. Birimi M-­‐1cm-­‐1 'dir. (lmol-­‐1cm-­‐1 veya mmol-­‐1cm2 'ye eşdeğerdir) cm2mol-­‐1 (M-­‐1cm-­‐1'in 1000 katı) olarak da ifade edilir Bu durumda hesaplanan derişimin (c'nin) birimi M (mol/l)'dır. Enzim Aktivitesinin Tanımlanması Bir enzimin aktivitesini çeşitli biçimlerde ifade etmek mümkündür: Örneğin, • Birim zamanda enzim tarafından meydana getirilen absorbans değişimi: (dA/dt) • Ancak daha standart bir birim olan "International Unit", IU) ÜNİTE (U; daha geniş kullanım alanı bulur. Buna göre 1 Ünite Enzim, 1 dakikada 1 µmol ürünün oluşumunu (veya 1 µmol substratın dönüşümünü) katalizleyen enzim miktarıdır (U= µmol /dak). Deneysel Ölçümlerin Üniteye Dönüştürülmesi Örnekteki Enzim V x dA/dt x 1000 x sulandırma faktörü t Ünitesi = ελ vs x d Vt = Reaksiyon karışımının toplam hacmi (ml) dA/dt = dakikada Absorbans değişimi (dak-­‐1) ελ = Absorpsiyon katsayısı (cm2mol-­‐1) Vs = Reaksiyon ortamına katılan örnek (enzim) hacmi (ml) D = küvetteki ışık yolu (genellikle 1 cm) 1000 çarpanı enzimi µmole çevirmek içindir. SPESİFİK AKTİVİTE = U/mg protein Saf bir enzimin spesifik aktivitesi sabittir ve o enzime özgü bir değerdir. Bu aktivite birimi, enzimin saflığını tanımlayan bir ölçüttür. Ham özütlerde protein derişimi yüksektir. Dolayısıyla ilgilenilen enzimin spesifik aktivitesi DÜŞÜK çıkar. Enzimi SAFLAŞTIRDIKÇA spesifik aktivitesi YÜKSELİR.