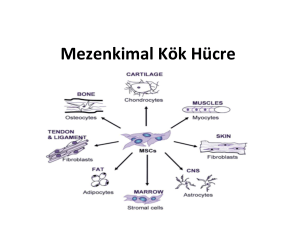
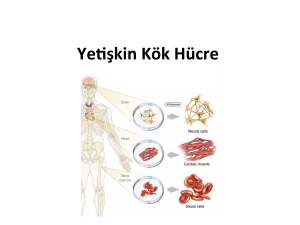
2.5.2.1.2 Mezenkimal Kök Hücre (MKH)
advertisement

1.GİRİŞ VE AMAÇ Kök hücreler, kendini yenileme özelliğine sahip, vücut içinde veya laboratuar ortamında uygun şartlar sağlandığında birçok değişik hücre tipine dönüşebilen farklılaşmamış hücrelerdir. Özellikle insan embriyonik kök hücreleri yeni ilaç tasarımı deneylerinde, ilaç toksisitesinin araştırılmasında ve erken embriyonik gelişim çalışmalarında model olabilecek hücrelerdir. Embriyonik kök hücrelerin farklılaşabilme özelliklerinden yararlanılarak doku hasarında daha hızlı iyileşmenin sağlanması veya sinir hücresi gibi hasarlandıktan sonra yerine konması mümkün olmayan hücrelere farklılaştırılarak tedavide kullanılması son yıllardaki en önemli araştırma konularındandır. Embriyonik kök hücreler hemen her hücre tipine farklılaşabilme potansiyeline sahipken yetişkin dokulardaki kök hücreler tipik olarak sadece sınırlı sayıda hücre tipini (retina, akciğer, kalp kası, iskelet, kas, bağırsaklar, böbrek, dalak, kemik iliği, kan, deri) şekillendirirler. Yetişkin dokulardaki kök hücreler üzerindeki en kapsamlı çalışmalar immun sistem ve kan yapımını sağlayan hematopoietik kök hücreler üzerinde gerçekleştirilmiştir. Hematopoietik progenitör hücre kaynağı olarak kemik iliği, periferal kan ve göbek kordonu kanı hayati öneme sahiptir. Bu gün tedavisi mümkün görünmeyen hastalıkların birçoğu, yaşam için vazgeçilmez olan bazı hücre-doku ve organların, normal yapı ve işlevlerine döndürülmeyecek şekilde hasarlanmış olması sonucudur. Örneğin; Tip 1 diabetes mellitus’da pankreasta insülin salgılayan beta hücrelerinin, Parkinson hastalığında beyinde dopamin salgılayan sinir hücrelerin hasarı söz konusudur. Alzheimer, Multiple skleroz (MS), Amniyotrofik lateral sklerozis (ALS), omurilik zedelenmesi, Purkinje hücre bozunumu-hasarlanması, Duchenn’s kas distrofisi gibi birçok hastalığın tedavisini sağlamak amacıyla araştırmacılar çalışma yapmaktadır. Bu çalışmaların sonucunda tıpta yeni bilim dalları doğmuştur. Bu bilim dallarından biri olan rejeneratif tıpta; hasar gören hücre-doku veya organların biyolojik işlevlerini yerine koymak amacıyla çalışmalar yapılmaktadır. Bu bilim dallarından diğeri olan reperatif tıpta ise hasar gören hücre-doku veya organların tamiri üzerine çalışmalar yapılmaktadır. Bir hedef doku veya organa, o organın işlevlerini eski haline getirmeye yetecek kadar sayıda ve kalitede izole edilmiş ve özellikleri belirlenmiş olan hücrelerin nakledilmesiyle reperatif ve rejeneratif tıpta ilerlemeler mümkün olabilir. Bu amaca hizmet edebilecek yani hücre tabanlı tedavide kullanılabilecek başlıca elemanlar kök hücreler olarak görünmektedir. Son zamanlarda, Avrupa’da kök hücreler ile ilgili olarak yürütülen çalışmalarda nörolojik bazı hastalıklar, kök hücrelerle tedavi edilebilir mi sorusuna yanıt aranmaktadır. Bu çalışmaların hedefi kök hücre üretim zincirleri kurulması ve nöron hücrelerinin üretilerek Parkinson hastalarının rutin şekilde tedavi edilmesi olarak planlanmıştır. Diğer yandan diyabet tedavisinde kök hücrelerin kullanımı ile ilgili olarak yürütülen çalışmalarda ise pankreasta beta hücrelerinin yeniden yapılmasının ve bu hücrelerin yeniden insülin üretmesinin sağlanması amaçlanmıştır. Bir diğer çalışma alanı ise hasarlanmış kalp dokusunun tamiri için kök hücrelerin kullanımıdır. Tedavi imkanı olmayan bazı hastalar için gönüllü insanlar üzerinde kök hücre nakli ile sınırlı sayıda klinik çalışma yapılmaya başlanmış olmakla birlikte bu tedavi şekli henüz klasik rutin tedavi metotları arasına girmemiştir. Ancak bu kök hücre nakli konusu dünyada giderek daha büyük önem kazanmakta ve bu alandaki veriler de gün geçtikçe netleşmektedir. Gelecek yüzyılın kök hücre nakillerinin organ nakillerinin yerini aldığı 2 ve kök hücre bankacılığının yaygınlaştığı bir yüzyıl olacağı öngörülmektedir. Bu çalışmada, kök hücrelerle ilgili yapılmış yayınlar derlenerek eczacılara bu yeni tedavi metodu konusunda önemli bir kaynak sunulması amaçlanmıştır. Kök hücrelerin çeşitleri, proliferasyonları, differansiasyonları, nasıl etki ettikleri ve hangi hastalıklarda kullanıldıkları ayrıntılı olarak araştırılmıştır. Çalışma hazırlanırken, immunoloji kitaplarından, kök hücre konusunda yazılmış Türkçe kitaplardan ve kök hücrelerle ilgili yapılmış ulusal ve uluslar arası çalışmalardan yararlanılmıştır. Kök hücrelerin, iskemik kalp hastalığı, graft-versus-host hastalığı, myokard infarktüsü, diabetes mellitus, romatoid artrit, sistemik lupus eritematozis, amniyotrofik lateral sklerozis, felç ve myastenia gravisde kullanımları tartışılmıştır. Sonuç olarak, kök hücrelerin eldesi ve çeşitli hastalıkların tedavisinde kullanımı ile ilgili güvenilir, sağlam ve bilimsel bir kaynak sadece eczacıların değil tüm sağlık personelinin hizmetine sunulması amaçlanmıştır. 3 2. GENEL BİLGİLER 2.1 KÖK HÜCRE NEDİR Kök hücreler, kendini yenileme özelliğine sahip, vücut içinde veya laboratuar ortamında uygun şartlar sağlandığında birçok değişik hücre tipine dönüşebilen farklılaşmamış hücrelerdir (Sağsöz H & Kaetani MA, 2008). 2.2 KÖK HÜCRELERİN GENEL ÖZELLİKLERİ Kök hücreler uzun zaman dilimleri boyunca bölünebilir ve kendilerini yenileyebilirler. Kök hücreler çok sayıda bölünebilir ve çoğalabilirler. Tekli hücrelerden elde edilen embriyonik kök hücre serileri 300-400 döngü boyunca çoğalabilirler. Eğer sonuçta ortaya çıkan hücreler de ebeveyn hücreleri gibi özelleşmemişse, bu hücreler uzun dönemde kendilerini yenileyebilme kabiliyetine sahiptirler. Hücrelerin bölünme kapasitesini ve ömrünü belirleyen faktörlerden biri kromozom ucundaki telomerlerdir. Telomerler, kromozom uçlarının parçalanmasını ve dağılmasını ya da diğer kromozomlarla kaynaşmasını engelleyerek, kromozomların yapısal bütünlüğünün korunmasını sağlar. Normal bir hücrenin her bölünüşünde telomer boyu yaklaşık 100 baz çifti kadar kısalır. Telomeraz ise telomer boyunun sabit kalmasını sağlayan enzimdir. Mezenkimal kök hücreler gibi bazı nadir rastlanan kök hücrelerde, telomeri sabit bir uzunlukta tutmaya yetecek seviyede telomeraz üretimi olmaktadır (Karaöz E & Ovalı E,2004). 4 Kök hücreler özelleşmemiş hücrelerdir, özelleşmiş hücrelere kaynaklık ederler. Kök hücreler, kalp kasında olduğu gibi kanı vücuda pompalamak için komşularıyla çalışamaz, kırmızı kan hücreleri gibi oksijeni dokulara taşıyamaz, sinir hücreleri gibi doku ve organlara gerekli olan elektrokimyasal sinyalleri iletemez. Fakat özelleşmemiş kök hücreleri, kalp kası hücreleri, kan hücreleri veya sinir hücreleri gibi özelleşmiş hücrelere kaynaklık edebilir ve onlara dönüşebilir (Karaöz E & Ovalı E, 2004). Kök hücreler hasarlanmış dokuları tamir edebilme yetenekleri vardır. Kök hücreler vücutta uygun niş bölgelerinde bulunur ve hasarlanmış dokuya yakındaki nişten göç ederek ulaşırlar. Niş, hücrenin dışındaki mikro çevredir. Nişi oluşturan hücre dışı matriks bileşenleri, komşu hücreler ve salgı proteinleri niş içindeki kök hücre sayısını kontrol altında tutarlar. Hümoral, metabolik, fiziksel, nöral ve parakrin etmenler, kök hücre nişleri üzerinde etkili olmaktadır (Can A & Karahüseyinoğlu S, 2009). Niş üzerine gönderilen mesajlar sonucu belli yolaklar ve moleküler mekanizmalar devreye girmektedir. Bunun sonucunda, kök hücre bölündüğünde kendine benzer iki hücre veya farklılaşmış iki hücre oluşturabildiği gibi, kendine benzer bir hücre ve farklılaşmış bir hücre de oluşturabilmektedir (Akar AR, 2009). Deneysel olarak santral sinir sistemi hipoksisi oluşturulmuş farelerin nörovasküler nişlerinde yer alan kök hücrelerin uzun süre hayatta kalabildiği ve çoğaldığı gösterilmiştir. Bu etkinin BDNF, VEGF ve SDF-1 gibi moleküllerin otokrin ve parakrin etkileri aracılığıyla olduğu belirlenmiştir (Madri JA, 2009). 5 Kök hücreler doku hasarının olmadığı durumlarda dahi özelleşmiş hücrelere katkı sağlamaktadırlar Hasarlanmış dokuya yakındaki niş bölgelerinden kök hücrelerin göç ettiği yapılan çalışmalarla gösterilmiş, aynı zamanda hasarlanma olmadığında dahi bu hücrelerin organların çalışmasına katkı sağlamak üzere onları pozitif yönde destekleyici kemokinler ürettiği de son zamanlarda gündeme gelmiştir. 2.3 KÖK HÜCRE TARİHÇESİ Kök hücrenin tarihçesi mitolojide ateşi Olimpos Dağından, tanrılardan çalarak insanlığa hediye etmesi üzerine Zeus tarafından cezalandırılan Prometheus’un hikayesi ile başlar. Zeus tarafından Kafkas Dağında bir kayaya bağlanarak karaciğerinin her gün bir kartal tarafından yenmesi şeklinde bir cezaya çarptırılan Prometheus’ un karaciğeri her gün kendisini yenilemektedir. Bu, karaciğer hücresinin rejenerasyon yeteneği ve dolayısı ile kök hücre kavramını ortaya koyan ilk hikayedir (Şahin F ve ark., 2005). Tablo 2.1. Kök hücrelerin tarihçesi 1868 İlk kök hücre teriminin kullanılması (Ernst Haeckel) 1939 Dünyada ilk kez aplastik anemili bir hastada kök hücre nakli yapılması ancak başarısız olunması (Osgood ve ark.) 1959 İlk başarılı kemik iliği naklinin yapılması (E Donnall Thomas) 1963 Kordon kanının ilk kez deneysel tedavi amaçlı kullanımı gerçekleştirilmesi (Ende M) 1968 Dünyada ilk başarılı allojenik kök hücre nakli yapılması (Gatti ve ark.) 1970 İlk olarak kemik iliğinden kök hücre toplanması işlemi (E. Donnall Thomas) 6 1973 Ülkemizde ilk hücre tedavisinin uygulanması (Dr Süreyya Tahsin Aygün) 1976 Mezenkimal kök hücrelerin ilk olarak tanımlanmsı (Friedenstein) 1978 Dünyada ilk başarılı otolog kök hücre naklinin yapılması (Appelboum ve ark.) 1979 İlk uyumlu akraba dışı kemik iliği naklinin gerçekleştirilerek, akraba dışı gönüllü verici bankalarının kurulması gerekliliğini ortaya konulması (Hansen) 1981 Embriyonik kök hücrelerin ilk kez, 3-5 günlük fare blastosistlerinin iç hücre kitlesinden elde edilmesi (Evans ve Kaufman) 1984 Türkiye’ de ilk otolog kök hücre naklinin yapılması 1985 Türkiye’ de ilk allojenik kök hücre naklinin yapılması 1988 İlk başarılı kordon kanı kök hücre transplantasyonun Fankoni Anemili bir çocuğa yapılması (Gluckman E. ve ark.) 1992 Dr. David Harris, oğlunun kordon kanını kendi laboratuarında dondurarak dunyadaki ilk ozel kordon kanı bankacılık sistemini başlamasına onculuk etmesi 1994 Dünyadaki ilk Kordon Kanı Bankasının Amerika Birleşik Devletleri'nde kurulması. 1996 Somatik çekirdek transferiyle ilk memeli türünün (Dolly) klonlanması (Campbell vd.) 1998 İnsan embriyonik kök hücre dizilerinin laboratuvarda ilk olarak türetilmesi (Thomson ) 2000 İnsan embriyonik kök hücrelerinin pluripotent olduğunun anlaşılması 2006 Tek blastomerden insan embriyonik kök hücre dizilerinin oluşturulması (Lanza ve ark..) 2.4 KÖK HÜCRELERİN FARKLILAŞMASI A) Totipotent 7 Döllenmiş yumurta tek bir hücre olmakla birlikte, vücut sistemlerini meydana getirecek bütün hücreler bu tek hücreden çoğalırlar. Bu döllenmiş yumurta hücresine totipotent hücre denir. Totipotent hücreler tam bir bireyi oluşturacak kapasiteye ve sınırsız farklılaşma yeteneğine sahiptirler (Sağsöz H & Ketani MA, 2008). Embriyo, embriyo sonrası tüm doku ve organlar ile embriyo dışı membranların ve organların kaynağını oluşturan kök hücre tipleridir (Kansu E, 2005). B) Pluripotent Döllenmenin 5. gününden itibaren ve birkaç hücre bölünmesinden sonra totipotent hücreler farklılaşmaya başlayarak blastosist denilen içi boş bir küreye dönüşürler. Pluripotent hücreler blastositin iç hücre tabakasından köken alırlar ve üç embriyonik germ tabakasından (mezoderm, endoderm ve ektoderm) oluşan hücreleri meydana getirirler. Bu üç germ tabakası bütün vücut hücrelerinin embriyonik kaynağıdır. Bu yüzden pluripotent hücrelere embriyonik kök hücreler de denilmektedir. Pluripotent kök hücreleri erken gelişim döneminde bulunurlar. Organizmada birçok dokunun oluşmasına kaynaklık etmelerine rağmen yeni bir birey oluşturamazlar (Sağsöz H & Ketani MA, 2008; Sargın D, 2003). 8 blastosit kültürde üretilmiş embriyonik kök hücreler ektoderm saç, retina embriyonik gangliyon sinir sistemi yassı epitel hücreleri endoderm akciğer karaciğer pankreas barsak endotel hücreleri mezoderm iskelet kıkırdak kemik düz kas çizgili kas kan hücreleri Şekil 2.1. Blastosistten vücut hücrelerinin oluşması İndüklenmiş pluripotent kök hücre (iPSC) ler yetişkin hücrelerdir. Son iki yılda yapılan tanımlamalar, dışarıdan yapılan müdahaleler ile transkripsiyonel faktörlerin insan somatik hücrelerini pluripotent olarak tekrar programlayabildiğini göstermektedir. Bu tekrar programlanmış pluripotent hücreler, indüklenmiş pluripotent kök hücreler olarak tanımlanmıştır. iPSC’ ler sınırsız yenilenme kapasitesi olan embriyonik kök hücrelere benzemektedirler. Fare iPSC leri ilk olarak 2006’ da, insan iPSC leri ise ilk olarak 2007’de rapor edilmiştir. Sonuç olarak bu hücreler rejeneratif tıp için önemli bir kaynaktır (Sun N ve ark., 2010; http://stemcells.nih.gov/info/basics/basics10, 2010). 9 İnsan hücreleri için iPSC ile tedavi yöntemi, temel olarak belirli genlerin ifadesinden sorumlu transkripsiyon faktörlerinin hücreye aktarılması prensibine dayanmaktadır. Pluripotensten sorumlu transkripsiyon faktörler olan Oct3/4, Sox2, Klf4 ve c-Myc proteinleri (ayrıca, Nanog ve Lin28) bu yönde belirlenmiş yeniden programlama etkenleri olarak tanımlanmaktadır. Bu genlerin aktarımında ilk defa virüsler taşıyıcı (vektör) olarak kullanılırken; yakınlarda ise viral olmayan gen taşıyıcıların iPSC oluşturmada kullanılabildiği rapor edilmektedir (Elçin YM, 2009). Şekil 2.2. Pluripotens genlerinin erişkin hücrelere aktarılarak embriyonik kök hücre-benzeri pluripotent kök hücrelerin türetilmesinin şematik gösterimi (Elçin YM, 2009) 10 C) Multipotent Pluripotent hücrelerden daha sınırlı sayıda hücre tipine dönüşebilen ve tek bir yönde farklılaşmak üzere programlanmış hücrelerdir. Multipotent kök hücreleri çocuklarda ve yetişkinlerde daha fazla bulunabilmektedir (Sağsöz H & Ketani MA,2008). Şekil 2.3: Multipotent kök hücreler (http://www.istemcelli.com/multipotent.html) 11 2.5 KÖK HÜCRELERİN KAYNAKLARI 12 KÖK HÜCRELER NON EMBRİYONİK KÖK HÜCRELER Erişkin kök hücreleri EMBRİYONİK KÖK HÜCRELER Fetus kök hücreleri Kadavra kök hücreleri Şekil 2.4. Kök hücrelerin kaynakları 2.5.1 Embriyonik Kök Hücre (EKH) EKH’ ler embriyo gelişiminin erken safhalarında bulunan, pluripotent özellik gösteren, yani her hücre tipini oluşturabilen ve kendini yenileme yeteneği olan hücrelerdir. Bu hücreler başlıca iki dokudan elde edilebilir: blastosistlerin iç hücre kitleleri ve mezenter bölgesindeki primordial germ hücreleri. Elektif abortus kaynaklı insan fetus dokularından elde edilen primordial germ hücrelerinin kültürleri yapılarak elde edilen hücrelere, kökenlerini belirtmek amacıyla Embriyo Germ Hücreleri adı verilmiştir. (Kara MA, 2004). EKH’ ler, in vitro fertilizasyon yolu ile üretilen embriyolardan da 13 elde edilebilir Fertilizasyondan sonra içi sıvı dolu küre şeklindeki blastosist yapısı bir dış hücre tabakası bir de iç hücre kitlesinden oluşur. Dış hücrelerden trofoektoderm ve daha sonra da plasenta ve diğer destek dokuları meydana gelmektedir. Blastositin içinde yer alan hücreler ise vücuttaki tüm dokuları meydana getirecektir. O nedenle içte bulunan bu hücreler pluripotenttirler. Kendini yenileme ve her üç germ tabakasının da hücrelerine farklılaşabilme yetenekleri nedeniyle bu hücrelerin rejeneratif tıpta kullanılabilmeleri umudu doğmuştur (Özel HB ve ark., 2008). EKH’ler pluripotent hücre populasyonundan elde edilmiş olmalı, genetik olarak diploid yapıda olmalı ve yapısı da stabil olmalıdır. Primitif embriyonik durumunda sonsuz miktarda çoğaltılabilmeli ve kültürde uzamış pasajları takiben normal karyotiplerini korumalıdırlar. İn vitro uygun koşullar altında 3 germ yaprağının çeşitli hücre tiplerine, alıcı blastosistte kolonize olduğunda da vücuttaki herhangi bir hücre tipine farklılaşabilmelidirler. Farklılaşmamış EKH’ ler farklı morfolojileri ve memeli pluripotent hücrelerine özel, moleküler belirteçlerin ekspresyonuyla karakterizedirler. İnsan EKH’ lerinde en sık kullanılan yüzey belirteçleri glikolipid antijenler olan SSE A3 ve SSE A-4, proteoglikanlar ise Tra 1-60 ve Tra 1-81’dir. Yüzey belirteçlerine ek olarak bazı transkripsiyon faktörlerinin ekspresyonu da EKH’ lere ait bir özelliktir. Bunlardan Oct-4 en iyi bilinen ve en çok kullanılanıdır. Blastosist dönemindeki embriyonun iç hücre kitlesinde eksprese olur ve farklılaşma süreci boyunca azalır. Daha sonra Nanog denilen bir homeoproteinin de özellikle farklılaşmamış EKH’ ler de var olduğu ve farede pluripotent iç hücre kitlesi hücrelerinin oluşumu için gerekli olduğu bulunmuştur. Farklılaşmamış fare EKH’ leri SSEA-3 ve SSEA-4’u eksprese etmezler, 14 fakat glikolipid SSEA-1’i eksprese ederler. Tra1-61 ve Tra1-81 de fare EKH’ lerin de gözlenmemiştir ( Özel HB ve ark., 2008). Tablo 2.2. Embriyonik kök hücrelerin yüzey belirteçleri ve transkripsiyon faktörleri Yüzey belirteçleri SSE A-1 Glikolipid antijenler SSE A-3 EKH SSE A-4 Proteoglikanlar Tra 1-60 Tra 1-81 Transkripsiyon faktörleri Oct-4 Nanog EKH Hem fare hem insan EKH lerinde var Hem fare hem insan EKH lerinde var Hem fare hem insan EKH lerinde var Fare EKH lerinde yok Fare EKH lerinde yok Hem fare hem insan EKH lerinde var Hem fare hem insan farklılaşmamış EKH lerinde var Farklılaşmış fare ve insan EKH’ leri tarafından eksprese edilir Farklılaşmamış fare EKH’ leri tarafından eksprese edilmez Farklılaşmamış insan EKH’ lerinde pozitiftirler Embriyonik hücrelerin farklılaşmasını inhibe eder Oct-4 le birlikte hücrelerin farklılaşmış düzeyde kalmalarını sağlar. Çeşitli büyüme faktörlerinin etkisi de embriyonik kök hücreler üzerinde denenmiştir. Sonuç olarak etkilerine göre mezodermal hücrelere farklılaşmayı uyaran faktörler (TGFβ-1); ektodermal ve mezodermal indüksiyon yapan faktörler (retinoik asit, EGF, bFGF) ve tüm germ tabakalarına (NGF, HGF) indüksiyon sağlayan faktörler olmak üzere üç gruba ayrılmışlardır (Can A & Karahüseyinoğlu S, 2009). Özellikle insan embriyonik kök hücreleri yeni ilaç tasarımı deneylerinde, ilaç toksisitesinin araştırılmasında ve erken embriyonik gelişim çalışmalarında model olabilecek hücrelerdir (Sökmensüer L & Karakoç L, 2007). 15 Embriyonik kök hücreler ilk kez 1981 de, 3-5 günlük fare blastosistlerinin iç hücre kitlesinden elde edilmiştir (Kaufman MH ve ark., 1983.). Oluşturulan ilk insan embriyonik kök hücresi 1998 yılında bir in vitro fertilizasyon kliniğinde kullanılmayan zigotlardan izole edilmiştir. Thomson ve arkadaşları ilk kez insan blastosistinden türetilmiş pluripotent hücre hatlarını normal karyotip olarak tanımlamış, telomeraz aktivitesinin yüksek seviyede olduğunu açıklamışlar ve her üç embriyonik germ yaprağı türevleri oluşturmak için korunmakta olduklarını bildirmişlerdir (Thomson JA ve ark., 1998). Morfolojik olarak, insan EKH’ leri yüksek çekirdek-sitoplazma oranına sahiptirler, her hücrelerinde tipik olarak bir ya da daha fazla belirgin çekirdekçik bulunur (Türkşen K,2006). Layden ve arkadaşları embriyonik gelişmede önemli bir rolü olduğu düşünülen Gproteine bağlı reseptör (GPCRs) ailesinin EKH’ lerdeki etkisini araştırmışlardır. Deneysel olarak farelerde yaptıkları çalışmada, GPCRs ailesinin en büyük α alt gruplarından biri olan Gs-α sinyal reseptörü expresyonunu incelemişler ve Gs-α sinyallerinin EKH ploriferasyonuna ve pluripotensine katkıda bulunduğunu göstermişlerdir (Layden BT ve ark., 2010). 2.5.1.1 Embriyonik Kök Hücre Elde Etme Yöntemleri Blastosist iç hücre kitlesinden embriyonik kök hücre eldesi mekanik veya immunocerrahi izolasyon yöntemiyle yapılmaktadır. İmmunocerrahi izolasyonda blastosist zona pellusidası pronaz enzimiyle eritildikten sonra fare veya insan embriyosu insana veya fareye karşı geliştirilmiş serum 16 antikorlarıyla inkübe edilmektedir. Antikorun blastosist içine geçişi trofoblast hücrelerinin hücre-hücre bağlantılarıyla engellenmekte ve iç hücre kitlesine antikor teması olmamaktadır. Antikor yıkandıktan sonra blastosist kompleman içeren solusyon içine alınıp hücre lizisi belirgin hale gelinceye kadar inkübasyon yapılır. İnaktive olmuş iç hücre kitlesi mitotik olarak inaktive edilmiş fare embriyonik fibroblastları üzerinde kültür yapılır. Mekanik izolasyonda ise embriyonik kök hücre dizileri kültürdeki blastosistlerin direkt mekanik diseksiyonu ve trofoblast tabakasının iğne ile kısmi uzaklaştırılması veya zonasız embriyoların doğrudan mitotik olarak inaktive edilmiş fibroblastlar üzerine yerleştirilmesiyle elde edilmektedir. Trofoblast hücreleri uzaklaştırılmadığında veya kısmen çıkarıldığında iç hücre kitlesi trofoblastlarla birlikte tek tabaka halinde büyür. İç hücre kitlesi yeterli büyüklüğe ulaştığında, ayrılarak kültüre edilir. Fibroblastlar üzerinde çoğalan embriyonik kök hücre kolonileri iki-üç günde bir pasajlama yapılarak yeni kültür kaplarına ekim yapılır. Elde edilen bu embriyonik kök hücreler uygun kültür ortamında farklılaşmadan çoğalabilir ve altı ay-bir yıl kadar pluripotent özelliklerini koruyabilir. Karyotip olarak normal olduğu gösterilmiş bu hücrelere embriyonik kök hücre dizileri adı verilir (Sökmensüer L & Karakoç L,2007). İlk çalışmalarda elde edilen insan embriyonik kök hücre dizileri immünocerrahi izolasyon metodu kullanılarak elde edilmiştir. Daha sonra gerçekleştirilen bazı çalışmalarda ise doğrudan kültür metodu kullanıldığı ve bu tekniğin en az immünocerrahi tekniği kadar verimli olduğu bildirilmektedir. Kullanılan embriyo kaynağı ve insan embriyonik kök hücre dizisi eldesi yönünden bakıldığında kaynağın kalitesine göre her iki metodun da uygulanabildiği yaklaşımlar başarı şansını 17 arttırabilmektedir. Diğer taraftan, klinik kullanıma uygun insan embriyonik kök hücresi elde edilmesi yönünden değerlendirildiğinde doğrudan kültür yönteminin hayvan kaynaklı komplement sistem proteinleri ve antikorların kullanıldığı immünocerrahi yöntemine göre avantajlı olduğu aşikardır. Her iki yöntemde de kullanılan embriyo kaynağına ait tüm hücrelerin ayrıştırılmasını gerektirmekte ve bu işlem sonrasında embriyonun implantasyon özelliğini kaybetmesine neden olmaktadır. Dünya genelinde etik açıdan yoğun tartışmaların yaşanmasına neden olan bu durum, özellikle insan yaşamının embriyo aşamasında başladığı görüşünü savunan toplumlarda ciddi olarak tepki görmektedir. Bu problemin ortadan kaldırılması amacıyla günümüzde iki temel yaklaşım denenmektedir. Bunlardan ilki embriyo biyopsi yöntemi ile embriyodan hücre alınması ve alınan hücrelerin in vitro şartlarda insan embriyonik kök hücresi eldesi amacıyla büyütülmesi, ikincisi ise somatik hücrelerin mevcut insan EKH’ leri ile füzyonu ve sonrasında somatik hücrelerin EKH özelliği kazanmasının sağlanmasıdır (Fındıklı N, 2009). 2.5.1.2 Embriyonik Kök Hücrelerin Farklılaşması Uygun kültür ortamı sağlandığında embriyonik kök hücreler farklılaşmadan çoğaldıkları gibi, ortamın değiştirilmesi ile bu hücrelerin farklılaşması da sağlanabilir. Embriyonik kök hücrelerin farklılaşabilme özelliklerinden yararlanılarak doku hasarında daha hızlı iyileşmenin sağlanması veya sinir hücresi gibi hasarlandıktan sonra yerine konması mümkün olmayan hücrelere farklılaştırılarak yara tamirlerinde kullanılması son yıllardaki en önemli araştırma konularındandır (Vatansever S, 2009). 18 Fareler üzerinde yapılan deneysel çalışmalarda EKH’ lerin nöronlara, glia hücrelerine, nöronal kök hücrelere, langerhans adacık hücrelerine, hepatositlere, osteoblastlara ve adipositlere dönüştüğü gösterilmiştir (Özel HB ve ark., 2008). Embriyonun ilk hücresel farklılaşması morulayı oluşturan hücrelerin blastosist hücrelerine farklılaşmasıdır. Morulanın dış tarafında bulunan hücreler sıvı transportunu sağlayan ve blastoselin oluşmasında rol oynayan trofoblast epitel hücrelerine farklılaşırlar. İçte bulunan morula hücreleri ise blastosistin iç hücre kitlesini oluşturur. İç hücre kitlesini oluşturan hücreler pluripotent kök hücreler olup embriyoyu oluşturacak olan tüm dokuların esas kaynağıdır (Vatansever S, 2009). Fare embriyosunda yarılanma dönemi ile birlikte başlayan farklılaşma süreci iç hücre kitlesi ve trofoblast hücrelerinin oluşması ile devam eder. Yaklaşık 32-hücreli olduğunda ise iç hücre kitlesinin farklılaşması başlar. Bu dönem DNA metilasyonu gerçekleşmesi ile somatik hücre farklılaşması ve gastrulasyon süreci ile devam eder. Yaklaşık 4 günlük fare embriyosunda blastosel tarafında bulunan iç hücre kitlesi hücreleri primitif endoderme, iç kısımda bulunan nonpolarize pluripotent 20 kadar hücre ise primitif ektoderme farklılanır. Hücrelerin proliferasyonu 6 günlük embriyoda başlar. 5.5 güne kadar epiblast hücreleri totipotent olarak kalırlar ve iç hücre kitlesi hücreleri gibi alkalen fosfataz, E-kadherin, SSEA-1 ve Oct4 pozitiftir. Bu dönemdeki embriyoda trofoblast hücrelerden ziyade iç hücre kitlesini oluşturan hücrelerde birçok faktör salgılanır. Örneğin embriyonik gelişimin erken dönemlerinde organizasyondan sorumlu integrin beta 1, epiblast hücrelerini apoptozisden koruyan taube nuss veya Smad 2 gibi erken farklılaşmayı önleyici faktörler salgılanır (Vatansever S, 2009). 19 Embriyonik kök hücrelerde nöral hücrelerin farklılaşması bazı büyüme faktörleri tarafından etkilenmektedir. Bir çalışmada, in vitro olarak amniyotik epitelyum hücreler (AECs) den nöral hücrelerin farklılaşması incelenmiştir. Bu çalışmada AEC’leri retinoik asit (RA) ile tek başına ve RA ile temel fibroblast büyüme faktörü (bFGF) birlikte karşılaştırılmıştır. Ayrıca, bu çalışmada, kemik morfolojik protein antagonosti (noggin) nin, AECs’ den nöral hücrelerin farklılaşmasını bloke edip etmediği de araştırılmıştır. Noggin uygulanan bütün kültürlerde daha yüksek seviyede nöral marker ekspresyonu olduğu gösterilmiştir. bFGF ve RA ile kombine uygulamada, nöral markerların yüksek seviyede olduğu görülmüştür. Kültür ortamında serum olmadığı koşullarda hücrelerin yaşayabilme yeteneği azalmış fakat nöral marker ekspresyon oranı artmıştır. Sonuç olarak bu çalışmada, AEC hücrelerindeki nöral farklılaşmanın, bFGF, RA, noggin ve serum gibi bazı faktörlerden etkilendiği gösterilmiştir (Niknejad H ve ark., 2010). Nestin, ilk olarak nöral kök hücrelerde bir marker olarak tanımlanmış, rejenere pankreasın yanı sıra erken embriyonik kök hücre türevlerinde de rapor edilmiştir. Bir çalışmada, nestinin embriyonik kök hücrelerdeki rolü ve yetişkin pankreatik kanal kök hücrelerinde insülin salgılayan beta hücrelerinin neogenezindeki rolü araştırılmıştır. Yetişkin pankreatik kanal kök hücrelerinde nestin ekspresyonunun inhibe edilmesinin pankreatik transkripsiyon faktörleri ve adacık hormonlarının ekspresyonunda düşmeye, beta hücrelerinin gelişmesi ve insülin sekresyonunda zayıflamaya sebep olduğu gösterilmiştir. Bu çalışma, nestinin sadece basit bir kök hücre markeri olmadığını, kök hücre farklılaşması sırasında fonksiyonel bir faktör olduğunu da göstermiştir (Kim SY ve ark., 2010). 20 2.5.2 Non Embriyonik Kök Hücre Embriyonun iç hücre kitlesi dışındaki kaynaklardan elde edilen kök hücreler, embriyonik olmayan kök hücrelerdir. 2.5.2.1 Erişkin (Yetişkin) Kök Hücre KEMİK İLİĞİ KÖK HÜCRELERİ HEMATOPOİETİK KÖK HÜCRELER ERİŞKİN KÖK HÜCRELER Şekil 2.5. Erişkin kök hücrelerin çeşitleri STROMAL KÖK HÜCRELERİ (MEZENKİMAL KÖK HÜCRELERİ) PERİFERİK KAN KÖK HÜCRELERİ KORDON KANI KÖK HÜCRELERİ 21 Yetişkin tip kök hücreler, dokularda az sayıda bulunan, spesifik bölgelerde lokalize olan, bireyin ömrü boyunca hayati önemde olan doku bütünlüğünün devamlılığını sağlayan hücrelerdir. Organizmanın o anki yaşı ne olursa olsun dokularında bulunan kök hücreler, yetişkin kök hücreler olarak değerlendirilmektedir. Multipotent bir kök hücre olan yetişkin kök hücreleri EKH’ ler ve embriyonik germ hücreleriyle karşılaştırıldığında daha düşük pluripotense sahiptirler. Yetişkin dokulardaki kök hücreler tipik olarak sadece sınırlı sayıda hücre tipini şekillendirirken, EKH’ler hemen her hücre tipine farklılaşabilme potansiyeline sahiptirler. Yetişkin kök hücreler retina, akciğer, kalp kası, iskelet, kas, bağırsaklar, böbrek, dalak, kemik iliği, kan ve deri gibi dokuların oluşumuna katkıda bulunabilmektedirler. Yetişkin kök hücreler üzerindeki en kapsamlı çalışmalar immun sistem ve kan yapımını sağlayan hematopoietik kök hücreler üzerinde gerçekleştirilmiştir. Hematopoietik progenitör hücre kaynağı olarak kemik iliği, periferal kan ve göbek kordonu kanı hayati öneme sahiptir (Yılmaz O & Uçar M, 2006). Embriyonik kök hücrelerin aksine, erişkin kök hücreler enjekte edildiklerinde teratoma oluşumuna neden olmazlar, hazır kök hücre kaynağı olarak kabul edilirler, bireylerden doğrudan elde edilirler, daha az etik probleme yol açarlar. Buna karşın ayrıştırılmaları, saflaştırılmaları ve tanımlanmaları daha zordur, sınırlı büyüme kapasitesi nedeniyle büyük miktarlarda elde edilmeleri zordur, tüm hücre tiplerine dönüşemedikleri için kullanımları sınırlıdır, zamanla özelliklerini Karahüseyinoğlu S, 2009). Tablo 2.3 Embriyonik ve erişkin kök hücrelerin farklılıkları de kaybedebilirler (Can A & 22 Özellikler Pluripotenslik Farklılaşma Tertoma oluşum Etik problem Ayrıştırılmaları, saflaştırılmaları tanımlanmaları Kullanımları Elde edilmeleri Embriyonik kök hücre Yüksek Hemen hemen her hücre tipine farklılaşabilirler Tertoma oluşumuna neden olurlar Daha çok etik probleme neden olurlar Kolaydır Erişkin kök hücre Düşük Sınırlı sayıda hücre tipine farklılaşırlar Tertoma oluşumuna neden olmazlar Daha az etik probleme neden olurlar Zordur Sınırsızdır Tüm hücre tiplerine dönüşemedikleri için sınırlıdır. Sınırlı büyüme kapasitesi nedeniyle büyük miktarlarda elde edilmeleri zordur Kolaydır Şekil 2.6. Multipotent erişkin öncül hücrelerin farklı sinyal moleküllerine yanıt olarak gösterdikleri değişik yöndeki farklılaşmaları (MEPH; Multipotent Erişkin Progenitor Hücre).(E. Karaöz, 2009) 23 Yapılan çalışmalarda, erişkin kök hücrelerin değişik hücre tiplerine ya ‘plastisite’ yada ‘transdifferasyon’ yoluyla farklılaşma gösterdiklerini rapor edilmiştir (Özmen S ve ark., 2006). Kök hücre plastisitesi, bir hücrenin köken aldıkları dokuların dışındaki dokulara diferansiye olabilme özelliğini tanımlamaktadır. Bunun örnekleri arasında endotel, kas hücreleri, kalp kası, hepatositler, hematopoietik kök hücreler bulunmaktadır (Şahin F ve ark., 2005). Transdifferansiyon ise, bir dokudan elde edilen kök hücrelerin, uygun ortam şartlarında, uygun uyarılarla farklı doku hücrelerine dönüşebilme yeteneklerini tanımlamaktadır (İnan S & Özbilgin K, 2009). Transdifferansiasyon, birkaç özgün türde doğal olarak meydana gelir. Örneğin, semender ve civcivlerde gözün lensi çıkartıldığı zaman, iris hücreleri lens hücrelerine dönüşür (Karaöz E & Ovalı E, 2004). 2.5.2.1.1 Hematopoietik Kök Hücre (HKH) Hematopoietik kök hücre transplantasyonu 30 yıldır hematolojik ve non-malign hastalıkların tedavisinde kullanılmaktadır. Son zamanlarda HKH’ ler rejeneratif tıp ve doku mühendisliği alanında giderek daha cazip hale gelmektedir. HKH’ ler sağlıklı donörlerin kemik iliklerinden, mobilize edilmiş periferik kanlarından ve kordon kanlarından toplanırlar. Maalesef HKH’ lerin in vitro olarak çoğaltılmaları zordur. Çünkü onlar çoğalırken aynı zamanda da farklılaşırlar. Bunun sebebi in vivo mikro çevre tarafından sağlanan uygun işaretlerin eksik oluşudur. HKH’ ler esas olarak kemik iliğine yerleşmişlerdir ve burada kök hücre nişleri denilen spesifik mikro çevre ile etkileşmektedirler. İstirahatteki HKH’ lerin yerleştiği niş bölgeleri genellikle 24 osteoblastik niş ve vasküler nişlerdir. Bu nişler onların istirahat dönemlerinin akıbetini, kendi kendilerini yenilemelerini ve farklılaşmalarını düzenler. HKH’ ler stres veya yaralanmalara tepki vererek vasküler nişlerden dolaşıma geçerler. Çeşitli faktörler ve hücreler arası sinyaller ile bir denge içinde rejenerasyon, hemostaz, proliferasyon ve in vivo farklılaşmaya aracılık ederler (Jing D ve ark., 2010). Tablo 2.4. HKH kaynaklarının önemli farklılıkları:(Arat Özellikler Kemik iliği Genel anestezi Hücre miktarı Ortalama çekirdekli hücre miktarı Ortalama CD34+ hücre miktarı Ortalama T-lenfosit miktarı Diğer özellikler Gereklidir Sınırlı sayıda içerirler 2×10e8/kg HKH M, 2009) Kök hücre kaynağı Mobilize periferik kan kök hücreleri Gerek yoktur Yüksek miktarda hücre sayısı 9×10e8/kg Kordon kanı Gerek yoktur Hücre sayısı sınırlayıcı unsurdur 0.3×10e8/kg 2.8×10e6/kg 7×10e6/kg 0.2×10e6/kg 2.2×10e7/kg 27×10e7/kg 0.4×10e7/kg G-CSF ye bağlı yan etkiler görülebilir Dondurulmuş ünitelere kolayca ulaşılabilir Bulaşabilen hastalık riski düşüktür 25 Parsiyal HLA kabul edilebilir uyumu Bir çalışmada, HKH lerin ex vivo ko-kültür sistemlerinde besleyici hücre tabakası olarak mezenkimal stromal hücreler kullanılmış ve ex vivo yayılma esnasında HKH’ ler ve mezenkimal stromal hücreler arasındaki boyutsal ilişki incelenmiş, ko-kültür sisteminde mezenkimal kök hücre tabakasına göre HKH’ lerin 3 ayrı lokalizasyonu tanımlanmıştır. 1) Üst fazda olanlar (yapışmayan hücreler) 2) Mezenkimal stromal hücrelerin yüzeyine yapışan hücreler (hareketli fazdaki hücreler) 3) Mezenkimal stromal hücrelerin altında olan hücreler (sönük fazdaki hücreler) Bu üç fraksiyonun hücre döngüsü, proliferasyonu, hücre bölünmesi ve immunofenotipi 1-7 gün içerisinde değerlendirilmiştir. Sonuç olarak ko-kültürde hareketli faz hücrelerinin en yüksek oranda progenitör hücre içerdiği, buna karşın sönük faz hücrelerinin çok daha yavaş bölündüğü tespit edilmiştir. Elde edilen verilere göre mezenkimal stromal hücre yüzeylerinin hematopoietik kök hücrelerin proliferasyonu için dominant bir bölge olduğu ve ko-kültür sisteminde SDF-1/CXCR4 etkileşimi ve integrin aracılığıyla hücre adezyonunun hematopoietik kök hücrelerin dağılımında önemli rol oynadığı gösterilmiştir. Mezenkimal kök hücrelerin HKH’ lerin onarımı ve yerleşimine yardım ettiği bulunmuş ve mezenkimal kök hücrelerin sahip olduğu immunomodülatör kapasite tanımlanmıştır (Jing D ve ark., 2010). 26 Hematopoietik erişkin kök hücreleri laboratuar şartlarında hücre yüzey markerlarının monoklonal antikorlar ile belirlenmesi sonucunda immunofenotipik olarak tanınabilmekte ve sayılabilmektedir. Bunlar arasında hematopoietik kök hücreyi tanımak için kullanılan en iyi bilinen kök hücre yüzey antijeni CD34’dür. Ancak bu özelliği taşıyan hücreler arasında istirahatteki kök hücreler ile bir miktar farklılaşma gösteren kök hücreler birlikte yer almaktadır. HKH içerisinde CD34+CD38- niteliği taşıyanlar erken aşamaya ait farklılaşma göstermemiş hücrelerdir. Erken kök hücreleri saflaştırmak için ilave olarak Thy-1(CD90), HLA-DR, CD133, c-kit(CD117) veya Rhodamin-123zayıf gibi diğer fenotipik özellikler de kullanılmaktadır (Beksaç M, 2005). Marciniak ve arkadaşları hematopoietik farklılaşma için basit bir denklem geliştirmişlerdir. Bu model, olgunlaşmanın her bir basamağında hücrelerin kendi kendilerini yenileme yüzdelerine karşı farklılaşmanın tek bir eksternal feedback mekanizması ile ayarlanması hipotezine dayanmaktadır. Kurdukları denklemlerin sonucunda, eğer HKH’ lerin bölünmeleri yavaşlarsa ve kendi kendilerini yenileme miktarları artarsa tüm yaşam boyunca hematopoezin devam edeceğini, fakat şimdiki klinik imkanlarla HKH’ lerin sınırsız olarak bölünemeyeceğini göstermişlerdir (Marciniak A ve ark., 2009). 27 Şekil 2.7. Hematopoietik sistem ve hücresel elemanları (Gülen H) Georgantas ve ark.larının yaptıkları bir araştırmada, insan kordon kanı, kemik iliği ve mobilize edilmiş periferik kök hücrelerinde HKH ve hematopoietik hücre gruplarında gen ekspresyon profilini incelemişlerdir. Böylece ilk kez farklı dokulardaki erken dönem ve farklılaşmaya başlamış HKH’ lerde artmış veya baskılanmış genler gösterilmiştir. Bu araştırmada erken HKH’ lerde incelenen 45102 genden 4746 sının tüm dokulardaki kök hücreler için ortak olduğu, mobilize çevre kanının fazla olarak 28 254, kemik iliğinin 394, kordon kanının ise 3686 gen içerdiği gözlenmiştir. Ortak olan genlerin sınıflandırılması sonucunda büyük kısmının henüz tanımlanmamış genlerden oluştuğu görülmektedir. Aynı araştırmada erken dönem HKH’ lerde geç dönem hematopoietik hücrelere oranla artmış olan gen ekspresyonlarına bakıldığında artış gösteren genlerde her doku için ortak olan ancak 81 gen bulunmuştur. Dokuya özgü farklı genlerde ise kemik iliği en çok gen ekspresyon artışı göstermektedir( n:926), onu kordon kanı (n: 575) ve ardından mobilize çevre kanı(n:314) izlemektedir (Beksaç M, 2005). HKH'lerin kemik iliğinde varlığını gösteren en önemli bulgu, kemoterapi ve/veya radyoterapi ile myeloablasyona uğratılmış kişiye verilen kemik iliğinin hematopoietik yapılandırmayı sağlamasıdır. HKH' lerin hematopoietik yapılandırmayı sağlamasının en önemli sebebi, HKH' lerin kendi kendini yenileme yeteneklerinin olması ve daha olgun hücre gruplarına farklılaşabilmelerindendir. Hematopoietik organlardan elde edilen kök hücrelerin, hematopoietik hücrelerden farklı olarak kemik, kıkırdak, nöral hücreler, pnömositler, kas, deri, endotel, epitel hücreleri, hepatositler gibi hücreleri oluşturma kapasiteleri vardır. HKH'ler den başka, hematopoietik hücreleri oluşturan dokularda en azından üç tane primitif progenitor/kök hücre tipi tanımlanmıştır: i) Hemanjioblast: hematopoetik ve kan damar endotel hücrelerinin prokürsörüdür. ii) Mezankimal kök hücre (MKH): mezodermal kökenli kemik, kıkırdak, kas, nöral hücreler, adipoziti oluşturur ve hematopoetik stromayı destekler. 29 iii) Multipotent erişkin progenitor hücre (MEPH): Ekdodermal, endodermal, mezodermal kökenli hücrelerin çoğunu oluşturur (Ural AU, 2006). 2.5.2.1.2 Mezenkimal Kök Hücre (MKH) Erişkin kemik iliği stroması mezenkimal progenitör hücreler olarak bilinen hematopoietik olmayan bir hücre grubu içerir. Bunlar kemik, kıkırdak, yağ, tendon, kas ve kemik iliği stromasını içeren farklı mezenkimal dokulara in vitro veya in vivo gelişebilen multipotent öncüllerdir. Ayrıca pluripotens özellik göstererek karaciğer, böbrek, kalp ve sinir dokusu gibi diğer doku tiplerine transdiferansiye olma potansiyelindedirler. Bunlar kemik iliği hücrelerinin yaklaşık %0,01 ile %0,001 ini temsil eder; fakat cam ve plastiğe yapıştıkları için hematopoietik hücrelerden kolaylıkla ayrılabilirler. Vücutta kemik iliği, kemik, kıkırdak, düz kas ve iskelet kası dokularda bulunan mezenkimal kök hücrelerin deri, karaciğer, beyin hücreleri (nöronlar ve glia) gibi hücrelere dönüşebildiği gösterilmiştir. Tam tersi olarak nöral kök hücrelerden, kan hücrelerine de dönüşüm gösterilmiştir (Özmen S ve ark., 2006). Bu hücreler ilk kez 1976 yılında Fridenstein tarafından tanımlanmışlardır. Fridenstein, fetal buzağı serumu içeren kemik iliği materyalinin ortama yayılması sonucunda adezyon yeteneği gösteren, morfolojik olarak fibroblastlara benzeyen hücre kolonilerinin bulunduğunu ve bunların kemik ve yağ hücrelerine farklılaşma yeteneğine sahip olduklarını göstermiştir (Çetinkaya DU, 2009). Mezenkimal kök hücre morfolojileri, ışık veya faz kontrast mikroskopi ile incelendiğinde iğ şeklinde ve fibroblast benzeri hücre toplulukları oldukları gözlenmiştir. Morfolojik özellikleri fibroblastlara benzemekle birlikte en önemli farkları 30 nükleus yerleşiminin fibroblastlarda asimetrik olmasına karşın bu hücrelerde simetrik olmalarıdır. İmmunofenotipik özellikleri itibariyle CD34, CD45, HLA-DR ve CD14 gibi tipik hematopoietik belirteçleri göstermezler, buna karşın CD105 (SH2), CD73 (SH3/4) gibi non-hematopoietik hücre yüzey belirteçlerini eksprese ederler. Uluslararası Hücre Tedavileri Topluluğu mezenkimal kök hücreler için 3 tanımlayıcı özellik önermektedir: 1- Standart kültür ortamında plastiğe yapışabilmeleri, 2- CD105, CD73 ve CD90 taşımaları, ancak CD45, CD34, CD14 veya CD11b, CD79 veya CD19 ve HLA-DR taşımamaları, 3- İn vitro koşullarda kemik, yağ ve kıkırdak hücrelerine farklılaşabilmeleri. Mezenkimal kök hücrelerin fenotipik özellikleri ile ilgili çalışmalar genellikle primer hücreden ziyade kültürde çoğaltılmış hücrelerde araştırılmıştır. Kültürde çoğaltılmış mezenkimal kök hücrelerin, endotel, epitel ve kas hücrelerine benzer fenotipik özelliklere sahip oldukları görülmektedir. Farklı dokulardan elde edilen hücreler genel olarak benzer fenotipik özelliklere sahip olmakla birlikte bazı farklılıklar da göze çarpmaktadır. Örneğin, yağ dokusundan elde edilen mezenkimal kök hücreler yüzeyinde CD49d taşırken, CD106 taşımamaktadır; kemik iliği kaynaklı mezenkimal kök hücreler de ise aksine CD49d negatif, CD106 pozitifdir. Erişkin mezenkimal kök hücrelerin hücre yüzeyinde HLA sınıf I antijenlerini zayıf eksprese ettikleri, HLA sınıf II antijenlerini taşımadıkları, ancak hücre yüzeyinde taşınmayan HLA sınıf II antijenlerin stoplazmada bulunduğu saptanmıştır (Yılmaz M, 2008). 31 Mezenkimal kök hücreler, T lenfosit aktivasyonu ve alloreaktif reaksiyonları önlerler. Bunun yanında aktive B lenfositleri de inhibe eder, regülatör T hücrelerini uyarırlar. Mezenkimal kök hücrelerin hayvan ve insanlarda lenfosit proliferasyonunu engelleyerek immünsupresif etki gösterdiği de bildirilmiştir. MKH’ ler artan konsantrasyonlarda (1:1, 1:10, 1:100) T lenfositlerle birlikte kültür edildiğinde konsantrasyona bağlı olarak değişen immünmodulatuar etki gözlenmiştir. MKH oranının 1:10 veya üzeri olması halinde immünsupresif etki gözlendiği, MKH konsantrasyonunun düşük olması halinde ise lenfosit proliferasyonuna yol açtıkları gösterilmiştir (Çetinkaya DU, 2009). Anti-enflamatuar etkinin uyarılmasında ve tolerans mekanizmasında MKH’ ler effektör T, regülatör T, dendritik ve doğal öldürücü (natural killer -NK) hücrelerin sitokin sekresyon profillerini değiştirerek rol oynamaktadırlar. Bunun yanında T lenfositler, NK hücreler, monosit, makrofajlardan salınan interferon gamma, interlökin 1 gibi sitokinler MKH’ leri uyararak immünmodülatör faktörlerin salgılanmasına yol açmaktadırlar. Bu faktörlerden immünsupresif mekanizmada etkili olanlar arasında en iyi bilinenleri, transforme edici büyüme faktörü (transforming growth factor beta -TGF beta), hepatosit büyüme faktörü (HGF), indolamin 2, dioksijenaz (IDO) ve prostaglandin E2 (PGE2)dir. Ayrıca HLA-G ve nitrik oksit de inhibitör özelliklerinde rol oynamaktadır. Ayrıca mezenkimal kök hücrelerin lenfositlerden IL-10 salınımını artırdıkları ve onlarda TH-1 yerine TH-2 profili egemenliğine yol açtıkları da bildirilmiştir. Mezenkimal kök hücreler ayrıca, immünmodülasyonda rolü olan Toll benzeri reseptörleride eksprese etmektedirler (Çetinkaya DU, 2009). 32 Tablo 2.5. Mezenkimal kök hücrelerin antijenik özellikleri (Yılmaz M, 2008) Antijen CD numarası Ekspresyon Endoglin (SH2) CD105 Pozitif 5’ terminal nükleotidaz (SH3) CD73 Pozitif SH4 CD73 Pozitif Thy-1 CD90 Pozitif 33 T lenfosit belirteci CD3 Negatif B lenfosit belirteci CD19 Negatif HLA-DR Negatif Lewis X CD15 Negatif T6 CD1a Negatif CD34 Negatif Leukocyte common antigen CD45 Negatif LPS reseptör CD14 Negatif Hematopoietik belirteci kök hücre Büyüme faktörü ve sitokin reseptörleri Interleukin-1 reseptör CD121 Pozitif Interleukin-3 reseptör CD123 Pozitif Interleukin-4 reseptör CD124 Pozitif Interleukin-6 reseptör CD126 Pozitif Interleukin-7 reseptör CD127 Pozitif Interferon γ reseptör CDw119 Pozitif CD120 Pozitif Tümör nekroz reseptör Fibroblast reseptör faktör büyüme alfa faktör Pozitif Platelet kaynaklı büyüme faktör reseptör CD140a Pozitif Transferrin reseptörü CD71 Pozitif Interleukin-2 reseptör CD25 negatif 34 Tablo 2.6. Mezenkimal kök hücrelerin taşıdıkları adezyon molekülleri (Yılmaz M, 2008) Adezyon molekülü CD numarası ALCAM CD166 ICAM-1 CD54 ICAM-2 CD102 L-Selektin CD62L VCAM CD106 Hyaluronate Reseptör CD44 NCAM CD56 LFA-3 CD58 VLA-α 1 CD49a VLA-α 2 CD49b VLA-α 3 CD49c VLA-β CD29 Beta 4 integrin CD104 E-Selektin CD62E P-Selektin CD62P LFA-1 α CD11a LFA-1 β CD18 Cadherin 5 CD144 PECAM-1 CD31 VLA-α 4 CD49d ALCAM : Activated leukocyte cell adhesion molecule ICAM : Intercellular adhesion molecule VCAM : Vascular cell adhesion molecule VLA : Very late antigen LFA : Lymphocyte function-associated antigen-1 PECAM : Platelet endothelial cell adhesion molecule NCAM : Neural cell adhesion molecule Ekspresyon Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Pozitif Negatif Negatif Negatif Negatif Negatif Negatif Negatif 35 Çeşitli dokularda destek hücresi olarak bulunmakta olan MKH’ ler, bu özellikleri ile ilişkili olarak çok sayıda biyoaktif molekül, sitokin, kemokin, enzim ve ekstraselüler matriks proteinlerini sentezlemektedir. Kemik iliği MKH’ leri hematopoietik hücreler için gerekli makrofaj koloni stimule eden faktör (M-CSF), Flt-ligand, kök hücre faktör (stem cell factor-SCF) gibi büyüme faktörlerini salgılamaktadır. Ayrıca MKH’ lerden Interlökin-6 (IL-6), IL-7 , IL-8, IL-11, IL-12, IL-14, IL-1 gibi sitokinler yanında başlıca SDFalfa-1 (stromal derived factor alfa-1), monosit kemoatraktan protein olmak üzere kemokinler de sentezlenmektedir (Çetinkaya DU, 2009). Mezenkimal kök hücreler kendi kendilerini yenileme ve birçok kökene farklılaşma yetenekleri ile doku rejenerasyonunda önemli rol oynarlar. Deneysel ve klinik çalışmalarda kullanılan kemik iliği, mezenkimal kök hücrelerin başlıca kaynağıdır. Göbek kordonu ve plasenta da kemik iliğinin bir alternatifi olarak hücre tedavisinde kullanılmaktadır. MKH’ ler kanın içerisine dağıldığında endotel hücrelerle yakın temas kurarlar. Endotelyumun içine girerler ve sonrasında hedef dokuya ulaşmak için endotelyumdan ayrılırlar. Hedef dokuya göç etme hızı, en hızlı göç edenden en yavaş göç edene şeklinde kemik iliği, plasenta ve göbek kordonu MKH’ leri olarak sıralanmaktadır (Li G ve ark., 2008). Tablo 2.7. Kemik iliği kökenli mezenkimal kök veya öncül hücrelerin in vitro farklılaşma potansiyeli: Uyarı, moleküler ve hücresel belirteçler FARKLILAŞMA UYARI (Karaöz E, 2009). TERMİNAL FENOTİP İDENTİFİKASYON BELİRTEÇLERİ MOLEKÜLER HÜCRESEL 36 Adipositler Deksametazon + İsobütilmetilksanthin Deksametazon + İsobütilmetilksanthin + indometasin + insülin PPARγ2, C/EBPβ Deksametazon + insülin aP2,Adiposin,Leptin Deksametazon+indometasin Lipoprotien lipaz Sitoplazmik lipit damlacığı birikimi Deksametazon + insülin + eikosate + raynoik asit Kondrositler TGFβ3 + askorbik asit Cbfa-1 TGFβ1 + askorbik asit Tip II ve IX kollagen TGFβ1 Agrekan ITS + Premix + TGFβ1 Tip TGFβ3 agrekan mRNA Proteoglikanlar ve Tip II ve IX kollagen yönünden Zenginleştirilmiş II kollagen ve matriks Matriksde kollagen tip II ve sülfatlanmış proteoglikan immunoreaktivitesi 37 Osteoblastlar Deksametazon + β- Cbfa-1 gliserofosfat + Kemik/karaciğer/ askorbik asit Böbrek alkalin fosfataz BMP-2 Kemik siyaloproteini Osteopontin Mineralize matriks Osteokalsin formasyonu Tip I kollagen Tenositler BMP-12 Tip II kollagen, Proteoglikanlar İmplante edilen tendonun gelişen biyomekanik özellikleri Hematopoietik Hidrokortizon + at serumu CD34+ hücrelerin destekleyici Hematopoietik kök hücre Hematopoietik farklılaşmasını stroma destekler ve devam ettirir Osteoklastogenezisi destekler İskelet kas hücreleri 5-azaktidin MyoD,Myt 5 ve 6, Çok MEF-2, kasılabilir hücreler Miyogenin, çekirdekli 38 MRF4 Miyozin Düz kas PDGF-BB hücreleri ASMA, Metavinkülin Kalponin h-Kaldesmon Düz kas aktin Kalp kası bFGF hücreleri Demsin, β-miyozin ağır zinciri, Fosfolamban GATA 4 ve 6 Kardiyak troponin I ve C Sarkomerik-aktin Yavaş kasılan miyozin, ANP Astrositler DMSO + Deksametazon Gliyal fibriler asidik FN + bFGF protein, Ara filaman Neonatal entegrasyon beyinde 39 Oligodendrosit PDGF + EGF + linoleik asit Galaktoserebrosit ler FN + bFGF Nörofilaman, Tübülin B III, Sinaptofisin Nöronlar β-mercaptoetanol + retinoik Nestin, NeUN, Tuj-1 asit Sinir hücreleri Retinoik asit Sinir hücreleri BDNF+NGF+bFGF Sinir hücreleri β-mercaptoetanol Nöral özgün belirteçler + Tübülin B, nestin Nörit benzeri yapılar B27+BDNF Sinir benzeri Retinoik asit hücreler Gliya hücreleri Retinoik asit Beta hücreleri Retinoik asit İnsülin Endotel VEGF + Fibronektin CD31, FIK-1, vWF Endotelyal fenotip FGF4 + HGF Sitokeratin18 Epiteloid morfoloji hücreleri Epiteloid hücreler HNF-1, Albumin (+hepatosit) İntervertebral TGFβ3 + Deksametazon + disk-benzeri Askorbat Tip II agrekan, kollagen, dekorin, fibromodulin hücreler kıkırdak oligomerik ve Sferoid yapılar 40 matriks protein Mezenkimal kök hücrelerde kardiyak farklılaşmayı göstermek amacıyla Cheng ve arkadaşları bir çalışma yapmışlardır. Bu çalışmada akut myokard infarktüslü hayvan modellerinde Geum japonicum bitkisinin metilen oksitteki ekstraktı (EGJ) nın etkileri incelenmiştir. EJG nin içerdiği aktif bir komponent olan kardiogenin izole edilmiş ve enfarkte olmuş kalbin tedavisindeki etkinliği araştırılmıştır. Bu yöntemde EJG veya kardiogenin kimyasal işlemlerden geçirilip miyokard infarktüslü hayvan modellerine verilmiş ve myokard da önemli ölçüde rejenerasyon sonucu anjiyogenez aktive edilmiştir. Bu çalışmanın sonucunda enfarkte olmuş kalbin onarımında kardiogeninin terapötik etkileri ispatlanmış ve ilgili sinyal yolakları tespit edilmiştir (Cheng L ve ark., 2009). Endometriumda bulunan kök hücrelerin kemik iliğinden türemiş MKH’ lerden meydana geldiği ve sonrasında endometrial stromal fibroblastların içinde geliştiği öne sürülmüş ve yapılan çalışma sonuçları kemik iliğinden türemiş MKH’ lerin endometrial kök/progenitör hücrelerinin kaynağı olabileceğini göstermiştir (Aghajanova L, 2010). Adiposit kök hücresi: Yağ dokusundan elde edilen pluripotent kök hücreler de, kemik iliğinden elde edilen kök hücreler kadar farklılaşma yeteneğine sahiptirler. İn vitro koşullarda adipojenik, kondrojenik, myojenik, ve osteojenik hücreler gibi birçok değişik hücre tiplerine dönüşebilirler. Epidermal kök hücre: Erişkin derisinde her bir kıl follikülü, kök hücreler içermektedir. Bu hücreler her kıl siklusunda, follikül rejenerasyonunda ve yara 41 iyileşmesi sırasında reepitelizasyonda önemlidirler. Bu hücreler, kolay elde edilebilmeleri açısından önemli bir kök hücre kaynağı olarak değerlendirilmektedir. Sindirim sistemi epitel kök hücresi: Organizmanın yaşamı boyunca kök hücrelerden köken alan farklılaşmamış epitel hücreleri sindirim sisteminde hızlı hücre yenilenmesini sağlarlar. Epitel hücre yenilenmesi; epitel ve bağ dokusu arasındaki hücre-hücre ve hücre-hücre dışı matriks etkileşiminin sıkı bir kontrolü altındadır. Kardiyomyosit kök hücresi: Mezenkimal ve hematopoetik kök hücrelerin ve kahverengi yağ dokusundaki CD133+, c-Kit– ve Sca-1– hücrelerin kardiyomyositlere farklılaştığı bildirilmiştir. Bu hücreler hasarlı myokardiyumun rejenerasyonunda önemlidir. Nöronal kök hücre: Nöronal kök hücrelerin taşıması gereken özellikler şunlardır: (1) Multipotent hücreler olmalı ve sinir sistemi hücrelerinden nöron, astrosit ve oligodendrositlerin bütün alt tiplerine farklılaşabilmelidir. (2) Sinir sistemi hücre tiplerine farklılaşabilme ve sinir sisteminin dejenere veya hasarlanmış bölgelerinde yeniden çoğalabilme yeteneğinde olmalıdır. (3) Seri olarak transplante edilebilir olmalıdır. (4) Kendi kendini yenileyebilir olmalı, aynı potansiyel ve özellikleri taşıyan yeni hücreler üretebilme yeteneğinde olmalıdır. Kanser kök hücresi: Kanser progenitor hücreleri kök hücre-benzeri özellikleri olan hücrelerdir ve kanser başlangıcında, ilerlemesinde, lokal invaziv kanserlerin yaygınlaşması ve tedavisi olmayan döneme girmesinde önemli rol oynarlar (İnan S & Özbilgin K, 2009). 2.5.2.2 Fetal Kök Hücreleri 42 Fetal kök hücreler ilk olarak 1998 yılında Gearhart ve ark.'nın çalışmaları sonucunda, 59 haftalık fetusun gonadal kıvrım ve mezenter bölgesindeki primordiyal germ hücrelerinin kültürlerinden elde edilmiştir. Fetustan elde edilen kök hücrelerin araştırma veya tedavide kullanımı uygun doku gruplarına ait fetus kaynaklarının oluşturulması gibi etik açıdan ciddi sorunlar doğurabilir. Ancak, kendiliğinden düşük yapmış kişilerde bu hücreler bağışlanarak araştırma ve tedavi amacıyla kullanılabilir. Gerekli fetus kaynağının az olması nedeniyle fetus kaynaklı germ hücreleri araştırmaları eski hızını kaybetmiştir. Fetuslardan elde edilen kök hücreler oldukça sınırlıdır (nöral kök hücreleri, hematopoietik kök hücreler ve pankreas öncül hücreleri). Fetal kök hücreler günümüzde çeşitli kalıtsal hastalıkların tedavisinde kullanılmaktadır (Sağsöz H & Ketani MA, 2008). 2.5.2.3 Kadavra Kök Hücreleri Kadavradan elde edilen kök hücrelerin kullanılmasına ilişkin ilk çalışmalar, solit organ nakillerinde toleransı uyarmak için hematopoietik kök hücrelerin infüzyonunu içeriyordu. Buradaki amaç organ nakli yapılan alıcı hücrelerinin verici hücrelerine immun cevaplarını düzenlemekti. Bunun yanında kadavradan elde edilen kemik iliği kök hücrelerinin, allojenik transplantasyonlar için uygun olabileceğini söyleyenler de olmuştur. Araştırmacılar bu tip hücrelerden elde edilen yeni hücrelerin çoğalma hızlarının ölen kişilerin yaşıyla ters orantılı olduğunu bildirmektedir. Gelecekte kadavralardan elde edilecek kök hücre uygulamalarının artmasıyla, hücre esaslı tedavi uygulamalarında insanlar için tartışmasız bir kaynak oluşturabilirler (Karaöz E & Ovalı E, 2004; Sağsöz H & Ketani MA, 2008). 2.6 KLİNİK DOKU MÜHENDİSLİĞİ 43 Doku Mühendisliği, kaybedilmiş veya hastalıklı doku ya da organların geri kazanılması/rejenerasyonu amacıyla yeni biyolojik eşdeğerlerinin geliştirilmesini hedefleyen bir rejeneratif tıp alanıdır. Bu amaç genellikle üç ana komponent içerir: (1) hasarlı veya yok olmuş dokuyu oluşturan hücreler; (2) taşıyıcı görevi yapan ve hücrelere destek olan materyaller; (3) hücre üremesi ve farklılaşması için uyumlu sitokinler ve diğer biyoaktif faktörler. Doku üretimi, istenilen özelliklere sahip, genellikle polimerik yapıda olan, materyal yüzeylerinde gerçekleşeceği için, yapılan çalışmalar, öncelikle yüzeyinde hücrelerin üreyebileceği çeşitli destek malzemelerin geliştirilmesi ve daha sonra bu yüzeylerde hücrelerin üretilerek üç boyutlu doku özelliğinin kazandırılması şeklindedir. Organoid adı verilen bu yeni doku benzeri hibrit oluşumlar hastaya geri nakledilir. Hasta bedeninin bir bölgesinden alınan dokunun bir başka bölgesine nakledilmesi işlemine otogreftleme adı verilmektedir. Bazen, alınabilecek doku miktarı yetersiz olabilmekte veya alınamamaktadır. Bir türden elde edilen dokunun, aynı türden bir diğerine nakledilmesi işlemine ise allogreftleme denir (Elçin YM, 2009; Delioğlu Gürhan İ ve ark., 2009). Günümüzde, çoğunlukla diz eklem kıkırdağı rejenerasyonuna yönelik olarak geliştirilmiş çeşitli doku mühendisliği ürünleri bulunmaktadır. Temel olarak işlem, sağlıklı kıkırdak dokudan alınan biyopsinin enzimatik olarak ayrıştırılması sonucu elde edilen az sayıdaki otolog kondrositin kollajen veya biyobozunur sentetik polimer matriksler/yapı iskeleleri içerisinde in vitro kültür şartlarında sayılarının artırılarak üç boyutlu artiküler kıkırdak benzeri bir dokuya dönüştürülmesi ve hastaya geri nakledilmesi prensibine dayanmaktadır. Kemik rejenerasyonu alanındaki ilk klinik denemeler, kemik iliğinin adezyon yapabilen multipotent klonojenik alt grubu 44 mezenkimal kök hücrelerin biyoseramik veya kompozit iskeletler üzerinde çoğaltılması yaklaşımıyla çene kemiği doku mühendisliğinde uygulanmıştır (Elçin YM, 2009). Doku mühendisliğinin gelecekteki klinik uygulamaları içinde, kemik iliği hücreleri (mezenkimal kök hücreler) veya periferal kandaki progenitor hücrelerin cazip alternatif hücre kaynakları olmaları beklenmektedir (Delioğlu Gürhan İ ve ark., 2009). Organ yetmezliklerine bağlı kronik hastalığı olan milyonlarca insan, nakil için organ sırasında beklemektedir. Nakil sırasında bekleyen hastaların ihtiyacına yanıt verebilecek sayıda organ mevcut değildir. Gen ve doku mühendisliğindeki gelişmeler, organ kaynağının karşılanması açısından oldukça ümit vericidir. Yapay organ ya da dokular oluşturmak doku mühendisliğinin en önemli hedefleri arasındadır. Son yıllarda yapılan çalışmalar, üç boyutlu organ oluşturma yönündedir. Hücreler, in vitroda vücutta olduklarından farklı davranışlara sahiptirler. Yapay organ üretmek için yalnızca hücreleri çoğaltmak yeterli olmamaktadır. Asıl olan, onlara işlevsel organın şeklini vermektir. Bunun için en sık kullanılan yöntemse organik iskeletlerden yararlanmayı içermektedir. Vücut içinde hücreleri bir arada tutan en önemli molekül “kollajen”dir. Kollajen, özellikle cilt, kıkırdak, damar ve kemik gibi dokularda bol miktarda bulunur ve insan vücudundaki tüm proteinlerin yaklaşık %30’unu oluşturur. Hücreler arasında bulunan bu ve benzeri yapıtaşları sayesinde, üç boyutlu organ ya da doku morfolojisi korunabilmektedir. Bu gözlemden yola çıkan bilim adamları, hücreleri bir arada tutabilecek yapay iskeletler geliştirmektedir. Üç boyutlu katı kıvamdaki iskeletler, büyük organların oluşturulmasında kullanılmaktadır. İstenilen şekilde oluşturulan bu iskeletler üzerine yerleştirilen hücreler, zamanla çoğalarak iskeletin tamamını kaplamaktadırlar. Hücreler çoğaldıktan sonra, iskelet yüzeyinin şeklini almakta ve bir 45 süre sonra da iskelet eriyip kaybolmaktadır. Böylece hücreler üç boyutlu bir şekil alabilmektedir (Delioğlu Gürhan İ ve ark., 2009). 2.7 KÖK HÜCRE İÇİN YASAL İZİNLER Kök hücre nakli özellikle hematolojik, onkolojik hastalıklarda bir tedavi yöntemi olarak uzun yıllardır kullanılmaktadır. Son yıllarda farklı hastalıklarda da tedavi amaçlı kök hücre kullanımı gündeme gelmiştir. Dünyada ve ülkemizde kök hücre nakli ile tedavi konusunda halen yoğun araştırmalar yapılmakta olup, konu ile ilgili haberler basın ve yayın organlarında sıklıkla yer almaktadır. Bazı hastalıkların tedavisinde ümit verici bir yöntem olarak değerlendirilmesine karşın, henüz kök hücre nakli yapılan hasta sayısı çok azdır ve uygulamanın başarısı veya uzun vadede tedavinin hastada meydana getirebileceği yan etkiler konusunda yeterli bilgi mevcut değildir (Sağlık Bakanlığı, 2006). Bakanlığımızca; kök hücre nakli çalışmalarıyla ilgili olarak, çalışmanın yapılacağı kurum bünyesinde gerekli altyapının oluşturulması ve çağdaş bilimin gereklerine uygun olarak uygulama yapılabilmesi amacıyla Kök Hücre Nakilleri Bilimsel Danışma Kurulu oluşturulmuş ve “Klinik Amaçlı Embriyonik Olmayan Kök Hücre Çalışmaları Kılavuzu” hazırlanmıştır (Sağlık Bakanlığı, 2006). Klinik amaçlı embriyonik olmayan kök hücre çalışmaları T.C. Sağlık Bakanlığı’nca kurulmuş olan “Kök Hücre Nakilleri Bilimsel Danışma Kurulu” tarafından değerlendirilerek, Bakanlıkça bu alanda çalışmasına onay verilen bilimsel merkezlerde yapılır. Bu merkezlerin kök hücre çalışması yapmak üzere bilimsel kurula başvururken 46 bu konuda gereken temel bilgi, beceri ve donanıma sahip olduklarını kanıtlayan verileri sunmaları gereklidir. Klinik amaçlı çalışmanın planlandığı kurum bünyesinde, kök hücre çalışmalarına yönelik olarak kurulacak “yerel etik kurul” onayını takiben, çalışma başvuru dosyası Kök Hücre Nakilleri Bilimsel Danışma Kurulu’na sunulur. Kurulun incelemesini müteakip Bakanlıkça izin verilmesi kaydıyla çalışma gerçekleştirilir. Kök Hücre Nakilleri Bilimsel Danışma Kurulu’na başvuru esnasında, çalışmaya ilişkin ayrıntılı bilgilerin yanısıra, hastalara verilecek olan “bilgilendirilmiş gönüllü olur formu” taslağının da dosyaya eklenmesi gereklidir. Hastada bu uygulama sırasında ya da sonrasında gelişebilecek istenmeyen veya beklenmeyen etkilerin önlenmesi için gerekli tedbirlerin alınması ve komplikasyonların telafi/tedavisi için güvence sağlanması (sigorta edilmesi) ardından çalışma başlatılır. Kök Hücre Nakilleri Bilimsel Danışma Kurulu tarafından onay verilmiş olan çalışmaların, 6 ayda bir gelişme raporlarının ve çalışma sonrasında “Sonuç Raporunun” Sağlık Bakanlığı’na bildirilmesi zorunludur (Sağlık Bakanlığı, 2008). Kordon kanı bankacılığı hakkındaki yönetmelik 05.07.2005 tarihli ve 25866 sayılı resmi gazetede yayınlanmıştır. Bu Yönetmeliğin amacı, Kordon Kanı Bankası açılması, faaliyetleri ve denetlenmesi ile ilgili usul ve esasları düzenlemektir. Kordon kanı, hastalıklarının tedavisi için kök hücre nakline ihtiyaç duyan ya da duyacak olan hastalar için, kök hücre kaynağı olarak kullanılmak üzere saklanmaktadır. Gelecekte başka bazı amaçlarla kullanımı söz konusu olabilirse de, halen bu amaçla saklanmasına neden olabilecek kesin bilimsel veriler oluşmamıştır. Kordon kanı bugünkü veriler ışığında 15 yıla kadar sağlıklı olarak saklanabilmektedir. 47 Bu amaçla banka açmak isteyen kuruluşların Müdürlüğe bir başvuru dilekçesi ve ekli başvuru dosyası ile başvurmaları gerekir Başvuru dosyası Bakanlık tarafından incelenerek Ulusal Kordon Kanı Koordinasyon Kurulunun görüşü alınır. Dosya değerlendirmesi sonrasında gerek duyulursa, bir ekip tarafından yerinde inceleme yapılır ve durum tespit raporuyla Bakanlığa sunulur. Yapılan inceleme sonrasında başvurusu uygun bulunan bankaya Bakanlıkça Kordon Kanı Bankası Çalışma Onayı düzenlenir. Türkiye kök hücre koordinasyon merkezi çalışma esasları yönergesi bu merkezin idari yapısı, teşkilatı, faaliyetleri ve merkezde çalışan personelin görev ve niteliklerine ilişkin esas ve usulleri belirler. Türkiye Kök Hücre Koordinasyon Merkezi akraba dışı hematopoietik kök hücre nakli gereken hastaların tedavisi için, gönüllü verici olmak isteyenlerin doku tipleme sonuçlarının saklanması ve bunların kemik iliği nakli için gönüllü verici ihtiyacı olan hastalarla eşleştirilmesi işlemlerini yapmak, kemik iliği nakli öncesinde, nakil sırasında ve sonrasında üçüncü taraflarla koordinasyonu sağlamak amacıyla, Ankara İl Sağlık Müdürlüğüne bağlı bir merkez olarak faaliyet gösterir (Sağlık Bakanlığı, 2005). 48 3. TARTIŞMA ve SONUÇ Kök hücrelerle ilgili olarak bugün dünyada en çok tartışılan konu bu hücrelerin hasarlanmış hücre-doku ve organların yerine nakledilmesidir. Bu amaçla kalp, böbrek ve pankreas gibi organ yetmezlikleri konularında önemli çalışmalar yürütülmektedir. Alzeimer, diyabet, felç, kanser gibi hastalıkların, otoimmun ve kongenital hastalıkların tedavisinde kök hücrelerin kullanılabilirliği bir diğer önemli çalışma alanıdır. Kök hücrelerin yetenekleri ve kapasiteleri hakkında bilinenler henüz başlangıç aşamasındadır ve gelecekte kök hücrelerin kullanım alanlarının çok genişleyeceğine inanılmaktadır. Sinir sistemi hastalıklarında kök hücre kullanımı ile ilgili olarak ilk nöral transplantasyon denemesi 1890 yılında WG Thompson tarafından yapılmıştır. Çalışmasında köpek veya kedilere yetişkin neokorteks parçacıklarını transplante etmiştir. Nöral transplantasyon çalışmaları yirminci yüzyılın başlarında hız kazanmış ve ilk başarılı transplantasyon, Elizabeth Bunn tarafından 1917 yılında gerçekleştirilmiştir. Bunn, yenidoğan sıçan kortikal dokularını kardeş yenidoğan sıçanların korteksine transplante etmiş ve nöronların hayatta kalarak kortikal tabakalanmayı gerçekleştirdiklerini görmüştür (Şahin G & Kırık D, 2005). 1990’lı yılların ortalarında, özel durumlarda beynin bazı kısımlarındaki ‘nöral kök hücreler’ den yeni nöronlar yapılabildiği gösterilmiştir. Nöral kök hücreler fetusta beyin ve spinal kordu oluşturan 49 hücrelere benzerler ve beyindeki tüm hücreleri (nöronlar, oligodendrositler ve astrositler) oluşturabilirler. Bu hücreler parkinson ve alzeimer gibi nörodejeneratif hastalıkların, amniyotrofik lateral sklerozis (ALS) in, felç veya travma ile gelişen beyin veya spinal kord hasarlarının tedavisinde kullanılabilirler (Sargın D, 2003). Stratejik olarak kök hücre tedavilerinde birinci önemli nokta; hangi tip nörolojik hastalarda hangi hücrelerin kullanılacağıdır. Nöronal progenitör hücrelerinin tek nöronal fenotip hastalıklarında (örneğin parkinson hastalığında), karışık progenitör hücrelerinin sınırlı sayıda farklı fenotiplerin kaybı ile karakterize hastalıklarda (örneğin spinal kord yaralanmaları ve motor nöropatiler gibi hastalıklarda), glial ve oligodendrositik progenitör hücrelerinin myelin hastalıklarında, nöral kök hücrelerinin lizozomal depo hastalıklarında ve diğer enzim yetersizliği hastalıklarında kullanılması önerilmektedir (Deda H, 2008). Hareketlerde yavaşlama, kaslarda sertlik ve tremor ile karakterize nörodejeneratif bir bozukluk olan Parkinson hastalığı kök hücre tedavisinin en çok çalışıldığı sinir sistemi hastalıklarından biridir. Bu hastalıkta harap olan nöronların normalde salgıladıkları ve vücut hareketlerini kontrol eden dopaminin az salgılanması söz konusudur. Parkinson hastalığında ilk hücre nakli denemesi 1980’lerde Meksika’da yapıldığı ve böbrek üstü bezinde bulunan dopamin yapan kromaffin hücrelerin nakledildiği ve sonucun başarılı olduğu bildirilmiştir. Parkinson hastalığının tedavisinde kök hücre transplantasyonu dejenere olan dopaminerjik nöronların işlevlerinin tamir edilmesini amaçlamaktadır. Parkinson hastalığı tedavisi araştırmalarında üç grup kök hücre kullanılmaktadır; embriyonik kök hücre (EKH)’ ler, nöral kök hücre (NKH) ler ve mezenkimal kök hücre (MKH) ler. NKH’ ler ve MKH’ ler erişkin santral sinir sisteminde olgun nöronlara 50 dönüşebilen somatik kök hücrelerdir. EKH’ ler NKH’ lere ya da nöral progenitör hücrelere diferansiye olduktan sonra transplante edilebilirler. EKH’ ler tümör hücre serilerinin aksine hücre kültüründe defalarca pasajlansalar dahi normal karyotiplerini muhafaza ederler. Bu nedenle EKH’ ler sinir dokusu transplantasyonunda geleceğin en güçlü hücre adayı olarak kabul edilmektedir (Sargın D, 2003;Şahin G & Kırık D, 2005). Alzheimer Hastalığı, bellek, konuşma, yüksek serebral işlevler ve görsel beceriler gibi birden çok sistemi etkileyen, bilişsel işlevlerde ilerleyici kayıp ile seyreden nörodejeneratif bir hastalıktır (Koçer B & Nazlıel B, 2003). Birçok araştırmacı alzheimer hastalığını geri döndürmeyi amaçlayan yeni tedavi potansiyellerinin mümkün olup olmadığını sorgulamaktadırlar. Alzheimer hastalığı için onaylanmış ilaçlar hastalığın ilerlemesini yavaşlatmakta ve bu hastalığın semptomlarını iyileştirmektedirler. Araştırılan yeni tedaviler ise bu hastalığı tersine çevirmeye yöneliktir. Bu yöntemlerde amaçlanan ise beyinde etkilenmiş bölgedeki ölen ve fonksiyonun yitirmiş nöronların yenileriyle değiştirilmesidir. Yeni nöronlar veya nörogenezis ile gerçek bir ilerleme kaydedileceği ve bilişsel hasarın tersine döndürülebileceği düşünülmektedir (Kelleher-Andersson J, 2006). Yapılan bir çalışmada, ratlardaki deneysel sporadik alzheimer hastalığı modelinde mezenkimal kök hücre tedavisinin etkinliği iki farklı uygulamada değerlendirilmiştir. Farelere tek veya çift doz mezenkimal kök hücre uygulaması yapılmıştır. Histoptolojik değerlendirme sonucunda çift doz mezenkimal kök hücre uygulanan hayvanlarda daha belirgin olmak üzere kök hücre tedavisi ile nöronal kayıpta azalma ve sinaps sayısında artış saptanmıştır. Oluşturulan modelde, tedavi olarak iki farklı dozda mezankimal kök 51 hücre uygulamasının da bilişsel fonksiyonlar üzerine anlamlı olmasa da düzeltme yaptığıve histopatolojik bulgulardaki değişimin daha belirgin olduğu gösterilmiştir. Bu sonuçlar doğrultusunda mezenkimal kök hücre tedavisi öncesi veya sonrasında kök hücre engraftmantını artırıcı yaklaşımların uygulanması gelecek için ümit vermektedir (Işık AT ve ark., 2009). Önemli demiyelinizan hastalıklardan biri olan multipl skleroz (MS) tedavisinde kök hücrelerin myelin hasarını düzelterek remyelinizasyonu sağladığı gösterilmiştir (Deda H, 2008). Amniyotrofik lateral sklerozis (ALS) yaygın üst ve alt motor nöron dejenerasyonu ile seyreden, semptomların başlangıcından itibaren ortalama üç yıl içinde, genellikle solunum yetmezliğine bağlı olarak ölümle sonuçlanan bir hastalıktır (Şener Özden H, 2009). Kesin olarak ALS tanısı almış olan altı hastaya allojenik kök hücre tedavisi uygulanmış ve immunomodulatör hücreler olarak motor nöron hasarının olduğu bölgeye bu hücrelerin yerleştiği gösterilmiştir. Bu hücrelerin hastaların yaşam sürelerinde bir uzama sağlamamasına rağmen santral sinir sisteminde yapılacak gen tedavileri için taşıyıcı olarak kullanılabilecekleri düşünülmüştür (Appel SH, 2008). ALS tanısı almış olan yedi hastanın otolog kemik iliğinden elde edilen hematopoetik hücreleri kendi spinal kordları içine yerleştirilmiştir. Üç yıllık takip sonucunda hastalarda belirgin kazanımlar olduğu gösterilmiştir. ALS hastalığında spinal kord içine “otolog mezankimal" kök hücrelerin direkt enjeksiyonunun güvenli, akut veya kronik toksisite göstermeyen ve iyi tolore edilen bir yöntem olduğu belirtilmiştir (Mazzini L ve ark., 2006). Bugüne kadar yapılan çalışmalara bakıldığında, ALS’de kök hücre uygulamalarının umut verici olduğu ancak uygulamanın bugün için bir tedavi olarak 52 algılanamayacağı, bir tedavi olarak yerini alabilmesi için bilimsel çalışmaların sürmesi gerektiği düşünülmektedir (Şener Özden H ve ark., 2009). Travmatik spinal kord yaralanmaları, tüm dünyadaki önemli sorunlarından biridir. Santral sinir sisteminin bu tür yaralanması ile dokudaki hücre kayıpları fazla olmakta, ciddi myelin kayıpları oluşmakta ve nöral bağlantıların yeniden kurulması adeta olanaksız hale gelmektedir. Son yıllarda yapılan yayınlarda gerek otolog kemik iliğinden elde edilen hematopoetik kök hücrelerin ve gerekse göbek kordon kanından elde edilen kök hücrelerin kronik spinal kord yaralanması olan hastalarda belirgin yararlar sağladığı gösterilmiştir (Deda H, 2008). Osteoartrit, yaygın bir eklem hastalığıdır. Artiküler kıkırdağın dejenerasyonu, kıkırdak rejenerasyon kapasitesinin kısıtlı olması ve terapötik seçeneklerin sınırlı olması nedeniyle ağır sonuçlara neden olabilmektedir. Küçük hasarlarda otolog kondrosit transplantasyonu ile tedavi gündemde olan bir konudur. Bu tedavinin esası, hücre süspansiyonu olarak otolog kondrositlerin ve destekleyici matriksin birlikte hasarlı bölgenin içine yerleştirilmesidir. (Pelttari K ve ark., 2008). Kardiyovasküler sistem hastalıkları günümüzde gelişmiş ve gelişmekte olan ülke toplumlarında mortalite ve morbiditenin en önemli sebebi olarak karşımıza çıkmaktadır. Kalpte kök hücre uygulamalarında olası etki mekanizmalarının; implante hücrelerin kalpte bulunan tüm hücre tiplerine differansiasyonu, parakrin sinyal yolaklarının aktifleşmesi (VEGF, bFGF, angiopoietin gibi), infarkt sınır zonunda apoptozisin önlenmesi, implante edilen hücrelerin kalpte bulunan hücrelere füzyonu, kalpte bulunan kök hücre nişlerinin stimülasyonu ile endojen onarımın tetiklenmesi mekanizmaları aracılığı ile ilgili olduğu spekülatif olarak öne sürülmektedir. Bu mekanizmaların tam 53 olarak açıklığa kavuşturulması ve manipüle edilebilmesiyle klinik uygulamalarda hücresel tedavilerin başarısının artırılması mümkün olabilecektir. Kök/öncül hücreler ile non-hematopoietik doku onarımını gerçekleştirme sürecindeki moleküler olaylar, halen yeterince açıklığa kavuşturulamamış gizemli ve karmaşık mekanizmaları içermektedir. Erişkin kök hücrelerin kardiyomiyositlere dönüşümü yolculuğundaki aşamalar ve moleküler yolakların açıklığa kavuşturulması ile akut miyokard infarktüsü, iskemik veya dilate kardiyomiyopati gibi pek çok kardiyovasküler hastalıkta alternatif tedavi çözümleri üretmeye olanak sağlanacaktır. Öte yandan, hangi hastalıkta hangi progenitör hücre grubunun kullanılacağı, progenitör hücrelerin hedef organa hangi yolla ulaştırılacağı, hastalığın hangi sürecinde kök hücre uygulanacağı gibi soruların yanıtlanmasıyla hücresel tedavilerden elde edilecek başarı umut edilen seviyelere ulaşabilecektir (Durdu S ve ark., 2009). Kemik iliği hücrelerinin kardiyovasküler hastalıklarda tedavi etme potansiyelini ilk kez Orlic ve ark.ları gündeme getirmişlerdir. Yaptıkları çalışmada, transjenik farelerde yeşil florasan protein (GFP) eksprese eden Lin-c-kit+ kemik iliği hücrelerini, deneysel myokart infarktı oluşturdukları farelerin kalbine enjekte etmişlerdir. Sonuçta kök hücrelerin infarktlı bölgedeki myokardı yenilediği gözlenmiştir (Orlic D ve ark., 2001). Rejeneratif tedaviler 1990’ların ortalarında prekürsör hücrelerin farklı tip hücrelere dönüşebileceğini gösteren deneyler sayesinde kardiyovasküler sistem alanına da hızlı bir giriş yapmıştır Miyokard hücrelerinin rejenerasyondan yoksun oldukları ya da çok az miktarda rejenerasyon kapasiteleri olduğu bilinmektedir. Ancak miyokard içinde rejeneratif hücrelerin tespit edilmesi bir şekilde bu hücrelerin manipüle edilmesi yönünde bir fikir doğurmuştur. Ayrıca, bu uyarının rejenerasyon kapasitesi olan kök 54 hücrelerin miyokarda yerleştirilmesi ile de olabileceği düşünülmüştür. Bu temel doğrultusunda akut ya da kronik nedenlerle zarar görmüş kalp kasının tamirinde değişik hücre serileri denenmiştir. Rostock Üniversitesi Tıp Fakültesi etik kurulunca değerlendirilip onaylanarak yapılan bir çalışmada‚ koroner arter baypas cerrahisi ile birlikte intramiyokardiyal olarak kök hücre uygulaması klinik çalışmalar dahilinde pratiğe geçirilmiştir. Bunun için gönüllü hastaların kemik iliğinden elde edilen CD133+ kök hücreler cerrahi sırasında hasta miyokarda transepikardiyal olarak enjekte edilmiştir. Her hastadan yaklaşık 100 ml kemik iliği aspire edilmiş ve bu kemik iliğinden ortalama 7.2 x 106 CD133+ kök hücre elde edilip hastalara implante edilmiştir. Bu kök hücrelerden, demir ile konjuge anti-CD133 antikorlar kullanılarak CD133+ kök hücreler işaretlenmiştir. İlerleyen dönem içerisinde hastaların hiçbirinde miyokard enfarktüsü ya da ölüm olmamış ve yeni kardiyak girişime ihtiyaç duyulmamıştır (Yerebakan C ve ark., 2009). Endotelyal öncül hücrelerin periferik kandan izolasyonu, endotel hücrelerine differansiasyonu ve angiogenezis bölgelerinde fonksiyonel süreçte görev almalarının Asahara ve ark. ları tarafından gösterilmesi ile vasküler tıpta yeni bir dönem başlamıştır. Bu deneysel çalışmalar sonrasında neovaskülarizasyonun yalnızca embriyonik yaşam sürecinde sınırlı kalmadığı, erişkinlerde de gerçekleşebildiği ortaya konulmuştur (Akar AR, 2009). Kemik iliğinden izole edilmiş otolog progenitör mononükleer hücreler, hücre implantasyonundan sonra vasküler endotelyal büyüme faktörü (VEGF) ve temel fibroblast büyüme faktöründe (FGF2) önemli bir artışla birlikte infarktlı kalplerde kollateral yeni damarlanmayı arttırmış, akut miyokard infarktüsünde kardiyak işlevde 55 önemli düzelme sağlamıştır. İnfarktlı kalplerde proliferatif ve aktive olmuş miyokard hücrelerinin varlığı da bildirilmiştir (Patel AN & Genovase JA, 2007). Otoimmün hastalıklar önemli morbidite ve mortaliteye neden olan bir hastalık grubudur. Otoimmun hastalıklar, bireyin kendi antijenlerine karşı immun reaksiyon sonucu oluşurlar. Spesifik immun cevaplar belli bir organ veya hücre tipine yönelerek lokal doku hasarı ile sonlanır ve bu hastalar genellikle irreversibl organ hasarı nedeniyle kaybedilirler. (Kumar V ve ark., 2008). Ağır ve tedaviye dirençli otoimmun hastalıkların tedavisi için kemik iliği veya periferik kandan otolog veya allojenik kök hücre transplantasyonu uygulanmaktadır (Carvalho JF ve ark., 2009). Otoimmun hastalıklarda yapılan kök hücre transplantasyonu ile umut verici sonuçlar elde edilmiştir. En iyi sonuçlar ise sistemik sklerozis, multipl sklerozis ve sistemik lupus eritamatozis de elde edilmiştir (Hügle T & Daikeler T, 2010). Kök hücrelerin keşfi bu hastaların hasara uğrayan organlarının tamiri için yeni bir umut olmuştur. Bu amaçla kişinin kendi kemik iliği veya göbek kordon kanından den elde edilen kök hücrelerin pankreatik β hücrelerini oluşturmak üzere kendine nakli veya yetişkin yada fetal pankreas dokusundan elde edilen ada prekürsör hücrelerinin nakli gibi farklı denemeler yapılmaktadır. Diabetes mellitus (DM), insülin bağımlı tip I ve insülin bağımsız tip II diyabeti olmak üzere iki tiptir. Tip II diyabette pankreas beta hücrelerinden insülinin salınımı yetmezliği gözlenirken, tip I diyabette pankreatik beta hücrelerinin immun yetmezlik sonucu yıkımı söz konusudur. Her iki tip diyabette de sonuçta langerhans adasının beta hücreleri hasar gördüğü için insülin yetmezliği ya da yokluğu gözlenir. Günümüzde diyabet tedavisi için geleneksel insülin tedavisi yapılmakta ve vücutta eksik olan insülin 56 dışarıdan hastaya verilmektedir. Yapılan çalışmalar göbek kordon kanının multipotent kök hücreler veya primitif progenitörleri içerdiğini ve bunların pankreatik β hücrelerini de içeren non hematopoietik fenotipteki hücrelere farklılaşma potansiyelinde olduklarını göstermiştir (Koblas T ve ark., 2009). İnsan göbek kordon kanından türetilmiş mezenkimal kök hücreleri (UCB-MSCs) tip1 diyabetin hücre replasman tedavisinde iyi bir uygulama potansiyeline sahiptirler ve in vitro olarak insülin üreten hücreler (IPCs) e farklılaşmayı uyarabilirler. İnsan UCBMSCs’ i Notch reseptör genlerini eksprese etmektedir. Yapılan bir çalışmada, Notch sinyalinin insan UCB-MSCs’ inin IPCs’ e farklılaşmasını regüle edip etmediği araştırılmıştır. Yapılan deneylerin sonucu göstermiştir ki; Notch sinyali çok fazla eksprese edildiğinde IPCs farklılaşmasını inhibe etmiştir. Aksine reseptör inhibitörü tarafından Notch sinyali azaltıldığında; indüklenen hücrelerde, kontrol grubuna göre insülin gen seviyesinin ortalama 3,06 kat, proinsülin protein ekspresyonun 2,60 kat ve IPCs oranını 1,62 kat arttığı gözlenmiştir. Bu yüzden Notch sinyalinin inhibisyonu IPCs’ in sayısını artırmada etkili bir yol olabileceği ve böylece tip1 diyabetin replasman tedavisinde adacık hücrelerinin yetersizliği çözülebileceği düşünülmüştür (Hu YH ve ark., 2010). Romatoid artrit sistemik, birçok dokuyu tutan fakat sıklıkla sakatlayıcı artritisle sonlanan eklem kıkırdağı ve alttaki kemiğin tahribine ilerleyen sistemik ve kronik bir hastalıktır. Juvenil romatoid artrit ise çocuklarda olan kronik idiyopatik artriti ifade eder (Kumar V ve ark., 2008). Juvenil romatoid artritli dört hasta üzerinde yapılan bir çalışmada kök hücre nakli ile ilgili alınan uzun dönem sonuçlarda hastaların 4-5 yıl boyunca olumlu sonuç verdiği rapor edilmiştir (Carvalho JF ve ark., 2009). 57 Sistemik lupus eritamatozis (SLE) pek çok self antijene karşı geliştirilen otoantikorların ve immun kompleks gelişmelerinin neden olduğu sistemik bir hastalıktır. Akut veya sinsi başlayabilir ve organizmadaki hemen her organı tutabilir. Ancak başlıca deri, böbrekler, serozal membranlar, eklemler ve kalbi tutar (Kumar V ve ark., 2008). SLE semptomları immun sistem baskılayan ilaçlarla tedavi edilmeye çalışılmıştır fakat bu ilaçlar hastalığı kontrol etmede yetersiz kalmışlardır. Tedaviye cevap vermeyen SLE’ li hastalar üzerinde yapılan bir çalışmada hastalara otolog nonmyeloablatif HKH transplantasyonu yapılmıştır. Sonuçta hastalık aktivitesinde iyileşme, serolojik markerlerda artma, organ disfonksiyonunda stabilizasyon veya iyileşme gözlenmiştir (Burt RK ve ark., 2006). Regülatör T hücresi eksikliğinde MKH’ lerin immunmodulator özellikleri nedeniyle farelerde tedavi için kullanılabileceği düşünülmüştür. MKH ile tedavi edilmiş farelerin distal ileum histopatolojisinde MKH’ lere özgü bir düzelme gözlemlenmiştir. MKH’ lerin otoimmun farelerde aktif hastalık sırasında mezenterik lenf nod (MLN) sellularitesini düşürdüğü ve MLN’ de aktive olmuş T hücre populasyonunu azalttığı gözlemlenmiştir. Yapılan çalışmada yeşil florasan proteini (GFP) kullanılarak MKH’ lerin barsakta kayda değer bir yerleşme göstermediği ancak GFP+ hücrelerinin MLN ve ikincil nodların içinde küme halinde bulundukları gösterilmiştir. Semikantitatif analizlerle MLN’ lerin içindeki GFP+ hücreleri ikincil nodlarla karşılaştırıldığında kümelerin sayısında bir farklılık olmadığını fakat MLN’ lerin içindeki GFP+ hücrelerinin farklı fibroblastoid morfolojisi ve komşu GFP+ hücreleriyle bir bağ oluşturduğu gözlenmiştir. Sonuç olarak MKH’ lerinin transplantasyonunun genel bir immunsupresyona neden olduğu kanıtlanmıştır. Bu bilgiler, barsağında MKH’ lerin 58 indüklendiği yeni bir yer olduğunu ve MKH’ lerin otoimmun enteropatiler için bir tedavi yöntemi olarak kullanılabileceğini göstermiştir (Parekkadan B ve ark., 2008). Myastenia gravis (MG), nöromüsküler iletimin hasarlı olduğu, kas-sinir kavşağının kas güçsüzlüğü ile karakterize otoimmun bir hastalıktır. Bu hastalarda anti asetilkolin reseptör antikorlar vardır ve postsinaptik membranda nörotransmitter olan asetilkoline duyarlılık azalmıştır. Hastalıkta tipik olarak güçsüzlük ilk olarak ekstraoküler kaslarda ortaya çıkar ve göz kapaklarında düşme ve çift görme gözlenir. Generalize kas güçsüzlüğü dramatik dalgalanmalar gösterebilir ve günler, saatler hatta dakikalar içinde değişebilir ve bu durum hastaların yaşam kalitelerini düşürmektedir (Kumar V ve ark., 2008). Önceden MG için pek çok tedavi uygulaması yapılmış, ancak hastalığın ilerlemesi engellenememiş olan 17 yaşındaki inatçı myastenia gravisli bir hastaya allojenik hematopoietik kök hücre transplantasyonu yapıldıktan sonra hasta izlenmiştir. Hasta 40 ay boyunca MG için özel bir tedavi almamasına rağmen, hastanın orofaringeal ve iskelet kas zayıflığının tamamen düzeldiği ancak oftalmoplejisinin inatçı bir şekilde devam ettiği ve anti asetilkolin reseptör antikor seviyelerinin yüksek olduğu rapor edilmiştir. Diğer tedavilerden yarar göremeyen inatçı MG olgularında, uzun dönemli etkileri hakkında bilinenler çok az olmakla birlikte allojenik hematopoietik kök hücre transplantasyonun tedavi için bir seçenek olabileceği düşünülmüştür (Strober J ve ark., 2009). Graft-versus-host hastalığı (GVHD), immun kompetan T hücreler veya onların prekürsörleri immunolojik olarak sorunlu alıcılara nakledildiğinde gelişen ve organ fonksiyon bozukluğu ile karakterize kompleks bir klinik sendromdur. GVHD alıcı ile donör arasında antijen uyumsuzluğu olduğunda gelişir (Kumar V ve ark., 2008). Hala 59 transplantasyon sonrası mortalitenin en büyük sebebi olan GVHD’ nın tedavisinde mezenkimal kök hücreler immun regülatör kapasiteleri nedeniyle kullanılmaktadır. Akut GVHD modelinde fareler üzerinde yapılan bir çalışmada, MKH’ ler hastalığın gelişmesini önlemiştir. İlginç bir şekilde, MKH’ lerin infüzyonunun sekonder lenfoid organlarda T lenfosit sayısını artırdığı da gözlenmiştir. MKH lerin ko-kültüre yada kotransferi ile T lenfositler ve dendritik hücrelerin doğal fenotiplerini korurken göç aktivitelerini değiştirdiği gösterilmiştir. MKH lerin ko- kültürü zaman ve doza bağlı olarak T lenfositler (CD4 CD25 regülator T hücreleri), CD62L ve CCR7 ekspresyonunu artırmakta ve CD69 ekpresyonunu baskılamaktadır. MKH’ ler T lenfosit aktivasyonunu down regüle etmekte, T lenfositlerin doğal fenotiplerini devam ettirmekte, böylelikle T lenfositlerin doğal fenotipleri ile SLOs içinde kalmasını ve perifere olgun T lenfosit geçişini engellemeyi sağlamaktadır. Dendritik hücreler immun yanıt için öncül hücrelerdir. CCR7’ nin ekspresyonu dendritik hücrelerin olgunlaşması ve SLOs içine göç etmelerinde çok önemlidir. Bununla birlikte, CCR7 ekspresyonu ve dendritik hücrelerin sekonder lenfoid doku kemokinleri aracılığıyla gerçekleşen göç aktivitesi MKH ko-kültürü tarafından önemli derecede baskılanmıştır. Sonuçta, akut GVHD un gelişiminde transplante edilen MKH’ lerin immunsupresif aktivitesine T ve dendritik hücrelerinin değişmiş göç özelliklerinin de katkıda bulunabildiği gösterilmiştir (Li H, 2008). Otoimmun hastalığı kontrol altında tutmak için yaşam boyu immünosupressif tedavi kullanılmasına rağmen kür sağlanamayabilir. Son yıllarda otoimmün hastalıkların tedavisi için yaşam boyu immünosupressif tedaviden kaçınmak ve hastalığın aktivitesini azaltmak için yeni tedavi seçenekleri denenmektedir. Hematolojik malignite ile birlikte 60 otoimmün hastalığı bulunan ve malignite nedeniyle kemik iliği transplantasyonu yapılan hastalarda, her iki hastalığın da remisyona girmesiyle ilgili gözlemler otoimmün hastalıkların tedavisinde kök hücre transplantasyonunun etkin olabileceğini işaret etmiştir (Şentürk T & Bolaman AZ, 2003). Kanser tüm dünyada en önde gelen mortalite ve morbidite nedenidir. Günümüzde kanser tedavisinde; ameliyat, kemoterapi ve radyasyon tedavisinin değişen kombinasyonları uygulanmaktadır. Kanser tedavisi konusunda tüm dünyada çalışmalar hızla devam etmektedir. Bu çalışmalardan birisi de kök hücrelerin kanserdeki rolü üzerinedir. Tedaviye yanıt vermeyen bazı kanser türlerinde hastalığa sebep olan hücrelerin kanser kök hücreleri olabileceği düşünülmüştür. Kanser kök hücrelerinin bulunmasından sonra bu hücrelerin yüzey markerleri belirlenmeye ve hücrelerin farklılaşmasındaki yolaklar ortaya çıkarılmaya çalışılmıştır. Kanser kök hücrelerinde belirlenen bu yüzey markerleri ve yolaklarda görev alan basamaklar bloke edilebildiği zaman kanserin de kontrol altına alınabileceği düşünülmüştür (Koç Ö ve ark., 2000). Bununla ilgili olarak yapılan bir çalışmada, kolorektal kanser (CRC) lerin patogenezinde kolorektal kanser kök hücrelerinin rolü araştırılmış ve bu hastalığın tedavisi için bu kök hücrelerin potansiyel bir hedef olabileceği düşünülmüştür. Kolorektal kanser kök hücrelerinin CD133, CD44, ve Lgr5 gibi değişik potansiyel markerleri tanımlanmıştır. Kök hücrelerin kendi kendilerini yenilemelerini, farklılaşmalarını ve proliferasyonlarını kontrol eden Wnt ve TGF-β yolakları da tanımlanmış ve bunların bloke edilebildiği durumda kanserin kontrol altına alınabileceği gösterilmiştir (Thenappan A ve ark., 2009). 61 Kanserde kök hücrelerin bir diğer kullanımı kemoterapi sonrası azalan kan hücrelerinin sayısının artırılmasında kullanımıdır. Yapılan bir çalışmada, yüksek doz kemoterapi sonrası otolog kök hücre desteği yapılan meme kanserli olgularda periferal kan progenitör hücreleri ile eş zamanlı MKH infüzyonunun kan hücrelerinin engrafmanını hızlandırdığı ve infüzyon sırasında ve sonrasında MKH infüzyonuna bağlı hiçbir yan etki görülmediği gösterilmiştir (Koç Ö ve ark., 2000). Kök hücreler hedef dokuya eğilimli olmaları nedeniyle taşıyıcı sistem olarak da kansere karşı kullanılmaktadırlar. Son zamanlardaki çalışmalar kemik iliği kökenli mezenkimal kök hücrelerin tümör dokusuna yerleştiğini ve tüm tümör dokusunu kapsadığını göstermektedir. Farelerde oluşturulan metastatik akciğer kanser modelinde, MKH ler TNF-bağlı apoptozis indükleyen bir ligant (TRAIL) aracılığıyla tümör hücrelerini apoptozise uğratmak üzere farelere verilmiştir. Bu ligand tümör hücrelerinin seçici olarak apoptozisine sebep olan bir transmebran proteinidir ve büyümekte olan tümörleri önemli derecede küçülttüğü doğrulanmıştır. Bu çalışma, TRAIL eksprese eden MKH’ ler kullanılarak metastatik tümörlerde önemli oranda azalmayı gösteren ilk çalışmadır (Loebinger MR ve ark., 2009). İlaç keşfinde kök hücre kullanımı ile ilgili olarak insan embriyonik kök hücreleri, yeni ilaçların gelişiminde ve test edilmesinde kullanılabilir. Örneğin, pluripotent insan hücre serilerinden elde edilen farklılaşmamış hücreler üzerinde, yeni ilaç tedavilerinin güvenilirliği test edilebilir. Diğer başka hücre serileri de bu amaçla halen kullanılmaktadır. Örneğin, kanser hücre serileri, potansiyel anti-tümör ilaçlarının takibinde kullanılmaktadır. Fakat, pluripotent kök hücrelerinin eldesiyle, ilaçların daha fazla sayıda hücre tipleri üzerinde test edilmesi mümkün olabilir. Kan hastalıkları ile 62 ilgili bir ilaç kan kök hücrelerinde, kas hastalıkları ile ilgili bir ilaç da kas kök hücrelerinde denenebilecektir. Bunun yanı sıra, ilaçları etkin bir şekilde denemek için, farklı ilaçların karşılaştırılmasında kullanılan şartlar aynı olmalıdır. Dolayısıyla, bilim adamları kök hücrelerinin ilaçları deneneceği hücre tipine farklılaşmasını tam olarak kontrol etmek zorunda kalacaklardır. Farklılaşmayı kontrol eden sinyallere ilişkin mevcut bilgiler, şimdilik söz konusu şartları taklit etmeye yetmemektedir (Karaöz E, 2004). Kök hücreler ile ilgili olarak halen şu soruların cevapları aranmaktadır: Kök hücrelerin genetik yapıları nasıldır ? Kök hücreleri harekete geçiren, onları hedef dokuya yönelten ve proliferasyonunu uyaran faktörler nelerdir ? Kök hücrelerin de-diferansiyasyon ve re-diferansiyasyon potansiyelleri nasıldır ve bunlar ne şekilde manüple edilebilir ? Kök hücre nakli, organ naklinin yerini alacak mı ? Kök hücre tedavileri ile diyabet, parkinson, felç, romatoid artrit, alzheimer gibi hastalıkların tedavisi mümkün olacak mı ? Kök hücrelerle bu hastalıkların tedavileri için ne kadar zamana ihtiyacımız var ? İnsanlarda kök hücre tedavileri açısından cevap arayan pek çok sorunun cevabı henüz bilinmemektedir. Kök hücrelerin özelleşmiş hücrelere dönüşümlerinde etkili olan mekanizmalar yeni yeni araştırılmaya başlanmıştır. Bilim kök hücreleri yeni keşfetmiş ve onları tanımaya çalışmaktadır. Şu an elde olan verilerle kök hücre uygulamalarının geleceğini tahmin etmek ise olanaksız gözükmektedir. 63 Günümüzde embriyonik ya da erişkin dokulardan elde edilen kök hücrelerin, uygun ortam ve koşullar oluşturularak birçok hücre tipine in vitro koşullarda farklılaşmaları sağlanmıştır. Ancak farklılaştırılan hücrelerin, in vivo tedavide kullanımları için, hücrelerin çoğalma kontrol mekanizmalarının ve genetik yapılarının çok iyi bilinmesi gerekmektedir. Elde edilecek bu hücrelerden oluşturulacak hücre, doku ya da organların hasarlı olan bölgeye aktarılması yerine koyma (reperatif) ve tamir etme (rejeneratif) tedavilerin yolunu açacaktır. Bu konuda yapılan son çalışmalar, farklılaştırılan bu hücrelerin de-diferansiyasyon ve re-diferansiyasyon potansiyellerini, hücrelerin çoğalma ve göçlerinin kontrolünü araştırmak yönündedir. Bu konunun aydınlatılması için daha birçok çalışmaya gereksinim olduğu da görülmektedir. Kök hücrelerin, kalp kasının yenilenmesinde, dejeneratif ve inflamatuvar kıkırdak ve kemik hastalıklarında, diyabet tedavisinde, ateroskleroz nedeniyle işlevini yitiren kan damarlarının yenilenmesinde, parkinson ve alzheimer gibi santral sinir sistemi hastalıklarında, omurilik yaralanmalarında, karaciğer hasarlarında ve çeşitli kanserler dahil olmak üzere birçok hastalık gruplarında kullanılabilmeleri için yapılan deneysel ve klinik çalışmalar hızla devam etmektedir. Kök hücrelerin; diyabet, alzheimer, multipl skleroz ve diğer çeşitli hastalıklarda etkin sonuçlar verdiği, hayvan deneyleri ile ispatlanmıştır. Diğer yandan, hayvan modelleriyle karşılaştırıldığında insan hastalıklarında, tedavi sonuçlarının önceden tahmin edilebilmesi zorluklar taşımaktadır (Elçin YM, 2009). Klinik olarak, ortopedik kusurlar, impotans gibi bazı ürolojik rahatsızlıklar ve bazı deri hastalıklarında kök hücre tedavisi ile ilgili çalışmalar ilerlemiş durumdadır (İnan S & Özbilgin K, 2009). Yakın bir gelecekte, kök hücrelerin kanser ve nörodejeneratif 64 bozukluklara yönelik geliştirilen yeni ilaç adaylarının tanımlanmasında da kullanılmaları söz konusu olabilecektir (Elçin YM, 2009). Sonuç olarak, günümüzde çözümü olmayan pek çok hastalığın tedavisinde kök hücreler ümit vaat etmektedir. Bu çalışma ile kök hücrelerin ne olduğu, kök hücrelerin eldesi ve çeşitli hastalıkların tedavisinde kullanımı ile ilgili güvenilir, sağlam ve bilimsel bir kaynak sadece eczacıların değil tüm sağlık personelinin hizmetine sunulmuştur. KAYNAKLAR Akar AR. Kardiyovasküler Hastalıklarda Kök Hücre Uygulamaları. Kök Hücre Biyolojisi ve Klinik Uygulamalar. Yalçın Matbaacılık, Ankara, 2009; 77-85. Arat M. Hematopoietik Kök Hücre Nakli. Kök Hücre Biyolojisi ve Klinik Uygulamalar. Yalçın Matbaacılık, Ankara, 2009; 69-75. Appel SH, Engelhardt JI, Henkel JS, Siklos L, Beers DR, Yen AA, Simpson EP, Luo Y, Carrum G, Heslop HE, Brenner MK, Popat U. Hematopoietic stem cell transplantation in patients with sporadic amyotrophic lateral sclerosis. Neurology. 2008;71(17):1326-34. Aghajanova L, Horcajadas JA, Esteban FJ, Giudice LC. The Bone Marrow-Derived Human Mesenchymal Stem Cell: Potential Progenitor of the Endometrial Stromal Fibroblast. Biol Reprod. 2010;82(6):1076-87. Beksaç M. Hematopoietik Kök Hücrenin Moleküler Biyolojisi. Moleküler Hematoloji ve Sitogenetik Alt Komitesi. Temel Moleküler Hematoloji Kursu. Mersin 12-13 Mart 2005; 27-30. Burt RK, Traynor A, Statkute L, Barr WG, Rosa R, Schroeder J, Verda L, Krosnjar N, Quigley K, Yaung K, Villa Bs M, Takahashi M, Jovanovic B, Oyama Y. Nonmyeloablative 65 hematopoietic stem cell transplantation for systemic lupus erythematosus. JAMA. 2006; 295(5):527-35. Can A, Karahüseyinoğlu S. Erişkin Kök Hücrelerin Farklanmasındaki Hücresel ve Moleküler Mekanizmalar. Sağlıkta Birikim Dergisi; Kök Hücre: Biyolojik ve Klinik Yaklaşım 2009;1(5): 57-65. Carvalho JF, Pereira RM, Gershwin ME. Hematopoietic cell transplants in autoimmunity. Isr Med Assoc J. 2009;11(10):629-32. Cheng L, Chen H, Yao X, Qi G, Liu H, Lee K, Lee K, Zhang J, Chen S, Lin X, Zhao W, Li J, Li M. A. Plant-Derived Remedy for Repair of Infarcted Heart.Plos One 2009;4(2):e4461. Çetinkaya DU. Mezenkimal Kök Hücreler. Kök Hücre Biyolojisi ve Klinik Uygulamalar. Yalçın Matbaacılık, Ankara, 2009; 53-6. Deda H. Nörolojik Hastalıklarda Kök Hücre Tedavileri. Sinir Sistemi Cerrahisi Derg. 2008; 1(3): 142-52. Delioğlu Gürhan İ, Özen MÖ, Sözer P, Lüleci İ. Kök Hücreler ve Doku Mühendisliği. Sağlıkta Birikim Dergisi; Kök Hücre: Biyolojik ve Klinik Yaklaşım 2009; 1(5): 143-68. Durdu S, Çubukçuoğlu Deniz G, Akar AR. Otolog Kök Hücre Tedavisi Ve Cerrahi Miyokardiyal Revaskülarizasyon. Anadolu Kardiyol. Derg. 2009; 9: 456-6. Elçin YM. Embriyonik Kök Hücreler. Kök Hücre Biyolojisi ve Klinik Uygulamalar. Yalçın Matbaacılık, Ankara, 2009; 23-8. Fındıklı N. İnsan Embriyonik Kök Hücresi. Sağlıkta Birikim Dergisi; Kök Hücre: Biyolojik ve Klinik Yaklaşım 2009;1(5): 45-56. Hu YH, Wu DQ, Gao F, Li GD, Zhang XC. Notch signaling: a novel regulating differentiation mechanism of human umbilical cord blood-derived mesenchymal stem cells into insulinproducing cells in vitro. Chin Med J 2010;123(5):606-14. Hügle T, Daikeler T. Stem cell transplantation for autoimmune diseases. Haematologica. 2010; 95(2):185-8. 2 Işık AT, Bozoğlu E, Çelik T, Ural AU, Ulusoy MG, Akdağ E, EliboB. Streptozotosinle Oluşturulan Deneysel Alzheimer Hastalığı Modelinde Mezenkimal Kök Hücre Tedavisi. Geriatri ve Geriatrik Nöropsikiyatri Dergisi 2009;1(Özel):102-3. İnan S, Özbilgin K. Kök Hücre Biyolojisi. Sağlıkta Birikim Dergisi, Kök Hücre: Biyolojik ve Klinik Yaklaşım 2009; 1(5): 11-23. In Stem Cell Information [World Wide Web site]. Bethesda, MD: National Institutes of Health, U.S. Department of Health and Human Services, 2009 [http://stemcells.nih.gov/info/basics/basics10], Erişim Tarihi: 03 Mart 2010. Jing D, Fonseca AV, Alakel N, Fierro FA, Muller K, Bornhauser M, Ehninger G, Corbeil D, Ordemann R. Hematopoietik Stem Cells in Coculture With Mesencymal Stromal CellsModelling the Niche Compartments İn Vitro. Haematologica 2010;95(4):542-50. Kim SY, Lee S, Hong SW, Min BH, Lee KU, Bendayan M, Park IS. Nestin Action During Insulin- secreting Cells Differentiation. J Histochem Cytochem 2010;58(6):567-76. Karaöz E, Ovalı E. “Kök Hücreler”, Derya Kitabevi, Trabzon, 2004;3-6;40-5. Karaöz E. Erişkin Kök Hücre Plastisitesi: Sanılanlar Ve Gerçekler. Sağlıkta Birikim Dergisi, Kök Hücre: Biyolojik ve Klinik Yaklaşım 2009;1(5): 81-143. Kara MA. Kök Hücre Araştırmaları Hakkında. T Klin Tıp Etigi-Hukuku-Tarihi 2004; 12:12131. Kansu E. Kök Hücre Biyolojisi ve Plastisitesinde Güncel Kavramlar. Hacettepe Tıp Dergisi 2005; 36: 191-97. Kaufman MH, Robertson EJ, Handyside AH, Evans MJ. Establishment of Pluripotential Cell Lines From Haploid Mouse Embryos. J. Embryol. exp. Morph. 1983;73: 249-61. 3 Kelleher-Andersson J. Discovery of neurogenic, Alzheimer's disease therapeutics. Curr Alzheimer Res. 2006;3(1):55-62. Koca E, Akpek G. Graft Versus Host Hastalığı ve Tedavi Yöntemleri. Turkiye Klinikleri J Int Med Sci 2006; 2(19):23-32. Koç ÖN, Gerson SL,Cooper BW, Dyhouse SM, Haynesworth SE, Caplan AI, Lazarus HM. Rapid hematopoietic recovery after coinfusion of autologous- blood stem cells and culture expanded marrow mesenchymal stem cellsin advanced breast cancer patients receiving high dose chemotherapy J Clin Oncol 2000; 18: 307–16. Koçer B, Nazlıel B. Alzheimer Hastalığı’nda Genetik Faktörler. Turkiye Klinikleri J Neur 2003; 1. Konyalıoğlu S, Özgönül M, Dağcı T. Effects of Embryonic Neural Stem Cell Therapy on Oxidative and Nitrosative Stress Biomarkers in Acute and Chronic Spinal Cord Injured Rats. Turkiye Klinikleri J Med Sci 2009;29(2):429-37. Koblas T, Zacharovova K, Berkova Z, Leontovic I, Dovolilova E, Zamecnik L, Saudek F. In Vivo Differentiation of Human Umbilical Cord Blood-Derived Cells into Insulin-Producing β Cells. Folia Biologica (Praha) 2009; 55: 224-32. Kumar V, Abbas AK, Fausto N, Mitchell RN Çevri: Uğur Ç. Kitap:Temel Patoloji. Nobel Tıp Kitapları 8. Basım. Eylül 2008;ss 135-830. Layden BT, Newman M, Chen F, Fisher A, Lowe WL Jr. G Protein Coupled Receptors in Embryonic Stem Cells: A Role for Gs-Alpha Signaling. Plos One 2010; 8;5(2):e9105. Li H, Guo Z, Jıang X, Zhu H, Li X, Mao N. Mesenchymal Stem Cells Alter Migratory Property of T and Dendritic Cells to Delay the Development of Murine Lethal Acute Graft-Versus-Host Disease. Stem Cells. 2008;26(10):2531-41. 4 Li G, Zhang XA, Wang H, Wang X, Meng CL, Chan CY, Yew DT, Tsang KS, Li K, Tsai SN, Ngai SM, Han ZC, Lin MC, He ML, Kung HF. Comparative Proteomic Analysis of Mesenchymal Stem Cells Derived From Human Bone Marrow, Umbilical Cord, and pPlacenta: Implication in the Migration. Proteomics. 2009;9(1):20-30. Loebinger MR, Eddaoudi A, Davies D, Janes SM.Mesenchymal stem cell delivery of TRAIL can eliminate metastatic cancer. Cancer Res. 2009;69(10):4134-42. Madri JA. Modeling The Neurovascular Niche: İmplications For Recovery From CNS İnjury. J. Physiol Pharmacol 2009;60 Suppl 4: 95-104. Marciniak-Czochra A, Stiehl T, Wagner W. Modeling of replicative senescence in hematopoietic development. Aging (Albany NY) 2009;1(8):723-32. Mazzini L, Mareschi K, Ferrero I, Vassallo E, Oliveri G, Boccaletti R, Testa L, Livigni S, Fagioli F. Autologous mesenchymal stem cells: clinical applications in amyotrophic lateral sclerosis. Neurol Res. 2006;28(5):523-6. Mıcılı Cilaker S, Özoğul C. Diyabette Kök Hücreler. DEÜ Tıp Fakültesi Dergisi 2007; 2(21): 109-17. Niknejad H, Peirovi H, Ahmadiani A, Ghanavi J, Jorjani M. Differentiation Factors That İnfluence Neuronal Markers Expression In Vitro From Human Amniotic Epithelial Cells. Eur Cell Mater. 2010; 19:22-9. Orlic D, Kajstura J, Chimenti S, Jakoniuk I, Anderson SM, Li BS. et al. Bone Marrow Cells Regenerate İnfarcted Myocardium. Nature 2001; 410(6829): 701-5. Özmen S, Fındıkçıoğlu F, Siemionow M. Kök Hücreler. Türk Plast. Rekonstr. Est. Cer. Derg. 2006; 3(14):187-96. 5 Özel HB, Ozan E, Dabak Ö. Embriyonik Kök Hücreler. Turkiye Klinikleri J Med Sci 2008; 28: 333-41. Patel AN, Genovese JA, Kalp yetersizliğinde kök hücre tedavisi. Current Opinion in Cardiology Türkçe Baskı 2007;22: 464–70. Pelttari K, Steck E, Richter W. The use of mesenchymal stem cells for chondrogenesis. Injury. 2008;39 Suppl 1: 58-65. Parekkadan B, Tilles AW, Yarmush ML.Bone marrow-derived mesenchymal stem cells ameliorate autoimmune enteropathy independently of regulatory T cells.Stem Cells. 2008;26(7):1913-9. Sargın D. Kök Hücre ve Kök Hücre Tedavisi. XXX. Ulusal Hematoloji Kongresi Mezuniyet Sonrası Eğitim Kursu. İstanbul 10- 14 Ekim 2003; 49-61. Sağsöz H, Ketani MA. Kök Hücreler. Dicle Üniv. Vet. Fak. Derg. 2008; 1(2): 29-33. Sağlık Bakanlığı Genelgesi. Kök Hücre Çalışmaları. 01.05.2006 / 8647 Sağlık Bakanlığı. Türkiye Kök Hücre Koordinasyon Merkezi Çalışma Esasları Yönergesi 07.08.2008/ 30161 Sağlık Bakanlığı. Kordon kanı bankacılığı hakkındaki yönetmelik 05.07.2005/ 25866 Sökmensüer Karakoç L. Embriyonik Kök Hücreler ve Tedavi Amaçlı Kullanımları. Hacettepe Tıp Dergisi 2007; 38: 15-9. Strober J, Cowan MJ, Horn BN. Allogeneic hematopoietic cell transplantation for refractory myasthenia gravis. Arch Neurol. 2009;66(5):659-61. Sun N, Longaker MT, Wu JC. Human iPS cell-based therapy: Considerations before clinical applications.Cell Cycle 2010; 2:9(5). 6 Şahin F, Saydam G, Omay SB. Kök Hücre Plastisitesi ve Klinik Pratikte Kök Hücre Tedavisi. Türk Hematoloji-Onkoloji Dergisi. 2005;1(15): 48-56. Şahin G, Kırık D. Parkinson Hastalığında Hücre Tedavisinin Bilimsel Temelleri ve Güncel Uygulamaları. Kök Hücre Biyolojisi ve Klinik Uygulamalar. Yalçın Matbaacılık, Ankara, 2009; 87-92. Şener Özden H, Parman Y, Şengün İ, Koç F, Oflazer P. Amyotrofik Lateral Sklerozda Kök Hücre Uygulamaları. Turk Norol Derg 2009;15:105-8. Şentürk T, Bolaman AZ, Otoimmün Hastalıklarda Hematopoietik Kök Hücre Transplantasyonu. T Klin D İmmünol Romatol 2003, 3: 88-94. Thenappan A, Li Y, Shetty K, Johnson L, Reddy EP, Mishra L. New Therapeutics Targeting Colon Cancer Stem Cells. Curr Colorectal Cancer Rep. 2009;5(4):209 Türkşen K. İnsan Embriyonik Kök Hücreleri İzolasyon İdame ve Farklılaşma. 9. Mezuniyet Sonrası Eğitim Kursu, Canada 9 Kasım 2006; 9-15. Thomson JA, Itskovitz- Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM. Embryonic Stem Cell Lines Derived From Human Blastocysts. Science 1998;282(5391):1145-7. Ural AU. Kök Hücreler. Türk Ortopedi ve Travmatoloji Birliği Derneği Dergisi. 2006; 34(5):140-45. Vatansever S. Embriyonik Kök Hücreler. Sağlıkta Birikim Dergisi; Kök Hücre: Biyolojik ve Klinik Yaklaşım 2009; 5 (1): 25-44. Yerebakan C, Uğurlucan M, Kaminski A, Westphal B, Liebold A, Steinhoff G. Kardiyak Kök Hücre Tedavisi. Anadolu Kardiyol. Derg 2009; 9: 457-64. 7 Yılmaz O, Uçar M. Kök Hücre Çalışmaları ve Terapötik Klonlama. Hayvancılık Araştırma Dergisi 2006; 16, 1: 26–31 Yılmaz M. Mezenkimal Kök Hücrelerin Tanımlanması ve Fenotipik Özellikleri. Türk Hematoloji Derneği’nin Eğitim Çalışmalarından Mezenkimal Kök Hücre Kursu. Çeşme 12 Ekim 2008;11-3.