Madde, atom adı verilen taneciklerden oluşur.Atom maddenin yapı
advertisement
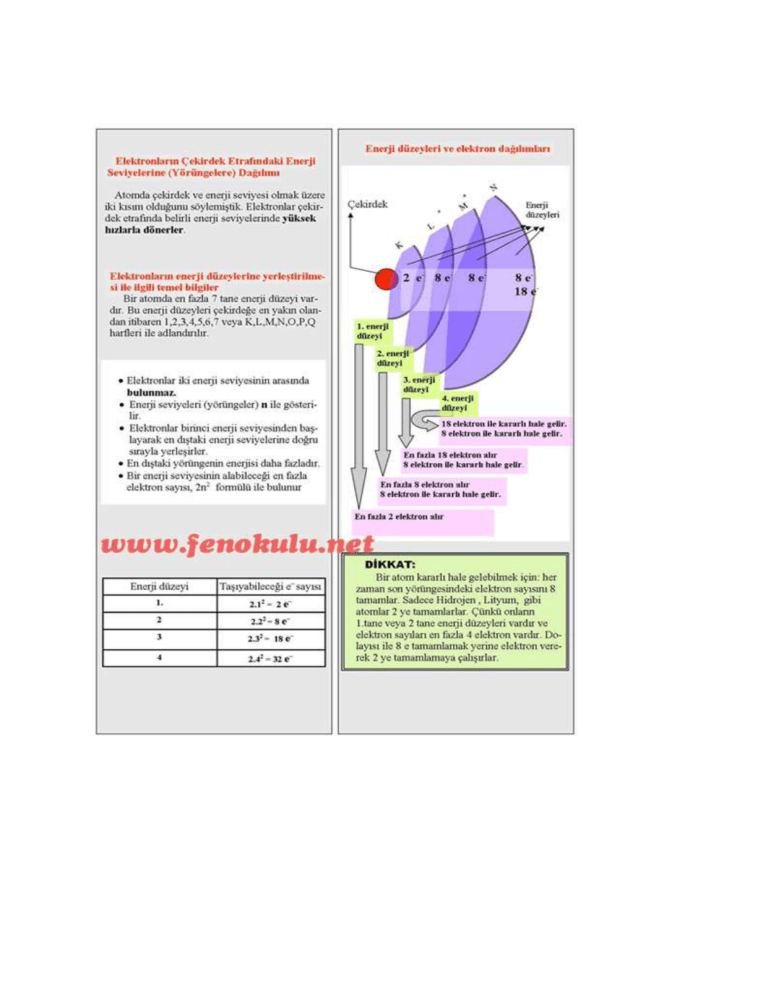
Madde, atom adı verilen taneciklerden oluşur.Atom maddenin yapı taşıdır. Atomun yapısında proton, nötron ve elektron bulunur. Proton ve nötron atomun çekirdeğinde yer alır. Elektron ise çekirdek etrafında dolanır. Atomu oluşturan tanecikler belli başlı özellikleri vardır. Proton: Atomun çekirdeğinde bulunur. (+) yüklü bir parçacıktır. Kütlesi 1 akb’dir. Nötron: Atomun çekirdeğinde bulunur. Kütlesi hemen hemen protona eşittir. Elektrik yükü taşımaz.Yani yüksüz bir parçacıktır. Elektron: Atomun çevresinde çok büyük hızla dönen hareketli bir parçacıktır. Elektronlar çekirdek etrafında farklı enerji seviyelerinde dolanır. Atom çekirdeğinin çapı, atom çapının 100 binde biri kadardır. Atom çekirdeğinde yüklü olarak sadece protonlar bulunduğu için, atomun çekirdek yükü daima (+) artıdır. 1 Karbon atomunun kütlesinin 1/12’sine, 1 atomik kütle birimi adı verilmiştir. Atomik kütle birimi akb ile gösterilir. 1 Karbon atomu = 12 akb’dir. Kimyasal hesaplamalarda atomların kütleleri gram cinsinden değil, akb cinsinden alınır. Atom numarası: Bir element atomunun çekirdeğinde bulunan proton sayılarının toplamına, atom numarası adı verilir. Atom numarası Z ile gösterilir.Z = Kütlenumarası: Bir atomun çekirdeğindeki proton ve nötron sayılarının toplamı, o atomun kütle numarasını verir. Kütle numarası A ile gösterilir. Kütle numarası = Proton sayısı + Nötron sayısı A=p+n Nötr ve Yüklü Atom: Bir atomdaki proton ve elektron sayıları birbirine eşitse bu atoma nötr atom denir. Nötr atomda (+) ve (–) yükler birbirine eşittir. Örneğin nötr karbon atomunda 6 proton 6 elektron vardır. Nötr atomda, p = e’dir. Atomlar elektron alıp verebilirler. Ancak çekirdekte bulunan proton ve nötronu alıp veremezler. ÖRNEK: Nötr bir magnezyum atomunda proton sayısı 12, nötron sayısı 13’tür. Bu atomun; a. Elektron sayısı nedir? b. Kütle numarası nedir? Çözüm a. Nötr atomda elektron ve proton sayısı birbirine eşittir. O hâlde, p = e = 12 dir. b. Kütle no = A = p + n p = 12, n = 13 olduğuna göre, A = 12 + 13 = 25 (–) yüklü atomEğer bir atom dışarıdan elektron alırsa (–) yük sayısı (+) yük sayısından fazla olur. Bu durumda atom (–) yüklü olur. Örneğin nötr flüor atomunun 9 elektronu, 9 protonu vardır. Flüor atomu 1e– alınca 10 elektronlu ve (–) yüklü olur. (+) yüklü atom Eğer bir atom bir elektronunu kaybederse, (+) yük sayısı (–) yük sayısından fazla olur. Bu durumda atom (+) yüklü olur. Örneğin nötr lityum atomunun 3 protonu 3 elektronu vardır. Lityum 1e– verirse 2 elektronlu ve (+) yüklü olur. Elementlerin Sembollerle Gösterilmesi Kimyasal hesaplamalarda maddelerin Lâtince isimleriyle işlem yapmak zordur. Bunun yerine elementlerin Lâtince isimlerinin kısaltmalarından oluşan semboller kullanılır. Element sembollerinde ilk harf her zaman büyük, varsa diğerleri daima küçük yazılır. Örneğin; Hidrojen H, Helyum He, Karbon C Kalsiyum Ca, Bor B, Berilyum Be Element sembolünün sol üst köşesine atomun kütle numarası, sol alt köşesine ise atom numarası yazılır. Elektron Dağılımı Elektronlar çekirdek çevresinde belli enerji seviyelerinde ve belli sayılarda dolanır. Enerji seviyeleri çekirdekte dışa doğru, 1. seviye, 2. seviye, 3. seviye şeklinde sıralanır. Bazen enerji seviyeleri, K, L,M, N... harfleriyle de gösterilir. 1. seviyede en fazla 2 elektron bulunur. 2. seviyede en fazla 8 elektron bulunur. Bir enerji seviyesinde bulunabilecek en fazla elektron sayısı, 2 n2 bağıntısı ile hesaplanır. (n, enerji seviyesini gösterir.) Atomun en dış enerji seviyesinde en fazla 8 elektron bulunabilir. En dış enerji seviyesinde 8 elektron bulunduran elementlere soy gazlar ya da asal gazlar adı verilir. Bunun tek istisnası helyumdur. Helyum elementi soy gaz olduğu hâlde 2 elektronu vardır. Örnek: İlk iki enerji seviyesi dolu olan bir atomun toplam elektron sayısı nedir? Örnek: Atom numarası 13 olan nötr bir atomun elektron dağılımı nasıl olur? Örnek: 18X atomunun elektron dağılımı nasıldır? Örnek: Üçüncü enerji seviyesinde 2 elektron bulunan bir atomun atom numarası kaçtır? A)6 B)10 C) 12 D) 26

















