csu > calkol - files.eba.gov.tr
advertisement

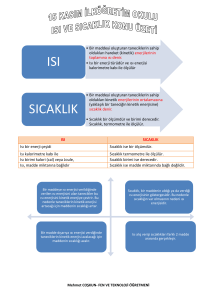
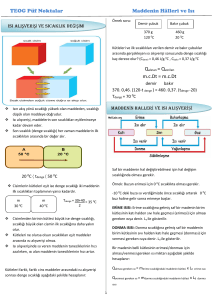
ISI-SICAKLIK VE HAL DEĞİŞİMİ Sıcaklık: Maddeleri oluşturan taneciklerin ortalama hareket enerjisidir. Birimi 0C dir. Isı alan maddenin sıcaklığı yükselir; ısı veren maddenin sıcaklığı düşer. Sıcaklık termometre ile ölçülür. Şekilde verilen kaplarda başlangıç sıcaklıkları aynı olan aynı maddeler bulunmasına ve bu kaplar özdeş ısıtıcılarla eşit süre ısıtılmasına rağmen, son durumda 200 g su bulunan kaptaki sıcakık daha azdır. Maddeyi oluşturan tanecik sayısı; yani kütle arttıkça o maddenin sıcaklığını artırmak için vermemiz gereken ısı miktarı artar. Öz Isı: Isı: Maddeyi oluşturan taneciklerin toplam enerjisine ısı denir. Bir enerji çeşidi olduğundan birimi joule veya kalori olarak kullanılır. Kalorimetre kabı ile ölçülür. Isı kavramının kullanılabilmesi için sıcaklıkları farklı maddeler arasında enerji akışı olması gerekir. Maddenin sahip olduğu ısıdan bahsedilemez; ancak yaydığı veya aldığı ısıdan bahsedilebilir. Bu nedenle “hava ısısı, suyun ısısı, vücut ısısı” gibi kullanımlar doğru değildir. Isı akışı sıcaklığı yüksek olan maddeden düşük olana doğrudur ve sıcaklık dengeleninceye kadar devam eder. Maddenin yaydığı/ aldığı ısı miktarı ısı kaynağına ve maddenin türüne bağlı olduğu kadar kütlesine de bağlıdır. ÖRNEK: 25 0C 100 g su 25 0C 200 g su 1 g maddenin sıcaklığını 1 0C artırmak için verilmesi gereken ısı miktarına öz ısı denir. Maddeler için ayırt edici bir özelliktir. Birimi joule/g 0C veya cal/g 0C olarak ifade edilir. “c” ile gösterilir. Öz ısısı yüksek olan madde geç ısınıp geç soğur; öz ısısı düşük olan madde çabuk ısınıp çabuk soğur. Eşit kütlede ve başlangıç sıcaklıkları aynı olan farklı maddelere eşit ısı verildiğini düşünelim. Bu maddelerden öz ısısı yüksek olan daha geç ısınacağından son sıcaklığı diğerinden düşük olur. ÖRNEK: csu > calkol 100 g alkol 100 g su 0 25 C 25 0C Bu kaplar özdeş ısıtıcılarla eşit süre ısıtıldığında suyun son sıcaklığı alkolden daha düşük olur. Çünkü suyun sıcaklığını artırmak için vermemiz gereken enerji miktarı daha fazladır. NOT Hal Değişimi Maddeleri oluşturan tanecikler arası çekim kuvveti ne kadar fazla ise o maddenin hal değişimi için yapması gereken ısı alışverişi de o kadar fazla olur. Katı maddelerdeki tanecikler birbirine en yakındır. Bu nedenle tanecikler arasındaki çekim kuvveti de en fazladır. ÖRNEKLER 20 g buzu sıvı hale getirmek için vermemiz gereken enerji kaç 0 kalori olur? (Le= 80 cal/g C) 17096 joule ısı alarak kaç gram alkol sıvı halden gaz hale geçer? (Lb: 854,8 joule/ g0 C) ERİME VE BUHARLAŞMA ISISI Katı maddenin sıvı hale geçtiği sıcaklık: Erime Noktası (E.N.) Sıvı maddenin gaz hale geçtiği sıcaklık: Kaynama Noktası (K.N.) Le : 1 g katı maddeyi sıvı hale geçirmek için gerekli olan ısı miktarı Lb: 1 g sıvı maddeyi gaz hale geçirmek için gerekli olan ısı miktarı