Mycobacterium tuberculosis
advertisement

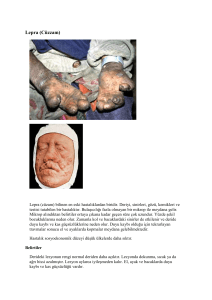
MİKOBAKTERİLER Prof. Dr. Nuri KİRAZ Tüberküloz çok eski çağlardan beri bilinen bir enfeksiyon hastalığıdır. M.Ö. 8000 İlk yerleşik topluluk oluşturması Sığırları evcilleştirmeye başlaması Hipokrat (MÖ 460-377) -Hastalık için "phytisis" deyimini kullanmış Vesalius(MS 1478) -Phitisisli hastaların otopsi incelemelerinde akciğerde kaviter lezyonların bulunduğunu bildirmiş Willemin (1865'de) -Tüberkülozlu hastaların kavitelerinden alınan materyeli inokule ettiği tavşanlarda tüberküloz geliştiğini göstermiş Robert Koch (1882'de) -Tüberküloz hastalığının Mycobacterium tuberculosis tarafından oluşturduğunu kanıtlanması Seibert (1930'da) -Saflaştırılmış protein türevi(PPD) testi Calmette ve Guerin (1921 de) -Tüberküloz aşısı, BCG (= Bacillus-CalmetteGuerin) Anti-tbc ilaçlarda kilometre taşları 1944'de Streptomisin 1946'da PAS 1950 de İNH 1954’de Pirazinamid 1962’de Ethambutol 1966'da rifampisin Tüberkülozda tedavi süreleri 1950, üçlü ilaç kombinasyonu ile 18-24 ay 1970, 6-9 ay Günümüzde ise 6 aylık tedavi rejimlerine geçilebilmiştir. Avrupa’da Tüberküloz Olguları, 1980-2003 400,000 350,000 300,000 250,000 200,000 150,000 100,000 50,000 02 20 00 20 98 19 96 19 94 19 92 19 90 19 88 19 86 19 84 19 82 19 19 80 0 Tüberküloz olguları 1/3 dünya populasyonu enfekte (DSÖ 2003) 8 milyon yeni olgu/yıl, 2 milyon ölüm/yıl (DSÖ) Primer bulaş yolu solunum ve kontamine aletler Bir çok ilaca karşı direnç geliştirmiş Virulansı yüksek mikroorganizmalar Dünya nüfusunun üçte biri bu bakteri ile infekte durumda ve bu insanların büyük çoğunluğu gelişmekte olan ülkelerde yaşıyor. Tüberkülozun hortlamasındaki Selam küçük kardeş ! en önemli neden; Geri döndüm ! bu hastalığın tüm dünyada yaygın olarak görüldüğü, çok sayıda toplu ölümlerin, iş gücü ve ekonomik kayıpların yaşandığı yıllarda bu hastalığa karşı açılmış olan savaşın günümüze kadar etkin bir şekilde sürdürülememesidir. MİKOBAKTERİLER LEPRA Mycobacterium leprae TÜBERKÜLOZ Mycobacterium tuberculosis complex Mycobacterium tuberculosis Tüberküloz Dışı Mikobakteriler (ATİPİK) (MOTT) (NTM) •M.tuberculosis Tek kaynak insan ve en sık görülen patojen.. •M.bovis Sığırlarda etken, insanlarda nadiren. •M.africanum Afrika’da insanlarda çok nadir. •M.ulcerans Nadiren insanlarda etken. •M.microti Kemiricilerde etken, insan için patojen değil. •BCG Bacille Calmett-Guerin. Tüberküloz Dışı Mikobakteriler (TDM) (Mycobacterium Other Than Tuberculosis : MOTT) (Non-Tuberculous Mycobacteria : NTM ) (ATİPİK MİKOBAKTERİLER) Sıklıkla patojen Potansiyel patojen Nadiren patojen (saprofit) M.kansasi, M.marinum M.avium-intracellulare (MAC), M.fortuitum, M.chelonae, M.simiae, M.scrofloceum, M.szulgai, M.xenopi, M.malmoense, M.haemophilum, M.asiaticum, M.abscessus, M.genavense M.gordonae, M.gastri, M.flavescens, M.vaccae, M.terrae, M.phlei, M.triviale,M.smegmatis,M.thermoresistible MİKOBAKTERİLER Mikobakteri cinsinin en temel özelliği; yavaş üremeleri aside dirençli olmaları ve hücre duvarlarında bol miktarda lipid içermeleridir. Gram pozitif bakteri S.aureus Gram negatif bakteri E.coli Aside dirençli bakteri M.tuberculosis MİKOBAKTERİLER Bakterinin asit-alkole dirençli boyanma özelliği; fiziki bütünlüğü yanında hücre duvarındaki bol miktarda bulunan mikolik asit ve lipit bariyer sistemine bağlıdır. Bu yapılarından dolayı boyayı zor alırlar ancak bir defa boyandılar mı kolay kolay bırakmaz ve asit alkol karışımı ile yapılan renksizleştirme işlemine direnç gösterirler. Gram yöntemi ile zor boyanırlar bu nedenle gram özelliklerinden söz edilmez. MİKOBAKTERİLER Aerop, sporsuz, hareketsiz bakterilerdir. Silindir şeklinde, 0.2-0.6 m eninde ve 1-10 m boyunda, düz veya hafif kıvrık basillerdir. Bazen dallanmış ve uzun filamentöz şekillerde ya da kokoidal formda olabilirler. Değişik morfolojide mikobakteriler a--Mycob. hyalinum b--Mycob. rubrum c--Mycob. cyaneum d--Mycob. bifiidum e--Mycob. citreum f--Mycob. filiforme. MİKOBAKTERİLER Genel olarak ilk izolasyonda çoğu tür 37 °C’de iyi ürer. En uygun üreme ısısı bazı türlerde (M.ulcerans, M.marinum, M.haemophilum) 30- 32 °C, bazı türlerde (M.xenopi) 42 °C ’dir. Üreme süreleri türlere göre 3 gün ile 2 ay arasında değişir. M.tuberculosis’in ikiye bölünme süresi ortalama 18 saattir. Bu nedenle katı besiyerlerinde kolonileri ancak 2-3. haftada görünür hale gelir. Genel olarak patojen türlerin; ikiye bölünme zamanı daha uzun, üreme ısıları daha sınırlı ve asit-alkole dirençleri daha fazladır MİKOBAKTERİLER Koloni görüntüsü türler arasında değişiklikler gösterir. S tipi : düzgün yüzeyli, nemli, sınırları düzgün koloni. (M.avium- intracellulare) R tipi: kenarları düzensiz, yüzeyi pürtüklü, kuru koloni. (M.tuberculosis) S-R tipi: Ara formda. (M.kansasi) Filamentöz : Koloniden etrafa yayılmış ince dallanmalar şeklinde. (M.xenopi) Bazı türleri pigment oluşturur. Nonkromojen : Pigment oluşturmaz. Kromojen : Pigment oluşturur. Fotokromojen : Sadece ışıklı ortamda pigment oluşturur. Skotokromojen : Hem ışıklı hem de karanlık ortamda pigment oluşturur. Order: ACTINOMYCETALES Family: MYCOBACTERIACEAE Species: M. tuberculosis M. tuberculosis dışında 80 'in üzerinde tür tanımlanmıştır. MİKOBAKTERİLER İNSANLARDA HASTALIK YAPANLAR M.tuberculosis complex M. M. M. M. M. avium complex M. avium M. intracellulare M. M. M. M. M. M. M. M. M. M. tuberculosis bovis africanum microti scrofulaceum kansasii genevense xenopi szulgai malmoense haemophilum marinum ulcerans leprae TİPİK MİKOBAKTERİLER ( Tüberküloz Etkenleri ) ATİPİK MİKOBAKTERİLERM. (Tüberküloz Dışı Mikobakteriler) Doğada, toprakta, suda bol bulunurlar İnsandan insana geçiş çok nadirdir. Çoğu patojen değildir. M.fortuitum-chelonae complex M. fortuitum M. chelonae Genellikle saprofitik mikobakteriler M. gordonae M. terrae complex M. flavescens M. smegmatis Nadir olarak hastalık oluşturur. Antitüberküloz ilaçların çoğuna dirençlidirler. İmmun sistemi zayıflamış infeksiyonlara neden olabilirler. konakta ciddi MİKOBAKTERİ HÜCRE DUVARI Diğer bakterilerin hücre duvarı ile karşılaştırıldığında ; OLDUKÇA KALIN VE OLAĞANÜSTÜ BİR LİPOFİLİK ÖZELLİKTEDİR. Gram pozitif bakteri Gram negatif bakteri Gram pozitif bakteri Lipid tabaka Mikolik asit Pepdoglikan tabaka Lipid + LPS Porlar Açil lipid Arabinogalaktan ARB MİKOBAKTERİ HÜCRE DUVARI ÜÇ TABAKADAN OLUŞMUŞTUR 1. PEPTİDOGLİKAN (MÜREİN): Plazma zarının üzerinde bulunan en iç tabaka Kısa peptid zincirleri ve çapraz bağlarla sıkıca bağlanan uzun polisakkarit zincirlerinden oluşmuştur HÜCRENİN SERT YAPISINI SAĞLAR 2. 3. ARABİNOGALAKTAN : Peptidoglikan tabakasının üzerinde bulunan ikinci tabaka Hücre duvarı kitlesinin %35'ini oluşturur ve peptidoglikan tabakasına fosfodiester köprüleriyle bağlıdır. Arabinogalaktanların yan zincirindeki uç arabinaz birimlerine MİKOLİK ASİT diye adlandırılan, uzun zincirli bir grup yağ asiti kovalent olarak bağlanırlar. MİKOLİK ASİT: Bakterinin hücreduvanı kalınlığı ve aside dirençli olmasından sorumludur. Trehaloz adı verilen bir şekerlere bağlanarak İP FAKTÖRÜ (CORD FACTOR) oluşturabilirler. MİKOZİDLER : En dış tabaka Hetorojen peptidoglikolipidler ve/veya fenolik glikolipidden oluşmuştur. Hücre duvarında bulunan ve duvar ağırlığının %60'ını yapan lipidler bu tabakada bulunur. Bu lipidler tüberkülostearik asit, mikoserik asit ve mikolik asitleri içerirler. MİKOBAKTERİLER LİPOFİLİK ÖZELLİKLERi NEDENİ İLE; Asit ve alkole dayanıklıdır. Konak hücreleri tarafından salınan eritici enzimlere ve bakterisidal ilaçlara dirençlidirler. Bakteri hücreleri kümeler halinde birarada toplanır. MİKOBAKTERİLER BOYANMA ÖZELLİKLERİ MİKOBAKTERİLER Hücre Duvarındaki Peptidoglikan + Arabinomannan oluşturduğu AĞ TABAKASI asit ve alkol ile yapılan renk giderme işlemine dirençlidir Anilin boyası (karbol fuksin) bu tabaka ile bağ oluşturarak asit ve alkol etkisine karşın yerinde kalır. ARB (Asit ve alkole rezistan basil) BU ÖZELLİK; son 60 yıldır kullanılan Ehrlich-Ziehl-Neelsen (EZN) tekniği ile KLİNİK ÖRNEKLERDE ARB'NİN SAPTANMASINI SAĞLAR. TÜBERKÜLOZ M. tuberculosis complex olarak tanımlanan bir grup mikobakteri tarafından oluşturulan çok değişik klinik görünümlere sahip KRONİK, NEKROTİZAN BİR İNFEKSİYONDUR TÜBERKÜLOZ SIKLIKLA AKCİĞERİ HEDEF ALAN BİR ENFEKSİYON HASTALIĞIDIR. tüberkülozun yayılmasında ANA KAYNAK AKCİĞER TÜBERKÜLOZUDUR ( Akciğer tüberkülozu tüm tüberküloz olgularının %80'ini oluşturmaktadır ) Bu nedenle; Bulaştırıcılık nedeniyle de halk sağlığı açısından en önemlisidir. TÜBERKÜLOZLA SAVAŞIM AKCİĞER TÜBERKÜLOZUNA YÖNELİKTİR. AKCİĞER TÜBERKÜLOZUNUN TANISI 1. Hastanın öyküsü, klinik belirtiler 2. Fizik inceleme bulguları 3. Histopatolojik inceleme 4. Akciğer grafisi 5. Tüberkülin deri testi 6. Mikrobiyolojik tanı AKCİĞER TÜBERKÜLOZUNUN TANISI Klinik, radyolojik ve/veya histolojik bulgularla TBC? bir hastada tüberkülozdan şüphelenilebilir. KESİN TANI yalnızca klinik örneklerde tüberküloz basilinin gösterilmesi ile konabilir. TÜBERKÜLOZ TANI VE TEDAVİSİNDE MİKOBAKTERİYOLOJİ LABORATUVARLARININ ROLÜ MİKOBAKTERİLERİN * Saptanması * İzolasyonu * Tür Tayini * İlaç Duyarlılığının Saptanması MİKOBAKTERİYOLOJİ LABORATUVARLARINDA TANISI TÜBERKÜLOZ 1. ÖRNEKLERİN İŞLENMESİ Homojenizasyon ve dekontaminasyon 2. MİKROSKOPİ Boyama ( Ziehl-Neelsen, Kinyoun, Florokrom) 3. KÜLTÜR Kültürde basil saptanması a- Geleneksel kültür (Yumurtalı, Agarlı) b- Bactec radyometrik yöntem c- Septi-check AFB sistemi d- Isolatör sistem (mikobakteriyel kan kültürleri için) 4. MOLEKÜLER YÖNTEMLER Kültür yapılmaksızın basilin saptanması PCR (hedef nükleik asitlerin PCR ile çoğaltılması) 5. TÜR a- Geleneksel yöntemler: Üreme hızı koloni morfolojisi, pigment üretimi ve biokimyasal testler b- Hızlı yöntemler: Bactec NAP testi, DNA prob, mikolik asit kalıplarının saptanması, DNA hibridizasyonu ve RFLP TAYİNİ 6. DUYARLILIK TESTLERİ a- Geleneksel yöntemler (mutlak konsantrasyon, direnç oran ve orantılama) b- Bactec duyarlılık testi c- PCR ile genetik mutasyonların saptanması d- Luciferase enzim aktivitesinin saptanması AKCİĞER TÜBERKÜLOZU DÜŞÜNÜLEN HASTALAR İÇİN ; incelenecek ilk klinik örnek BALGAMDIR Birbirini izleyen üç gün sabah balgamlarının incelenmesi yeterlidir. Balgam örneği alınacak hasta, istenen örneğin tükürük ya da nazofarengeal sekresyon olmadığı konusunda bilgilendirilmelidir. Balgam örneği üç ardışık gün sabah alınmalıdır. Burada “sabah” terimi belli bir saati değil, uyku süresince birikmiş solunum sekresyonlarını içermesi amacıyla hasta kalkar kalkmaz örnek alınması gerektiğini belirtmektedir. ÖRNEKLERİN İŞLENMESİ HOMOJENİZASYON VE DEKONTAMİNASYON AMAÇ ; Klinik örnek içerisinde bulunan MİKOBAKTERİ GRUBU dışındaki diğer bakterilerin (normal flora) ortadan kaldırılması ve mikobakterilerin yoğunlaştırılmasıdır ÖRNEKLERİN İŞLENMESİ HOMOJENİZASYON VE DEKONTAMİNASYON Tüberküloz basilleri asit ve alkalilere dayanıklıdır. Kimyasal maddeler ile muamele edildiklerinde diğer bakteriler ölür, mikobakteriler canlı kalır. HOMOJENİZASYON-DEKONTAMİNASYON YÖNTEMLERİ %4 Sodyum hidroksit (NaOH) %2-4 Sodyum hidroksit- N-asetil -L-sistein ( NALC ) %5 Oksasilik asit %5 Sülfirik asit %3 Hidroklorik asit Zefiran-trisodyum sitrat Sodyum lauril sülfat- sodyum hidroksit TÜBERKÜLOZU TANISI MİKROSKOPİ BALGAM YAYMA İNCELEMESİNİN ANA İŞLEVİ ; “ bir toplumda gerçek bulaştırıcı hastaların saptanmasıdır “ TÜBERKÜLOZ TANISI Yaymada ARB'nin saptanması “ incelenen örnekte mikobakteri varlığını gösteren ilk bakteriyolojik kanıttır “ Kolay uygulanabilirliği, ucuz ve önemli tanısal yararı nedeniyle ; Akciğer Tüberkülozu Tanısında En Önemli İnceleme Yöntemidir. BALGAMDA TÜBERKÜLOZ TANISI MİKROSKOPİ TEKSİF İLE MİKROSKOPİ DİREKT MİKROSKOPİ nekrotik kanla karışık partikülleri içeren balgamın doğrudan lama yayılması klinik örneğin işlenmesi ve santrifüje edilmesinden elde edilen çökeltinin lama yayılması ARB BOYAMA Ehrlich-Ziehl-Neelsen (EZN), Kinyoun ve Auramin-Rhodamine TÜBERKÜLOZ TANISI EZN BOYAMA Türkiye'de ve dünyada bu amaçla en yaygın olarak kullanılan boyama yöntemidir. ZİEHL NEELSEN İLE BOYAMADAN SONRA ASİDE DİRENÇLİ BASİLLER yayma preparat ışık mikroskobunda Karşı boya olarak metilen mavisi kullanıldığında yağlı immersiyon objektifinde x100 büyütmede incelenmektedir. mavi zeminde pembe-kırmızı ince çubuklar halinde görülmektedir. TÜBERKÜLOZ TANISI FLOROKROM BOYAMA Her gün 100 veya daha fazla yayma incelemesi yapan laboratuvarlarda, daha kolay ve hızlı tarama yapılabildiği için ön tarama testi olarak kullanılmaktadır. FLORESANS VEREN AURAMİN-RHODAMİNE boyasıyla boyanan preparatlar floresan mikroskopta 250x veya 400x büyütmede incelenir ARB ‘ler siyah zeminde parlak sarı renkte görülür. ARB POZİTİF PREPARATLAR EZN BOYAMA YÖNTEMİ İLE TEKRAR İNCELENDİKTEN SONRA KESİN SONUÇ VERİLİR. Auramine boyası TÜBERKÜLOZ TANISI Yayma preparatta gözlenen ASİDE DİRENÇLİ BASİL (ARB) SAYISI Rakamsal Olarak Raporlanmalıdır . BU DURUM ; Hem tedavi öncesinde hastalığın ağırlığı ve basil yükünü saptamada, Hem de hastanın tedaviye yanıtını değerlendirmede büyük önem taşımaktadır. BALGAM YAYMASINDA ARB'NİN POZİTİF OLABİLMESİ İÇİN, Her iki boyama yönteminde de ; Balgamın 1 ml' sinde en az 5-10 bin basilin bulunması gerekir. Balgam yayması pozitif olan hastalar; bulaştırıcı özellikleri EN FAZLA OLAN HASTALAR OLARAK KABUL EDİLMEKTEDİR TÜBERKÜLOZ TANISI Tüm mikobakteri türleri aside dirençli olduğu için, balgamda ve diğer klinik örneklerde aside dirençli basillerin saptanması; “ basilin tipi ve canlılığı konusunda bilgi vermez “ Bu nedenle; YAYMA İNCELEMEDE ARB pozitifliğinin saptanması kesin tüberküloz tanısını sağlayamaz. TÜBERKÜLOZDA KESİN TANI saf kültürde M. tuberculosis 'in izolasyonu ile sağlanır. Mycobacterium tuberculosis 18-24 saatte kendini eşler, üremesi yavaştır. Standart kültür ortamında üremesi ortalama 4-6 haftada gerçekleşir. Olumsuz koşullara oldukça dayanıklıdır ve uzun süre canlılığını sürdürebilir. Aerob olan bakteri; +4°C’de haftalarca, -70°C’de yıllarca canlılığını korur. Buna rağmen; 60°C'de 20 dakikada, 70°C'de beş dakikada ölür. TÜBERKÜLOZU TANISI KÜLTÜR GELENEKSEL KÜLTÜR YÖNTEMLERİNDE; İçinde mikobakteri bulunduğundan kuşku duyulan TÜM KLİNİK ÖRNEKLER uygun biçimde işlenip aseptik hale getirilir santrifüj edilirek, yoğunlaştırılır. BESİYERLERİNE EKİLİR Ekim yapılan besiyerleri 35-37 0 C’de 6-8 hafta inkübe edilir. Üremeyi saptamak için besiyerleri her hafta incelenir. LÖWENSTEİN-JENSEN BESİYERİNDE ARB yayma (-) hastaların balgam ve diğer örneklerin kültürlerinde basil; ARB yayma (+) hastaların balgamlarında basil; 2-3 haftada ÜRER 4-8 haftada TÜBERKÜLOZ TANISINDA KULLANILAN BESİYERLERİ YUMURTALI BESİYERLERİ AGARLI BESİYERLERİ SIVI BESİYERLERİ LÖWENSTEİN-JENSEN BESİYERİ MİDDLEBROOK BESİYERLERİ TİCARİ SİSTEMLERİ BACTEC- MGIT DEZAVANTAJLARI Pozitiflik saptama süresi uzun Hazırlanması ve saklanması zor Kontaminasyon durumunda sıklıkla Yüksek maliyet besiyeri kaybedilir. Antitüberküloz ilaçlarla etkileşime girer Hazırlandıktan sonra kısa sürede (en Yüksek maliyet fazla üç hafta) kullanılmak zorundadır. AVANTAJLARI Hazırlanması kolay Koloniler daha kısa sürede Otomatize Ucuz belirginleşir. Antitüberküloz ilaçlarla etkileşime girmez Standardize Tüberküloz bakterisini iyi üretir. Uzun süre buzdolabında saklanabilir. Kontaminasyon riski düşüktür. Pozitflik saptama süresi kısa MİKOBAKTERİLERDE TÜR TAYİNİ MYCOBACTERIACEAE ailesinde bugüne kadar 80 ‘den fazla tür tanımlanmıştır. BU TÜRLERİN; BİYOFİZİKSEL ÖZELLİKLER BİYOKİMYASAL ÖZELLİKLER Üreme zamanı Niasin üretimi Üreme ısıları Nitrat redüktaz aktivitesi Koloni yapıları Katalaz aktivitesi Pigment karakterleri Peroksidaz aktivitesi TCH 2 duyarlılığı BİRBİRİNDEN FARKLIDIR. MİKOBAKTERİLERDE TÜR TAYİNİ KÜLTÜRDE ÜREYEN BAKTERİDEN PASAJ YAPILIR 1.ÜREME ZAMANI Bakteri steril şartlarda süspanse edilir.Üremenin görüldüğü gün not edilir. Öze ile sürterek veya sodyum hidroksit ile pasaj yapılmaz. Sürtme pasajlarda vaktinden erken, sodyum hidroksitli pasajlarda vaktinden geç üreme olur. 2.ÜREME ISISI Pasaj yapılan bakteri süspansiyonundan üç ayrı tüpe ekim yapılır. Her bir tüp 240C, 370C ve 450C’de inkübe edilir. 3.KOLONİ YAPISI Kolonilerin düzenli-düzensiz, ıslak-kuru, renkli-renksiz oluşları not edilir. 4.PİGMENT OLUŞTURMA Karanlıkta ve ışıkta pigment oluşturma özelliğine bakılır. Karanlıkta pigment oluşturanlar skotokromojen, yalnız ışıkta pigment oluşturanlar fotokromojen, hiçbir şekilde pigment oluşturmayanlar non kromojendir. 5.NİASİN ÜRETİMİ M.tuberculosis’in tanımlanmasında en önemli testtir.Pozitif olması durumunda katalaz ve peroksidaz testleri yapılır. 6.NİTRAT REDÜKTAZ AKTİVİTESİ M.tuberculosis ile M.bovis’i ayırt etmede ve hızlı üreyen mikobakterilerin tiplendirlmesinde kullanılır 7.KATALAZ AKTİVİTESİ Oda sıcaklığında ve 680 C’ de katalaz aktivitesine bakılır. M.tuberculosis oda scaklığında pozitif, 680 C’ de negatiftir. Her iki ısıda pozitif olması atipik mikobakteri olasılığını güçlendirir. 8.PEROKSİDAZ AKTİVİTESİ Yapılışı ve değerlendirilmesi katalaz testi gibidir. 9.TCH 2 DUYARLILIĞI M.bovis’in ayırt edilmesinde kullanılır.Bakteri süspansiyonundan 5g ml tiofen 2 –karboksilik asit hidrazid içeren LJ besiyerine pasaj yapılır.Üreme durumu kontrol edilir. Üreme yoksa M.bovistir. Mycobacterium leprae 1873 de Hansen tarafından bulunmuştur. 0.2-0.4 X 1-8 mikrometre boyutlarında, sporsuz, hareketsiz ve aside dirençli bir bakteridir. Klinik örnek( burun kazıntısı, leprom) lerden yapılan preparatlarda çalı demeti şeklinde aside dirençli bakteriler görülür. Kültürü yapılamamış. Bakterinin bölünme süresi 11-13 gündür. Dolayısyla hastalığın kuluçka süresi 1-10 yıl. Dolayısıyla bazı kişilerin hastalanmak için ömürleri yetmeyebilir. İki tip klinik oluşturur. 1. Tükerküloid lepra 2. Lepramatöz lepra Tanıda DOPAmin deri testi uygulanabilir. Bakterinin bu maddeyi parçalayan enzimi bulunur. Lepra sinsi başlangıçlı bir hastalıktır. Vucudun soğuk yüzeylerinde hastalık oluşur. Bunlar deri, yüzeyel sinirler, burun, farenks, larinks, gözler ve testislerdir. Deri lezyonları soluk, ağrısız 1-10 cm çapında maküler tarzdadır. Lepra Lepra’da sinir harabiyeti oluşur Lepramatöz lepra hücresel immunitede yetmezlik mevcuttur ve deri T süpressör hücrelerle infiltredir. Tüberküloid lepra daha hafif seyirlidir. Teşhis: lezyonlardan hazırlanan preparatlarda ARB gösterilmesi ile konur. Kültür ve serolojik testlerin tanıda değeri yoktur. Tedavide Dapson tercih edilir.