Biokimyasal_Termodinamik1.51 MB
advertisement

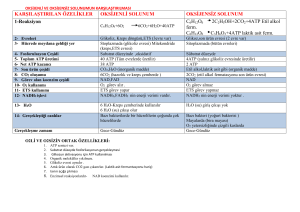
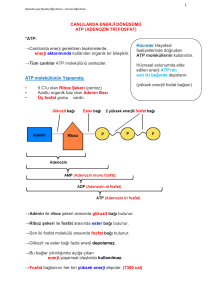
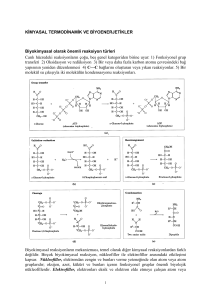
Biyokimyasal reaksiyonlarda enerji değişikliklerini inceler Bazı reaksiyonlar olurken bazıları neden olmaz ? Sistemler arasındaki fark? Biyolojik olmayan sistemler ısı enj kullanılır Biyolojik sistemler “ izotermik “ kimyasal enerji kullanır marasmus beslenme bozukluğu Enerji kaynakları tükenince açlıktan ölüm meydana gelir Aşırı enerji depolanması obezite Kimyasal enj nasıl oluşur? Hücresel solunum Oxd yıkım , Kimyasal bağ enj NAD+, FAD NADH , FAD(2H) (indirgenmiş koenzim) Elektron transport zincirinde ATP rejenerasyonu (Oksidatif fosforilasyon) ATP ~P bağı Elektron transport zincirinde ATP rejenerasyonu O2’ye elektronların verilmesi ΔG0’ E 0 redüksiyon potansiyeli ile ilişkili ~P Bağı nerede kullanılır? Kas kasılması Detoksifikasyon Isı Transport Fosforil transferi Biyosentez Ara ürün aktiflenmesi (UDP-şekerler) ATP CO2 Isı Enerji üretimi Karbohidrat Lipid Protein O2 Enerji kullanımı Kas kasılması Aktif iyon taşınması Biyosentez Detoksifikasyon Termojenezis ADP + Pi ATP Homeostasis Yakıt kullanımı ↑ , ATP Kullanım ↑ Yakıt kullanımı ↓ , ATP kullanımı ↓ ATP homeostasis – enerji dengesi Problem - Obezite - Hipertiroidizm - Myokart infark Enerji değişiminde 3 termodinamik ifade ΔG ΔH ΔS Serbest enerji Entalpi Entropi ΔG Bir sistemde toplam enerjinin iş yapabilen kısmı 9 Faydalı enerji 9 Kimyasal potansiyel G = Gibbs serbest enerji Birim: Kalori (cal, Joule) 1 cal = 4.184 joule ΔH Reaksiyonun ısı içeriğini ifade eder Reaksiyona giren ve çıkan maddelerin bağlarının sayı ve türüne bağlı olarak sistemin ısı alış verişini yansıtır Birim : Cal, joule ΔS Geriye dönüşümsüz,düzensiz enerji şekli Düzensizliğin kantitatif göstergesi Başlangıç durumundan sapma derecesi ifadesi Reaksiyon ürünlerinin girenlere göre daha düzensiz oluşu reaksiyonun entropi kazandığını gösterir Yararlı şekle dönüşemeyen enerji Birim: Cal, joule ΔG Yararlı, iş yapabilen enj ΔH Serbest enj şekline dönüşemeyen enj ΔS Yararlı şekle dönüşemeyen enj İzole Sistem Kapalı Sistem Çevre ile hiçbir enerji veya madde alışverişi olmayan sistem Açık Sistem Çevreleri ile enerji ve madde alışverişi yapar (canlı hücreler) Termodinamik 1. Kural Enerjinin korunması kuralı Bir fiziksel veya kimyasal değişiklikte evrende toplam enerji sabit Sistemde enerji değişimi sırasında enerji kazancı veya kaybı olmaz Ancak enerji diğer bir şekle dönüşür kimyasal enj ısı elekt enj mekanik enj 2. Kural • Spontan (kendiliğinden) işlemlerde toplam entropi artar • Sistem gerçek dengeye yaklaştıkça entropi maksimum olur 9 Entropi reaksiyonun kendiliğinden olup olmadığını görmek için kullanılır Biyokimyada kullanımda dikkat !! Entropi kapalı sistemlerde incelenir Organizma açık sistem (solunum,boşaltım, ısı kayıpları) Kapalı sistem olmadığından entropi değişikliği ölçümü zor ¾ Spontan değişikliği görmek için ΔG kullanılır Sabit ısı ve basınçta ΔG = ΔH - TΔS G = Gibbs serbest enerjisi (Jul/mol, cal/mol) T = Mutlak ısı (Kelvin) ΔH = Entalpi (ısı) (Jul/mol, cal/mol) ΔS = Jul/mol . °K 1 cal= 4.184 J 25°C = 25 + 273 = 298 °K EKZERGONİK reaksiyon • Enerji açığa çıkar (Serbest enerji kaybı) • ΔG (-) • Reaksiyon spontan • ΔG ne kadar büyük ise reaksiyon o kadar irreversibl olarak ilerler • ΔS artar • ΔH Ürün ısı içeriği, girenlerden az ENDERGONİK reaksiyon • ΔG (+) (Serbest enerji kazanılır) • Sisteme enerji verilirse reaksiyon meydana gelir • ΔG , büyük ise, - Sistem stabil - Reaksiyona eğilim az veya yok ΔG = 0 ise Sistem dengede Kimyasal Reaksiyonlarda Denge Sabiti aA + bB cC + dD [C]c [D]d Kdenge = 2NaOH + H2SO4 [A]a [B]b Na2SO4 + 2H2O Standart Şartlar Reaktanlar konsantrasyonu 1 mol/L 25°C = 298°K Pa = 1 atm (Kısmi basınç) ise ΔG ΔG° Standart serbest enerji değişimi Kimyasal reaksiyonlar sulu ortamda oluşur H iyonlarının yer aldığı standart şartlar : [H+] = 1M ; pH=0 olmalı ; ΔG° Fakat biyokimyasal reaksiyonlar pH = 7.0 ; [H+] = 55.5 mol/L, tampon çözelti ortamında gerçekleşir Bu şartlarda ΔG° ΔG°' şeklinde gösterilir Bir tepkime için sabit değerdir ΔG = -2.308 R T log Kdenge Standart şartlarda : ΔG°’ = -2.308 R T log K'denge ΔG°’ < 0 (-) reaksiyon kendiliğinden, ürünlere ΔG°’ > 0 (+) reaksiyon ters yönde ΔG°’ = 0 reaksiyon dengede Kd’ ΔG°’(kcal/mol) Tepkime Yönü 0.001 4.1 Ters 0.01 2.7 Ters 0.1 1.4 Ters 1.0 0.0 Dengede 10.0 -1.4 Kendiliğinden ilerler 100.0 - 2.7 “ 1000.0 - 4.1 “ ¾ ΔG° Standart serbest enerji değişimi Reaksiyonun (her bir komponent 1 M pH=7,0 ve 25°C'de olduğu zaman) hangi yönde ve ne kadar hızlı olacağını gösterir ¾ ΔG Gerçek serbest enerji değişimi - Reaktanların konsantrasyonuna ve - Reaksiyon sırasında oluşan ısıya bağımlı ΔG (-) ve yüksek olmalı Aksi takdirde ölçülebilir hızda reaksiyon meydana gelmez Örnek Odunun yanarak CO2 ve H2O'ya dönüşümü termodinamik olarak mümkün fakat yıllarca stabil kalır Çünkü oda ısısında yanması için gerekli aktivasyon yüksektir Bu enerji bir kibritle sağlanırsa reaksiyon meydana gelir 9 ΔG değeri reaksiyonun meydana geldiği yoldan bağımsız, ilk ve son ürünlerin konsantrasyonuna bağımlı ΔG değerleri toplanabilir Glukoz Pi Glukoz-6-fosfat + H2O Δ G°' = + 13.8 kJ/mol Reaksiyon termodinamik olarak mümkün değil!! Ekzergonik bir reaksiyona kenetlenirse 1. Glukoz + Pi Glukoz-6-fosfat +H2O ΔG°' = 13.8 2. ATP + H2O ADP + Pi ΔG°' = -30.5 Σ: Glukoz + ATP Glukoz-6-fosfat + ADP ΔG°’= 13,8+(-30,5) = - 16,7 kJ/mol Son reaksiyon ekzergonik ¾ Endergonik prosesler ekzergonik proseslere kenetlenerek gerçekleşebilir Hücreler izotermal sistemlerdir Sabit P ve T'de iş yaparlar Isı akışı hücreler için enerji kaynağı değil Hücre Gibbs serbest enerjisini kullanır Bu enerjiyi sabit T'de biyolojik iş için gerekli enerjiyi sağlayabilen ATP veya diğer yüksek enerjili bileşiklere dönüştürür Biyokimyada önemli olan diğer yüksek enerjili bileşikler : • Koenzim A ( Örnek : Asetil-CoA), • Acil taşıyıcı protein, • Protein sentezinde yer alan aminoasit esterleri, • SAM (S-adenozil metionin), • UDP-Glukoz • PRPP (5-fosforibozil-1-pirofosfat) Yüksek enerjili fosfatlar ~ P semboliyle gösterilir • ATP’de 2 yüksek enerjili fosfat grubu • ADP’de 1 yüksek enerjili fosfat grubu bulunur • AMP’deki fosfat düşük enerjili, (ester bağı) • ATP sıralamada daha altta yer alan bileşikleri Glu, Fruktoz,Gliserol’fosfatlar 3 Ana ~P kaynağı 1. Oksidatif fosforilasyon Aerobik organizmalarda ~P 'nin en büyük kaynağı 2. Glikoliz Glukoz Laktat 2 ~P oluşur 3. Sitrik asid siklusu Siklusta süksinil tiyokinaz basamağında 1 ~P Fosfogenler Yüksek enerjili fosfat depoları Kreatin fosfat Omurgalı iskelet kası,kalp, sperm ve beyinde Arginin fosfat Omurgasız kas Kalpte enfarktüse karşı ani koruma Adenilil Kinaz (myokinaz) • Birçok hücrede bulunur • Adenin nükleotidlerini birbirine çevirir Adenilil kinaz ATP + AMP AMP ADP oluşabilir 2ADP ATP tükendiğinde AMP konsantrasyonu artar, AMP artışı katabolik reaksiyonların hızının artması için metabolik (allosterik) bir sinyal olarak etki eder bu da daha fazla ATP oluşumuna yol açar ATP ↓... AMP ↑... Katobolik reak↑.... ATP ↑ Adenin nükleotidlerin değişimi İnorganik pirofosfataz Acil CoA Sentetaz Adenilat Siklaz Diğer Nükleozid Trifosfatlar ~P Aktarır Nükleozid difosfat kinaz ATP + UDP ATP + GDP ATP + CDP ADP + UTP (Üridin trifosfat) ADP + GTP (Guanozin trifosfat) ADP + CTP (Sitidin trifosfat) Trifosfatların hepsi de hücre içi fosforilasyonda yer alır ATP hidrolizi için ΔG neden büyük ve (-) bir değerdir ? 1.Hidroliz sonrası yük ayrılması ile ATP üzerindeki 4 (-) yük arasındaki elektrostatik itme ferahlar 2. Hidrolizle salınan Pi rezonans hibridi oluşumuyla stabilize olur P-O bağlarının 4’ü de aynı derecede çift bağ karakterindedir 3. Hidroliz ürünü olan ADP hızla iyonlaşarak H+ iyon konsantrasyonu ~10-7 çok düşük olan ortama H+ verir Ürün konsantrasyonunun düşük olması hidroliz reaksiyonunun kütle etkisi nedeniyle ilerlemesini sağlar 4. Pi ve ADP ürünlerinin hidratasyon derecelerinin ATP’ye göre yüksek olması da ayrıca ürünlerin reaktanlara göre daha stabil olmasını sağlar Asetil CoA’nın hidrolizi Piruvat kinazın katalizlediği fosfoenol piruvatın hidrolizini ürünün spontan tautomerizasyonu takip eder Fosfokreatinin hidrolizi Enerji Nerede Kullanılır? Mekanik işlemlerde Kas kasılmasında ATP’nin proteine bağlanması ile konformasyonel değişiklik olur Transport Aktif transport ATP enerjisi konsantrasyon gradientine karşı kulanılır Elektrokimyasal gradient ↑ Konst → ↓ Konst Enj kullanılmaz Denge 1. Primer aktif transport Enerji taşıyıcıya uygulanır Na+K+ATPaz 2. Sekonder aktif transport Enerji iyon gradienti oluşturmak için kullanılır Bu gradient başka bir bileşiği konsantre etmede kullanılır Primer aktif transportla elde edilen Na iyonu intestinal epitelde glukoz, aa transportunda kullanılır Biyokimyasal İşlemler Anabolik İşlemler= Sentez Sentezde yeni bağ oluşumu için gerekli enerji nereden sağlanır ? Termojenezis Isı üretmek amaçlı enerji kullanmak Yakıt oksidasyonu ile enerji nasıl elde edilir? Yakıt oksidasyonu major ATP kaynağı Elektronlar indikatör koenzimler üzerinde toplanır Yakıt e- verir, okside olur, NAD+, FAD e- alır, indirgenir Ne zaman FAD, ne zaman NAD+ kullanılır? Elektron vericisine ve enzim katalizli reaksiyona bağlı NAD+ ve NADP 2e- (H:- hydride iyonu) alır NADH , NADPH FAD, H atomu olarak 2e- alır, indirgenir FAD(2H) H , tek, farklı atomlardan, disülfit bağı veya çift bağlardan gelen FAD(2H) 2 atom aynı zamanda alınmış FAD 2 Fosfat FMN 1 Fosfat Redüksiyon Potansiyeli Her oksido-redüksiyon reaksiyonu ΔE°‘ ile orantılı sabit bir enerji miktarı alır veya verir ΔE° - Redüksiyon potansiyel farkı - e- Alıştaki istekliliği belirtir - Bileşiğin okside olduğu ve indirgendiği durumları arasındaki enerji farkı Bazı yarı reaksiyonların redüksiyon potansiyelleri E°’ pH 7 ½ O2 + 2H+ + 2e- H2O 0.816 CoQ + 2H+ + 2e- CoQH2 0.060 Fumarat + 2H+ + 2e- Süksinat Okzaloasetat + 2H+ +2e- Malat 0.030 -0.102 FAD + 2H+ + 2e- FAD-H2 NAD+ + 2H+ + 2e- NADH + H+ - 0.320 Asetat + 2H+ + 2e- Asetaldehit -0.468 -0.200 9 Red Pot ↑; (-) olanlar e- oksijene verir, ATP oluşturmada yüksek enj elde edilir eNADH O2 ΔG°' >> E°’ -0.32 eFAD(2H) O2 E°’ -0.2 ETZ’de ATP sentezi için NADH FAD kullanılırsa -53Kcal “ - 41 Kcal ΔG°' = - n. F. ΔE°' n elektron sayısı F Faraday sabiti 23 kcal/mol NADH’tan Oksijene elk transferinde: ΔG°’ = - 2. 23. [0.816 – (-0.32)] = - 52 kcal/mol Yakıtların Kalori Değeri Besinlerin oksidasyon durumları ile ilişkili Yakıttan oksijene e- nakledilirken ölçülen ΔG°‘ Elektronlar C-H ; C-C bağlarından verilir CH3- (CH2)14 COOH palmitik asit 9 Kcal/g Glukoz 4 Kcal/g Odun yanarken elektronlar selüloz veya KH’lardan oksijene aktarılır Selüloz organizma için yakıt değil! Selülaz yok 9 Besinler uygun enzimler varsa yakıt Kolesterol yakıt değil, kalori değeri yok Karbonları okside edip NADH, FAD(2H), NADPH elde edilemez NADP+ , NAD+ aynı redoks potansiyele sahip fazla fosfat grubu enzim bağlamada etkin Pentozfosfat yolunda elektronlar NADP+ verilir NADPH yağ asidi sentezi, detoksifikasyon reaksiyonlarında direkt oksijene elektron verir