maddenin halleri ve ısı
advertisement
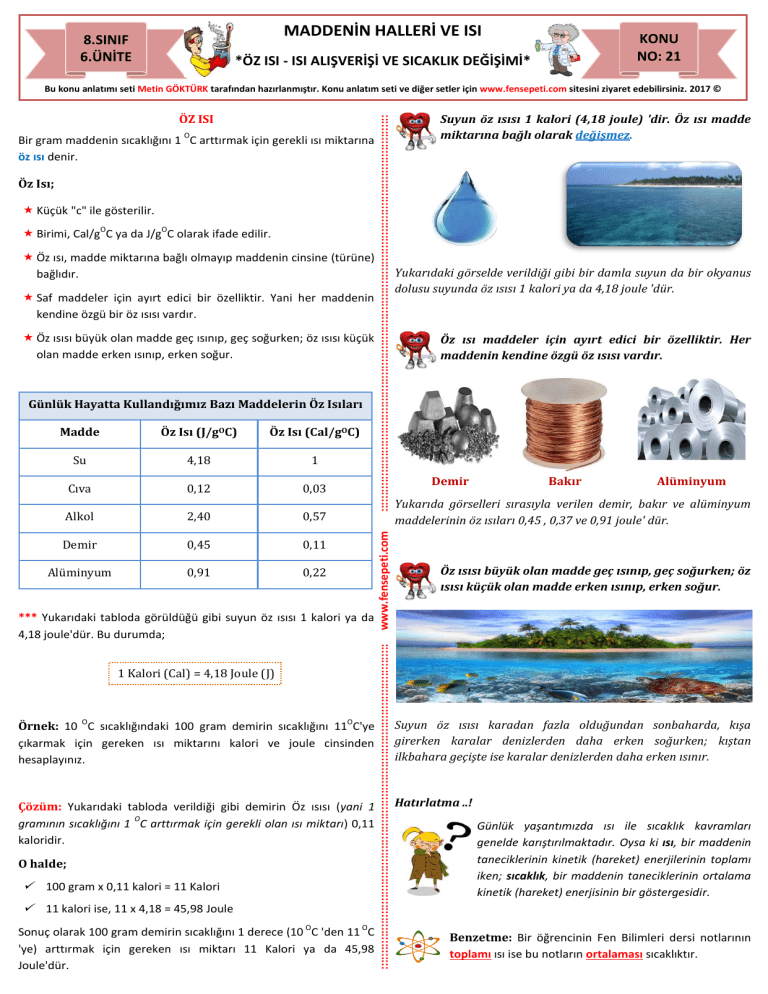
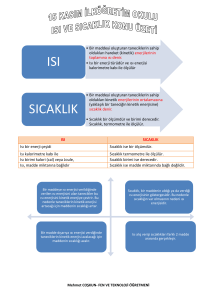
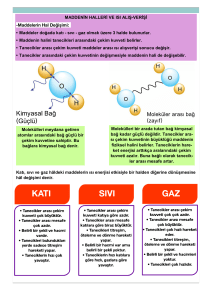
MADDENİN HALLERİ VE ISI 8.SINIF 6.ÜNİTE KONU NO: 21 *ÖZ ISI - ISI ALIŞVERİŞİ VE SICAKLIK DEĞİŞİMİ* Bir gram maddenin sıcaklığını 1 C arttırmak için gerekli ısı miktarına öz ısı denir. Öz Isı; Küçük "c" ile gösterilir. O O Birimi, Cal/g C ya da J/g C olarak ifade edilir. Öz ısı, madde miktarına bağlı olmayıp maddenin cinsine (türüne) bağlıdır. Saf maddeler için ayırt edici bir özelliktir. Yani her maddenin kendine özgü bir öz ısısı vardır. Öz ısısı büyük olan madde geç ısınıp, geç soğurken; öz ısısı küçük olan madde erken ısınıp, erken soğur. Günlük Hayatta Kullandığımız Bazı Maddelerin Öz Isıları Madde Öz Isı (J/gOC) Öz Isı (Cal/gOC) Su 4,18 1 Cıva 0,12 0,03 Alkol 2,40 0,57 Demir 0,45 0,11 Alüminyum 0,91 0,22 *** Yukarıdaki tabloda görüldüğü gibi suyun öz ısısı 1 kalori ya da 4,18 joule'dür. Bu durumda; 1 Kalori (Cal) = 4,18 Joule (J) O O Örnek: 10 C sıcaklığındaki 100 gram demirin sıcaklığını 11 C'ye çıkarmak için gereken ısı miktarını kalori ve joule cinsinden hesaplayınız. Çözüm: Yukarıdaki tabloda verildiği gibi demirin Öz ısısı (yani 1 O gramının sıcaklığını 1 C arttırmak için gerekli olan ısı miktarı) 0,11 kaloridir. O halde; 100 gram x 0,11 kalori = 11 Kalori 11 kalori ise, 11 x 4,18 = 45,98 Joule O O Sonuç olarak 100 gram demirin sıcaklığını 1 derece (10 C 'den 11 C 'ye) arttırmak için gereken ısı miktarı 11 Kalori ya da 45,98 Joule'dür. www.fensepeti.com O :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: ÖZ ISI :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: Bu konu anlatımı seti Metin GÖKTÜRK tarafından hazırlanmıştır. Konu anlatım seti ve diğer setler için www.fensepeti.com sitesini ziyaret edebilirsiniz. 2017 © Suyun öz ısısı 1 kalori (4,18 joule) 'dir. Öz ısı madde miktarına bağlı olarak değişmez. Yukarıdaki görselde verildiği gibi bir damla suyun da bir okyanus dolusu suyunda öz ısısı 1 kalori ya da 4,18 joule 'dür. Öz ısı maddeler için ayırt edici bir özelliktir. Her maddenin kendine özgü öz ısısı vardır. Demir Bakır Alüminyum Yukarıda görselleri sırasıyla verilen demir, bakır ve alüminyum maddelerinin öz ısıları 0,45 , 0,37 ve 0,91 joule' dür. Öz ısısı büyük olan madde geç ısınıp, geç soğurken; öz ısısı küçük olan madde erken ısınıp, erken soğur. Suyun öz ısısı karadan fazla olduğundan sonbaharda, kışa girerken karalar denizlerden daha erken soğurken; kıştan ilkbahara geçişte ise karalar denizlerden daha erken ısınır. Hatırlatma ..! Günlük yaşantımızda ısı ile sıcaklık kavramları genelde karıştırılmaktadır. Oysa ki ısı, bir maddenin taneciklerinin kinetik (hareket) enerjilerinin toplamı iken; sıcaklık, bir maddenin taneciklerinin ortalama kinetik (hareket) enerjisinin bir göstergesidir. Benzetme: Bir öğrencinin Fen Bilimleri dersi notlarının toplamı ısı ise bu notların ortalaması sıcaklıktır. Sıcaklığı yüksek tanecikler Madde taneciklerinin hareketi maddenin sıcaklığı ile doğru orantılıdır. Bu nedenle bir maddenin sıcaklığı arttığında maddenin taneciklerinin hareketi de o oranda artar. Aşağıda ısı - öz ısı ilişkisi, ısı - kütle ilişkisi ve ısı - sıcaklık ilişkisi ele alınacaktır. ISI - ÖZ ISI İLİŞKİSİ Daha önce bahsettiğimiz gibi öz ısısı büyük olan madde geç ısınıp, geç soğurken; öz ısısı küçük olan madde erken ısınıp, erken soğur. Bu durumu örnekleyecek olursak; A B Kütlesi: 50 g Sıcaklık: 40 0C Öz Isı: 1,50 Kütlesi: 50 g Sıcaklık: 40 0C Öz Isı: 3,50 Yukarıda verilen kütleleri ve ilk sıcakları eşit A ve B maddelerinin 0 sıcaklıklarını 60 C 'ye çıkarabilmek için verilmesi gereken ısı miktarı aynı olmaz. Bunun nedeni B maddesinin öz ısısının A maddesinin öz ısısından büyük olmasıdır. Bu durumda öz ısısı küçük olan A maddesi hemen ısınırken, öz ısısı büyük olan B maddesi hemen ısınmaz ve ısı almaya devam eder. 0 Sonuç olarak; B maddesinin 60 C 'ye ulaşması için alması gereken 0 ısı miktarı, A maddesinin 60 C ' ye ulaşması için alması gereken ısı miktarından fazladır. ISI - KÜTLE İLİŞKİSİ Isı, madde taneciklerinin kinetik enerjisinin toplamıdır. O halde iki aynı tür maddeden kütlesi büyük olan madde daha yavaş ısınır, daha yavaş soğur. A Kütlesi: 50 g Sıcaklık: 10 0C Öz Isı: 1,50 A Kütlesi: 100 g Sıcaklık: 10 0C Öz Isı: 1,50 :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: Sıcaklığı düşük tanecikler www.fensepeti.com Maddeler atomlardan dolayısıyla taneciklerden meydana gelmişlerdir. İster katı ister sıvı ister gaz olsun tüm maddelerin tanecikleri hareket halindedir. :::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::: ISI ALIŞ VERİŞİ VE SICAKLIK DEĞİŞİMİ O O Yukarıda ilk sıcaklıkları 10 C olan A maddelerinin sıcaklıkları 40 C 'ye çıkarılmak istendiğinde kütlesi 100 g olan maddeye, kütlesi 50 g olan maddeye göre daha fazla ısı verilmelidir. Bu durum kütle arttıkça maddeye verilmesi gereken ısının arttığını göstermektedir. Günlük hayattan örnek: Özdeş iki ocak üstünde bir bardak su mu bir çaydanlık su mu daha erken kaynar? ISI - SICAKLIK İLİŞKİSİ Aşağıda içerisinde 20'şer gram ve ilk sıcaklıkları eşit su bulunan kaplar verilmiştir. Bu kaplardan birini 1, diğerini 2 özdeş ısıtıcıyla ısıttığımızda Y kabındaki suyun daha yüksek sıcaklığa sahip olduğu görülmektedir. Bu durumda maddeye verilen ısı arttıkça maddenin sıcaklığı artar sonucuna ulaşılır. X Y Kütlesi: 20 g Sıcaklık: 10 0C Öz Isı: 1 Kütlesi: 20 g Sıcaklık: 10 0C Öz Isı: 1 Yukarıda verilen başlıklar incelendiğinde ısı ile öz ısı, kütle ve sıcaklık arasında bir ilişkinin olduğu görülecektir. Bu ilişki aşağıda verilmiştir. Q=m.c. Q: Isı m: Kütle t c: Öz ısı t: Sıcaklık Farkı Verilen formülden de anlaşılacağı gibi bir maddeye verilen ısı; o maddenin kütlesi, öz ısısı ve maddenin son sıcaklığı ile ilk sıcaklığı arasındaki farkın (sıcaklık farkı) çarpımına eşittir. 0 0 Örnek : 200 gram suyun sıcaklığını 10 C' dan 20 C'a çıkarmak için O verilmesi gereken ısı miktarı kaçtır? (csu = 4,18 J/g C) Çözüm : Yukarıdaki soruda bir maddenin yani suyun sıcaklığını arttırmak için verilmesi gereken ısı miktarı (Q) istenmiştir. O halde; Q=m.c. t formülünü kullanırız. Soruda verilenlerden yola çıkarak, m = 200 gram O 0 csu = 4,18 J/g C t = 20 - 10 = 10 C Bu durumda, Q = 200 . 4,18 . 10 = 8.360 Joule 0 0 Sonuç: 200 gram suyun sıcaklığını 10 C arttırmak için (10 C 'dan 0 20 C 'a) gerekli olan ısı miktarı 8.360 joule 'dür.