Slayt 1 - WordPress.com
advertisement
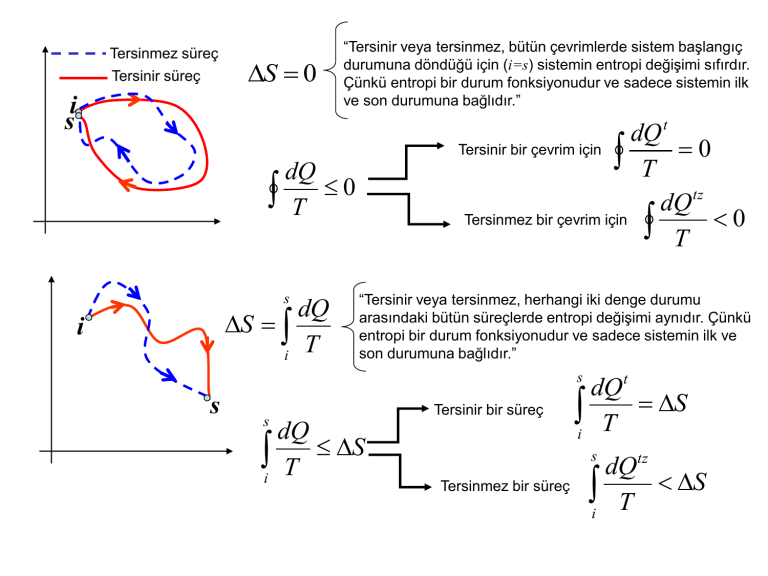
Tersinmez süreç Tersinir süreç S 0 i s “Tersinir veya tersinmez, bütün çevrimlerde sistem başlangıç durumuna döndüğü için (i=s) sistemin entropi değişimi sıfırdır. Çünkü entropi bir durum fonksiyonudur ve sadece sistemin ilk ve son durumuna bağlıdır.” dQ t Tersinir bir çevrim için T 0 dQ tz Tersinmez bir çevrim için T 0 dQ T 0 s dQ S T i i “Tersinir veya tersinmez, herhangi iki denge durumu arasındaki bütün süreçlerde entropi değişimi aynıdır. Çünkü entropi bir durum fonksiyonudur ve sadece sistemin ilk ve son durumuna bağlıdır.” s s s dQ i T S Tersinir bir süreç dQt i T S s Tersinmez bir süreç dQtz i T S Termodinamiğin İkinci Kanunu “Tamamen yalıtılmış bir sistemin entropisi hiçbir zaman azalmaz, artar veya sabit kalır.” S 0 Tamamen yalıtılmış bir sistemin çevre ile ısıl enerji alışverişi olmaz. (Q=0) Q0 S 0 S 0 Evren S 0 dQ 0 s dQ S T i S 0 S 0 Yalıtılmış sistem içindeki değişimler tersinmez ise S 0 Yalıtılmış sistem içindeki değişimler tersinir ise “Yalıtılmış bir sistemde gerçekleşen kendiliğinden değişimler (tersinmez süreç), sistemin daima entropisini arttırır.” Çevremiz evrenin bir parçasıdır ve evrenin başka sistemle teması olmayan yalıtılmış bir sistemdir. Çevremizde kendiliğinden gerçekleşen bütün değişimler evrenin entropisini arttırır. Kapalı sistemlerde kendiliğinden gerçekleşen süreçler Serbest genleşme P ilk durum Vi, Pi, T sistem Serbest genleşme, kendiliğinden gerçekleşen tersinmez süreç. son durum Vs, Ps, T ÇEVRE İlk durumdan son duruma tersinir bir süreç (eşsıcaklıklı), entropi değişimi bu süreçten yararlanarak hesaplanabilir. V -Sistem, sınırlarını değiştirmediği için çevreye karşı bir iş yapmaz W=0. -Sistemin sınırları yalıtıldığı için çevre ile ısıl enerji alış verişi olmaz Q=0. -Böylece, serbest genleşen sistemin iç enerjisi değişmez E=0 ve sıcaklığı sabittir T= sabit. -Ancak sistem serbest genleşirken hacmi ve basıncı değişir. Gaz serbest genleşirken kendi moleküllerine karşı iş yapar. Bu esnada sistemin entropisi değişir S0. s İdeal gazın entropi değişimi S i s dQ T i ncV dT PdV T V T P ncV ln s nR ln s ncP ln s nR ln s T Ti Vi Ti Pi Serbest genleşen İdeal gazın entropi değişimi Vs Ps S nR ln nR ln 0 Vi Pi Isıl enerjinin sıcak cisimden soğuk cisme akması S S1 S 2 Q T1 ilk durum Q T T2 ÇEVRE T s i son durum s dQ1 T dQ2 0 T i Kendiliğinden gerçekleşen bir süreçte ısıl enerji daima sıcak cisimden daha soğuk olana doğru akar. Bu süreç sonunda sistemin antropisi mutlaka artar. Serbest genleşme ve ısıl enerjinin sıcak cisimden soğuk cisme akması gibi kendiliğinden gerçekleşen süreçlerde yönlülük birçok olasılık içeren süreçlerin gerçekleşebilme yollarının sayısına bağlıdır. Bazı sonuçların daha olası olmasının sebebi mümkün olan durumların sayısının bu sonuç için daha çok olmasıdır. T1 Q T2 Q T1 T2 Mümkün olan ve gerçekleşen sonuç Mümkün olan ve ancak gerçekleşmeyen sonuç Dört tane para birlikte havaya atılıyor. Mümkün olan durumlar şunlardır: YYYY, YYYT, YYTY, YTYY, TYYY, YYTT, YTTY, TTYY, TYTY, YTYT, TYYT, TTTY, TTYT, TYTT, YTTT, TTTT W=16 mümkün durum vardır. Her durumun gerçekleşme olasılığı P=1/16 dır. Durum 1 : Paraların hepsinin yazı gelmesi (YYYY), yalnızca 1 durumda gerçekleşir. P=1/16 Durum 2: İki yazı iki tura gelmesi (YYTT, YTTY, TTYY, TYTY, YTYT, TYYT) 6 farklı durumda gerçekleşir. P=6/16 50 tane para birlikte havaya atılıyor. Mümkün olan durumlar şunlardır: W=2501015 mümkün durum vardır. Her durumun gerçekleşme olasılığı P=1/ 1015 dır. Durum 1 : Paraların hepsinin yazı gelmesi (YYYY…), yalnızca 1 durumda gerçekleşir. P=1/ 1015 0 Durum 2: Yarısının yazı yarısının tura gelmesi yaklaşık 1014 durumda gerçekleşir. P=1014/1015=0.1 Durum 1 Durum 2 T1 Q Q T1 T2 P0 T2 Hangi durum için bahse girersiniz? Serbest genleşme ve ısıl enerjinin sıcak cisimden soğuk olana doğru akması gibi kendiliğinden gerçekleşen süreçlerde yönlülük bir mucize olmayıp sadece kazanılacağı kesin olan bir bahistir. s Durum 1 T1 Q Q Durum 2 T1 T2 S i s T2 S i dQ 0 T dQ 0 T ►Termodinamiğin ikinci yasasına göre, yalıtılmış bir sistemde kendiliğinden gerçekleşen süreçler (tersinmez) sistemin entropisini daima arttırır. ► 1. durumda sistem yalıtılmıştır ve kendiliğinden gerçekleşen bir süreç vardır ancak sistemin entropisi azalmıştır. 2. yasaya göre bu mümkün olamaz. ► 2. durumda ise sistem yalıtılmıştır, kendiliğinden gerçekleşen bir süreç vardır ve sistemin entropisi artmıştır. ikinci yasaya göre bu mümkündür. ► 1. Durumda sistem, çok az sayıda durumdan oluşan, gerçekleşme olasılığı çok küçük ve entropisinin azaldığı bir son duruma ulaşır. Bu son durum daha düzenlidir. ► 2. Durumda sistem, çok sayıda durumdan oluşan, gerçekleşme olasılığı çok büyük ve entropisinin arttığı bir son duruma ulaşır. Bu son durum daha düzensizdir. ► Entropi (S) düzenle ilişkilidir. Yalıtılmış bir sistemde, kendiliğinden gerçekleşen (tersinmez) değişimler sonunda sitemin daha düzensiz bir son duruma ulaşması daha olasıdır. ► Tamamen yalıtılmış bir sistemde sistemin entropisi ya artar (tersinmez) ya da sabit kalır (tersinir). Bu durumda sistem ya aynı kalır (tersinir) ya da daha düzensiz bir son duruma ulaşır. ► Entropi mikroskobik düzensizliğin bir ölçüsüdür. Boltzman, entropi ile mikroskobik durumların sayısı arasındaki ilişkinin şu şekilde olması gerektiğini söylemiştir: S kB ln W Entropi ve enerjinin kullanılabilirliği Kapalı bir sistemin enerjisi mutlaka korunur. Ancak tersinmez bir süreçte enerjinin bir kısmı bir iş yapmak için kullanılamaz hale gelir ve harcanır. mgh h Q=mgh Evrenin entropi değişimi S Hava sürtünmesi olmasın, sıcaklık sabit kalsın ve şekil değişikliği olmasın. Sistemin mgh mekanik enerjisi ısıl enerjiye dönüşmüştür. Yani ısı yoluyla sistemin iç enerjisi artmıştır. Mgh enerjisi harcanmıştır ve artık iş yapmak için kullanılamaz. Q mgh harcanan enerji T T T Buradaki TS tersinmez bir süreç sonunda harcanan enerjidir ve bir daha iş olarak kullanılamaz. dWh TdS Tersinmez bir süreçte tekrar işe dönüşemeyen, harcanan enerji ► Mekanik enerji (mgh, mv2/2) düzenlidir ve işe dönüştürülebilir. ► İç enerji düzensizdir, moleküllerin rasgele hareketinden kaynaklanır ve işe dönüştürülemez. DİKKAT! veya Sistem tamamen yalıtılmış. Q=0 E=-W, bu gibi değişimlerde iç enerji işe dönüşmüştür yanılgısına düşmemek gerekir. Burada sistem W işini yaparak veya sistem üzerine W işi yapılarak sistemin iç enerjisi değişmiştir. E artık işe dönüştürülemez.





















