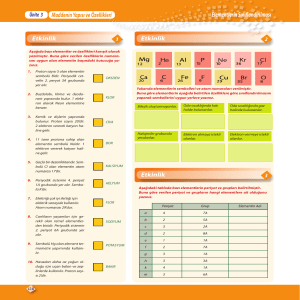
Slayt 1 - Google Groups
advertisement

1 1. PERİYODİK SİSTEMİN TARİHÇESİ Alman Lother Mayer ve Rus Dimitri Mendeleev, Avogadro'nun makalesinin kopyasını alarak memleketlerine dönmüşlerdi. 1869 yılında Mayer ve Mendeleev birbirinden habersiz olarak elementlerin artan atom kütlelerine göre sıralanması halinde düzenli olarak tekrarlanan özelliklerin gözlenebildiğini keşfettiler. Mendeleev bu gözlemlere peri yodik kanun adını verdi. Argonun bağıl kütlesi 40 idi ve kalsiyumun aynısı idi. Fakat argon bir asal gaz, kalsiyum ise aktif bir metaldi. Böyle beklenmeyen durumlar, araştırmacılarda, bağıl atom kütlelerinin elementlerin düzenlenmesinde temel olarak alınmasında şüpheler uyandırdı. 2 1. PERİYODİK SİSTEMİN TARİHÇESİ Mendeleev'in hazırladığı periyodik cetvel kimya literatürüne elementlerin aileleri (grup) kavramını kazandırmıştı. Mendeleev'in periyodik cetvelindeki tutarsızlıklar, gözlenen periyodikliğin temelinde, atom kütlesinden daha başka bazı temel özelliklerin, alabileceği düşüncesini akıllara getirmiştir. Bu özelliğin, atom numarası ile bağlantılı olabileceği de düşünülmekteydi. 3 2. MODERN PERİYODİK SİSTEM α saçılma deneylerinde elde edilen verileri kullanan Rutherford, bir kaç elementin çekirdeğindeki pozitif yükün miktarını tahmin edebilmişti. Ancak 1913'e kadar atom numaralarının tayini için genel bir yöntem yoktu. 1913 yılında genç bir fizikçi olan Henry Moseley yüksek enerjili elektronlarla bombardıman edilen elementlerin ürettiği X ışınlarının frekansları ile atom numaraları arasında, bir ilişki olduğunu keşfetti. Birkaç istisna dışında Moseley, atom numaralarının artış sırasının, atom kütlesinin artış sırası ile aynı olduğunu buldu. Örneğin, kalsiyumun atom kütlesinin artış sırasına göre, yirminci elementtir ve atom numarası da yirmidir. 4 2. MODERN PERİYODİK SİSTEM Bu çalışmalarıyla Moseley, elementlerin kimyasal davranışlarının atom ağırlıklarına değil atom numaralarına göre sıralanması gerektiğini göstermiştir. Bugünkü modern periyodik çizelge atom numaralarını esas almaktadır. Modern bir periyodik çizelge, genellikle element simgesiyle atom numarasını birlikle gösterir. Elementlerin elektron dağılımları, fiziksel ve kimyasal özelliklerdeki tekrarların açıklanmasına yardımcı olur. Periyodik çizelge bir grubun veya bir periyodun içinde yer alan elementlerin genel özelliklerini ve kimyasal eğilimlerini anlamamıza, her hangi bir elementin özelliklerini oldukça doğru bir şekilde tahmin edebilmemize yardımcı olur. 5 2. MODERN PERİYODİK SİSTEM Elementleri özelliklerinden benzerliklerine göre sınıflandıran çizelgeye periyodik cetvel veya periyodik tablo denir. Periyodik cetvel, periyot ve gruplardan oluşur. Periyodik cetvelin yatay sıralarına periyot denir. Periyotlar enerji seviyelerini temsil eder. Temel elektron dizilişinde elektron içeren enerji seviyeleri eşit olan elementler atom numaralarının artışına göre sıralanarak periyotlar oluşturulmuştur. Periyodik cetvelin düşey sütunlarına grup denir. Gruplar değerlik elektron sayısını temsil eder. A ve B olmak üzere iki tür grup bulunmaktadır. 6 2. MODERN PERİYODİK SİSTEM Periyodik cetvel periyotlar ve gruplar dışında dört ana bloğa ayrılmıştır. Bunlar s, p, d ve f bloklarıdır. Temel Elektron dizilişleri s ile biten elementler s bloğunda (He hariç), p ile bitenler p bloğunda, d ile bitenler d bloğunda ve f ile bitenler f bloğunda yer alır. 7 8 2. MODERN PERİYODİK SİSTEM s ve p bloklarındaki elementler A gruplarını, d ve f bloklarındaki elementler ise B gruplarını oluşturur. Periyot ve grupların bulunmasında başkuantum sayısı, değerlik orbitaller ve değerlik elektron sayısı kullanılır. ***Temel elektron dizilişinde *başkuantum sayısı (en yüksek enerji seviyesi olup en son s orbitalinin katsayısıdır) periyot numarasını, *değerlik orbitaller grubun türünü, *değerlik elektron sayısı ise grubun numarasını verir. 9 10 11 12 13 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK a) Periyotlar En yüksek enerji düzeyleri eşit olan elementlerin atom numaralarındaki artışa göre, soldan sağa doğru sıralanmasıyla elde edilen satırlardır. Bir elementin değerlik elektronlarının bulunduğu enerji düzeyini gösterir. Bundan dolayı 7 tanedir. Yukarıdan aşağıya numaralanır. Periyotların numarası “n” ile gösterilir. “n” baş kuantum sayısıdır. Birinci periyot hariç, her periyot bir metalle başlar. Yedinci periyot hariç, her periyot bir soygaz ile biter. 14 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK b) Gruplar Gruplar değerlik orbitallerin türünü ve değerlik elektron sayısını temsil eder. Bir gruptaki elementlerin kimyasal özellikleri birbirine benzer. Bu ilkeye 1H elementi uymaz. 1A grubu elementlerine alkali (bazik) metaller denir. Bu elementlerin özellikleri birbirine benzer. Ancak H elementi metal değildir ve özellikleri gruptaki elementlerin özelliklerine benzemez. Periyo dik tablonun gruplarının ve bloklarının ortak özelliklerinden kaynaklanan özel adları vardır. 15 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK * B gruplarına dahil olan f bloğundaki elementlere ise iç geçiş elementleri denir. 16 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK c) Bloklar Bir element atomunun değerlik katmanındaki elektron dizilimi, o elementin periyodik sistemdeki yerini belirler. Kesin olarak helyum s bloğuna aittir, fakat p bloğunda göste rilmiştir. Helyum, 2A gruptaki metallerden ziyade 8A gruptaki (18. grup) asal gazların özelliklerini gösteren bir gazdır. 8A grubunun diğer elementlerinde olduğu gibi helyum da dolu bir değerlik katmanına sahip olduğundan onun yeri 8A grubudur. Hidrojen, periyodik sistemde, ayrıcalıklı bir yerde bulunmaktadır. Bir tane s - elektronu olduğundan birinci grup (1A grup) tadır. Hidrojen aynı zamanda asal gazlardan bir eksik elektrona sahip olduğundan 7A grubu (17. grup) üyesi gibi davranabilir. 17 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK s ve p blokları, ana grupları oluştururlar. Aynı ana grupta bulunan elementlerin atomlarının değerlik katmanındaki elektron dağılımı aynı olup yalnız baş kuantum sayıları farklıdır. Bir temel grupla atomların özelliklerinin büyük ölçüde benzer olmasının nedeni; aynı dış enerji seviyesinde bulunan elektron sayısının ve dağılımının benzerliğidir. Grup numarası, değerlik elektron sayısını verir. 18 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK Altıncı periyotta 32 element bulunur. Bu periyotta 57'den 71'e kadar olan elementlere lantanitler veya nadir toprak elementleri denir. Bu periyotta 6s, 4f, 5d ve 6p orbitallerine elektron girdiğinden, toplam 32 elektronun girebileceği yer vardır. Lantanitler genellikle benzer kimyasal özellikler gösterirler. 7. periyottaki f-blok elementlerinin de kimyasal özellikleri birbirine benzer. 89'dan 103'e kadar olan elementlere aktinitler denir. Bunların hepsi radyoaktif element olup, çok benzer özelliklere sahiptirler. 19 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK 20 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK 21 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK 22 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK 23 3. ELEKTRON DİZİLİMİ, PERİYOT, GRUP VE BLOK 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54