MAGNETİK ÖZELLİKLER Orbitallerinde çiftlenmemiş
advertisement

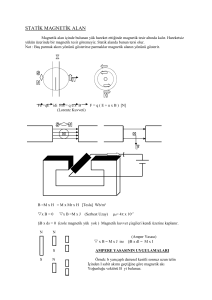
MAGNETİK ÖZELLİKLER Orbitallerinde çiftlenmemiş elektronu bulunan maddeler paramanyetik, bütün elektronları orbitallerde çiftlenmiş olarak bulunan maddeler ise diyamanyetik özellik gösterirler. Paramanyetik maddeler manyetik kuvvet çizgilerini çeker, diyamanyetik maddeler iter. Bir kristal yapıda yinelenen paramanyetik atomların çiftlenmemiş elektronları paralel spinli olarak yönelirlerse, birbirlerine paralel olan spin manyetik moment vektörlerinin bileşkesinden çok daha kuvvetli bir manyetik alan oluşur. Böyle maddelere ferromanyetik madde denir. Cihazda kullanılan mıknatıs bir elektromıknatıs veya daimi mıknatıstır. Kullanılan alan şiddetinin 600 gauss’tan aşağı olmaması gerekir. Elektronun haraketi sonunda magnetik alana konan madde magnetik özellik kazanır. Diamagnetizim: Sıcaklığa ve uygulanan magnetik alana bağlı değildir. Mıknatısın kuvvet çizgilerinin yakın olması uygulanan alanın kuvvetli olduğunu gösterir. Madde diamagnetikse kuvvet çizgileri biribirinden uzaklaşır. Eşleşmiş elektronların neden olduğu bir özelliktir. Paramagnetizim: Ortaklanmamış elektronun maddeye verdiği bir özelliktir. Paramagnetik maddelerin de diamagnetik özellikleri vardır ancak paramagnetik özellikleri yanında çok küçüktür. Paramagnetik özellik alana değil sıcaklığa bağlıdır. Ferromanetizim: Bir maddeye dış magnetik alan uygulandığında paramagnetizme göre çok daha fazla magnetik moment görülür. Yani magnetik alan tarafında çok fazla çekilir. Bu özellik hem alana hen de sıcaklığa bağlıdır. Asitte çözülürse bu özellik kaybolur. Magnetik Süssebtibilite koordinasyon bileşiklerinde yapı aydınlatmasında, metal atomunun sterokimyası, bağ türü, oksidasyon basamağı belirlenmesinde kullanılır. Katıların magnetik süssebtibilitesi Gouy yöntemiyle ölçülür. Ölçüm sonucu koordinasyon bileşiğinin içinde kaç tane ortaklanmamış elektron bulunduğu ve bileşiğin yapısı bulunabilir. “n” eşleşmemiş elektron sayısı XA = Xm – Xdia eşitlikte Xdia yı yok sayarsak XA = Xm alabiliriz. Xm = Xg .MA Xm: maddenin 1 mol gr. Inda oluşturulan magnetikleşme şiddeti. Xg: Maddenin 1 gr. Da oluşturulan magnetikleşme şiddeti. R0 = Boş tüp için okunan değer R = Tüp örnek dolu iken okunan değer m = mdolu – mboş Örnek ağırlığı L: Örneğin tüp içindeki yüksekliği K3[Cr(C2O4)3] Potasyumtriokzalatokromat(III) Kompleksinin Magnetik Süssebtibilitesinin Hesaplanması T = 293 K Cst = 1029 Cok= 1011 Cbal = Cst / Cok = 1029 / 1011 = 1,0178 R0 = -34 R = 883 L = 2,3 cm mdolu = 1,0300 gr mboş = 0,8171 gr m = mdolu – mboş ise m= 1,0300 – 0,871 = 0,159 gr K3[Cr(C2O4)3] .3H2O için MA = 487 gr / mol Xg = 1,35009.10-5 Xm = Xg .MA ? Xm =1,35009.10-5. 487 gr/mol Xm = 0,0065749 XA = Xm – Xdia eşitlikte Xdia yı yok sayarsak XA = Xm alabiliriz. m = 3,92517 bulunur. eşitliğinden Her iki tarafın karesini alırsak ; n2 + 2n -15,40699 = 0 denkleminin çözümünden n1= 3,05 ve n2= -5,05 bulunur. Denklemin çözümüne göre eşleşmemiş elektron sayısı “3″ olarak bulunur. Bu çözüme göre kompleksin özellikleri aşağıdaki gibi olur. 1s2 2s2 2p6 3s2 3p6 3d5 4s1 K3[Cr(C2O4)3] kompleksi; oktahedral yapıdadır. Koordinasyon sayısı 6 dır. Paramanyetiktir Bazen magnetik süseptibilite ölçümleri ile bir koordinasyon bileşiğinin ayrıntılı yapısı bulunur. Örneğin: K2[Fe(CN)5(NO)] Fe nin 3+ değerde kabul edildiği halde nitroso prusiadların diamagnetik oluşundan NO daki tek elektronun Fe ye transferi ile Fe nin 2+ değerde bulunmuştur. Ödev 1. [Co(C5H7O2)3] Kobalt(III) asetilasetonato Kompleksinin magnetik Süssebtibilitesinin koordinasyon sayısını, değerliğini, geometrisini bulun. T = 293 K Cst = 1029 Cok= 1011 R0 = -33 R = -23 l = 2 cm mdolu = 0,9323 gr mboş = 0,8188 gr 2. Cr(CH3COCHCOCH3)3 ve Mn(CH3COCHCOCH3)3 oktahedral geometrilerdir. her biri için çiftleşmemiş elektron sayısını bulunuz. Dipol momentin teorik değeri nedir? (Cr: 24, Mn: 25) Komplekslerin manyetik özellikleri aşağıda belirtildiği gibi hesaplandı. Wo W WWo 0.081 9 L Ro R Cbal Xg Xm µeff n 1. 6 33 319 1.05 4 6.795x1 0-6 4.695x 10-3 3.3 4 B.M [NiL2](OH)2 691 0.812 8 0.894 7 [FeL2Cl3] 461 0.819 4 0.929 4 0.11 1. 8 31 256 0 1.05 4 44.687x 10-6 20.600x 10-3 7.0 0 [CuL2]Cl 698 0.814 0 0.835 3 0.021 3 1 32 38 1.05 4 3.513 x10-6 2.452.10 2.4 1 [CuL2](CH3 COO)2 784 0.775 0 0.808 7 0.033 7 1. 5 32 176 1.05 4 9.758x1 0-6 7.650.10 [CoL2(H2O)2 0.828 ](OH)2 4 668 0.857 1 0.028 7 1 31 365 1.05 4 14.60x1 0-6 2.460.10 Ctüp: 998 Ro: -32 -3 -3 -3 4.2 7 4.8 9 R standart tüp: 914 Cbal : 998/ 914+32: 1.054 Xg Ni(II) = 1.054 x1.6(319+33) : 6.795x10-6 0.0819x109 Xg Fe(III) = 1.054 x1.8(2560+31): 44.687x10-6 0.11x109 Xg Cu(I) = 1.054 x1,5(38+33) : 3.513 x10-6 0.0320x109 Xg Cu(II) = 1.054 x1.5(176+32): 9.758x10-6 0.0337x109 Xg Co(II) = 1.054 x1.5(180+32): 3.683x10-6 0.0910x109 Xm: Xg x M XmNi(II): 6.795.10-6 x 691: 4.695x 10-3 XmFe(III): 44.687.10-6x 461 : 20.600x10-3 XmCu(I): 3.513 .10-6x 698 : 2.452.10-3 XmCu(II): 9.758.10-6 x784 :7.650.10-3 XmCo(II): 14.60.10-6 x 668: 10.04.10-3 µ eff: 2.828 Ni(II): 3.34 Xm x T : n(n+2) Fe(III):7.00 Cu(I):2.41 Cu(II): 4.27 Co(II): 4.89 Komplekslerin 25oC de magnetik süsseptibilite değerleri ölçülerek, eşleşmemiş elektron sayıları ve hibrit türleri ve elde edilen sonuçlardan da geometrik yapıları saptanmaya çalışıldı. Komplekslerin mağnetik özelliklerinden bulunan sonuçlara göre; Ni(II) atomunun, [NiL2](OH)2 şeklindeki kompleks yapıda magnetik momenti (µeff) 3.34 B.M olarak bulunmuştur. Literatürde oda sıcaklığında yüksek sipin Ni(II) komplekslerinin magnetik momentinin 2.9- 3.3 B.M olduğu bildirilmektedir . Buradan Ni(II) kompleksinin iki eşleşmemiş elektrona sahip ve oktahedral geometride olduğu söylenebilir. Fe(III) atomunun, [FeL2Cl3] şeklindeki kompleks yapıda magnetik momenti 7.00 B.M olarak bulunmuştur.. Buradan Fe(III) kompleksinin beş eşleşmemiş elektrona sahip ve üçgen çift piramit yapıda olduğu söylenebilir. Cu(I) atomunun, [CuL2]Cl şeklindeki kompleks yapıda magnetik momenti 2.41 B.M olarak bulunmuştur. Literatürde Cu(I) komplekslerinin magnetik momentinin 2.9- 3.3 B.M olduğu bildirilmektedir (Lit.). Buradan Cu(I) kompleksi tek eşleşmemiş elektrona sahiptir. Cu(II) atomunun, [CuL2](CH3COO)2 şeklindeki kompleks yapıda magnetik momenti 4.27 B.M olarak bulunmuştur. Buradan Cu(II) kompleksinin iki eşleşmemiş elektrona sahip ve tetrahedral geometride olduğu söylenebilir. Co(II) atomunun, [CoL2(H2O)2](OH)2 şeklindeki kompleks yapıda magnetik momenti 4.89 B.M olarak bulunmuştur. Literatürde oda sıcaklığında Co(II) komplekslerinin magnetik momentinin 4.3-5.2 B.M olduğu bildirilmektedir . Buradan Co(II) kompleksinin üç eşleşmemiş elektrona sahip ve oktahedral geometride olduğu söylenebilir. Paskal'da ' sabitleri koordinasyon bileşiklerinin manyetik özelliklerinin değerlendirilmesinde kullanılan sayılardır. Bir bileşiğin manyetik özelliği diamanyetik paramanyetik duyarlılık toplamıdır. Paramagnetik özellik diyamanyetik özellikten kaynaklanan etkiyi çok fazla aşmaktadır. Bu nedenle, diyamanyetik düzeltme çok hassas olmayan çalışmalarda ihmal edilebilir. Diyamanyetik düzeltmeler, molekülün bileşenlerindeki katkıları toplanmasıyla hesaplanır. Bunlar Pascal'ın sabitleri olarak bilinir.. Pascal Constants (10-6 cgs-emu) cation value + Li -1.0 + Na -6.8 + K -14.9 + Rb -22.5 + Cs -35 + NH4 -40 2+ Mg -5 2+ Fe -12.8 2+ Co -12.8 2+ Ni -12.8 2+ Cu -12.8 2+ Zn -15 2+ Cd -24 2+ -40.0 Hg 2+ Pb -32.0 ligands value H2O -13 NH3 -18 pyridine -49 ethylenediamine -46.5 bipyridyl -105 phenanthroline -128 acetylacetonate -52 glycinate -37 Triphenylphosphine -167 In covalent compounds value H -2.93 B -7.0 C -6.00 C (ring) -6.24 -5.57 N (open chain) N (ring) -4.61 O -4.6 F -6.3 Cl -20.1 anion F– Cl– Br– I– OHCNNCSCO32– NO3– SO42ClO3ClO4BrO3IO3IO4- value -9.1 -23.4 -34.6 -50.6 -12.0 -13.0 -31.0 -29.5 -18.9 -40.1 -30.2 -32 -38.8 -51.4 -51.9 Br I -30.6 -44.6 With organic molecules corrections are made for bond types other than C-C and C-H single bonds. Correction Constants Bond type value C=C +5.5 C≡C +0.8 C=O +6.3 COOH -5.0 C≡N 0.0 Cevap Co(C5H7O2)3] Kobalt(III) asetilasetonato Kompleksinin Magnetik Süssebtibilitesinin Hesaplayınız T = 293 K Cst = 1029 Cok= 1011 Cbal = Cst / Cok = 1029 / 1011 = 1,0178 R0 = -33 R = -23 l = 2 cm mdolu = 0,9323 gr mboş = 0,8188 gr m = mdolu – mboş ise m= 0,9323 – 0,8188 = 0,1135 gr [Co(C5H7O2)3] için MA = 356 gr / mol Xg = 1,79348.10-7 Xm = Xg .MA ? Xm =1,79348.10-7. 356 gr/mol Xm = 6,38479.10-7 XA = Xm – Xdia eşitlikte Xdia yı yok sayarsak XA = Xm alabiliriz. m = 0,38680 bulunur. eşitliğinden Her iki tarafın karesini alırsak ; n2 + 2n -0,14961 = 0 denkleminin çözümünden D = b2-4ac ve n1,2 = (-b+/-?D)/2a n1= 0,07 ve n2= -2,07 bulunur. Denklemin çözümüne göre eşleşmemiş elektron sayısı “0″ olarak bulunur. Bu çözüme göre kompleksin özellikleri aşağıdaki gibi olur. 1s2 2s2 2p6 3s2 3p6 3d7 4s2 3d64s0 [Co(C5H7O2)3] kompleksinin koordinasyon sayısı 6 dır. Oktahedral yapıdadır. İç orbital kompleksidir. Diamanyetiktir.