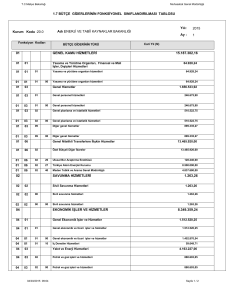
Yakıt Pilleri Ders Notları - Bülent Ecevit Üniversitesi
advertisement

T.C. Zonguldak Karaelmas Üniversitesi Mühendislik Fakültesi Çevre Mühendisliği Bölümü ÇEV 346 Yakıt Pilleri Ders Notları Prof. Dr. Yılmaz YILDIRIM 2011 1. Giriş Kömür ve petrol gibi fosil yakıtlar sanayi toplumu hayatının refah ve zenginlik seviyesinin artmasındaki en önemli aktörler durumundadır. Ağır sanayinin kömür ve petrol öncesi yakıtlarla oluşturulmasının güçlüğü malumdur. Bu bakımdan ağır sanayi, makineleşme ve fabrikasyonda bu yakıtların etkinliği tartışılmazdır. Ancak tüm bu gelişmeler bir takım problemleri de beraberinde getirmiş, fakat bu problemler sürekli arka plana itile gelmiştir. Bu problemlerin başında petrol türevli yakıtların ekolojik dengeye verdikleri zararlar gelmektedir. Hemen hemen tümü karbon içerikli bu yakıtların yanması ile açığa çıkan emisyonların zehirli olması, atmosferde bu emisyonların derişimindeki artış; asit yağmurları ve sera etkisini de beraberinde getirmektedir. Bu etkiler günümüzde daha da hissedilir bir boyuta ulaşmıştır. Küresel bazdaki en önemli etkisi sera etkisi olarak görülmektedir. Bu etki özellikle CO2’in yol açtığı ve atmosferdeki derişiminin artması ile bir doğal sera gibi güneş ışınlarını yerküreye hapsederek ısınmaya ve sıcaklık artışına yol açmasıdır. Her ne kadar bu sıcaklık artışı küçük değerlerde gerçekleşse de, bu yerküre için önemli sonuçlar doğurmaktadır. Özellikle yerkürede ısıl anlamda pek çok fonksiyonlar taşıdığı düşünülen kutup bölgelerindeki buzulların erimesi, o bölgedeki ekolojik dengeyi bozmaya, iklimlerde anormal gelişmeleri (aşırı yağış, kuraklık, fırtına, kasırga vb.) beraberinde getirmektedir. Petrolün kullanımı sonrası ortaya çıkan bir diğer temel problem ise fosil kökenli oluşu ve bu nedenle tükenebilirliğidir. Bugün dünya enerji ihtiyacının %88’i fosil yakıtlardan (kömür, petrol ve doğalgaz) sağlanmaktadır. Bunun %38’ini petrol, %30’unu kömür ve %20’sini ise doğalgaz oluşturmaktadır. Tüketim hızının dünya nüfus artışı ile fazlalaşması mevcut petrol rezervlerini her geçen gün azaltmaktadır. Bazı araştırmalarda bu rezervlere 50-60 yıllık bir ömür biçilmektedir. Bu süre ise aslında yeni bir enerji sisteminin kurulması ve yaygınlaşması için hiçte uzun değildir. Yani bu rezervlerin tükenmesi halinde ortaya alternatif bir yakıt ve enerji sisteminin kurulmasının gerekliliği ortadadır. Bu gerekliliğe rezerv sınırlılığı ile beraber çevresel faktörlerde eklendiğinde alternatif bir yakıta duyulan ihtiyaç daha da fazlalaşmaktadır. Alternatif bir yakıttan istenen temel karakteristikler özetle; yüksek ısıl değer, zehirli olmama, çevreyle uyumlu olma, farklı enerji dönüştürücülerinde kullanılabilme ve ekonomiklik olarak ifade edilebilir. Bu bakımdan hidrojen yakıtı da önemli niteliklere sahip ve sınırsız olarak tanımlanabilecek bir alternatiftir. Yakıt pili özellikle 20. yüzyılın ikinci yarısında hızlı bir gelişim süreci sergilemiş yeni bir enerji üretecidir. Isı makinelerinde söz konusu olan “yakıt kimyasal enerjisi-ısı enerjisimekanik enerji” dönüşümü yerini yakıt pilinde, “yakıt kimyasal enerjisi-elektrik enerjisimekanik enerji” dönüşümüne bırakmaktadır. Yakıt pilinde yanma olmaksızın, elektro kimyasal bir dönüşüm ile elektrik üretilmektedir. Bu elektrik ise istenilen herhangi bir amaçla kullanılabilmektedir. Örneğin bir elektrik motoru tahrik edilerek taşıta hareket sağlanması mümkündür. Yani yakıt pilinin taşıtta kullanılması halinde mekanik enerji; krank-biyel mekanizması yerine, elektrik motoru ile sağlanarak; pek çok karmaşık ve günümüze göre hantal denilebilecek mekanizma ortadan kalkmaktadır. Bu mekanizmaların yol açtığı titreşim, gürültü, mekanik kayıplar, komplike yapı, yüksek sıcaklık ve zararlı emisyonlardan kurtulmak mümkün olabilmektedir. Pek çok yakıtın kullanımına uyumlu olabilen yakıt pilinde hidrojenin yakıt olarak kullanımı halinde reaksiyon sonrası emisyon olarak yalnızca su oluşmaktadır. Yüksek verimlilik, yakıt pili tipine bağlı olarak düşük çalışma sıcaklığı (100 °C’nin altında), hareketli parça içermemesi ve bu nedenle titreşimsiz çalışma, hızlı cevap süresi ve az mekanik aksam temel üstünlükleri olarak sayılabilir. Yakıt pili, çok eski bir buluş olmasına rağmen ilk kez 1958 yılında NASA’nın uzay programında Apollo, Gemini, ve Space Shuttle uzay gemilerinde kullanılmıştır. İlk yakıt pili çalışmaları 1838 yılında Sir William Grove tarafından H2-O2 pili üzerinde yapılmıştır. Yaptığı çalışmalar sırasında suyun elektrolizinin ters reaksiyonu sonucunda sabit akım ve gücün üretildiğini fark eden Grove, tesadüfen çok büyük bir buluş gerçekleştirmiştir. 1893 yılında Friedrich Wilhelm Ostwald, yakıt pili içindeki her elemanın görevini ve etkisini araştırmıştır. William W. Jacques, 1896 yılında ergimiş elektrolitli yakıt pillerinin temelini atarak kömürün elektrokimyasal enerjisinden faydalanarak doğrudan elektrik üretmeyi amaçlamıştır. 1900 yılında, ünlü bilim adamı Nernst’in başlattığı katı oksit elektrolit ile çalışan yakıt hücresi projesini, Emil Baur 1937 yılında başarıya ulaştırmıştır. Yakıt pilinin günümüzdeki konumuna gelmesini sağlayan en önemli çalışma 1939 yılında Thomas Bacon tarafından alkalin yakıt pilleri üzerinde yapılan çalışmalar olmuştur. Bu çalışmanın önemini anlayan Pratt&Whitney şirketi bu projeye lisans vererek NASA programlarında kullanılmasını sağlamıştır. 1950 Uzay çalışmalarındaki yarış ile yakıt pillerine olan ilgi arttı ve 1958 yılında NASA H2-O2 pilini uzay araçlarında kullanmaya başladı.1980’de bas gösteren petrol krizleri sonrası hidrojen ve hidrojenli yakıt pilleri büyük önem kazandı. 2000’li yıllarda ise teknoloji geliştirme çalışmalarının yanı sıra, yaygın kullanıma geçilmesi ve maliyetlerin düşürülmesi için yoğun çalışmalar sürdürülmektedir. Günümüze değin farklı yakıt pili tipleri geliştirilmiştir. Bu yakıt pillerinin her biri farklı uygulamalar için tercih edilmektedir. Bu uygulamalar; enerji santrali, taşıt, sanayi, evsel ve taşınabilir elektronik cihaz uygulamaları olarak kategorize edilebilir. Özellikle enerji santrali ve taşıt uygulamaları konularında yapılan yoğun çalışmalar ve sonucunda prototip üretimler; artık hızla seri üretime dönük çalışmaların planlanmasının da önünü açmıştır. Pek çok otomobil üreticisi firma, yakıt pili ile çalışan taşıt yada yakıt pili destekli hibrid taşıt konusunda Ar-ge çalışmaları yürütürken, pek çok da bilimsel çalışma yapılmaktadır. Bu Arge çalışmaları çerçevesinde üretilen prototip taşıtlar farklı koşullardaki (basınç, sıcaklık, nem) coğrafyalarda da denenerek seri üretim alt yapısı oluşturulmaya çalışılmaktadır. Yakıt pillerinin kullanımına yönelik hazırlanan pek çok ulusal ve uluslar arası rapor, gelişmiş ülkelerin bu konuya bakışları ve verdikleri önem bakımından oldukça önemlidir. Taşınabilir cihazlarda yakıt pilinin kullanımına yönelik pek çok çalışma yürütülmektedir. Portatif uygulamalar denilebilecek bu cihazlar, sivil kullanım dışında askeri uygulamalar için de uygun niteliktedir(23,24). Mobil uygulamalar ise özellikle kara, hava, deniz ve uzay araçlarına daha fazla katkılar sağlayacak, verimlilik, çevre ile uyumluluk, daha dengeli ve sessiz çalışma ekseninde pek çok avantajlar kazandıracaktır. Stasyoner (sabit) uygulamalar bakımından ise özellikle enerji santrallerinde yenilikler sağlayabilecektir. Yerleşim merkezlerinin genellikle dışında kurulan dev santraller yerlerini, daha bölgesel ya da yerel enerji santrallerine bırakabilecek, böylelikle enerji iletim hatlarının daha da azaltılabilmesi ve böylelikle kayıpların düşürülebilmesi temin edilebilecektir. Özellikle yerleşim alanlarının dışındaki bölgelerde daha özel enerji gereksinimleri, yerinden yakıt pilleri ile sağlanabilecektir. Hatta evlerde de belki başlangıçta yedek güç kaynağı olarak (evsel jeneratör) yakıt pili üreteçleri kurulabilecektir. Fosil yakıtların giderek azalması ve fosil yakıtların enerji üretiminde kullanılmalarının neden olduğu olumsuz çevresel etkiler, yeni ve temiz enerji üretim kaynaklarına yönelmeyi zorunlu kılmaktadır. Yakıt pilleri, yakıt olarak hidrojeni kullanan ve son yıllarda üzerinde yoğun olarak çalışılan alternatif teknolojilerden birisidir. Yakıt pilleri, yakıt enerjisini bir yanma prosesine başvurmadan doğrudan akıma çeviren elektrokimyasal düzeneklerdir. Yakıt hücresinde kimyasal olarak depolanan enerji elektrokimyasal bir prosesle elektrik akımına çevrilir. Hidrojen ve oksijen arasındaki reaksiyon ile elde edilen ve toplam verimlilikleri %80'lere kadar ulaşabilen yakıt pilleri, sürekli çalışan piller veya elektrokimyasal makineler olarak da bilinir Yakıt Pili Nedir? Yakıt pili; uygun bir yakıt ve oksitleyicinin elektrokimyasal bir reaksiyonu ile elektrik enerjisi üreten bir sistemdir. Yani yakıt pili, yakıt ve havanın elektrokimyasal tepkimesi ile yakıt kimyasal enerjisini doğrudan elektrik enerjisine dönüştüren bir üreteçtir. Elektrolizin ters reaksiyonu olarak da tanımlanabilecek olan yakıt pili reaksiyonu sonrası, doğru akım (DC) formunda elektrik üretilir. Yakıt pilleri, elektrokimyasal bir proses ile elektrik üretiyor olmaları bakımından piller ve aküler ile benzerlik gösterirler. Piller ve aküler, içerisinde depo edilmiş olan enerjiyi elektrokimyasal bir reaksiyon ile elektrik enerjisine dönüştürürler. Sağladıkları enerji, içerisinde depo edilmiş olan enerji ile sınırlıdır. Yakıt pilleri ise yakıt ve hava sağlandığı sürece bu dönüşümü sürekli gerçekleştirebilen enerji üretim sistemidir. Şekil 1’de bir yakıt pili ve işleyişi şematik olarak görülmektedir. Şekli 1. Bir yakıt pilinin genel yapısı ve işleyişi Temel olarak bir yakıt pili; elektrolit ve bunun her bir yüzeyi ile temas halinde bulunan geçirgen-gözenekli yapıda bulunan anot ve katot elektrotlardan oluşur. Yani elektrotlar geçirgen ve gözenekli (poroz) yapıdadır ve elektrotların arasında elektrolit yer alır. Yakıt pilinin anot (negatif) kutbu ya da elektrotuna; gaz yakıt, katot (pozitif) kutbu ya da elektrotuna ise; oksitleyici (hava yada oksijen) gönderilir. Gönderilen bu yakıt ve havanın elektrokimyasal reaksiyonu sonucunda anot ve katot arasında oluşan potansiyel farkı bir elektron akışını ve elektriksel gerilimi meydana getirir. Reaksiyon sonrası ısı, saf su ve karbon içerikli bir yakıt kullanılıyorsa ilave olarak karbondioksit açığa çıkar. Pek çok yakıt pili gerek normal gerekse kombine çevrimlerde kullanılabilirler ve oldukça yüksek verimle enerji dönüşümü sağlarlar. Bu dönüşüm sırasında yakıt pilleri ısı makineleri gibi Carnot çevrimine bağlı kalmazlar. Yakıt pillerinde her bir anot-elektrolit-katot grubuna “Membran Elektrot Grubu-Membrane electrode assembly (MEA)” denilir (Şekil 2). Ya da bunların her birisi “Yakıt Hücresi“ olarak adlandırılmaktadır. Bir yakıt hücresinde oluşan gerilim 1 Volt’un altında olduğundan çok sayıda hücre seri olarak bağlanarak, yüksek gerilim seviyelerine ulaşılabilmektedir. Temel olarak anot, katot ve elektrolitten oluşan yakıt pillerinde yakıt ve hava akışını yönlendiren, hücreler arası bağlantıyı sağlayan kısımlar söz konusudur. Hücreler arası bağlantı elektrotlarla temas halinde bulunan “Akım Toplayıcı Plakalar (bipolar plaka)” ile sağlanır (Şekil 3). Bu plakaların üretiminde genellikle; iyi bir ısıl ve elektriksel iletken, mekanik olarak katı (rijit) ve kimyasal olarak kararlı olmaları nedeni ile grafit malzeme kullanılmaktadır. Ancak grafitin işlenme güçlüğü ve yüksek maliyeti nedeni ile çelik ve benzeri karbon içerikli metallere yönlenilmektedir. Pek çok yakıt pili uygulamasında gaz dağıtım kanalları da bu plakalar üzerinde yer alır. Bu dağıtım kanalları farklı akış biçimi ve geometride olabilmektedir. Şekil 2. Membran Elektrot Grubu (Membrane Electrode Assembly-MEA) Yakıt pillerinde ayrıca katalizörler de kullanılır. Reaksiyon oluşum hızını arttırmak için kullanılan bu katalizörler, yakıt pili tipine bağlı olarak farklılıklar gösterir. Ve genellikle de her bir elektrotla temas halinde katalizörler kullanılır. Yakıt pili performansında işletme şartları önemli olsa da, bu performansta temel faktörler olarak yakıt pilinin her bir biriminde kullanılan elemanların yapısı, malzemesi ve bunlara bağlı olarak performansları sayılabilir. Bu nedenle yakıt pilinde kullanılan malzemeler ve ekipmanlarla ilgili olarak yapılan çalışmalar da büyük önem taşımaktadır. Yakıt pilinde çok sayıda hücrenin bir araya getirilmesiyle “yakıt pili yığını-fuel cell stack” denilen yapılar oluşturulmaktadır. Yakıt pili yığınları ile istenilen oranda voltaj üretebilecek bir sistem geliştirilerek değişik amaçlar için kullanılmaktadır. Bir yakıt pili yığını ve elemanlarının detaylı görünümü Şekil 4’te verilmektedir. Şekil 3. Bir yakıt pili yığını ve bi-polar plakalarının detaylı görünümü Şekil 4. Bir yakıt pili yığını ve elemanlarının detaylı görünümü Yakıt pilinde çok sayıda hücrenin bir araya getirilmesine ilave olarak, yakıt işleme ünitesi, güç dönüştürücü, kontrol ünitesi gibi kısımları ile beraber birkaç watt’tan megawatt seviyelerine kadar güç çıktısı sağlanabilmektedir Ayrıca ihtiyaç halinde yakıt pilinden elde edilen gerilimin düzenlenmesi için regülatör, doğru akımın alternatif akıma (AC) dönüşümü için ise dönüştürücü (inverter) kullanılabilmektedir. Yakıt pilleri çalışma sıcaklık aralığına göre düşük ve yüksek sıcaklık yakıt pilleri olarak kategorize edilebilirlerse de, (bazı kaynaklarda orta sıcaklık da sınıflandırmaya dâhil edilmektedir) asıl farklılık kullanılan elektrolit malzemesinden kaynaklanmaktadır. Yakıt pillerinin yüksek verimlilikleri dışında, hareketli parça içermeme, sessiz, modüler, kompakt yapılı, geniş yakıt yelpaze ile çalışabilme, düşük emisyon, yüksek güvenilirlik, kolay kurulum, hızlı enerji dönüşümü ve kojenerasyona uyumlu olma gibi özellikleri yada avantajları vardır. Dezavantajları ise; yüksek maliyet, büyük hacim ya da ağırlıkta yakıt depolama gereksinimi (Özellikle mobil uygulamalarda önem taşır), direkt hidrojen kullanımı halinde yüksek yakıt fiyatı, kullanım ömürlerinin tam olarak bilinememesi olarak özetlenebilir. Pek çok enerji üretecinde olduğu gibi yakıt pillerinde de yakıt pilini tamamlayan yada bir sisteme dönüştüren ekipman yada ilave üniteler kullanılması gerekebilmektedir. Bu şekildeki yani yakıt pili ve yardımcı üniteler ile birlikte oluşan sistem “Yakıt Pili Sistemi” şeklinde adlandırılabilir. Bu yönden bir yakıt pili sistemi, temel olarak 4 üniteden oluşmaktadır Böyle bir yakıt pili sistemi Şekil 5’de gösterilmektedir. Bu temel üniteler; yakıt işleme ünitesi, güç üretim ünitesi (yakıt pili grubu-modül), güç dönüşüm ünitesi ve kontrol ünitesi grubundan oluşmaktadır. Şekil 5. Yakıt Pili Sistemi genel yapısı ve elemanları Yakıt işleme ünitesi; yakıtın yakıt piline gönderilmesi öncesinde hazırlandığı, eğer doğrudan hidrojen kullanılmıyorsa, kullanılan yakıttan hidrojenin ayrıştırıldığı, saflaştırılıdığı ve koşullandırıldığı ünitedir. Güç üretim sistemi; olarak isimlendirilen bölüm bir veya birden fazla yakıt pili modülünden meydana gelebilmektedir. Sistemde güç üretiminin gerçekleştirildiği ünitedir. Güç dönüşüm ünitesinde hücrede üretilen doğru akım ticari kullanım için düzenlenir (regüle edilir) ya da dönüştürücüler (inverter) yardımı ile alternatif akıma çevrilir. Kontrol sistemi ünitesinde, sistemin tüm işleyişi denetlenir ve kontrol edilir. Bu noktada en önemli kontrol; başta nemlendirme, yakıt pili sıcaklık kontrolü, yakıt-hava debi kontrolü, gerilim-akım çıktı kontrolü, atık ısı, atık su kontrolü, soğutucu akışkan kontrolü vb. gibi sıralanabilir. Ayrıca pek çok yakıt pili sisteminde yardımcı elemanlar olarak adlandırılabilecek bazı ekipmanlar da söz konusudur. Bunlar; fan, kompresör, nem ünitesi, ısı değiştiriciler vb. olarak sayılabilir. Yakıt Pillerinin Özellikleri ve Önemi Geleneksel enerji üretim sistemlerinde elektrik enerjisi eldesi üç aşamada gerçekleşmektedir. Birinci aşamada yakıtın yanması sonucunda ısı enerjisi elde edilmektedir. İkinci aşamada üretilen ısı mekanik enerjiye dönüştürülmektedir. Son aşamada ise mekanik enerji elektrik enerjisine dönüştürülmektedir. Tüm bu dönüşüm kademeleri enerji kaybına neden olmaktadır. Özellikle ikinci aşamanın verimi oldukça düşüktür, en gelişmiş modern sistemlerde dahi % 40’lık bir verim söz konusu olabilmektedir. Son zamanlarda nano teknolojide olan gelişmelere paralel olarak yeni bir bin yıla girerken yakıt hücresinin dünya çapında değişik ortam araçlarının kullanımında kayda değer bir şekilde artmakta olduğu ve enerji için dünya çapında giderek rağbet görmeye başladığı bu konularda yapılan çalışmalardan görülebilmektedir. Enerji stoklarımızı korumak, çevremizi korumak ve yaşam kalitesini düzeltmek için teknolojiden yeterince yararlanmak gereklidir. Arabalar, evler ve enerji santralleri için yeterli çok yönlü bir teknolojiye ihtiyaç vardır. Çevre kirlenmesini azaltmaya yardım edebilecek yeterince temiz ve uygulanabilir teknolojiler gereklidir. Bu teknolojilerden biriside yakıt pili teknolojisidir. Yakıt pilleri konvansiyonel sistemlerden farklı olarak enerji dönüşüm aşamalarına gerek duymadan yakıttaki kimyasal enerjiyi %80’lere varan yüksek verimle elektrik enerjisine dönüştürebilme özelliğine sahiptirler. Bu dönüşüm sırasında çevre kirliliğine neden olmaz ya da çok az miktarda kirletici atmosfere salıverirler. Yakıt olarak hidrojenin kullanıldığı durumlarda atık yalnızca su iken yakıt olarak fosil yakıt kullanılması durumda dahi açığa çıkan çevreye zararlı gazlar geleneksel yöntemlere oranla oldukça azdır. Yakıt pilleri başta partikül madde olmak üzere kükürt dioksiti ve azot dioksiti sıfıra indirirken, CO2 emisyonunu da oldukça azaltırlar. Yakıt pillerinin bir diğer önemli özelliği ise mekanik aksam içermemeleri sebebiyle oldukça gürültüsüz çalışmaları ve gürültü kirliliğine neden olmamalarıdır. Mekanik aksam içermemeleri aşınma ve yıpranma gibi sorunları ortadan kaldırmaktadır ve bu aşınmalardan ortaya çıkan partikül maddeler yok sayılacak kadar azdır. Oldukça basit bir yapıya sahip dayanıklı sistemlerdir ve kolaylıkla pek çok alanda kullanılabilirler. Teorik olarak yakıt beslendiği sürece, bakım gerektirmeden sürekli elektrik üretebilme kapasitesine sahiptirler. Yakıt hücreleri, konvansiyonel güç üretim sistemlerine göre aşağıdaki üstünlüklere sahiptir. • • • • • • Çevresel kirlilik oranı düşüktür. Enerji üretim verimi oldukça yüksektir. Farklı yakıtlarla çalışabilir. (Doğal gaz, LPG, Borhidrür, Metanol, Etanol) Egzoz ısısı (atık ısı-waste heat) yeniden kazanılabilir. Modüler yapıdadır. Montaj süresi kısadır. • • • • • Çok yüksek miktarda soğutma suyu ( deniz suyu gibi ) gerektirmez. Güvenilir bir sistemdir. İşletim özellikleri uygulamada kolaylıklar sağlamaktadır. Geleceğe yönelik olarak gelişme potansiyeli oldukça yüksektir. Katı atık ve gürültü problemi yoktur. Yakıt Pili Çeşitleri Yakıt pilleri çalışma sıcaklık aralığına göre; düşük ve yüksek sıcaklık yakıt pilleri olarak sınıflandırılabilirler. Fakat günümüzde daha çok bu sınıflandırma yerine yakıt pilleri elektrolit kısmını oluşturan malzeme cinsine göre farklı tiplere ayrılır. Bu çeşitlilik temel çalışma prensibini etkilemez, ancak performansları çalışma koşulları ve uygulama alanlarının farklılaşmasına yol açar. Tablo 1’de yakıt pili çeşitleri ve özellikleri görülmektedir. Uygulamada en sık karşılaşılan yakıt pili çeşitleri şunlardır: • • • • • • Alkalin Yakıt Pili Proton Dönüşüm Zarlı (PEM) Yakıt Pili Fosforik Asit Yakıt Pili Erimiş Karbonat Yakıt Pili Katı Oksit Yakıt Pili Direkt Metanol Yakıt Pili Tablo 1. Yakıt pili çeşitleri ve özellikleri Yakıt Pili Elektrolit Çalışma Sıcaklığı Potasyum Oda sıcaklığıHidroksit Alkali 250 °C çözeltisi Proton iletken Oda sıcaklığı– elektrolit PEM 80 °C membran Polimer iletken Oda sıcaklığıDirekt Metanol membran 130 °C Elektriksel Verim Yakıt/Oksitleyici % 60–70 H2/O2 % 40 60 % H2/O2, hava % 20–30 CH3OH/O2, hava Fosforik Asit Sıvı fosforik asit 160–220 °C % 55 Erimiş Karbonat Alkali karbonatlar 620–660 °C % 65 Katı Oksit Erimiş alkali metal karışımı 800–1000 °C % 60–65 Doğalgaz, biyogaz, H2/O2, hava Doğalgaz, biyogaz, kömür gazı, H2/O2, hava Doğalgaz, biyogaz, kömür gazı, H2/O2, hava 1. Alkali Yakıt Pili Geliştirilen ilk yakıt pili tipi olup, NASA uzay programlarında geniş kullanım olanağı bulmuştur. Bu yakıt pillerinin geliştirilmesi sırasında esas sıçrayış Francis T. Bacon’ın çalışmasıyla gerçekleştirilmiştir. Bacon, elektrolit olarak değişik konsantrasyonlarda KOH, anot olarak çift gözenekli sinterlenmiş nikel metali ve katot olarak lityumlanmış nikel oksit kullanmıştır. Elektrolit olarak %30’luk KOH kullanılan Bacon’a ait bir hücrede 200°C sıcaklık ve 45 atm basınçta 800 mA/cm2’de 0.78 V hücre voltajı elde edilmiştir. Anot ve katot için malzemenin seçimi genel olarak katalizörün seçimine bağlıdır. AFC, değerli metalleri (Pt) veya normal metal katalizörleri (Ni veya Ag) kullanabilir. Bu durumların her birinde iyi elektrik iletkenliği, uygun porozite, yeterli mekanik, kimyasal ve elektrokimyasal kararlılığın sağlanması şarttır. Alkali yakıt pillerinde elektrolit olarak potasyum hidroksit kullanılır. Kullanılan potasyum hidroksitin derişimine bağlı olarak çalışma sıcaklığı 120 °C’den az ya da 250 °C’nin üzerinde olabilmektedir. AYP’de yüksek sıcaklık uygulamalarında (250°C) ağırlıkça % 85 KOH, düşük sıcaklık uygulamalarında ise (<120°C) ağırlıkça %35-50 KOH kullanılmaktadır. Fakat çoğunlukla kullanılan alkalin yakıt pilleri düşük çalışma sıcaklığında (23°C - 70°C) çalışacak tarzda dizayn edilmektedir. Bu sıcaklıklardaki verimleri ise % 60’lara kadar çıkmaktadır. Üretim ve kullanımlarında bazı sıkıntılar bulunmaktadır. Anot olarak kullanılan Ni ve katot olarak kullanılan Ag katalizörler ile güç üretimi düşüktür. KOH elektrolit sirkülasyonu ve CO2 zehirlenmesine aşırı duyarlı olmaları nedeniyle mobil uygulamalarda pratik değildirler. Alkalin yakıt pili oksitleyici yada yakıtta yer alan karbondioksite karşı oldukça duyarlıdır. Çünkü karbondioksit, elektrolitte yer alan potasyum hidroksit ile tepkimeye girebilmekte ve elektroliti tükettiği gibi, elektrotları da olumsuz yönde etkilemektedir. Alkalin yakıt pilinin çalışması ise genel olarak farklılık göstermez. Yakıt olarak gönderilen hidrojen molekülleri anotta elektron vererek, hidrojen iyonlarına dönüşür. Bu iyonlar potasyum hidroksit elektrolitten yoluna devam ederken, elektronlar ise bir dış devre üzerinden katota ulaşır. Burada hidrojen iyonları, katota gönderilen oksijen ve dış devreden gelen elektronlar reaksiyona girerek devre tamamlanır. Reaksiyon sonunda su açığa çıkar. Alkali yakıt pilinin şematik gösterimi Şekil 6 de verilmektedir. Alkali yakıt pilleri anot ve katot kısmında gerçekleşen reaksiyonlar: Anot Reaksiyonu: H2 + 2(OH)- → 2 H2O + 2e- Katot Reaksiyonu: ½ O2 + H2O + 2e- 2(OH)- Toplam Reaksiyon: H2 + ½ O2 → H2O + Elektrik enerjisi + Isı Şekil 6. Bir Alkali yakıt pilinin genel işletim prensipleri Hidroksil iyonları elektrolitte iletkenliği sağlamaktadır. Anotta önemli oranda su oluşmaktadır. Katoda doğru olan su hareketi elektroliti seyreltebilmekte ve bu durum hücre iletkenliğini azaltarak performansının düşmesine yol açmaktadır. Bu problemi çözmek için iki farklı yöntem mevcuttur. Söz konusu yöntemlerden biri, suyun buharlaştırılarak ısının uzaklaştırılmasını sağlayacak şekilde elektrolitin sirküle edilmesidir. Diğer yöntem ise su buharının taşınabilmesini sağlayacak biçimde hidrojen gazının sirküle edilmesidir. Bu ikinci durumda ısı, soğutucunun sirküle edilmesi suretiyle uzaklaştırılmaktadır. Bu prosesler oldukça pahalı olduğundan Alkali yakıt pili teknolojisi üzerinde sürekli bir gelişme sağlanamamıştır. Fakat alkali yakıt pilleri yine de üretilebilecek en ucuz yakıt hücreleridir. Elektrotlar için gerekli katalizörler, diğer tip yakıt hücreleri için gerekli olanlardan nispeten daha ucuzdur. Alkali yakıt pilleri ile ilgili ticari beklentiler son zamanlarda geliştirilen bi-polar tabaka versiyonu teknoloji ile büyümektedir, bu teknoloji önceki mono (tek)-tabaka versiyonlardan çok daha üstün bir performansa sahiptir. Bir diğer ilginç gelişme ise, sıvı yerine anyon-değişim membranlarının kullanıldığı katı-faz alkali yakıt hücreleridir. Alkali yakıt pilinde katalizör olarak nikel, gümüş, metal oksitler ve soy metaller kullanılabilmektedir. Çoğu alkali yakıt pilinin düşük çalışma sıcaklığında olması nedeni ile kojeneratif dönüşüm imkânını sınırlandırmaktadır. 2. Proton Değişim Membranı (PEM) Yakıt Pili Proton değişim membranı yakıt pili (PEM), tasarım ve işletim bakımından en zarif yakıt hücresidir. İlk PEM General Electric tarafından 1960’larda NASA için geliştirilmiştir. Burada bir katı polimer elektrolit membran iki platin katalizörlü gözenekli elektrolit arasına yerleştirilmektedir. Polimer elektrolit membran (zar) yakıt pili olarak da adlandırılır. Diğer yakıt pillerine göre daha fazla güç yoğunluğu, düşük hacim ve düşük ağırlığa sahiptir. Yakıt pilinde elektrolit olarak ince polimer bir zar kullanılır. Mikron düzeyinde kalınlığa sahip olan membran, proton geçirgen bir yapıdadır. Çalışma sıcaklıkları 100°C’in altında olup genellikle 60-80°C aralığındadır. Katalizör olarak soy metallerin kullanılması (genellikle platinyum) maliyetini arttırmaktadır. Platinyum katalizörlerin karbonmonoksite karşı aşırı duyarlı oluşları, yakıtta yer alabilecek karbondioksitin ayrıştırılmasını gerektirir. Bu ise ilave proses ve maliyete neden olur. Bu probleme karşı, yapılan bazı tasarımlarda karbonmonoksit duyarlılığı çok az olan plantinyum/ruthenyum katalizörler kullanılmaktadır. Şekil 7’de PEM yakıt pili ve aşağıda verilen reaksiyon denklemlerinde, PEM yakıt pilinde gerçekleşen reaksiyonlar görülmektedir. Anot Reaksiyonu: 2H2 → 4H+ + 4e− Katot Reaksiyonu: 4H+ + 4e− + ½ O2 → 2H2O Toplam Reaksiyon: 2H2 + O2 → 2H2O + Elektrik enerjisi Çalışmanın gerçekleşmesi açısından adı geçen membran hidrojen iyonlarını (protonlar) iletmelidir, zira elektronları iletmesi durumunda yakıt hücresinde “kısa devre” durumu doğmaktadır. Membran ayrıca herhangi bir gazın hücrenin diğer tarafına geçmesine izin vermemelidir. İlave olarak söz konusu membran katottaki indirgeyici ortamın yanı sıra anodun sert yükseltgeyici ortamına da dirençli olmalıdır. Şekil 7. Proton değişim membranı yakıt pilinin genel çalışma prensipleri Anoda gönderilen hidrojenden elektronların ayrılması ile oluşan protonlar, proton geçirgen zardan; elektronlar ise ayrı bir devreden katoda ulaşır. Katoda gönderilen hava/oksijen, gelen proton ve elektronların reaksiyonu ile devre tamamlanır ve su açığa çıkar. Katı membrandan oluşan bu yakıt pillerinde membranın iyon geçirimliliği ve dolayısı ile performans; membranın nemliliği ile önemli ölçüde ilişkilidir. Bu nedenle membranın belirli bir nem seviyesinde tutulması gerekir. Bu amaçla genellikle sisteme hidrojen ve hava, bir nem ünitesinden geçirilerek gönderilir. Bu nem seviyesinin denetlenmesi ve sağlanması için sistemde genellikle su yönetimini sağlayan üniteye yer verilir. Aksi halde yani bu nemin sağlanamaması durumunda performansta önemli düşüşler olacağı gibi, membran zarar görebilmektedir. Bu nedenle yakıt pili nemlendirmenin performansa olan etkileri ile ilgili pek çok çalışma yapılmaktadır. Bu tip yakıt pili özellikle taşıt uygulamaları ve bazı durağan (stationary) uygulamalarda tercih edilmektedir. Hızlı cevap süresi, yüksek güç yoğunluğu ve kompakt yapıları; taşıt uygulamalarındaki temel tercih nedenleridir. Verimleri %50’ler seviyesindedir. Proton değişim membranı yakıt pili üç temel yapıdan oluşmaktadır ve bu yapılar sistemin çalıştırılmasında önemli görev yapmaktadırlar. Bu yapılar polimer yapıdan oluşan elektrolit, elektrolitin her iki tarafında yer alan elektrotlar (anot ve katot) ve bipolar-plakadan oluşmaktadır. Bir proton değişim membranı yakıt pilinin elemanlarının ve çalışma sisteminin detaylı görünü Şekil 8 de verilmektedir. Bu üç temel yapı detaylı olarak aşağıda açıklanmaktadır. Elektrolit (Membran) Membranın temel fonksiyonu anot ve katot arasındaki iyonik etkileşimi gerçekleştirmektir. Aynı zamanda reaksiyona giren iki gazı (hidrojen ve hava) birbirinden ayırır. PEM yakıt pilinde kullanılan membranın en önemli niteliği kuruması ile proton ya da hidrojen iyonu iletiminin azalmasıdır. Su miktarının fazlalığı ise elektrotlarda su taşması ve geri basınç oluşumuna neden olmaktadır. Bunlar ise yakıt pili performansını önemli ölçüde etkiler. Bu yüzden membranda iyi bir su yönetiminin yapılması gereklidir. Yakıt pilinde meydana gelen elektrokimyasal reaksiyon sonucu açığa çıkan ısının da sistemden uzaklaştırılması önemlidir. Yani yakıt pili sıcaklığının sabit tutulma gerekliliği özellikle orta ve büyük ölçekli uygulamalarda uygun bir soğutma sistemine ihtiyacı ortaya çıkarır. Şekil 8. PEM yakıt pili elemanlarının detaylı gösterimi ve çalışma prensipleri PEM yakıt pilinde çoğunlukla perfluorokarbon esaslı iyon değiştirici membranlar kullanılmaktadır. Günümüzde kullanılan standart elektrolit malzemesi Nafion'dur. 1960’lı yıllarda Dupont firması tarafından geliştirilmiştir ve teflon kökenli bir malzemedir. Çeşitli serileri üretilmiş olup günümüzde Nafion 115 ve Nafion 117 kullanımı yaygındır. Nafion membranların ısıl ve kimyasal kararlılığa sahiptir. En çok kullanılan membran olan Nafion®, protonların aktarılması için membranın sıvı su nemlendirmesi prensibine dayanmaktadır. Suyun olmadığı durumlarda membran kuruyacağı için sistemin işletilmesi 80-90°C’nin üzerindeki sıcaklıklarda uygun olmamaktadır. Diğer son zamanlarda ortaya çıkan membran tipleri Polibenzimidazol (PBI) veya fosforik asit temelli olup herhangi bir su yönetimine ihtiyaç duymaksızın 220°C’ye kadar çıkabilmektedirler. Bu membranların belli başlı avantajlarının arasında yüksek sıcaklığın daha iyi verim, güç yoğunluğu, kolay soğuma (büyük sıcaklık farklarından dolayı) sağlaması, karbonmonoksit zehirlenmesine karşı düşük duyarlılık ve daha iyi kontrol (membranda su yönetimi işleminin yokluğundan dolayı) bulunmaktadır. Fakat bu son tip membranlar çok fazla yaygın değildir ve araştırma laboratuarları hala Nafion kullanmaktadır. Günümüzde membran performansları ve kararlılıkları memnuniyet verici seviyelerdedir. Maliyetlerinin yüksek oluşu önemli bir dezavantajlarıdır. Elektrotlar Elektrotlar gaz difüzyon elemanlarıdır ve hidrojenin, proton ve elektronlarına ayrılmasında rol oynarlar. Elektrotlara preslenmiş olarak 5-50 µm kalınlığında ve genellikle platinyum malzemesinden hazırlanan katalizörler her iki elektrotta da en çok kullanılan katalizördür. Platinyumun pahalı oluşu, platinyum kullanım yoğunluğunu azaltmaya dönük çalışmaları arttırmaktadır. PEM yakıt pilinde kullanılan katalizör; CO, CO2 ve hidrokarbondan olumsuz etkilenmektedir. Bu da yakıt piline gönderilen gazların saflığının arttırılması gerekliliğini, bu ise saflaştırma maliyetlerini ortaya çıkarır. Bipolar Plaka Birçok PEM yakıt pili uygulamasında akım toplama, dağıtımı ve ısıl yönetim amacı ile karbon/grafit plakalar kullanılmaktadır. Kalınlığı ~350 µm seviyesindedir. Çoğu zaman yakıt pili soğutması için gerekli olan soğutucu yüzeyler bipolar plaka ile entegre durumdadır. Soğutucu akışkan olarak kullanılan hava ya da su bu yüzeylerden geçirilerek soğutma gerçekleştirilir. Yakıt pili verimliliği için bipolar plakaların temas direncinin minimum, elektriksel iletkenliğinin ise maksimum olması istenir. PEM yakıt hücreleri, kompakt yapılarından dolayı taşıtlar ve cep telefonlarına kadar diğer mobil uygulamalar için başlıca aday olarak görülmektedir. Fakat su yönetimi performans açısından hayati önem arz etmektedir: çok fazla su membranı ıslatırken çok azı kurutmaktadır, her iki durumda da güç çıkışı düşmektedir. PEM sistemlerinde su yönetimi çok zordur. Su yönetimi için elektro-ozmotik pompaların entegrasyonu gibi değişik çözümler mevcuttur. Ayrıca membran üzerindeki platin katalizör CO ile kolayca zehirlenmektedir ve membran, metalik bipolar levhaların korozyonundan kaynaklanan metal iyonları gibi maddelere karşı hassastır. Metanol kullanan PEM sistemlerinde metanolün hidrojen elde etmek üzere reaksiyona sokulması oldukça komplike bir prosestir ve reaksiyon ürünlerinin CO gazından arındırılmasını gerektirmektedir. Bir miktar CO kaçınılmaz olarak membrana ulaştığından bir platin-rutenyum katalizörünün kullanılması gereklidir. Karbonmonoksit düzeyi 10 ppm’yi geçmemelidir. Ayrıca bu tür bir işleme reaktörünün başlatma zamanı yaklaşık yarım saattir. Alternatif olarak metanol ve diğer biyo-yakıtlar PEM yakıt hücresine işlenmeden direkt olarak beslenerek direkt metanol yakıt hücreleri (DMFC) yapılabilmektedir. Bu tür tertibatların işletimi oldukça sınırlıdır. PEM’lerin verimi %40-50 aralığında değişmektedir. 3. Fosforik Asit Yakıt Pili Elektrolit olarak sıvı fosforik asit çözeltisi, katalizör olarak ise genellikle platinyum kullanılır. Çoğunlukla stasyoner güç üretiminde kullanılırlar. Bazı taşıt uygulamalarında da kullanımı söz konusudur. PAFC’ler fosil yakıtlardaki safsızlıklara ve CO2 gibi atık gazlara karşı oldukça toleranslıdır. Tipik çalışma sıcaklığı 150°C-220°C aralığındadır. Normal çalışma durumunda verimleri sadece elektrik üretimi söz konusu olduğunda %37–42 aralığındaki bu yakıt pilinde, kojeneratif uygulamalar ile verim elektrik ve ısı birlikte üretildiğinde % 85’lere kadar çıkabilmektedir. Fosforik asit yakıt pilinde güç yoğunluğu diğer yakıt pili tiplerine göre daha azdır. Bu ise daha ağır olmalarına ve daha fazla hacim kaplamalarına yol açar. Fosforik asit yakıt pili karbondioksitten etkilenmediği için, kullanılan yakıtta karbondioksitin bulunması sorun çıkarmaz. Çalışmasında anoda gönderilen hidrojen moleküllerinden elektronların ayrılması ile oluşan hidrojen iyonları fosforik asit elektrolitten, elektronlar ise dış devreden katoda ulaşır. Burada oksijen ile bir araya gelen hidrojen iyonları ve elektronların reaksiyonu ile devre tamamlanır. Fosforik asit yakıt hücrelerinin çalışma prensibi Şekil 9 de gösterilmektedir. Şekil 9. Fosforik asit yakıt pili genel işletim prensipleri Fosforik asit yakıt hücreleri (PAFC) elektrolit olarak fosforik asit kullanmakta, 180 ~ 210°C aralığında çalışmakta ve hem elektrik hem de ısı üretmektedir. Hali hazırda ticari kullanım bakımından (AFC’den sonra) ikinci sıradadırlar. Bu yakıt pili için yarı hücre reaksiyonları aşağıdaki gibidir: Anot Reaksiyonu: 2H2 → 4H+ + 4e− Katot Reaksiyonu: 4H+ + 4e− + ½ O2 → 2H2O Toplam Reaksiyon: 2H2 + O2 → 2H2O + Enerji Fosforik asit yakıt hücrelerinde (PAFC) asit elektrolit Teflon bağlı silikon karbit matrislerinde tutulmakta ve porlu karbon elektrotlar platin katalizör içermektedir. Kimyasal reaksiyonlar şekilde gösterildiği üzere sağa doğru gerçekleşmektedir. PAFC’ler, modern yakıt hücrelerinin ilk nesli olarak kabul edilmektedir. Bu tip hücreler tipik olarak sabit güç üretimi için kullanılmakla birlikte şehir otobüsleri gibi büyük araçlara güç üretmek için uygulamaları da mevcuttur. PEM yakıt hücreleri gibi PAFC’ler de maliyeti arttıran pahalı platin katalizörüne ihtiyaç duymaktadır. Tipik bir fosforik asit yakıt hücresi kilowatt başına 4,000 ila 4,500 dolar maliyete sahiptir. 4. Erimiş Karbonat Yakıt Pili (EKYP) Bu tip yakıt pilinin elektroliti; lityum, sodyum ve potasyum karbonatların kombinasyonundan oluşur. Daha çok yakıt olarak doğal gaz kullanılır ve özellikle enerji santrali, endüstriyel ve askeri uygulamalarda tercih edilir. Çalışma sıcaklığı 600°C-700°C aralığındadır ki bu seviyede elektrolitin iyonik iletkenliği oldukça yüksektir. Yüksek çalışma sıcaklıkları nedeni ile katalist olarak soy metallere ihtiyaç duyulmaz. Verimleri normal koşullarda % 60’lara ulaşmaktadır. Kojeneratif uygulamalar halinde ise bu % 80’lere çıkabilmektedir. Erimiş karbonat yakıt pilinin önemli bir özelliği ise diğer yakıt pillerinde gerek duyulan harici yakıt işlemcisine ihtiyaç duyulmamasıdır. Çünkü yüksek sıcaklıkta bu işlem yakıt pili içinde yapılmakta, yakıttan hidrojen ayrışmaktadır. Bu ise prosesleri ve maliyetleri olumlu yönde etkilemektedir. Erimiş karbonat yakıt pili karbonmonoksit ve karbondioksite duyarlı değildir ve yakıtta bu gazların bulunmasından etkilenmez. Bu tür kirliliğe karşı oldukça dirençlidir. En önemli dezavantajları ise dayanıksızlıklarıdır. Yüksek sıcaklıkta çalışıyor olması korozif elektrolitleri nedeni ile performans düşüşü, korozyon oluşumu yakıt pili ömrünü azaltır. Hidrojen ve karbonmonoksidin elektrokimyasal olarak yanmasından dolayı MCFC performansını sağlamak üzere işletim koşullarını karşılayan tek elektrolit malzemesi karbonatlardır. Tekniğin bilinen durumunda mevcut malzemeler gözenekli Ni anot, gözenekli Li-katkılı NiO katot, ve erimiş karbonat (%62 Li2CO3 %38 K2CO3) elektrolittir ve bu elektrolit ve gözenekli alüminyum oksit (γ-LiAlO2/α-Al2O3) yapısının içerisine tutturulmuştur. Bu tabaka yarı-geçirgen yapıdadır ve sadece karbonat iyonlarının (CO32-) bu tabakadan geçmesine izin verir. İyonik olmayan çözünmüş gazlar gibi diğer maddeler bu tabakadan geçemezler. Erimiş karbonat yakıt pillerinde elektrolitteki karbonat konsantrasyonunu sabit tutmak için katotta bir miktar CO2 gereklidir. Bundan dolayı CO2 anotta üretilir ve katotta tüketilir. EKYP için kullanılan yakıt H2 ve CO2’dur. Yükseltgeyici ise O2 ve CO2’nin bir karışımıdır. Anot Reaksiyonu: Katot Reaksiyonu: Toplam pil reaksiyonu: H2 + CO32− → H2O + CO2 + 2e− CO + CO32− → 2CO2 + 2e− ½ O2 + CO2 + 2e− → CO32− H2 + ½ O2 → H2O + DC + Isı CO + ½ O → CO2 + DC + Isı Şekil 10, EKYP’de meydana gelen reaksiyonları değişik bölümler üzerinde akış yönleri ile beraber şematik olarak göstermektedir. Yukarıdaki denklemlerden de görüldüğü gibi EKYP’leri iki tür yakıt ile işletilebilmektedir. Bu yakıtlar hidrojen ve CO gazlarından oluşmaktadır. Hidrojeni yakıt olarak kullanan EKYP anot ve katot reaksiyonlarını içeren genel yapı Şekil 11 de, karbon monoksiti yakıt olarak kullanan EKYP anot ve katot reaksiyonlarını içeren genel yapı ise Şekil 12’de verilmektedir. Şekil 10. Erimiş karbonat yakıt pili (EKYP) genel işletim prensipleri Şekil 11. Hidrojeni yakıtlı EKYP genel yapısı Şekil 12. Karbon monoksit yakıtlı EKYP genel yapısı Elektrolit tabakasının iki kısmında bulunan her elektrotta bir gaz kanalı oluşturulmuştur. Elektrottaki reaksiyondan önce temel gazlar reformlama prosesiyle hidrojen gazına dönüştürülür ve H2 yakıt olarak sisteme beslenmektedir. Bu prosesi içeren erimiş karbonat yakıt pilinin şematik görünümü Şekil 13 de gösterilmektedir. Şekil 13. Erimiş karbonat yakıt pili ve hidrojen gazı üretimi için temel gaz reformlama sistemi Elektrolit tabakasının her iki kısmında gözenekli katalizör tabakalar ve elektrotlar bulunmaktadır. Bu elektrotlar elektron iletme özelliğine ve reaksiyonların oluşması için katalitik promotör özelliğine sahiptirler. Erimiş karbonat yakıt pilinin anot ve katot elektrotlarında malzeme olarak nikel ve nikel oksit maddeleri kullanılmaktadır. Bir kısım erimiş karbonat elektrotların gözeneklerine yüklenmiştir ve kapilari (kılcal) kuvvetleri ile gözeneklerde tutulmaktadır. Elektrotların gözeneklerinin kalan kısmı ise gaz ile doldurulmuştur. Elektrokimyasal reaksiyonlar temelde üç-fazlı sınırda gaz, sıvı ve katalizör arasında gerçekleşmektedir. Bu nedenle gözeneklerin yapısında yüzeyler arası alan gerekmektedir. EKYP’lerin fosforik asit yakıt hücrelerine (PAFC) kıyasla önemli maliyet avantajı sağlamasının bir diğer nedeni de bu hücrelerin sahip olduğu yüksek verimliliktir. Zira erimiş karbonat yakıt hücreleri yüzde 60’a varan verim değerlerine ulaşabilmektedir. Fazla ısı tutularak kullanılabildiğinde bu oran yüzde 85’e kadar çıkabilmektedir. Alkali, fosforik asit ve elektrolit membran yakıt hücrelerinin aksine MCFC’ler yakıtların hidrojene dönüştürülmesi için bir dış iyileştiriciye ihtiyaç duymamaktadır. MCFC’lerin yüksek işletim sıcaklığından dolayı bu yakıtlar iç iyileştirme olarak anılan bir prosesle hücrenin kendisi tarafından hidrojene dönüştürülmekte ve bu durum da maliyetlerin düşmesine neden olmaktadır. Erimiş karbonat yakıt pilleri karbon monoksit ve karbon dioksit zehirlenmesine karşı dayanıklıdır ve hatta karbon oksitleri yakıt olarak kullanabilmektedir. Bu yüzden söz konusu hücreler kömürden üretilen gaz yakıtlar için çekici hal almıştır. Bu yakıt hücreleri diğer yakıt hücresi tiplerine kıyasla safsızlıklara karşı daha dirençli olduklarından, kömürün dönüştürülmesi ile ortaya çıkan kükürt gibi safsızlıklara dirençli hale getirildikleri varsayıldığında kömür gibi kirli fosil yakıtların hidrojen oluşturmak üzere iç iyileştirilmesinin yapılabileceğine inanılmaktadır. EKYP teknolojisinin başlıca dezavantajı dayanıklılıkla ilgili problemlerdir. Bu hücrelerin işletildikleri yüksek sıcaklıklar ve kullanılan korozyon özelliğine sahip elektrolit, bileşenlerin bozulmasını ve korozyonunu hızlandırmakta ve hücre ömrünü kısaltmaktadır. 5. Katı Oksit Yakıt Pili (KOYP) Elektrolit olarak ZrO2 kullanılmakla beraber buna molar % 8-9 kadar Y2O3 (yitrinyum oksit) şeklinde tanımlanabilecek metal oksit ilavesi ile yalıtkan olan zirkonyum ya iletkenlik kazandırılmaktadır. Elektrolitteki iyonik iletim, oksijen iyonları ile sağlanır. Genellikle endüstriyel uygulamalarda kullanılmaktadır ve verimleri % 50–60 civarındadır. Kojeneratif uygulamalar halinde ise verimde % 80–85 seviyelerine ulaşılmaktadır. Çalışma sıcaklıkları 900-1000 °C seviyesindedir ve bu yüksek sıcaklık seviyesinde çalışıyor olması soy metal katalizörü kullanım zorunluluğunu ortadan kaldırarak maliyetleri azaltır. Anot Reaksiyonu: H + O2− → H O + 2e 2 2 (CO + O2− → CO + 2e−) 2 (CH + 4O2− → 2H O + CO + 8e− ) 4 2 2 Katot Reaksiyonu: ½ O2 + 2e− → O2− Pildeki Tüm Reaksiyonlar: H + ½ O → H O + DC + Isı 2 2 2 (CO + ½ O → CO + DC + Isı) 2 2 (CH + 2O → 2H O + CO + DC + Isı) 4 2 2 2 Fark edileceği üzere SOFC’ler değişik yakıtlar ile de (örn. H2, CO, CH4) çalışabilmektedir. Hali hazırda bilinen SOFC’ler elektrolit ile oksijen iyonu (O2−) ve proton (H+) iletenler olmak üzere ikiye ayrılmaktadır. Bir katı oksit yakıt pilinin genel işletim prensiplerini Şekil 14’de verilmektedir. Şekil 14. Katı oksit yakıt pili genel işletim prensipleri Yukarıdaki denklemlerden de görüldüğü gibi KOYP’leri iki tür yakıt ile işletilebilmektedir. Bu yakıtlar hidrojen ve CO gazlarından oluşmaktadır. Hidrojeni yakıt olarak kullanan KOYP anot ve katot reaksiyonlarını içeren genel yapı Şekil 15 de, karbon monoksiti yakıt olarak kullanan KOYP anot ve katot reaksiyonlarını içeren genel yapı ise Şekil 16’de verilmektedir. Şekil 15. Hidrojeni yakıtlı KOYP genel yapısı Şekil 16. Karbon monoksit yakıtlı EKYP genel yapısı 6. Doğrudan Metanol Yakıt Pili Çalışma prensibi olarak PEM yakıt piline benzerlik gösteren direkt metanol yakıt pilinde, sıvı yakıt kullanılmakta olup, yakıt işleme ünitesi yoktur. Elektrolit olarak katı polimer membranın kullanıldığı bu tip yakıt pilinde, temel olarak tüm organik moleküller enerji dönüşümünde kullanılabilir. Bu noktada metanol tercih nedeni olabilecek özelliklere sahiptir. Bu özelliklerden birisi ise (hidrojen ile karşılaştırıldığında düşük olsa da) yüksek dönüşüm hızıdır. PEM yakıt pilinden temel farklılığı, dönüştürücü gerektirmeksizin metanolün yakıt olarak kullanılabilmesidir. Genellikle sisteme metanol su karışımı gönderilir ve böylelikle hem membranın nemlendirilmesi hem de soğutulması aynı anda gerçekleştirilir. Çalışma sıcaklığı PEM yakıt piline göre biraz yüksektir, 80–130 °C aralığındadır. Verimleri ise % 40 seviyesindedir. PEM yakıt piline göre daha fazla katalizör kullanımı gerekliliği vardır. Metanol (CH3OH) herhangi bir işleme tabi tutulmaksızın doğrudan beslenmektedir. Metanol doğrudan beslendiği için komplike katalitik işlemlere ihtiyaç duyulmamakta ve hidrojene kıyasla metanolün depolanması daha kolay olmaktadır. Metanolün birim hacim başına verdiği enerji yüksek derecede sıkıştırılmış hidrojenin bile birkaç katı olabilmektedir. Fakat doğrudan metanol yakıt hücrelerinin verimi, metanolün membrandan fazla miktarda geçmesi ve dinamik davranışının ağır olmasından dolayı düşüktür. Diğer problemler arasında anottan salınan karbondioksit de bulunmaktadır. Teknolojinin mevcut halinde DMFC’ler üretebildikleri enerji bakımından sınırlı olmakla beraber yine de küçük bir hacimde fazla enerji tutabilmektedir. Bu durum söz konusu yakıt hücrelerinin az miktarda enerjiyi uzun süre sağlayabilmeleri anlamına gelmektedir ve bu yüzden taşıtlar için pek uygun görülmeyip genellikle cep telefonları, dijital kameralar veya dizüstü bilgisayarlar gibi tüketim malları için uygun oldukları düşünülmektedir. Metanol toksik ve yanıcı özelliğinden dolayı dezavantaja sahiptir. DMFC’nin temel prensibi metanolün karbondioksit oluşturmak üzere bir katalizör tabakası üzerinde yükseltgenmesidir. Su anotta tüketilip katotta üretilmektedir. Pozitif iyonlar (H+) proton değişim membranı (genellikle Nafion) üzerinden katoda taşınmaktadır ve burada su üretmek üzere oksijenle reaksiyona girmektedir. Bir doğrudan metanol yakıt hücresinde yarı reaksiyonlar aşağıdaki gibidir: Anot Reaksiyonu: CH OH + H O → CO + 6H− + 6e− 3 2 2 Katot Reaksiyonu : (3/2) O + 6H− + 6e− → 3H O 2 2 Toplam Net Reaksiyon: CH3OH + 3/2 O2 → CO2 + 2H2O Reaksiyonda su anotta tüketildiği için saf metanol geri difüzyon (ozmoz) gibi pasif taşıma veya pompalama gibi aktif taşıma vasıtasıyla suyun beslenmesi olmaksızın kullanılamamaktadır. Hali hazırda her iki yarı reaksiyon için de katalizör olarak platin kullanılmaktadır. Metanol geçişi probleminin de nedeni budur, zira katot bölümünde mevcut olabilecek metanol okside olacaktır. Oksijenin indirgenmesi için başka herhangi bir katalizör bulunması durumunda metanol geçişi muhtemelen önemli derecede azalacaktır. Ayrıca platin oldukça pahalı olması nedeniyle DMFC’nin ticari üretimini kısıtlamaktadır. doğrudan metanol yakıt pilinin genel işletim prensiplerini Şekil 17’de verilmektedir. Doğrudan Metanol yakıt pili anot ve katot reaksiyonlarını içeren bir hücre yapısı genel çalışma durumu Şekil 18 de gösterilmiştir. Bir yakıt hücre yapısında anot, katot ve polimer membran bulunurken, Metanol-su karışımı anot tarafından gerekli oksijen ise katot tarfından sisteme sağlanmaktadır. Sistemde bir kısım metanolün polimer membranı geçerek katot tarafına ulaştığı ve burada oksitlendiği görülmektedir. Bu olay sistemde güç kaybına yol açmaktadır. Bir tek Metanol yakıt hücresinin içerdiği difüzyon tabakası ve katalizör tabakası boyutları ve konumları ile hücrede ortaya çıkan reaksiyonlar ise Şekil 19 de verilmektedir. Şekil incelendiğinde difüzyon tabakasının kalınlığının 100–300 µm ve katalizör tabakasının ise 5– 25 µm arasında değiştiği görülmektedir. Şekil 17. Doğrudan Metanol yakıt pili genel işletim prensipleri Şekil 18. Doğrudan metanol tek hücre yapısının detaylı prosesleri ve elemanları Şekil 19. Doğrudan Metanol yakıt hücresi boyutları ve pilde oluşan anot-katot reaksiyonlar Diğer yakıt pilleri ise aşağıda verilmektedir. 7. Doğrudan Etanol Yakıt Pili 8. Doğrudan Borhidrür Yakıt Pili 9. Doğrudan Formik Asit Yakıt Pili 10. Metal Hidrür Yakıt Pilleri 11. Elektro-galvanik Yakıt Pilleri 12. Mikrobiyal Yakıt Pilleri Yakıt Hücrelerinde Kullanılan Membranlar Polimer elektrolit membran yakıt hücreleri, diğer adıyla proton değiştirici membran yakıt hücreleri (PEMYH); çalışma koşulları, uygulanabilirliği, yüksek verimi gibi özellikleri nedeniyle en çok üzerinde durulan yakıt hücresi çeşididir. Proton değişim membran yakıt hücrelerinin en önemli elemanı proton iletim özelliğine sahip polimer membrandır. Polimer elektrolit membran yakıt hücresinde membranın işlevi protonu anot bölgesinden katot bölgesine iletmektir. Hidrojen, elektronunu platin ile asidik membran üzerindeki aktif sitelerin ki genelde sülfon (-SO3H+ ) gruplarıdır, temas ettiği yerlerde verir. Membran bünyesindeki su molekülleri, proton ile zayıf bağlar oluşturarak hidrojen iyonunun anot bölgesinden katot bölgesine ilerlemesini sağlar. Başka bir deyişle, membran üzerindeki aktif siteler sadece hidrojenden elektronun koparılması, membran bünyesindeki su ise, hidrojen iyonunun anottan katoda ilerlemesi ile sorumludur. Polimer elektrolit olarak kullanılan membranlar ile ayırma proseslerinde kullanılan membranlar arasında büyük farklılık vardır. Ayırma proseslerinde ortamdaki gazlar geçirilirken yakıt hücrelerinde kullanılan membranlarda gazların geçişi istenmez. Yakıt hücresinde kullanılan membranların gazları iyonlarına ayırıp o şekilde iletmesi istenir. Böylece elektrik enerjisi elde edilir. Membranlar yakıt hücrelerinde elektrolit olarak bulunmalarının yanı sıra; ayırma işlemleri ve sıvı saflaştırma gibi çok çeşitli amaçlar için kullanılabilmektedirler. İyon değiştiren membranları diğer membranlardan ayıran karakteristik özellik polimer yapılarının içinde proton iletkenliğini sağlayan iyonik grupların bulunmasıdır. Bünyesinde negatif yüklü sabit aktif siteler bulunduran membranlar katyon değiştiren membranlar, pozitif yüklü sabit aktif siteler bulunduran membranlar ise anyon değiştiren membranlar olarak adlandırılır. Bu koşullarda iyon değiştiren membranlarda istenen en önemli özellik, membran bünyesindeki sabit zıt yüklü iyonları geçirmesi, benzer yüklü iyonları geçirmemesidir. Bu, ancak membranın sahip olması istenen yüksek iyon değişim kapasitesi ve düşük direnç özellikleri ile sağlanır. Günümüzde DuPont tarafından üretilen Nafion adlı perflorosülfonik asit kopolimer kullanmak polimer elektrolit membran yakıt hücreleri için en popüler metottur. Nafion’un yakıt hücreleri uygulamalarında iyi kimyasal ve fiziksel özellikleri olmasına rağmen kullanımları sınırlayan üç teknik problem vardır. • • • Yüksek maliyete sahip olması Düşük nem ya da yüksek sıcaklıkta iletkenliğinin düşük olması Hücre verimini azaltan yüksek metanol geçirgenliği Bu sebeplerden dolayı Nafion yerine farklı polimerlerden oluşan membran sentezleri önem kazanmıştır. Yakıt hücrelerinde kullanılan membranlar; organik, inorganik ve kompozit membranlar olmak üzere 3’e ayrılır. Organik membranlar ucuz olması, kolay işlenebilir ve şekil verilebilir olması gibi avantajları arasında sayılır. Bunun yanı sıra, termal ve mekanik dayanımının az olması nedeniyle bu membranlara alternatif olabilecek membranlar geliştirilmiştir. İnorganik membranlarda ise uzun ömürlü olması, yüksek basınç altında mekanik kararlılığının iyi olması, organik çözücülere karşı kimyasal kararlılığının iyi olması, gözenek boyutlarının ve dağılımının iyi kontrolü gibi avantajlarının yanında; maliyetinin yüksek ve yapısının gevrek olması nedeniyle tercih edilmezler. Kompozit membranlar, hem organik hem de inorganik yapıları bünyesinde beraber bulundurduğu için her ikisinin özellikleri taşımakla beraber, sülfonasyon gibi bir takım işlemlerle istenilen özellik kazanılarak daha etkin duruma getirilebilir. Yakıt Hücresi Membranlarda Aranılan Özellikler Membranın yüksek proton iletkenliğine, düşük elektrik direncine sahip olması ve bünyesindeki su miktarının mümkün olduğunca düşük olması istenir. Ayrıca sisteme verilen diğer kimyasallara karşı dayanıklı olmalı ve onlarla kimyasal tepkimeye girmemelidir. Membran uzun süreli ve sürekli çalışmaya, sistemdeki yüksek sıcaklık ve basınç gibi çalışma koşullarına, mekanik dayanıklılığa sahip olmalıdır. Membran sentezinin parasal boyutu göz önünde bulundurulursa; membran için seçilen ve yapıyı oluşturan maddeler ucuz ve kolay sağlanabilir olmalıdır. İletkenlik: İletkenlik, iyon değiştiren membranların kullanımını etkileyen en önemli özelliklerden biridir. İyon değiştiren membranların iletkenliğini etkileyen birkaç faktör vardır. Bunların en önemlileri; iyon boyutu, iyon tipi ve membranın taşıyıcı kısmıdır. En çok iletkenliğe sahip membran elektrolitler, hareketli iyonu hidrojen olan ve taşıyıcısı su olanlardır. Yakıt hücreleri için gözlenen en iyi membran tipi, gerekli güç miktarına çıkabilmek için, hareketli iyonu hidrojen olan ve taşıyıcısı su olan membran elektrolitlerdir. Su Geçirgenliği : Yakıt hücreleri uygulamalarında su geçirgenliği verimi etkileyen önemli parametrelerden biridir. Su, hücrede temas halindeki iyonların sebep olduğu elektro-ozmotik geçişle ve hücrenin anot ve katot bölgelerinde oluşan konsantrasyon farkından dolayı difüzyon ile iletilir. PEM yakıt hücrelerinde su transferinin önemi; göç eden iyonların, suyu membranın bir ucundan diğerine taşımasından kaynaklanmaktadır. Bu durum suyun az olduğu bölgelerde daha yüksek dirence sebep olmaktadır. İyon değiştiren membranların, yakıt hücrelerinde elektrolit olarak kullanılmasında, membranın dehidrasyon özelliğinin membranın fiziksel boyutları ve elektrolit direnci üzerindeki etkisi çok önemlidir. Kimyasal Dayanıklılık : İyon değiştiren membranların değişik kimyasal ortamlardaki dayanıklılıkları hakkında bilgi literatürde çok azdır. Bununla birlikte yakıt hücrelerinde oksitleyicilere karşı dayanıklılıkları çok önemlidir. Membran, yakıt olarak saf hidrojen kullanmayan sistemlerde yan ürün olarak açığa çıkan CO ve CO2 gibi maddelerle aktifliğini kaybetmektedir ve yakıt hücresinde kullanılamaz hale gelmektedir. Mekanik Özellikler: Proton iletkenliğini sağlayan aktif grupların membran bünyesindeki yüksek konsantrasyonu, membranda mekanik zayıflık yaratmaktadır. Bu sebeple yakıt hücreleri uygulamalarında bir avantaj sağlayan yüksek yoğunluktaki aktif grup bulunduran membranların mekanik olarak güçlendirilmeye ihtiyacı vardır. Bir membranın elektrokimyasal araçlarda proton iletken olarak kullanılabilmesi için; • • • • • • Çalışma şartlarında kimyasal ve elektrokimyasal olarak kararlı olmalıdır. Operasyon sistemlerinde mekanik dayanım ve kararlılık gösterebilmelidir. Reaktif gazlara karşı olabildiğince düşük geçirgenlik göstermelidir. Yüksek elektrolit taşınımı göstermelidir (Bu yerel kurumalara engel olmak ve uniform (homojen) elektrolit içeriğinin sağlanması için önemlidir). Yüksek proton iletkenliği göstermelidir (Yüksek akım ve minimum direnç sergilenmesine destek olması içindir). Üretim maliyetleri uygulamalarla uyumlu olmalıdır. Yeni bir membran geliştirmek için birçok neden ortaya çıkmaktadır. Bunlar; • • • • Düşük sıcaklıklarda platin üzerindeki CO zehirlenmesini azaltmak Daha yüksek termal ve su yönetimi göstermek Yüksek kimyasal ve mekanik dayanım Birim maliyetin yüksek olması veya daha az üretim maliyeti vb. Yüksek sıcaklık membranları için takip edilen yol; • • Polimer elektrolitin su tutma kapasitesini düzenlemek Proton iletimini membranın nemliliğinden bağımsız kılmaya çalışmak olarak özetlenebilir Membranlar ve Membran Malzemeleri • • • • • • • • • • • • Nafion membranlar Poly(arylene ether) membranlar Poly(ether sulfone) membranlar Polyimide membranlar Poly phthalazinone ether ketone membranlar Poly sulfone membranlar Poly vinylidene fluoride membranlar Poly benzimidazole membranlar Polytetrafluoroethylene (PTFE) membranlar Poly(ether ether ketone) (PEEK) membranlar Polivinil alkol (PVA) membranlar Polistiren membranlar Yakıt Hücrelerinin Uygulama Alanları Çevreye zarar vermeyen, elektrik üretim verimi oldukça yüksek, sesiz çalışan, atık olarak sadece su, elektrik akımı ve ısı üreten yakıt hücrelerinin, çevre kirliliğinin oldukça yüksek boyutlara ulaştığı günümüzde ulaştırma sektöründe de yerini alması yakın gözükmektedir. Dünya çapında hala testleri devam etmekte olan ve yakıt hücreleri ile çalışan otobüs, tren, otomobil ve denizaltı gibi taşıt uygulamaları da mevcuttur. Kullanılan elektrolit tipine göre çeşitli isimler alan yakıt hücre tipleri arasında birim hacim başına üretilen güç miktarı en yüksek olan değişken proton membranlı yakıt pili oldukça sık kullanılmaktadır. Yakıt hücresi ile çalışan otomobiller diğer akülü araçlara göre daha fazla ilgi görmektedir. Akülü araçların avantajlarını sunmaları yanında, yakıt hücreli araçlar daha çabuk yakıt ikmali yapıp ikmal aralığını artırırlar. Yakıt hücreli arabalar, içten yanmalı motorlu araçlara göre daha az bakım gerektirirler ve daha sessizdirler. Aynı zamanda standart bir motora göre daha az hareketli parçası bulunur. PEMYP’nin işletim ömrü, araba ömründen daha uzundur. Yakıt hücreli araba hurdaya çıktığı zaman PEMYP çalışır durumdadır ve kullanılabilir. Ayrıca yakıt hücreleri hidrojen kullanımı ile araçlarda sıfır emisyon ve diğer yakıtların kullanımı ile de yaklaşık sıfır emisyon sağlanabilir. Yakıt hücreleri bir ızgara – güçlü aküsü olan araçtan daha etkili çalışma sağlayabilir. Yakıt hücreli arabalar türlü gazların oluşumundan daha az bir sistem genişliği sağlarlar. Çevresel etmenler göz önüne alındığında enerji verimi ve çıkan zararlı madde oranları karşılaştırıldığında yakıt hücreleri en iyi durumdadır. Bazı demir yolu şirketleri ve lokomotif üreticileri gelecek 10 – 15 yıl içerisinde ticari yakıt hücreli lokomotif üretimi planlamaktadır. Özellikle uzun mesafeler arasında (çöl veya geniş ova) ve elektrikli tren ulaşımının elektrik direkleri, enerji kablo ve taşıma maliyetlerinin arttığı durumlarda yakıt hücreleri enerji üreten bir sistem olarak alternatif gözükmektedir. Denizaltı uygulamalarında ise, nükleer enerji ile çalışan denizaltıların artan maliyetleri ve çevre tehditleri, dizel motorlu denizaltıların gürültü ve belirli aralıklarla yüzeye çıkma zorlukları nedeniyle yakıt hücreleri ile çalışan denizaltılar üreticiler için oldukça caziptir. Yakıt hücrelerinin ilk uygulamalarını meydana getiren uzay aracı çalışmaları devam etmektedir. Bu tür uygulamalar oldukça ilginçtir: uzay aracı güneş görebildiği sürece enerjisini güneş pilleri ile sağlamakta ve artan enerjinin bir kısmı ile araçta bulunan su elektroliz yolu ile bileşenleri olan hidrojen ve oksijene ayrışmaktadır. Güneş görülmeyen vakitlerde ise üretilen hidrojen ve oksijen yakıt hücrelerinde bir araya getirilerek su, elektrik akımı sağlamaktadır. Bu konuda NASA’ da yoğun çalışmalar sürmektedir. YAKIT PİLİ TERMODİNAMİĞİ Yakıt pili performans analizlerini yapabilmek için termodinamiğin temel kanunlarından yararlanmamız gerekmektedir. Bu amaçla bu bölümde öncelikle termodinamiğin iki temel kanunu olan enerjinin korunumu ve entropi üzerinde durulacaktır. Termodinamiğin I. Kanunu Termodinamiğin birinci kanunun enerji korunumudur. Isı ya da iş formunda olan enerji, sistemin sınırlarından geçer ve sistemin toplam enerjisini etkiler. Bu ilişki denklem halinde yazılırsa, δQ − δW = dE D1 D1 için girdiler için pozitif çıktılar için negatif işaret kullanılır. Bu denklemde (Q) sisteme giren ısıyı, (-W) sistemde yapılan işi ve E ise sistemin toplam enerjisini verir. Isı ve iş için olan değişimler diferansiyel (δ) terimi ile gösterilmiştir. Çünkü bu değerler yola bağlıdır ve bundan dolayı da yol fonksiyonları olarak adlandırılırlar. Enerji ise nokta fonksiyonudur, yoldan bağımsızdır ve sadece ilk ve nihai durumlara bağlıdır. D1’in integrali alınırsa, ∫ (δQ − δW ) = ∫ dE Q − W = ∆E D2 Kapalı bir sistem için (örn., piston-silindir, bir kontrol kütlesi olarak da adlandırılır) enerji değişimi; iç enerji (U), kinetik enerji (KE) ve potansiyel enerji (PE) toplamına eşittir. ∆E = ∆U + ∆KE + ∆PE D3 Açık sistemler için (örn., bir buhar türbini, kontrol hacmi olarak da adlandırılır) toplam enerjiye ilave bir terim daha eklenir. Bu terim, PV, olarak bilinir ve burada P basıncı, V ise akışkanın hacmini temsil eder. Bu terim akışkan üzerine yapılan işi yansıtır ve bu yapılan iş akışkanın akışkan halde kalmasını sağlar. Entalpi aşağıdaki denklem ile sağlanır. H = U + P ×V D4 Yatışkın akım şartları altında durağan (sabit) bir kontrol hacmi için kinetik enerji ve potansiyel enerji değişimi sıfır olur (∆KE= ∆PE=0) ve zamanla özellikler değişmez. Bu durumda I. kanuna göre entalpideki değişim yeniden yazılırsa; Q − W = ∆H D5 Termodinamik analiz için bir yakıt pilinin kontrol hacmi D5’in kullanılmasıyla Şekil 20 de temsili olarak verilmektedir. Şekil 20. Bir yakıt pilinin kontrol hacmi olarak gösterilmesi, E elektriksel potansiyel (volt). Termodinamiğin II. Kanunu Termodinamiğin ikinci kanunu entropiyi tanımlar. Entropi bir sistemdeki düzensizliğin bir ölçüsüdür. Eğer bir sistem entropi oluşturmuyorsa tersinir proses olarak adlandırılır. Dolayısıyla tersinir bir proseste birinci kanuna göre sitemde veya çevresinde ısı ve iş değişimi olmaz. Tersinmez sistemler ise kontrol edilemeyen bir genişleme, sürtünmeden dolayı ısı kaybı ve sonlu sıcaklık farklarından dolayı ısı transferi gibi olaylar dolayısıyla entropi oluştururlar. Isı transferi içeren prosesler sonlu sıcaklık farkları veya sıcaklık gradiyentinin minimize edilmesiyle tersinir hale getirilebilirler. Entropi bu tersinir ısı transferine bağlıdır ve şöyle açıklanır; δQ dS = T ters D6 Entropideki değişim sadece sistemin ilk ve son yapısına bağlıdır ve D6’nın integre edilmesi ile bulunur; 2 δQ ∆S = S 2 − S1 = T ters 1 ∫ D7 Tersinir ısı transferi oluşan bir sistem için (Qrev) sabit sıcaklıkta (T0) entropi aşağıdaki denklemle açıklanır; ∆S = Qters T0 D8 Sıcaklık ve Basınç Sıcaklık ve basınç değişiminin ideal pil potansiyeline olan etkisi Gibbs serbest enerjisindeki temel değişimlerde analiz edilebilir. Gibbs serbest enerjisi sıcaklık ve basınçla değişebilmektedir. ∆S ∂E = ∂T P n × F ∆Hacim ∂E =− n× F ∂T T Bu denklemlerde, S: Entropi, P:Basınç; E:İdeal potansiyel, F:Faraday sabiti, T:Sıcaklık ve n:Reaksiyonda üretilen elektron sayısı olarak tanımlanmaktadır. H2O reaksiyonu için entropi değişimi negatiftir. H2O yakıt pilinin tersinir potansiyeli sıcaklığın artmasıyla azalır. Bu oran her oC başına 0.84 mV olmaktadır. Aynı reaksiyon için hacim değişimi (-)’dir. Bu nedenle tersinir potansiyel basıncın artmasıyla artacaktır. Verimlilik Termal Verimlilik = (Kullanılan Yayarlı Enerji/Yakılan Yakıttaki Kimyasal Enerji) olarak tanımlanmaktadır. Denklem ile ifade edilirse; η= Yarralı _ enerji olarak verilebilir. ∆H Bir kömürün yapısındaki enerji değeri bellidir. Fakat enerjisinin 1/3 yararlı enerji, 1/3 egzoz gazı, 1/3 soğutma suyuyla alınır(Yararlı enerji,%33). Pilin verimi serbest Gibbs serbest enerjisindeki değişimden elde edilir. η= ∆G ∆H H2(g) + ½ O2(g) → H2O(s) ∆G= 56635 kal/mol ∆H= 68269 kal/mol η =0.83 Yarralı _ enerji Yararlı _ güç Vgerçek × Akık 0.83 × Vgerçek = = = Videal × Akık ∆G ∆H Videal η 0.83 H2/O2 sistemi için 1 atm basınç ve 25 °C de ideal voltaj değeri, 1.229 V olarak bilinmektedir. O halde; η= η= 0.83 × Vgerçek Videal = 0.83 × Vgerçek 1.229 = 0.675 × Vgerçek η = 0.675 × Vgerçek (sıcaklıktan bağımsız verim elde edilir). Gibbs serbest enerjisi ve ideal performans Sabit sıcaklık ve basınçta maksimum elektriksel iş elektrokimyasal reaksiyonun serbest enerjisindeki değişim ile bulunabilmektedir. W = ∆G = − n × F × E Bu denklemde, n elektron sayısı, F; Faraday sabiti (96487 Coulomb/g-mol.elektron) ve E; ise pilin ideal potansiyelidir. Eğer ürünler ve reaktantların standart yapıda olduğu kabul edilirse (25 C veya 298 k ve 1 atm) yukarıdaki son denklem kullanım için aşağıdaki nihai yapısını alır. ∆G o = −n × F × E o Molar Gibbs Serbest Enerji Değişim Hesaplamaları 1. Hidrojen Yakıt Pili H2 + ½ O2 → H2O Bir sistemin Gibss fonksiyonu entropi ve entalpi terimlerinde tanımlanmaktadır. Bu tanım aşağıdaki genel denklem ile verilmektedir. Gibbs Serbest enerjisi= Entalpi -Sıcaklık×Entropi G= H – T×S Benzer olarak molar Gibss enerji formasyonu, molar entalpi formasyonu ve molar entropi aşağıdaki ilişki ile açıklanmaktadır. Gf = Hf – T× S Bu durumda enerjideki değişim önemlidir. Aynı zamanda bir yakıt pilinde sıcaklık sabittir ve aradaki ilişki farklar şeklinde ifade edilebilir. ∆Gf = ∆Hf – T×∆S ∆Hf ürünler entalpisi ile reaktantlar entalpisi arasındaki farktır. H2 + ½ O2 → H2O için bu fark aşağıdaki gibi yazılabilir. ∆Hf = (Hf)su -(Hf)H2 – ½ (Hf)O2 Benzer şekilde entropide oluşan fark ürünler ve reaktantlar arasındaki ilişkiden ibarettir ve aşağıdaki gibi yazılabilir. ∆S = (S)su -(S)H2 – ½ (S)O2 Hf ve S değerleri aşağıda verilen eşitliklere göre sıcaklıkla değişmektedir. Bu standart eşitlikler termodinamik teori kullanılarak geliştirilmiştir. Bu eşitliklerde alt indis olarak gösterilen h ve ŝ sıcaklıktır, ve cp sabit basınçta molar ısı kapasitesidir (özgül ısı). Standart sıcaklığın tam olarak değeri 298.15 K olarak alınmalıdır. T sıcaklığında molar entalpi formasyonu (oluşumu), T ∫ c p × dT HT = H 298.15 + 298.15 Benzer şekilde molar entropi ise şu denklemle verilir; T ∫ ST = S298.15 + 298.15 1 × c p × dT T Molar entropi ve entalpi değerleri T=293.15 K için termodinamik tablolardan elde edilebilir. Bu değerler standart basınçta Tablo 2 de verilmektedir. Yukarıdaki denklemleri kullanabilmek için sabit basınçt (p=sabit) molar ısı kapasitelerinin bilinmesine gerek vardır. Fakat geniş sıcaklık aralıklarında molar ısı kapasiteleri sabit değildir. Molar ısı kapasitelerini bulabilmek için ampirik eşitlikler geliştirilmiştir ve bu eşitlikler ile sıcaklığın 300–3500 K olduğu aralıkta % 0.6 gibi çok küçük bir hata ile cp değerlerini hesaplayabilmekteyiz. Örneğin buhar için böyle bir eşitlik aşağıdaki gibi verilmektedir. c p = 143.05 − 58.040 × T 0.25 + 8.2751 × T 0.5 − 0.036989 × T H2 için c p = 56.505 − 22222.6 × T −0.75 + 116500 × T −1 − 560700 × T −1.5 O2 için c p = 37.432 − 2010.2 × 10−5 × T 1.5 + 178570 × T −1.5 + 2368800 × T −2 Tablo 2. Hidrojen yakıt pili için T=298.15 K de Hf ve S değerleri Hf (J/mol) S (J/mol.K) Madde H2O (sıvı) -285838 70.05 H2O (gaz) -241827 188.83 H2 0 130.59 O2 0 205.14 Tablo 3. H2 + ½ O2 → H2O için ∆Hf , ∆Gf ve S için bazı sıcaklıklardaki oluşum değerleri Sıcaklık (°°C) 100 300 500 700 900 ∆Hf (kJ/mol) -242.6 -244.5 -246.2 -247.6 -248.8 S (kJ/mol) -0.0466 -0.0507 -0.0533 -0.0549 -0.0561 ∆Gf (kJ/mol) -225.2 -215.4 -205.0 -194.2 -183.1 Yük (coulomb)/zaman = Amper (I) 2. Karbon monoksit Yakıt Pili Yüksek sıcaklıkta işletilen yakıt pillerinde CO gazı metanın buhar reformlaması sonucu üretilmektedir. Üretilen bu CO oksijen ile doğrudan oksitlenerek ilave enerji üretmektedir. CO + ½ O2 → CO2 Gibbs serbest enerji değişiminin hesaplanama metot ve teorisi hidrojenle aynıdır, sadece ortaya çıkan reaksiyon farklıdır. Oksijen için cp değeri daha önceden verildiği gibidir. CO ve CO2 için cp değerleri aşağıdaki gibi verilmektedir. CO için c p = 69.145 − 0.022282 × T 0.75 − 2007.7 × T −0.5 + 558964 × T −0.75 CO2 için c p = −3735.7 + 3052.9 × T 0.5 − 0.041034 × T + 2419.8 × 10 −6 × T −2 Molar entalpi ve entropi değişimleri aşağıdaki eşitlikler kullanarak hesaplanabilir. ∆Hf = (Hf)CO2 -(Hf)CO – ½ (Hf)O2 ∆S = (S)CO2 -(S)CO – ½ (S)O2 Yakıt Hücresi için Önemli Eşitlikler Bu bölümde oksijen kullanım oranı, hava besleme ve çıkışı akış oranları, hidrojen kullanım miktarı ve hidrojenin enerji içeriği, su üretim oranı ve ısı üretim miktarları ile ilgili açıklamalar ve eşitlikler verilmektedir. En basit pil reaksiyonlar aşağıda verilmektedir. Hidrojen kullanımı 2H2 → 4H+ + 4e− Oksijen kullanım denklemi O2 + 4H+ + 4e− → 2H2O Toplam oluşan reaksiyon ise 2H2 + O2 → 2H2O Bu denklem sonucunda 4×F kadar yük oluşur. Sistem çalıştırılırken hem hidrojen hem de oksijen stokiyometrik orandan daha fazla oranda sisteme sağlanmaktadır. Stokiyometri λ gibi değişken olan bir sembolle açılanır. Eğer bir reaksiyonda kimyasalın kullanım oranı ń mol/s ise sisteme temin edilen yakıtın miktarı λ× ń mol/s olmaktadır. Formüllerin kullanılabilirliğini artırmak için tüm elektrik pili yığınının elektrik gücü (Pe) olarak ve yığındaki her bir hücrenin ortalama voltajı ise (Vc) olarak verilir. Yakıt pilinin elektrik gücü daima bilinecektir. Eğer Vc verilmemişse, Vc değerinin 0.6–0.7V arasında olacağı kabul edilir ve birçok yakıt pili bu bölgede işletilir. Eğer verim verilmiş ise, Vc ilgili denklemden hesaplanabilir. Eğer herhangi bir değer verilmemişse, Vc = 0.65 × V olarak kullanılabilir. Eğer yakıt pili basınçlı bir işletime sahipse o zaman tahmin biraz yüksek çıkabilir. Oksijen ve Hava Kullanım Oranı Oksijen kullanım denklemi O2 + 4H+ + 4e− → 2H2O olarak verilmişti. Bu denkleme göre harcanan her mol oksijen başına 4 elektron üretilmektedir. O zaman; Yük = 4 × F × O2 _ miktarı Bu denklem zamana bölünürse (yük/zaman veya Coulomb/zaman= Amper) ve yeniden düzenlenirse; O2 _ kul = I mol/s olur. 4× F Yapısında n tane hücre olan bir yakıt pili yığını için bu değer şöyle olur. O2 _ kul = I ×n mol/s olur. 4× F Bu formülde elde edilen değerin kg/s olması pil yığınında kaç tane hücre olması gerektiğini bilmezsek de güç terimi anlamında bize avantaj sağlar. Eğer pil yığınındaki her bir hücrenin ortalama hücre voltajı Vc ise ozaman güç denklemi aşağıdaki gibi açıklanır. Güç......Pe = Vc × I × n I= ve akım ise Oksijen kullanım denklemi, O2 _ kul = I ×n 4× F Pe Vc × n olur. yukarıdaki eşitlikleri kullanarak yeniden düzenlenirse; Pe mol/s haline gelir. Birimi (mol/s), kg/s cinsinden 4 × Vc × F yazarsak denklem yeniden düzenlenerek aşağıdaki halini alır. O2 _ kul = 32 × 10−3 × Pe P O2 _ kul = = 8.29 × 10 −8 × e 4 × Vc × F Vc O2 _ kul = 8.29 × 10−8 × Pe kg/s Vc veya olur. Bilindiği gibi oksijen genelde havadan sağlanmaktadır. Eğer sistem saf oksijen kullanıyorsa yukarıdaki denklemi, değilse “hava kullanım oranı” denklemini kullanmamız gerekmektedir. Havanın %21’i oksijen ve molekül ağırlığı 28.97 kgmol olarak alınıp yukarıdaki denklemde yeniden yerine konulursa “hava kullanım oranı” denklemi elde edilmiş olur: Hava _ kul = 28.97 × 10 −3 × Pe P = 3.57 × 10−7 × e kg/s 0.21 × 4 × Vc × F Vc Eğer gerekli hava miktarı bu oranda kullanılırsa hücre reaksiyonunda var olan tüm oksijen kullanıldığından hücreyi terk eden egzoz gazı içerisinde oksijen hiç bulunmayacaktır. Bu pratik değildir ve genelde gerekli hava miktarından en az iki kat daha hava sisteme verilir. Bu durumda gerekli stokiyometrik hava miktarı λ ile verilirse, yukarıdaki denklem yeniden düzenlenerek aşağıdaki nihai denklem oluşturulur. Hava _ kul = 3.57 × 10 −7 × λ × Pe kg/s Vc Kg/s olarak çıkan sonucu 3050 ile çarparsak m3/saat ve 5.1×104 ile çarparsak standart L/dakika birimleri elde edilir. Hava Çıkışı Akım Oranı Hidrojen kullan oranı oksijen kullanım oranına benzer şekilde üretilir. Tek ayrılan nokta kullanılan her hidrojen molekülünden iki elektron oluşmaktadır. H 2 _ kul = I ×n Pe mol/s olur ve H 2 _ kul = mol/s 2× F 2 × Vc × F haline gelir. Hidrojenin kütlesi 2.02 g/mol veya 2.02×10 -3 kg/mol alınırsa stokiyometrik şartlarda; P 2.02 × 10−3 × Pe H 2 _ kul = = 1.05 × 10 −8 × e kg/s olur. Vc 2 × Vc × F Bu formül hidrojen yakıtlı yakıt pillerine uygulanabilir. Hidrojen/CO karışımındaki bir durumda sonuçlar karışımdaki CO’in kısmi basıncına göre değişik olacaktır. Sonuçlar hidrojenin yoğunluğu kullanılarak hacimsel orana dönüştürülebilir. Normal sıcaklık ve basınçta hidrojenin yoğunluğu 0.084 kg/m3 dür. Hidrojen “ham” ve etkin enerji değeri aşağıdaki Tablo 4 de verilmektedir. Tablo 4. Hidrojen “ham” ve etkin enerji değeri (LHV’yi elde etmek için HHV’yi 0.846 ile çarpınız) Form Enerji İçeriği Özgül Entalpi, (HHV) 1.43×108 J/kg Özgül Entalpi, (HHV) 39.7 kWh/kg Etkin elektrik enerjisi, 26.8×Vc, kWh/kg Enerji yoğunluğu, STP de (HHV) 3.20 kWh/m3 = 3.20 WhS/L Enerji yoğunluğu, NTP de (HHV) 3.29 kWh/m3 = 3.29 WhS/L Not: HHV, üst ısıl değer; STP, Standart basınç ve sıcaklık Eğer verim için denklem gerekirse, şu denklem kullanılabilir, Verim = Vc 1.48 Su Üretim Miktarı Hidrojen yakıtlı bir pilde, her iki elektron başına 1 mol su üretilmektedir. Daha önce Pe kullanılan O2 _ kul = mol/s denklemi yardımıyla (Pe, elektriksel güç ve Vc, pil 4 × Vc × F yığınındaki bir pilin ortalama voltaj değeri), Su _ üretimi = Pe mol/s 2 × Vc × F denklemi elde edilir. Suyun moleküler ağırlığı, 18.02×10-3 kg/mol olduğundan denklem yeniden düzenlenerek; Su _ üretimi = 9.34 × 10 −8 × Pe kg/s olur. Vc Bu değer hidrojen yakıtlı pil için su üretim miktarının stokiyometrik orana yakın olduğunu göstermektedir. Eğer ortamda CO varsa o zaman durum biraz değişmektedir ve su üretimi azalmaktadır. Su üretimi denklemini daha belirgin bir hale sokmak için bir örnek verilmesi olayın anlaşılması açısından önemlidir. Örneğin 1-kW gücündeki bir yakıt pili bir saat bir süre için bir hücredeki voltaj değeri 0.7V olarak bilinmektedir. Bu sistemdeki su üretim miktarı ne kadardır? Hidrojen yakıtlı bir pilin verimi aşağıdaki formülle bulunabilmektedir. ηverim = µ f × V × 100 1.48 Bu denklemde µf yakıt kullanım oranıdır ve genellikle 0.95 olarak alınmaktadır. V ise Pil yığınındaki bir tek hücrenin voltaj değeridir. ηverim = µ f × V 0 .7 × 100 = 0.95 × × 100 = 45% Böyle bir sitemin verimi %45 olur. 1.48 1.48 Üretilen su miktarı; Su _ üretimi = 9.34 × 10 − 8 × Pe 1000 = 9.34 × 10 −8 × = 1.33 × 10− 4 kg/s olur. Vc 0 .7 Bir saatlik zaman zarfında üretilen toplam su mikatrı; Su _ üretimi = 1.33 × 10 −4 × 3600 = 0.48 kg olur. Suyun yoğunluğu 1 g/cm3 olduğundan bu ağırlıktaki su miktarı 480 cm3 olur. Özetle 1 kWh bir elektrik üretiminde yaklaşık olarak yarım (0.5 L) litre su üretilmektedir. Üretilen Isı Miktarı Bir yakıt pili çalıştırıldığı zaman ısı üretilmektedir. Eğer bir hidrojen yakıt pili reaksiyonunu tüm eltalpisi elektrik enerjisine çevrilirse, ortaya çıkan voltaj değeri suyun sıvı ve buhar olmasına göre değişir: Eğer ürün su halinde ise “üretilen voltaj değeri 1.48V”, buhar halinde ise “üretilen voltaj değeri 1.25V” olur. Bu değer ile gerçek pil voltajı arasındaki fark bize elektrik enerjisine çevrilemeyen değeri verir. Bu enerji miktarı ısıyı dönüştürülen miktardır. Bu reaksiyonda sıvı formunda ortaya çıkan su miktarı çok azdır. Hesaplamada buhar formunda olan su kullanılır. Bununla beraber su buharının soğuma etkisi göz önüne alınmaktadır. Bunun bir başka anlamı ise enerji yakıt pilini üç şekilde terk etmektedir: elektrik, duyarlı ısı ve su buharının gizil ısısı. Yapısında n tane hücre bulunan ve akım değeri I olan bir yakıt pili yığınının ürettiği ısı şöyle bulunur (W; yapılan işi, Pe, elektriksel güç, n; pil yığınındaki pil sayısını ve Vc, pil yığınındaki bir pilin ortalama voltaj değerini göstermektedir): Üretilen _ ısı = n × I × (1.25 − Vc ) × W Üretilen elektriksel güç anlamında ise denklem aşağıdaki yapısını alır: 1.25 Üretilen _ ısı = Pe × − 1 × W Vc Güç denklemi ise şöyle elde edilir: Pe = n × I × Vc Elektriksel iş denklemi ise şöyle verilmektedir. Welektrik = n × F × E Yakıt Pili Performansı Kimyasal ve termodinamik işlemler, hangi şartlarda işletildiği bir pilin performansı açısından önemlidir. Bu nedenle işletim şartları yakıt pilinin performansını etkilemektedir. İşletme şartlarını etkileyen faktörler: 1-Sıcaklık 2-Basınç 3-Sisteme beslenen yakıtın bileşimi Öncelikle bir yakıt pilinin işletimini anlamak için o yakıtın ideal performansını bilmemiz gerekir. İdeal performans bulunduktan sonra işletmede bazı kayıplar meydana gelmektedir. Bu kayıplar ideal performanstan çıkarılarak gerçek işletim performansı ortaya çıkarılır. İdeal Performanslar Tablo 5. Değişik Yakıt pilleri için anot ve katot reaksiyonları Yakıt Pili Anot Reaksiyonu Polimer Elektrolit H2 → 2H+ + 2eMembran, PEM Alkali H2 + 2(OH)- → 2H2O + 2eFosforik Asit H2 → 2H+ + 2eH2 + CO32- → H2O + CO2 + 2eErimiş Karbonat CO + CO32- → 2CO2 + 2eH2 + O2- → H2O + 2eKatı Oksit CO + O2- → CO2 + 2eCH4 + 4O2- → 2H2O + CO2 + 8e- Katot Reaksiyonu ½ O2 + 2H+ + 2e- → H2O ½ O2 + H2O + 2e- → 2(OH)½ O2 + 2H+ + 2e- → H2O ½ O2 + CO2 + 2e- → CO32½ O2 + 2e- → O2- Bir yakıt pilinin ideal performansı elektrokimyasal reaksiyonlara bağlıdır. Bu reaksiyonlarda değişik yakıtlar ve oksitleyici olarak oksijen kullanılmaktadır. Düşük sıcaklıkta çalışan yakıt pilleri değerli metalleri (Pt, Ru, Pd vb.) kullanmak zorundadırlar. Çünkü düşük sıcaklıkta ancak bu katalizörler ile (özellikle Pt) anot ve katotta gerekli reaksiyon hızlarını hidrojen yakıtı kullanıldığında ulaşılabilmektedir. H2 + 2Pt → 2Pt-H 2Pt-H → 2Pt + 2H+ + 2eNet Reaksiyon: H2 → Pt → 2H++2eYüksek sıcaklıkta işletilen yakıt pilleri değerli metal katalizörleri ile çalıştırılamayabilir. Bu katalizörler yerine değişik katalizörler (Fe,Ni vb) kullanılabilir. Yakıt içinde küçük safsızlıklar halinde bulunan CO, Pt ile bağ yaparak Pt’un aktivitesini yok eder (zehirler) ve katalizörün aktivasyon özelliğini kaybettirir. Pt + CO → Pt-CO Pt-CO + H2O → CO2 + Pt + 2H+ + 2e- Fakat CO bir başka açıdan düşünüldüğünde yüksek sıcaklıkta çalıştırılan yakıt pilleri için H kaynağı görevini görür.H üretim potansiyeli Ni katalizörü ile gerçekleştirilebilir. Yakıt olarak kullandığımız H2, CO, CH4 anodik oksidasyon dediğimiz elektrokimyasal oksidasyona uğrar. Hidrojen, CO’in su buharı ile ve metanın su buharı reaksiyonunda ortaya çıkarılabilmektedir. CO + H2O(g) → CO2 + H2 CH4 + 2H2O(g) → CO2 + 4H2 Düşük sıcaklıkta işletilen yakıt pili sistemlerinde hidrojenin üretilebilmesi için enerjiye ihtiyaç vardır. Yüksek sıcaklıkta işletilen katı oksit ve erimiş karbonat pilleri gibi sistemlerde iç reformlara üniteleri bulunmaktadır. Bu iç reformlama işlemi ile Hidrojen yakıt pili sisteminin içinde üretilebilmektedir. Bir yakıt pilinin ideal performansı Nernst potansiyeli ile belirlenir ve Nernst potansiyeli bir pilde üretilen voltaj miktarını temsil eder. Nernst potansiyelini elde edebilmek için genel bir denklem oluşturulursa, aA + bB → cC + dD Bu genel denklem için Nernst potansiyeli aşağıdaki denklemle yazılabilmektedir. E = E0 + RT PAa × PBb ln nF PCc × PDd Yakıt pillerinde oluşan net reaksiyonlara göre Nernst potansiyel denklemleri aşağıda verilmektedir. Net Reaksiyonlar; 1) H2+ ½ O2 → H2O Bu reaksiyon sonucu sistemde her hidrojen molekülü başına iki elektron (2e−) üretilmektedir. Hidrojeni yakıt olarak kullanan PEM yakıt pili sisteminde oluşan Nernst potansiyel denklemi şöyledir: E = E0 + PH R × T 1 R ×T 2 × ln + × ln PO 2 PH O 2 × F 2 2× F 2 2) H2 + ½ O2+ CO2(k) → H2O + CO2(a) katot için kullanılmıştır. Bu denklemlerde alt indis a anot ve k ise Erimiş karbonat yakıt pillerinde elektrolitteki karbonat konsantrasyonunu sabit tutmak için katotta bir miktar CO2 gereklidir. Bundan dolayı CO2 anotta üretilir ve katotta tüketilir. Anot ve katot besleme akımlarındaki konsantrasyonlar mutlak olarak eşit olmadığından her iki elektrot reaksiyonları için CO2 kısmi basınçları Nernst denkleminde mevcuttur. Bu reaksiyon sonucu sistemde her hidrojen molekülü başına iki elektron (2e−) üretilmektedir. Hidrojeni yakıt olarak kullanan ERİMİŞ KARBONAT yakıt pili sisteminde oluşan Nernst potansiyel denklemi şöyledir: E = E0 + 3) PH 2 R ×T × ln PH O × PCO 2× F 2, a 2 R ×T 1 + × ln PO 2 × PCO2, k 2× F 2 CO + ½ O2 → CO2 Bu denklem özellikle yüksek sıcaklıklarda işletilen yakıt pilleri için karbon-monoksitin yakıt olarak kullanıldığı sistemlerde oluşmaktadır. Bu reaksiyon sonucu sistemde her karbonmonoksitin molekülü başına iki elektron (2e−) üretilmektedir. Bu tür sisteminde oluşan Nernst potansiyel denklemi şöyledir: E = E0 + 4) P R ×T × ln CO PCO 2× F 2 R ×T 1 + × ln PO 2 2× F 2 CH4 + 2 O2 → 2H2O + CO2 Bu reaksiyon KATI OKSİT yakıt pilinde gerçekleşmektedir. Bu reaksiyon sonucu sistemde her metan molekülü başına sekiz elektron (8e−) üretilmektedir. Bu tür sisteminde oluşan Nernst potansiyel denklemi şöyledir: E = E0 + PCH 4 R ×T × ln 2 PH O × PCO 8× F 2 2 ( ) R ×T + × ln PO22 8× F 5) CH3OH + 3/2 O2 → CO2 + 2H2O Bu reaksiyon Metanol yakıtlı PEM yakıt pilinde gerçekleşmektedir. Bu reaksiyon sonucu sistemde her metan molekülü başına altı elektron (6e−) üretilmektedir. Bu tür sisteminde oluşan Nernst potansiyel denklemi şöyledir: E = E0 + PCH OH R ×T × ln 2 3 PH O × PCO 6× F 2 2 R ×T 3 + × ln PO 2 6× F 2 Bu denklemlerde, E:Denge potansiyeli; E0:İdeal potansiyeli; T:Sıcaklık(K); R:Gaz sabiti; F:Faraday sabiti ve n:Reaksiyonda ortaya çıkan elektron sayısı olarak tanımlanmaktadır. İdeal potansiyel farklı sıcaklıklarda farklı değerler alabilmektedir. H2/O2 reaksiyonlu bir yakıt pili için sıcaklığın bir potansiyeli olarak ideal potansiyelin değişimi aşağıdaki grafikte (Şekil 21) verilmektedir. Şekil 21. H2/O2 yakıt pili ideal potansiyelinin sıcaklığın fonksiyonu olarak değişimi 25 oC de normal bir reaksiyon(H2-O2) 1.18 volt, 80 oC de PEM 1.17 volt, 205 oC de Fosforik asit Y.P 1.14 volt ve 650 oC de Erimiş karbonat Y.P 1.03 volt olarak belirlenmiştir. Entropiler: HSU= -285838 J/mol, SSU= 70.05 J/mol.K, SH2= 130 J/mol.K, SO2= 205 J/mol.K H2 + ½ O2→H2O ∆HT=∆H(285838) ∆S= ∆SÜRÜNLER-∆SREAKTANTLAR ∆S=70-130-205= -265J/mol.K Yakıt Hücresinde Polarizasyonlar ve Voltaj Kayıpları Teorik olarak yakıt hücresinden 1.229 V voltaj elde edilmelidir. Bir yakıt pilinde oluşan ideal voltaj, birçok kaynaktan dolayı tersinmez kayıplara neden olur. Dolayısıyla yakıt hücresindeki tersinmez kayıplar yüzünden bu değer elde edilemez. Tersinmez kayıplara polarizasyon adı verilir. Polarizasyon, aşırı-potansiyel (aşırı-gerilim; overpotential) veya aşırı-voltaj (aşırı gerilim) olarak bilinen bu kayıpların üç temel nedeni vardır. Bu kayıplar; 1) 1.Aktivasyon polarizasyonu (ηact); 2) Ohmik polarizasyonu (ηohm) ve 3) Konsantrasyon polarizasyonu (ηconc) olarak bilinmektedir. Bu kayıplar oluştuğu zaman bir pilin ideal potansiyeli azalır ve aradaki ilişki yani pilin gerçek potansiyel teorik ideal potansiyelden bu kayıpların çıkarılması ile bulunur: ( V= E − Toplam Kayıplar ). Aktivasyon polarizasyonları, yakıt hücresinde meydana gelen elektrokimyasal reaksiyonlar sırasında oluşan voltaj farkından kaynaklanmaktadır. Direnç polarizasyonları, iyonların elektrolitten ve elektronların elektrot maddesinden geçişi sırasında oluşan dirençlerden kaynaklanmaktadır. Direnç polarizasyonu, membranın iyon iletkenliğini arttırılarak düşürülebilir. Konsantrasyon polarizasyonları, elektrot yüzeyinde elektrokimyasal reaksiyonlar sonucu tükenen reaktantlar ve yeni gelecek olan reaktantların yeterince hızlı iletmemesi sonucu görülen kayıplardır. Şekil 22’de hücre voltajına karşı akım yoğunluğu grafiği görülmektedir. Şekil 22. Yakıt hücresi polarizasyonları ve voltaj kayıpları. Teorik olarak elde edilmesi gereken voltaj değeri yakıt hücresindeki kayıplar nedeniyle farklılaşmıştır. Bu kayıpların bir bölümünü de polimer elektrolit membran meydana getirmektedir. Bu nedenle sentezlenen membrandan elde edilecek akım yoğunluğu önem kazanmaktadır. Sentezlenen membranın direncinden meydana gelecek kayıplar düşük olursa ideal voltaj değerinde sabit bir akım yoğunluğu değeri elde edilebilir. Aktivasyon polarizasyonu: Reaksiyon hızından dolayı olan kayıp olarak bilinir. Yavaş elektrot kinetiği ile bir elektrotun yüzeyindeki elektrokimyasal reaksiyon hızı kontrol altında olduğu zaman aktivasyon polarizasyonu gerçekleşir. Bir başka ifade ile aktivasyon polarizasyonu elektrokimyasal reaksiyonların hızlarıyla doğrudan ilgilidir. Elektrotlarda reaksiyonun oluşabilmesi için belirli bir enerjiye ihtiyaç duyulur. Bu enerji seviyesine ulaşılması halinde reaksiyon gerçekleşebilir. Katalizör yüzeyinin yakıt ve havayı absorbsiyonu, anot reaksiyonunda ortaya çıkan elektronların anottan ayrılmaları, ürün maddelerin desorbe olması gibi durumlarda aktivasyon kayıplarının nedenleridir. Elektrokimyasal reaksiyon bir aktivasyon bariyeri (engeli) içerir. Bu engelin reaksiyona giren türler tarafından aşılması gerekir. Reaksiyona giren ürünlerin aktifleşme kaybı vardır. Bir elektrokimyasal reaksiyonun Tafel denklemi aşağıdaki eşitlikle açıklanmaktadır. R ×T i ln n × α × F i0 ηact = Denklemde geçen α; elektron transfer katsayısı ve i0; dönüşüm akım yoğunluğu olarak tanımlanır. α , elektrotta kullanılan malzemeye bağlı olarak 0-1 aralığında bir değer alır. Anot ve katot olarak her iki elektrotta da gerçekleşen aktivasyon kaybı; anotta katota göre ihmal edilebilir seviyededir. Aktivasyon kayıplarının azaltılmasında i0‘ın önemli bir etkisi vardır. Yakıt pili sıcaklığının yükseltilmesi, daha etkin katalizör kullanımı, elektrot yüzey alanının direkt ya da dolaylı olarak arttırılması (yüzey pürüzlülüğünün arttırılarak), basıncın arttırılması şeklindeki tedbirler ile i0‘ın arttırılması ve aktivasyon kayıplarının azaltılması gerçekleştirilebilir. Ohmik polarizasyon: Bu tür kayıplar direnç kaybından dolayı olan kayıp olarak da bilinir. Bu kayıplar elektrolitteki iyonların akışına gösterilen dirençten ve elektrot malzemesi içerisinden akıp geçen elektronun akışına gösterilen dirençten meydana gelir. PEM yakıt pilinde direnç kayıpları, hidrojen iyonlarının hareketine karşı membran ve elektrotlardaki dirençlerden meydana gelir. Önemli direnç kaybının oluştuğu membranda; iyonik iletkenliğin arttırılması (yüksek iletkenlikte malzeme kullanımı) ve membran kalınlığının azaltılması direnç kayıplarını da azaltacaktır. Aynı şekilde bipolar plakalarda önemli direnç kayıplarının oluştuğu noktalardır. Buralarda da benzer önlemlerle direnç kayıpları azaltılabilir. Baskın olan ohmik kayıplar elektrot ayrımının (separation) azaltılmasıyla ve elektrolitin iyonik iletkenliğinin artırılmasıyla azaltılabilir. Elektrolit ve elektrotlar ohm yasasına uyduğundan dolayı ilgili bağıntı şu şekilde açıklanır; ηohm = i × R Bu denklemde i;Hücreden akan akım ve R; Toplam direnç (elektrolit, iyonik ve temas dirençlerinden oluşur) olarak ifade edilmektedir. Membran direnci; membran nemi ve sıcaklığı ile önemli oranda ilişkilidir. Direnç, membran kalınlığı ile doğru; iletkenliği ile ters orantılıdır. Konsantrasyon polarizasyonu: Bu tür kayıplar gaz taşınımından dolayı olan kayıp olarak da bilinir. Reaktant elektrotta elektrokimyasal reaksiyon ile tüketilirken bir potansiyel kaybı oluşur. Bu potansiyel kayıp ana akışkanın (bulk fluid) başlangıç konsantrasyonunu sağlayamadığından dolayı oluşur. Böylece bir konsantrasyon gradienti (farkı) oluşur. Konsantrasyon polarizasyonuna birkaç proses etki edebilmektedir; 1) Elektrot gözenekleri içerisinde gaz fazdaki yavaş difüzyon (dağılma); 2) Elektrolit içerisinde reaktantların çözünmesi ve elektrolitten ürünlerin ayrışması veya Elektrokimyasal reaksiyon kısmına reaktantların elektrolit üzerinden difüzyonu ve Elektrokimyasal reaksiyon kısmından ürünlerin elektrolit üzerinden difüzyonu aşamalarını kapsamaktadır. Pratik akım yoğunluklarında reaktantların elektrokimyasal reaksiyon kısmına yavaş transferleri ve ürünlerin elektrokimyasal reaksiyon kısmından yavaş transferleri konsantrasyon polarizasyonunun en önemli etkenleridir. i R × T ln1 − n × α × F i0 ηact = Elektrot Polarizasyonu Özeti: Aktivasyon ve konsantrasyon polarizasyonu hem katotta hem de anotta meydana gelir. ηanot = ηconc,( a ) + η act ,( a ) ηcatot = ηconc,( k ) + η act ,( k ) Polarizasyon elektrotun potansiyelini değiştirir. Velektrot = Eelektrot ± ηelektrot Vanot = Eanot + ηanot Vkatot = Ekatot − η katot Hücre Voltajı Özeti: Hücre voltajı anot, katot potansiyellerini ve ohmik polarizasyonu içerir. Aradaki matematiksel ilişkiler aşağıda verilmektedir. V pil = Vkatot − Vanot − i × R Vanot = Eanot + η anot Vkatot = Ekatot − η katot V pil = Ekatot − η katot − [Eanot + η anot ] − i × R V pil = ∆Ee − ηkatot − ηanot − i × R olur. Bu denklemde ∆Ee = Ekatot − Eanot olarak alınmalıdır. Ohmik polarizasyon ve elektrotlardaki polarizasyondan dolayı hücredeki potansiyel azalır. Potansiyel katot ve anot arasındaki farktan oluşur. Anottaki ve katottaki ohmik polarizasyonu hiç yok edemiyoruz. Fakat minimum değere indirmemiz gerekir. Elektrot yapılarının geliştirilmesi, daha iyi elektro-katalizörlerin geliştirilmesi, daha iyi iletkenlik yapan elektrolit geliştirilmesi, hücre bileşenlerinin kalınlıklarının daha da azaltılması polarizasyonu minimuma indirmek için uygulanabilecek işlemlerdir. Elimizdeki hücre dizaynını geliştirmek için(dolayısı ile performansın artırılması için) işletim şartlarını optimize ederek gerçekleştirebiliriz. Bu işletim şartları daha yüksek gaz basıncı, daha yüksek sıcaklık ve yakıt olarak kullanılan gaz bileşeninin değiştirilmesidir. Buna rağmen herhangi bir yakıt pili için yüksek sıcaklık veya basınçta işletme beraberinde stabilite ve duraylılık (dayanım) problemlerini oluşturur. Yakıt Pili Performans Değişiklikleri Yakıt pili performansı işletim değişkenleriyle etkilenmektedir. İşletim değişkenleri sıcaklık, basınç, sisteme yakıt olarak beslenen gaz bileşimi, reaktant kullanımı, akım yoğunluğu gibi değişkenlerden oluşmaktadır. Yakıt pili performansı ayrıca yakıt içindeki safsızlıklar, pilin ömrü gibi diğer faktörlerle de etkilenmektedir. Pratik bir sistemde bir yakıt pili uygulaması için pil parametrelerine göre işletim noktalarının esnekliği aşağıdaki grafikte (Şekil 23) gösterilmiştir. Şekil 23. Pil parametrelerine göre işletim noktalarının esnekliği Hücre işletim parametrelerinin değiştirmeyle (sıcaklık, basınç, vb.) bir fayda veya hücre üzerinde zararlı etkiye sahip bir performans elde edebiliriz. İşletim şartlarının değiştirilmesi yakıt pilinin maliyetini azaltabilir. Fakat pil dışındaki diğer sistemlerin maliyetini artırır. Genellikle uygulama ihtiyaçlarını karşılamak için işletim parametrelerinde bir uyuşma gereklidir. Bu yolla daha düşük maliyetini sistem elde edilir ve dolayısıyla kabul edilebilir bir pil ömrüne ulaşılabilir. Aşağıda verilmekte olan şekil (Şekil 24), bir önceki şekildeki bilgileri içerir fakat hücre dizaynında başka bir bakış açısını özetlemektedir. Bir yakıt pilini en yüksek akım yoğunluğunu veren tepe noktasındaki maksimum güç yoğunluğunda işletmek mantıksal olarak doğrudur (şekildeki sağ taraf). Fakat yüksek güç yoğunluklarındaki işletim, düşük pil voltajlarındaki işletim veya düşük pil verimi anlamına gelir. İşletim şartlarını güç yoğunluğunun en üst olduğu noktaya uyarlarsak bu olay kontrolde kararsız duruma sebebiyet verecektir. Pratik olan, işletmede güç yoğunluğu üst noktanın sol tarafına odaklanması gerekir. Yüksek pil verimi, yüksek voltaj veya düşük akım yoğunluklarında meydana gelir. Şekil 24. Bir yakıt pilinde voltaj ve güç yoğunluğu arasındaki ilişki Bazı Yakıt Pilleri için Elektrokimyasal Reaksiyonlar Bu bölümde polimer elektrolit membran kullanan hidrojen yakıt beslemeli ve Metanol yakıt beslemeli iki temel ve uygulamalarda en çok kullanılan sistemler üzerine durulacaktır. PEM Yakıt Pili Elektrokimyası Polimer elektrolit yakıt hücresi elektrokimyasını anlamak için, katalizör yüzeyinde olan reaksiyonları anot ve katot kısmı için göz önüne almak ve kinetik ifadeleri simültane çözmeyi gerektirir. Katotta oksijenin Pt aktif sitelerine adsorplanması ve kimyasal olarak indirgenmesi tek basamaklı gerçekleşen bir reaksiyondur. Polimer elektrolit yakıt hücresinin anot ve katot yüzeyinde eş zamanlı olarak gerçekleşen reaksiyonlar aşağıda verilmektedir: Anot yüzeyinde gerçekleşen yarı hücre reaksiyonu 2H2 → 4H+ + 4e− Katot yüzeyinde gerçekleşen yarı hücre reaksiyonu 4H+ + 4e− + ½ O2 → 2H2O Tüm hücrede gerçekleşen toplam reaksiyon 2H2 + O2 → 2H2O(sıvı) + Elektrik enerjisi ∆G= - 207 kJ/mol Anotta meydana gelen hidrojenin parçalanma reaksiyonu çok basamaklıdır ve farklı katalizörler varlığında farklı şekillerde gerçekleşir. Son yapılan çalışmalara göre platin yüzeyinde reaksiyon mekanizmasının özeti aşağıdaki gibidir. İlk olarak hidrojen platin yüzeyine adsorblanır ve daha sonra bir proton ve elektron açığa çıkar. 2Pt + H2 → 2Pt-H 2Pt-H → Pt + H+ + e− Eğer hidrojen yakıtı ile beraber ortamda bir miktar CO varsa (genelde istenmez) ya platin katalizörü zehirlenir ve aktif özelliğini kaybeder veya CO gazı da aşağıdaki reaksiyona göre elektro-katalitik olarak oksidayona uğrayarak CO2 gazı, proton ve elektron ürünlerini açığa çıkarır. Pt + CO → Pt-CO Pt-CO + H2O → Pt + CO2 + 2H+ + 2e− Doğrudan Metanol Yakıt Pili Elektrokimyası Yakıt hücresinde reaksiyonlar anot-katot kısmında eş zamanlı olarak, iletken difüzör tabakası ile polimer elektrolit membran arasındaki katalizör tabakasında gerçekleşir. Bu reaksiyonlar elektrokimyasal olarak gerçekleştiklerinden reaksiyon hızı aktivasyon enerjisi bariyerine bağlıdır. Elektrokimyasal reaksiyonun hızı birim zamanda reaksiyon sonucu oluşan elektronun miktarına bağlıdır. Faraday kanununa göre i = n× F × j Bu denklemde i; akım yoğunluğunu, n; redoks tepkimesinde transfer olan e− sayısını, F; Faraday sabitini ve j ise reaktantların akısı, mol/(s.cm2) tanımlamaktadır. Bu yüzden elektrokimyasal hız hücreye bağlanan bir akımölçer cihaz sayesinde kolaylıkla belirlenebilir. Böylece harcanan reaktantlara karşılık ne kadar akım elde edilebileceği hesaplanabilir. Doğrudan metil alkol yakıt hücresi elektrokimyasını anlamak için, katalizör yüzeyinde olan reaksiyonları anot ve katot kısmı için göz önüne almak ve kinetik ifadeleri simültane çözmeyi gerektirir. Katotta oksijenin Pt aktif sitelerine adsorblanması ve kimyasal olarak indirgenmesi tek basamaklı gerçekleşen bir reaksiyondur. Doğrudan metil alkol yakıt hücresinin anot ve katot yüzeyinde eş zamanlı olarak gerçekleşen reaksiyonlar aşağıda verilmektedir: Anot yüzeyinde gerçekleşen yarı hücre reaksiyonu CH3OH + H2O → CO2 + 6H+ + 6e− Katot yüzeyinde gerçekleşen yarı hücre reaksiyonu 3/2 O2 +6H+ + 6e− → 3H2O Tüm hücrede gerçekleşen toplam reaksiyon CH3OH + 3/2 O2 → CO2 + 2H2O ∆G= - 702 kJ/mol Anotta meydana gelen metil alkolün parçalanma reaksiyonu çok basamaklıdır ve farklı katalizörler varlığında farklı şekillerde gerçekleşir. Son yapılan çalışmalara göre platin yüzeyinde reaksiyon mekanizmasının özeti aşağıdaki gibidir. İlk olarak metil alkol platin yüzeyine adsorplanır ve daha sonra bir proton ve elektron açığa çıkar. Pt + CH3OH → Pt-CH3OH Pt-CH3OH → Pt-CH2OH + H+ + ePt-CH2OH + Pt → Pt2-CHOH + H+ + ePt2-CHOH + Pt → Pt3-COH + H+ + ePt3-COH + Pt → Pt4-CO + H+ + eBu 5 adım çok hızlı olduğundan 4 bağ kopuşu aşağıdaki tek denklemle özetlenebilir. Pt + CH3OH → Pt-CO + 4H+ + 4eBu reaksiyon denklemde verildiği gibi pratikte proton açığa çıkaramaz ve istenmeyen bir durumdur çünkü Platinden CO bağını koparmak çok zordur. Böyle bir durumda DMYH’nde karbon monoksit zehirlenmesi oluşmaktadır. Bu sebeple DMYH sadece metil alkol ile çalıştırılamaz ve daha uygun bir yöntem olan metil alkol su ile seyreltilerek sistem çalıştırılır. DMYH’ne yakıt olarak su ile metil alkol beslendiğinde anot yüzeyinde su-platinyum etkileşmesi oluşur ve bu zehirlenmeyi atlatmak için Pt-Su arasındaki aşağıdaki reaksiyon sonucu oluşan Pt-OH, Pt-CO ile tepkimeye girmelidir. Bu tepkime dolayısıyla ortamda CO2 üremektedir. Pt + H2O → Pt-OH + H+ + e- D2 Pt-CO + Pt-OH → CO2 + 2Pt + H+ + e- D3 Bu reaksiyonun gerçekleşmesi için Pt-CO ile Pt-OH’ın komşu sitelerde olması gereklidir. Aksi halde bu reaksiyon gerçekleşmez.Bu adım DMYH’nin yavaş gerçekleşen bir başka reaksiyonudur ve DMYH anot reaksiyonunda reaksiyon hızını D2 ve D3 reaksiyonları belirler. D2 ve D3 reaksiyonlarının ikisi de yavaş gerçekleştiğinden reaksiyon hızını hangi reaksiyonun belirlediği belli değildir. Açık devre voltajından 0.4 V’a kadar hücre gerilimlerinde D3 reaksiyonu baskın iken, 0.4 V altı gerilimlerde D3 numaralı reaksiyon baskındır. Bu adımlar gerçekleşirken ara basamaklarda istenmeyen reaksiyonlar ve ürünler de ortaya çıkabilir. Çalışmalar eser miktarda formik asit ve formaldehitin hücre çıkışında görülebileceğini göstermiştir. Bu sorunları gidermek için Platinin yanına D2 numaralı reaksiyonun aktivasyon enerjisini düşürecek ve bu basamağı hızlandıracak katalizörler araştırılmıştır. Bu etkiye sahip kalay, molibden, rutenyum atomları keşfedilmiştir. Rutenyum atomu diğerlerinden daha iyi performans göstermesi sebebiyle Platin atomunun yanında DMYH için genel anot katalizör olarak anılmış olsa da hala daha fazla performans elde etmek için araştırmalar devam etmektedir. PEM Yakıt Pili Teorik Analizi Diğer yakıt pili tiplerinde olduğu gibi PEM yakıt pili de, ısı makinelerinin teorik verimini sınırlayan Carnot veriminden bağımsızdır. Yakıt pilleri, geniş bir sıcaklık aralığı için ısı makinelerinden çok daha verimlidir. Bu ise yakıt pillerinin temel üstünlüklerinden birisi olarak ortaya çıkmaktadır. Bir reaksiyonda toplam enerji, Gibbs serbest enerji değişimi ve toplam entropi değişiminden oluşur. ur. ∆H reaksiyon entalpi değişimi, ∆G Gibbs serbest enerji değişimi, ∆S reaksiyondaki entropi değişimini, T ise reaksiyon sıcaklığını göstermektedir. ∆H = ∆G + T∆S (2.1) Gibbs serbest enerji değişimi; elektron hareketi ile yakıt pilinde yapılan işi (elektriksel iş) ve buna bağlı olarak elektriksel gerilimi ifade etmektedir. Buna göre yapılan iş (We ); reaksiyondaki elektron sayısı (n), Faraday sabiti ve ideal elektriksel gerilime (E) bağlı olarak ifade edilmektedir. Welektrik = ∆G = −n × F × E (2.2) Gibbs serbest enerji değişimi standart şartlar için (25 °C ve 1 atm) ∆G0 ile ifade edilir. ∆G o = −n × F × E o (2.3) Genel bir reaksiyon yazılırsa; aA + bB → cC + dD (2.4) Reaksiyona ait Gibbs serbest enerji değişimi (2.5) denklemi ile tanımlanmaktadır. P a × PBb ∆G = ∆G 0 + RT ln Ac d PC × PD (2.5) Standart şartlardaki Gibbs enerji değişimine bağlı bu denklemde; R ideal gaz sabiti, PA, PB, PC ve PD reaksiyona giren ve çıkan gazların kısmi basınçlarıdır. (2.5) denkleminde (2.2) denklemi yerine yazılırsa aşağıdaki denklem oluşur; RT PAa × PBb E=E + ln nF PCc × PDd 0 (2.6) (2.4) denkleminden itibaren denklemler PEM yakıt piline uyarlanırsa reaksiyon denklemi: H2 + ½ O2 → H2O olur. Bu reaksiyona ait Gibbs enerji denklemi ise aşağıdaki şekilde oluşur: (2.7) PH 2 × PO12/ 2 ∆G = ∆G + RT ln PH O 2 0 (2.8) Tersinir gerilim ifadesi ise aşağıdaki denklemle ifade edilmektedir: E = E0 + 1/ 2 RT PH 2 × PO2 ln nF PH 2 O (2.9) Yakıt pili teorik verimi ve teorik elektrokimyasal yakıt pili verimi ise aşağıdaki denklemlerle verilmektedir: η yp,t = η e ,t = ∆G ∆H E E0 (2.10) (2.11) Doğrudan Metanol Yakıt Pili Termodinamiği Yakıt hücresinde herhangi bir yanma meydana gelmediği için teorik olarak metil alkolün kimyasal enerjisinin tamamının elektrik enerjisine dönüştürülebileceği düşünülebilir fakat her kimyasal reaksiyonda entropi üretildiğini düşünürsek bu görüş geçerli olamaz. Reaksiyon entalpisinin ne kadar bir oranının enerjiye çevrilebileceği Gibbs serbest enerjisinde belirtilmiştir. ∆G = ∆H − T × ∆S Gibbs serbest enerjisi ifadesine göre DMYH’nde gerçekleşen reaksiyonda T∆S kadarlık bir enerji ısıya dönüştürülecektir ve bu enerji geri kazanılamaz olacaktır. 25 °C sıcaklık için DMYH anot reaksiyonun ∆G’sini hesaplayacak olursak; CH3OH (s) + 3/2 O2 (g) → CO2 (g) + 2H2O (s) ∆H = 2 × (h f ) H 2O + (h f )CO2 − (h f )CH 3OH − 3 / 2 × (h f )O2 ∆H = 2 × (−285.838) H 2O + (−393.522)CO2 − (−239.2)CH 3OH − 3 / 2 × (0)O2 ∆H = −725.98 kJ/mol ∆S = 2 × ( s f ) H 2O + ( s f )CO2 − ( s f )CH 3OH − 3 / 2 × ( s f )O2 ∆S = 2 × (70.05) H 2O + (213.80)CO2 − (126.8)CH 3OH − 3 / 2 × (205.14)O2 ∆S = −80.61 kJ/mol ∆G = ∆H − T × ∆S = −725.98 − 298.15 × (−0.08061) ∆G = 700.31 kJ/mol Bu hesaplamalara göre Metanol ile çalışan bir yakıt pili reaksiyonunda elde edilebilecek maksimum kullanılabilir enerji 700.31 kJ/mol’dür. Teorik hücre gerilimini hesaplamak için ise önce elektriksel işin tanımlanması gerekmektedir. Welektrik = q × E Bir yakıt hücresinde transfer edilen toplam yük ise, q = n× F Olarak ifade edilir. İlgili terimler yerine konursa, bir yakıt hücresinde yapılan elektriksel iş; Welektrik = n × F × E Şeklinde olur. Yukarıda belirtildiği gibi bir reaksiyondan elde edilebilecek maksimum enerji Gibbs Serbest Enerjisi kadardır. Yani, Welektrik = − ∆G Buna göre bir hücrenin teorik potansiyeli aşağıdaki gibi olur; E= − ∆G n×F Herhangi bir enerji dönüştüren cihazın verimi enerji girişi ile kullanılabilir enerji çıkışı olarak tanımlanır. Yakıt hücrelerinde yararlı enerji çıkışı üretilen elektrik enerjisidir. Enerji girişi ise metil alkol ve suyun entalpisidir. Tüm Gibbs serbest enerjisinin elektrik enerjisine çevirilerse bir doğrudan metil alkol yakıt hücresinde ulaşılabilecek maksimum verim şöyle hesaplanır: η= − ∆G − 700.31 = = 0.96464 − ∆H − 725.98 DMYH tersinir koşullarda çalıştırıldığında, tersinir hücre gerilimi ise aşağıdaki gibi olur; E= − ∆G − (−700.31) = = 1.21 V n× F 6 × 96.485