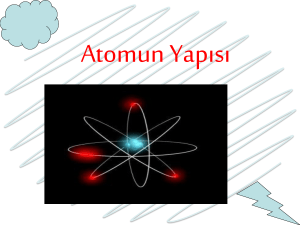
Atom ve Atomaltı Dünyası | İnovatif Kimya Dergisi
advertisement

İnsanlar doğdukları andan itibaren devamlı olarak evrenin ne olduğu ve nelerden oluştuğu konusunda devamlı olarak kafa yormuşlar ve fikir yürütmüşlerdir,öyle ki bu düşünceler yıllar boyu değişmiş ve en nihayetinde deneysel kanıtlara gelmiştir. Milattan önce bir çok filozof bu konuda kendi fikirlerini söylemiştir.Tarihte ilk filozof olarak tanımlanan Thales bu konuda şu düşünceleri ortaya atmıştır.’Her şey suda oluşmuştur ve mıknatıs demiri çeker,öyleyse mıknatıs canlıdır’ düşüncelerini ortaya atan filozof,her şeyin sudan oluştuğunu söylemiştir,oysa su ateşi söndürebilir fakat bir sel baskınını önleyemez,bu yüzden evrenin arkhesi yani tohumu su olamaz,daha sonraki yıllarda Thales’in öğrencileri Anaksimandros ve Anaksimenes bu konuda bir çok düşünce ortaya atmışlardır,bunlardan biri de Anaksimenes’in ‘hava’ düşüncesidir,fakat bu olgununda zamanla etkin olmadığı görülmüştür.Çok yıllar sonra Empedokles adında bir filozof bu düşünceleri birleştirerek (ki daha önceden Herakleitos ateş demiştir arkheye) dört unsuru elde etmiştir.Bunlar hava,su,toprak ve ateştir.Peki bunlar nasıl bir araya geliyor ve ayrılıyorlar,buna da iki unsur diyen filozof,bunları iki şekilde ayırır ; Sevgi ve nefret,bunlardan sevgi bu dört unsuru birleştirirken,nefret ise ayırmaktadır.Derken yıllar geçiyor bu unsurların gerçek olamayacağını bazı filozoflar söylüyor,bunlardan biride yunan filozofu Demokristos’tur.Evrenin çok küçük yapıdaki atomlardan oluştuğunu söyleyen filozof,bilim açısından oldukça önemli bir adım atan bu yapı,atoma olarak bilinir ki,modern atom teorisinin adı buradan gelmektedir,fakat bir ayrım yapma gerekiyor burada,Demokritos’un atomu bölünemezdir ama şimdi biliyoruz ki atom bölünüyor ve temel parçacıklarına İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. ayrılıyor.Demokritos’u atomu oldukça da durağandır,onda boşluk vardır ama hareket yoktur.Atomun boşluklu yapıda olduğunu daha sonra ünlü bilim insanı E.Rutherford söyleyecektir.Şimdilik düşünce tarihini burada bitiriyor ve bilimin teorik ve deneysel boyutuna adım atıyoruz. Şimdi ise geldik asıl konumuz olan modern atom teorisine ve bunu kronolojik olarak takip eden atom modellerine. Yıllar geçiyor,bilim ilerliyor fakat atoma dair kanıtlar nedense birikmiyordu.1805 yılında J.Dalton yaptığı bir çok deneyde direkt olarak atom hakkında değil de atomun yarattığı etkiler üzerine araştırma yapmıştır.Bunlardan biride kütlenin korunumu yasasıdır.Bir reaksiyonda girenlerin kütlesi,toplam kütleye eşit olan bu yasa daha öncede yinelenmiştir,fakat yeterli veri ve deneysel kanıt yoktu,Dalton’un diğer bir katkısı ise bir kimyasal reaksiyonda toplam kat sayılar yine toplamda aynı değeri vermektedir..Bir çok eksiği olan bu teori,Thomson’ın ufkunu açması açısından önemli bulgular taşımaktadır.Bu eksiklerden bazıları ise,atomun bölünemez olduğu ve aynı elementin atomları aynı,farklı elementin farklı,fakat bugün biliyoruz ki izotop atomlar bu duruma uyarlar. Diğer bir modelimiz ise 1900’lü yılların başına doğru atılan J.J.Thomson atom modelidir.Bu modelde elektron keşfedilmiş (1897) ve ona göre yorumlar yapılmıştır,şöyle ki Thomson atom modeli artı yüklü olup elektronlar atoma gömülü ve hareket etmez durumdadırlar.Thomson’ın atomu küre şeklinde olup elektronlar buralara rastgelen dağılmışlardır (meşhur üzümlü kek modeli) Fakat burada elektronun keşfi bilim adına önemli olduğundan bu konu üzerinde biraz duralım.Thomson 1897 yılında yaptığı bazı deneylerde (Thomson esasında kuramsalcıdır ama bu deneyleri asistanlarıyla birlikte yapmıştır.) ki bu deneyin adı katot ışınları deneyidir.(Bu deney Cavendish laboratuarında yapılmıştır.) Bir düzenek hazırlayan Thomson katot ışınlarına yüklü parçacıklar göndererek bunları sapmasına neden olmuştur,şöyle ki katot ışınları bu zıt yükte sapmış ve negatif yüklü parçacıkların olduğu konusunda hem fikir olmuşlardır.Daha sonra buna elektron denmiştir ve keşfedilen ilk atomaltı parçacıktır,özelliklerinin daha sonra uzun uzun açaçağız fakat şimdilik konuyu burada bırakıyorum. Yıllar geçtikçe bazı durumlarda eksiklikler çıkıyor ve atom hakkında söylenenler hiçte geçmişteki gibi olmadığı görülüyordu.Bu eksikliklerin bazı kısımlarını gören ünlü bilim insanı E.Rutherford 1911 yılında kendi atom modelini ortaya atmıştır.Rutherford’a göre atom içerisinde çekirdek olan ve büyük boşluğa sahip bir yapıdır.Proton ve nötronun varlığı da zaten Rutherford’tan sonra keşfedilmiştir.Bu deneyleri isterseniz biraz açalım.Rutherford yaptığı bir deney sonucu çekirdeği keşfetmiş ve güneş sistemini andıran bir model önermiştir.Rutherford’un deneyini kısaca tanımlarsak,Rutherford çinkosülfit tabakasında bir levhaya kurşun kaynaktan fırlatılan alfa parçacıkları etki etmiştir,büyük bir hızla çarpan parçacıkların çoğu levhadan geçerken,bir kısmı da daha büyük hızla geri İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. saçılmaktadır.Bunun sonucunda Rutherford şu sonuca varmıştır.Atomun içinde çekirdek denilen bir yapı vardır ve bu yapı büyük bir boşluktan oluşmaktadır. Elektron fikrini Thomson’ın ortaya atmasından sonra Rutherford’ta bu durumu birleştirerek atomun proton sayısı kadar elektron olabileceği kanısına varmıştır.Bu teorinin de eksiklerini 1913 yılında N.H.Bohr görerek kendi adıyla anılan atom modelini ortaya atarak modern kuantum teorinin zeminini atacaktır. 1913 yılında ünlü bilim insanı N.Bohr yaptığı bazı kuramsal çalışmalarda atomun hiçte Rutherford’un sandığı gibi bir yapıda olmadığını göstermiştir.Bohr’a göre atom çekirdek denilen (proton ve nötron ki nötron daha sonra Chadwick tarafından keşfedilecektir,Rutherford’un öğrencisidir aynı zamanda Chadwick) bir yapıda oluşmaktadır,elektronlar ise belli dairesel yörüngelerle çekirdeğin etrafında dolaşmaktadırlar.Fakat bu konuda bir açıklama yapmayan Bohr sadece bazı durumları klasik mekaniğe göre açıklama durumunda kalmıştır,bunlardan biride momentumdur (hızın kütleye olan çarpımı demektir)birde Bohr çok elektronlu atomları açıklayamamıştır.Bohr’un teorisi ise şu dört varsayıma dayanmaktadır. 1. Elektronlar belli bir yörüngede dururlar ve h/2π gibi bir açısal momentum oranına sahiptir. 2. Elektronlar kararlı enerji seviyesinde belli bir yörüngede hareket ederler. 3. Elektron kararlıyken ışık yayınlamaz.Anacak yüksek enerji durumundan,düşük enerji durumuna geçerse yayınlar. 4. Elektron oldukça kararlı bir yapıda bulunmak ister ve enerji düzeyi 1 olmak üzere,her enerji düzeyi t gibi + gibi bir tam sayıya denk gelir. Bugün artık biliyoruz ki,modern atom teorisi bu dört atom modelinden hiç biri değildir,sadece bir yaklaşımdır ve eksiklikleri vardır.Bu eksiklikler nedir,buna da başka bir yazımızda kuantum atom modelinde değinebiliriz,konuyu şimdilik burada bırakıp atomaltı parçacıkları dünyasına giriş yapıyorum. İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. Atomaltı Dünyası J.Dalton’un atom hakkında söylediklerini daha önceki bölümden biliyoruz.J.J.Thomson yaptığı bir çok deney sonucunda nihai parçacık olan elektrona ulaşmış ve bu durum modern atomun temeli olarak önemli bir adım olarak görülmüştü.Cavendish laboratuarında keşfedilen bu parçacık,aynı zamanda keşfedilen ilk atom altı parçacıktır.Elektron üzerinde biraz duracak olursak,elektron leptonlar grubu bir parçacığıdır.1897 yılında J.J.Thomson tarafından keşfedilen bu parçacık oldukça hafif ve zayıf bir yüke sahiptir.Sayısal olarak ise şu değerlere sahiptir; Kütlesi:9,1091.10-²⁸ g Yükü ise=1,6021.10-¹⁹ Elektron elektromanyetik kuvvetle çekirdeğe bağlanmıştır ve bütün kimyasal olaylar bu parçacık tarafından gerçekleştirilir. Protona dönecek olursak,proton çekirdeği oluşturan ve kuarklarca bir araya gelip oluşan bir yapıdır.İki yukarı bir aşağı kuarktan oluşan proton bir fermiyondur yani spini kesirlidir.Protonun keşfi ise atomun nötr olduğu düşüncesinden çıkmıştır.Eğer ortamda bir denge söz konusu ise,birde bunu dengeleyen durum olmalı,bu durumun adı da protondur.E.Goldstein 1886 yılında yapılan deney sonucu bu yüklü parçacığa kanal ışınları demiştir,Bu isim daha sonra E.Rutherford tarafından 1920 de değiştirilerek ve daha kapsamlı olarak belirlenerek proton adı verilmiştir.Kütlesi elektrondan 1836 kat daha büyük olan bu yapı aynı zamanda radyoaktivitede büyük görev almaktadır. İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. (İki yukarı,bir aşağı kuarktan oluşan proton ) Çekirdek ve nötrona gelecek olursak,çekirdek atomun merkezinde küçük bir hacme sahip pozitif yüklü atomaltı bir parçacık bütünüdür (hadron). Çekirdeği daha öncede hatırlayacağımız gibi E.Rutherford keşfetmiş,alfa parçacıkları saçılması esasında dayanan bu durum,çekirdeğin varlığını onaylamıştır. Nötron ise yüksüz bir atomaltı parçacıktır.İki aşağı ve bir yukarı kuarktan oluşan bu yapı,atomun çekirdeğinin bir parçasıdır.Chadwick tarafından 1932 yılında keşfedilen nötron ,protondan hafif elektrondan ağır bir parçacıktır,radyoaktif bozunmaların çoğu burada gerçekleşmektedir. (iki aşağı,bir yukarı kuarktan oluşan nötron) Kuarklar Kuarklar maddenin yapıtaşını oluşturan proton ve nötronun yapı birimleridir.Proton iki yukarı bir aşağı kuarktan oluşur,nötron ise iki aşağı bir yukarı kuarktan oluşur ve bunlar birer baryon ailesidir.(Baryonlar 3’lü kuarklara denir ve bunlara proton,nötron,ksi ve omega İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. örnektir.) Bir fermiyon olan baryonlar proton hariç tamamı kararsızdır ve bozunarak diğer parçacıklara ayrışırlar.Nötron ise iki aşağı bir yukarı kuarktan oluşur ve bir baryondur.Peki bu kuarklar nasıl bir arada duruyor? Bununda yanıyı gulondur ,tutkal anlamına gelen bu yapı,merkezden uzaklaştıkça çekim arttığından bu derece bir enerjiye sahip bir hızlandırıcı şimdilik bulunmuyor.Peki kuarkların varlığından nasıl bu kadar emin olabiliyoruz ? bununda cevabı;Protonları elektronlarla bombardımana tabi tutulduklarında oluşan durumun 3 tane parçacığın topaklandığıdır.Bu kuarkların hangi kuarklara ait olduğunu nereden biliyoruz soruna da yanıtımız;kuarkların davranışları ve bozunma hızlarıdır. Kuarkla aynı orbitaller gibi kuantum sayılarına sahiptirler.Bunlar renklerdir yani her kuantum sayısının bir rengi vardır,kırmızı,mev,yeşil olarak adlandırılan bu renk isimleri esasında kuarklara renkli oldukları için konulmamıştır,sadece bazı durumları daha iyi açıklayabilmek için bu renk isimleri verilmiştir. Birde kuarkların hapsi var,bu da kuarklara belli derecede enerji verilirse burada kuarkları ayıran diğer bir sanal parçacık araya girer ve bu kuarkları tekrar başka kuarklara yönlendirir ve bu kuarklar arasında kümelenmeler oluşur,işte bu kümelere ‘kuark hapsi’ denir ve kuarkları merkeze doğru büyük bir kuvvetle çeker,bu kuvvet taşıyıcısının adı da gluondur,gluonda İngilizcede glue yani tutkal kelimesinden gelmektedir. Kuarkların bir diğer etkileşimi ise iki kümelerdir,bunlar mezonlardır,bir kuark birde anti kuarktan oluşan bu yapılar birer bozundur yani spinleri tam değerdir.Baryonlar ve mezonları bir araya getiren yapıya da hadronlar diyoruz. Kuarkları spinlerine göre sıralayacak olursak; Kuark Spin Alt -1/3 Üst +2/3 Tılsımlı +2/3 Acayip -1/3 Aşağı -1/3 Yukarı +2/3 Mezonlara diğer bir örnek ise pion,kaon ve etadır.Yukowa yaptığı bir çok kuramsal çalışmada protonla nötron arasında orta kütleli bir parçacığın olabileceği düşüncesini ortaya atmış,daha sonra buna mezo yani orta anlamında mezon adı verilmiştir.Yukowa’nın önerdiği mezon ise kararsız bir parçacık olan pion’dur İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. Mezonlar ve baryonlar birleşerek hadronları oluşturur demiştik,mezonlar bir kuark birde anti kuarktan oluşurlar yani birer bozondurlar hatırlanacağı gibi.Pion,kaon,eta bunlara örnektir ve eta hariç hepsi kararsızdırlar.Baryonlar ise proton,nötron,omega,ksi,lamda gibi parçacıklardan oluşmuşlardır,bunlarda 6 çeşit kuarkın spin istatistiğine uyan durumlarını ifade eder ve kuantum spin kuramına uyarlar ve birer fermiyondurlar.Fermiyon ise,fermidirac istatistiğine uyan parçacıklardır yani aslında parçacıklar iki gruba ayrılılar,fermiyon ve bozon,fermiyonlar aynı zamanda kesirli spinlidir.Daha doğrusu leptonların ve kuarkların hepsi birer fermiyondur.Işık yani foton ve higgs bozonu (maddeye kütle kazandıran parçacıktır aynı zamanda) bozonlara birer örnektir.Bozon ise,Bose-Einstein istatistiğine uyarlar ve spinleri tam sayılardır,foton graviton buna örnektir. Leptonlar Leptonlar ise 6 çeşit parçacığın ve bunların antiparçacıklarından oluşur,bunlar elektron,elektron nötrinosu,müun,müon nötrinosu,tau ve tau nötrinosudur,en ağır lepton ise tau,en hafif olanı elektrondur,leptonlarda zaten kelime anlamı ‘zayıf,küçük’ demektir.Lepton ismi ise ilk olarak 1948’de fizikçi L.Rosenfels tarafından kullanışmıştır.Müon ilk kez 1936 yılında C.D.Anderson tarafından,bir nötriona olan müon nötrinosu ise 1962 yılında L.M.Lederman,M.Schwatz ve J.steinberger tarafından,yine bir nötrino olan tau nötrinosu ise 1974 ile 1977 yılları arasında M.L.Perl adında bir fizikçi tarafından keşfedilmişlerdir. Bunun dışında elektron ve elektron nötrinosu var,bunlarda bazı olaylardan sorumludurlar,bunlar; Elektron nötrinosu:Her saniye vücudumuzdan geçer Elektron ise daha öncede söylediğimiz gibi,kimyasal olaylardan sorumludur.Bütün leptonların spinleri ½ dir yani hepsi birer fermiyondur. Birde skyremiyonlar var,bunlar ise bozonlardan oluşmuş fermiyonlardır,yani bozon tam bir spin hareketi yapamaz,bunun yerini fermiyon alır ve yarım şekil yaparak hareketini tamamlar,bu duruma da skyrmiyon denir.Bu kuram bozonların fermiyon gibi davranmalarını açıklar. Atomaltı parçacıkların çoğu örneğin neredeyse kozmik ışınlardan elde edilir ve yeryüzünden neredeyse yok denecek kadar azdırlar. Bunları dışında birde antiparçacık-parçacık ikilemi var,bu da kuantum mekaniğinin temellerini atan Dirac tarafından ortaya atılmıştır ve daha sonra ise doğrulanmıştır.ilk antiparçacık elektronun karşı parçacığı olan pozitrondur.1932 yılında bulunan bu parçacık daha sonra antiparçacık olgusunu daha da genişletmesi adına önemli bir adımdır. İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. Doğada her parçacığın birde antiparçacığı olduğuna inanılıyor,peki her parçacığın bir antiparçacığı varsa bu iki durum neden kendini yok etmiyor? Bununda yanıtı,burada parçacık durumu antiparçacıktan daha fazladır ve bu durum diğer parçacığı yok edip enerjiye çevirmiyor. Bunun dışında sürpriz bir parçacık olan nötrino W.Pauli tarafından 26 yıl önce ortaya atılmış ve daha sonra bu doğrulanmıştır.Bunu da şu sözleriyle tamamlayan Pauli oldukça mutlu olmuştur bu durumdan ‘Her şey beklemeyi bilen kişiye sonunda gelecektir.’ Ve sözleriyle tamamlamıştır. Nötrinoya gelecek olursak,nötrino beta bozunması sonucu açığa çıkan yüksüz ve bulunması oldukça zor bir parçacıktır,ilk sürpriz yaptı dediğimiz parçacıktır,daha sonra bunları pozitron,müon,pion,sigma,hiperon ve delta takip etmiştir. Doğadaki temel kuvvetlere gelecek olursak,bu kuvvetler dört gruba ayrılmaktadır,bunlar; Temel Kuvvetler Kuvvet Taşıyıcısı Güçlü etkileşim Gluonlar Zayıf etkileşim W+,W-,W⁰ Elektromanyetik kuvvet Fotonlar Kütleçekim Graviton Kuvvet taşıyıcıları birer bozondur yani maddenin yapıtaşları değillerdir,bu yüzden madde etkileşmelerinde yerleri yoktur graviton ise bulunması şimdilik zor görünen bir parçacık ki,bunun için fizik kuralları geçersiz kalır diyor bazı kaynaklar diyerek yazımızı da burada sonlandırıyoruz,vakit ayırıp okuyan tüm dostlara canı gönülden teşekkür ederiz.Başka bir yazımızda görüşmek üzere,esen kalın. Kaynaklar 1. Parçacık Fiziği En Küçüğü Keşfetme Macerası – Sezen Sekmen (ODTÜ Geliştirme Vakfı Yayıncılık ) 2. Yrd.Doç.Dr.Soner Ergül – Genel Kimya (Anı Yayıncılık-2009) 3. http://tr.wikipedia.org/wiki/Atom 4. http://tr.wikipedia.org/wiki/Kuark 5. http://tr.wikipedia.org/wiki/Lepton 6. http://www.yaklasansaat.com/evren/temel_parcaciklar/temel_parcacik.asp 7. http://www20.uludag.edu.tr/~epilicer/kuvvet.html#gravitasyonel 8. http://tr.wikipedia.org/wiki/Par%C3%A7ac%C4%B1k_fizi%C4%9Fi 9. http://tr.wikipedia.org/wiki/Standart_Model İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz. 10. 11. 12. 13. 14. 15. 16. 17. http://www.zamandayolculuk.com/cetinbal/atomaltiparcaciklar.htm http://tr.wikipedia.org/wiki/Renk_hapsi http://tr.wikipedia.org/wiki/Dalton_Atom_Modeli http://tr.wikipedia.org/wiki/Thomson_atom_modeli http://tr.wikipedia.org/wiki/Rutherford_atom_modeli http://tr.wikipedia.org/wiki/Bohr_modeli http://w2.anadolu.edu.tr/aos/kitap/IOLTP/2279/unite12.pdf http://eogrenme.anadolu.edu.tr/eKitap/FEL101U.pdf Yazar : İsmail ÇELİK Üniversite : Abant İzzet Baysal Üniversitesi Bölüm : Kimyager Dergi : Sayı 1– Sayfa 25 Yorumlar İnovatif Kimya Dergisi kaynak gösterilmeden paylaşılamaz.