enzim
advertisement

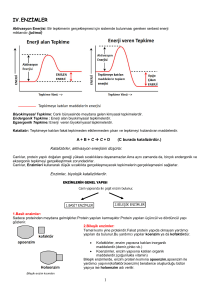
29 Mart 2010 ENZİMLER VE KİNETİĞİ AINOUR AMET 620050036 1- TARİHÇE • • • • • • • 1800 yılların başında “sütün ekşimesi, şekerin alkole fermantasyonu gibi” olayların canlı organizmalar aracılığı ile oluştuğu düşünülürdü. 1833’de şekeri parçalayan aktif madde kismi olarak saflaştırıldı ve DİASTAZ (şimdi amilaz)olarak adlandırıldı.Kısa bir süre sonra diet proteinlerini parçalayan bir madde, gastrik sıvıdan izole edilerek pepsin olarak adlandırıldı. 1850’lerde LOUİS PASTEUR maya tarafından şekerin alkole dönüşmesinde “FERMENTLER” diye tanımladığı ve canlı organizmada bulunan maddeler yardımı ile oluştuğunu ileri sürdü. 1878’ de ilk olarak KÜHNE tarafından ENZİM terimi önerildi. Enzim yunanca da “maya’da” anlamı taşıyan enzume (έγξνμη) den gelmektedir. 1897’de EDUARD BUCHNER hiç canlı hücre içermemesine rağmen maya hücresi özütü eklendiğinde şekerin fermante olduğunu göstermesi bu görüşü ortadan kaldırmıştır. 1926’da SUMMER soyadan ÜREAZ’ı kristallendirmiştir. Sonra ki yıllarda saflaştırılan ve kristal yapıları incelenen enzimlerin çoğunun (protein) yapısında oldukları belirlenmiştir. ENZİM ; Biyolojik sistemlerde kimyasal tepkimeleri katalizleyen ve tepkime sonunda yapıları değişmeyen moleküllere enzim denir.Bir hücredeki hemen her kimyasal olaylar(reaksiyonlar) enzimler aracılığıyla gerçekleştirilir. Katalizörlere nispetle daha karmaşık ve daha yeteneklidirler.Katalizörlerde birden fazla ürün oluşurken enzimlerin olduğu yerde ürün tektir. ENZİM 1.1 ENZİMLERİN ÖZELLİKLERİ 1-Enzimler protein yapısında maddelerdir. Enzimler kolaylıkla denatürasyona uğrarlar. D Proteinlerin doğal yapılarının bozulması sonucunda aktivitelerinin bozulmasıdır. 2-Enzimler özgül molekülerdir. Enzimler yalnız belirli reaksiyonları katalizledikleri ve sadece substratları ile etkileştiklerinden dolayı spesifik (özgül ) maddelerdir. 3-Enzimler katalitik etkinliğe sahiptir. Enzimle katalizlenen reaksiyonların çoğu katalizlenmeyen reaksiyonlara göre 103 - 108 kere daha hızlı gerçekleşmektedir. Enzimin dönüşüm sayısı (Turnover sayısı); Enzim molekülü tarafından bir saniyede ürüne çevrilen substrat molekülü sayısıdır. Bu 0 C°’de katalaz enzimi için 5.000.000 dür. 4. Substrat –ürün dönüşümleri çift yönlü olabilmektedir. 5. Biyokimyasal reaksiyonları düşük enerji ve vücut ısısında gerçekleştirirler. 2 H2O2 2H2O + O2 1 mol Hidrojen peroksit’in kendi kendine yıkılması için 18000 kal Enerjiye ihtiyaç vardır. KATALAZ bu reaksiyonu 2000 kal’ik Enerji ile yapabilmektedir. 1.2 REAKSİYONLARDA ENERJİ PROFİLİ Geçiş durumu Serbest aktivasyon 0 T enerjisi (katalizlenmemiş) Serbest aktivasyon enerjisi (katalizlenmiş) Serbest enerji A Başlangıç durumu (reaktanl ar) B Son durum (ürünler) Reaksiyonun akış yönü Grafikte görüldüğü gibi enzimler reaksiyona girerek reaksiyonun aktivasyon enerjisini düşürerek reaktanların ürünlere dönüşmesine yardımcı olular. Eğride enerjinin en yüksek olduğu noktada E-S kompleksinin oluşumu kolaylaşır ve DG nin yaklaşık 10 kat küçülmesine yani reaksiyon hızının yüz milyon kat artmasına yardım eder. 1.3 ENZİMLERİN YAPISI Protein Kısmı ( Apoenzim kısmı): Enzimin protein yapıdaki kısmına apoenzim denir. Apoenzim kısmıyla enzim çeşitliliği sağlanır.Bunun nedeni aminoasit sırası ve yapısının apoenzim kısmıyla ilişkili olmasındandır. Enzimin türünü ve etkileyeceği substrat maddesini apoenzim kısmı tarafından belirlenir. Apoenzimler tek başına reaksiyonu gerçekleştiremez, ancak koenzim kısmıyla aktifleşerek reaksiyonu gerçekleştirirler. Koenzîm Kısmı: Koenzim ise enzime katalitik aktivite özelliği veren yani enzimin katalizör görevi görmesini sağlayan kısımdır.Koenzimler apoenzimlere göre daha küçük maddelerdir. Bir apoenzim sadece bir koenzimle çalışırken, bir koenzim birden fazla apoenzimle çalışabilir. Enzimler yapı olarak iki kısımda incelenir. Basit enzimler ve bileşik enzimler 1.3.1.Basit Enzimler: Sadece proteinden meydana gelmiş enzimlerdir. DNA’ daki bilgiye göre sentezlenirler. Bu kısım enzimin hangi maddeye etki edeceğini saptar. Basit enzimlere pepsin,lipaz,üreaz gibi enzimler örnek verilebilir. 1.3.2.Bileşik Enzimler: Bileşik enzimler iki kısımdan meydana gelir. Protein + Vitaminler Protein + Mineral maddeler veya metal iyonlarıdır. Koenzimlerin pek çoğunun yapısı vitamindir. Örneğin, B grubu vitaminleri koenzimlerin büyük bir kısmını oluşturur. Koenzim kısmı inorganik maddelerden (Ca ++ ,Mg + ,Zn ++ ,K+) oluşabilir. Enzimde işlev gören ve esas iş yapan kısım bu kısımdır . Metal iyonları (Mn, Cu, Zn, Fe gibi) ve mineral maddeler gibi kısımlarınada enzim aktivatörleri denir. Koenzimiyle beraber olan apoenzime holoenzim denir, bu o enzimin aktif halidir. Bileşik enzim (Holoenzim)’in Yapısı 1.4 ENZİMLERİN AKTİF BÖLGESİ Enzim moleküllerinde aktif bölge ismi verilen özel bir boşluk yada cep kısmı bulunur. Aktif bölgedeki aminoasidlerin yan zincirleri ,substratın yapısına uyumlu, üç boyutlu bir yapı oluşturmaktadır. Aktif bölgenin substratı bağlamasıyla oluşan enzim –substrat kompleksi (ES) önce, enzim-ürün kompleksine, daha sonra ise serbest enzim ve ürüne dönüşmektedir. Enzim ile substrat birbirlerine hidrojen elektrostatik ve wan der waals bağları gibi non kovalent(zayıf) bağlarla bağlanırlar. ENZİM AKTİF MERKEZİ Enzimin üç boyutlu bilgisayar görüntüsü, enzimin yapısını ve aktif bölgede, substratın yerleşeceği oyuk kısmı göstermektedir. (en üstte) ENZİM AKTİF MERKEZİ 1.5 ENZİMLERİN ÇALIŞMA MEKANİZMASI Enzim ile substrat bağlanmasında iki model ileri sürülmektedir. 1. Model : Anahtar-kilit modeli 1894 Emil Ficher 2. Model : İndüklenmiş uyum oluşturma modeli 1958 Daniel Koshlan Substrat bağlanması, aktivasyonu ve reaksiyon enzim aktif merkezinde gerçekleşir. Substrat bağlanma enerjisi 3-12 kcal/mol 1.6 ENZiMLERiN SINIFLANDIRILMASI Enzimler etki ettiği maddenin sonuna "ase=az" eki getirilerek ya da katalizlediği tepkimenin çeşidine göre adlandırılırlar. Örn: Nişasta Amilaz Yağ Lipaz Protein Proteaz Bu kurala uymayanlar ; Pepsin,tripsin, pityalin gibi. Katalizledikleri reaksiyon tipine göre; Oksidaz ,dekarboksilaz ,vs • 1.6.1.Oksidoredüktazlar: Redüksiyon-oksidasyon reaksiyonlarını katalize etmekle sorumlu enzimlerdir. • 1.6.2.Transferazlar: Hidrojenin dışında bir atomun veya atom grubunun (metil, karboksil, glikozil, amino, fosfat grupları) bir molekülden diğerine aktarılmasını sağlarlar. AB + C → A + BC • 1.6.3.Hidrolazlar: Bir molekül su sokmak suretiyle ya da su molekülü aracılığıyla moleküllerin yıkılmasını sağlayan enzimlerdir. AB + H2O AOH + H • 1.6.4.Liazlar: Su açığa çıkarmadan molekülleri yıkan enzim çeşitidir.Örneğin C-C bağı , aldolaz ve dekarboksilazla yıkılır. AB A+ B 1.6.5.İzomerazlar: Molekül içerisinde atomların yerlerini değiştiren enzimlerdir. (Glukoz 1 fosfat Glukoz 6 fosfat gibi) ABC ACB 1.6.6.Ligazlar (Sentetazlar): Yüksek enerjili fosfatların enerjisini kullanarak,karbon ile C,O,S,N arasında bağ oluşumunu katalizleyen enzimlerdir. (Glutamik asit + NH3 + ATP Glutamin + ADP + Pi) A + B + ATP AB + ADP + Pi 2-ENZİMLERİN KİNETİĞİ Enzim kinetiği, enzimlerin substratlarına bağlanmasını ve onları ürüne dönüştürmesini araştıran bilim dalıdır. Kinetik analizlerde kullanılan hız verileri enzim ölçümlerinden elde edilir. Enzim tepkimelerinin iki aşamalı olduğu bilinmektedir. Birinci aşamada substrat enzime tersinir olarak bağlanıp enzim-substrat kompleksini oluşturur. Enzim sonra tepkimenin kimyasal adımını katalizler ve ürünü salar. 2.1 Enzim Aktivitesinin Ölçülmesi: Her enzimin aktivitesi kendine özgüdür. Etkinliği veya aktivitesi fazla olan bir enzim, belirli bir sürede daha fazla substrat molekülünü ürün haline dönüştürür. En çok kullanılan enzim aktivitesi birimi, IU’dir. IU enzim aktivitesi, optimal koşullarda, 1 dakikada 1µmol substratı değiştiren enzim etkinliğini ifade eder. 2.2 ENZİM AKTİVİTESİNİ ETKİLEYEN FAKTÖRLER 1-Ortam pH’ı 8-Diğer faktörler 2-Sıcaklık 7-İyonların derişimleri özellikleri 3-Enzim kons. 6 –Reax. ürünü 4 -Substrat 5 -Zaman 2.2.1- pH Genellikle her tip proteinin en iyi iş gördüğü belli bir pH değeri vardır. Bu değeri de o proteinin moleküler yapısı belirler. Örneğin midedeki enzimler, midenin asidik ortamında çalışabilirken pankreastan salgılanan ve yine protein sindiriminde rol alan tripsin, ancak 8,5 pH'de optimum olarak çalışabilir. 2.2.2 SICAKLIK Sıcaklığin artırılması moleküllerin hem kinetik enerjisini hemde çarpışma sıklığını artırarak tepkimeye giren molekül sayısını artırır. Enzim tepkimelerinde sıcaklığın her 10°C artışıyla tepkime hızı 1-3 kat artar. Hayvansal kaynaklı enzimler genellikle optimum ısıya ancak 40-50° C arasında, bitkisel kaynaklı enzimler ise genellikle 50-60°C arasında erişirler. Enzimler genellikle protein yapıda oldukları için sıcaklıktan etkilenirler. Bu yüzden enzim etkinliği belli bir sıcaklıktan sonra düşmeye başlar ve proteinler bozunduğunda da tamamen sona erer. Enzim Hızı – Sıcaklık İlişkisi 2.2.3 ENZİM /SUBSTRAT DERİŞİMİ Substrat yoğunluğu, tepkime hızını etkileyen etmenlerden biridir. Substrat yoğunluğu arttırıldığında tepkimenin hızı bir süre artar. Fakat daha sonra tepkime hızının sabit kaldığı gözlenir. Bunun sebebi enzim moleküllerinin hepsi bir substrata bağlı durumda bulunurlar, birini bıraktıkları anda diğerine bağlanırlar, sonuçta daha fazla substrat eklemenin bir anlamı kalmaz. Teorik olarak düşünüldüğünde ortamda ne kadar çok enzim olursa tepkimenin hızının o kadar artması beklenir. Yeterli miktarda substrat olduğu sürece tepkime hızının zamana göre artış grafiği doğrusal olur. Enzim hızı –Substrat konsantrasyonu İlişkisi Enzim Hızı–Enzim Konsantrasyonu İlişkisi 2.2.4 ZAMAN Enzimle katalize edilen reaksiyon hızı zamanla azalır. Bunun nedeni: reaksiyon ürünleri kendi aralarında birleşerek ters yöndeki bir reaksiyonu meydana getirmeleri, enzimin zamanla inaktive olması, reaksiyonu önleyen maddelerin oluşması ve nihayet substratın tükenmesidir . 2.2.5 DİĞER FAKTÖRLER Işık enzim aktivitesini artırır veya azaltır. Kırmızı ve mavi ışık, tükürük amilazı ve diğer bazı enzimlerin aktivitelerini artırır. Ultraviyole ise azaltıcı etki eder. 2.2.6 SU DERİŞİMİ Su derişimi de enzim etkinliğini değiştirir. Su derişimi %15 in altındaki ortamda enzimler görev yapamaz ye sahiptir. 2.3 MİCHAELİS-MENTEN EŞİTLİĞİ 1913 yılında Michaelis-Menten tarafından hız (Vo ilk hız) ve [S] arasındaki ilişkiyi matematize ederek Km gibi Enzim ve substrat arasındaki ilişkiyi veren sabit bir değer bulunmuştur. Böylece Michaelis-Menten eşitliği Enzim miktarı ile ilişkili bir reaksiyonun hızının ölçülmesine olanak sağlamıştır. Michealis-Menten kinetiği tek substratlı reaksiyonlar için geçerlidir. Her enzimin belli bir substrat için karakteristik bir Km değeri vardır, bu değer substratın enzime ne derece sıkıca bağlandığını gösterir. Reaksiyon hızının (Vo) substrat konsantrasyonuna S karşı grafiğe çizilince hiperbolik bir şekil elde edilir .Fakat allosterik enzimler sigmoidal eğri gösterir Tek S’li bir enzimin katelizlediği reaksiyon E + S k1 ES k3 E + k2 k1 hızıyla oluşan [ES] kompleksi daha sonra 2 akıbete uğrar: 1- k2 hızıyla yeniden E ve S’ye dönüşür. 2- k3 sabit hızıyla ürün [Ü] oluşurken enzim de sertleşerek ilk haldeki yapısını kazanır. ES oluşum hızı = k1 [E] [S] ES yıkılım hızı = (k2+k3) [ES] P Michaelis - Menten denklemi kurulurken aşağıdaki varsayımlar göz önünde tutulur: Substrat konsantrasyonu [S], enzim konsantrasyonundan [E] çok daha fazladır. Böylece belli bir zamanda enzime bağlı olan substrat miktarı ihmal edilebilir. Denge durumunda ES kompleksinin oluşum ve yıkılım hızları birbirine eşittir. k1 [E] [S] = [ k2 + k3 ] [ES] (1) [ES] = [E] [S] (2) (k2+ k3) / k1 KM (mol /L) = k2+ k3 k1 MİCHAELİS –MENTEN EŞİTLİĞİ Belirli bir andaki kataliz hızı: Vi = Vmax [S] [S] + KM Km Michaelis Menten sabitidir. Michealis menten sabiti bir enzime ve belirli bir substrata özeldir ve o enzimin substrata olan ilgisini yansıtır. Küçük Km: Sayısal olarak küçük Km enzimin substratına karşı ilgisinin yüksek olduğunu gösterir.. Büyük Km: Sayısal olarak yüksek Km, enzimin substratına karşı olan ilginin düşük olduğunu gösterir. 2.4 LİNEWEAVER –BURK EŞİTLİĞİ • • • Michaelis-Menten denklemi hiperbolik bir eğrinin denklemidir. Bu denklem tersine çevrildiğinde düz eğri elde edilir.(Lineweaver-Burk eğrisi) Düz eğrinin çizilmesi ile KM ve Vmax değerlerinin duyarlı bir biçimde belirlenmesini kolaylaşmaktadır. Bu doğru ayrıca enzim inhibitörlerinin etki mekanizmalarının saptanmasında kullanılır. Lineweaver-Burk Çift Resiprok Eğrisi • • • • • 1 = KM × 1 + 1 Vi Vmax [S] Vmax Lineweaver-Burk Eğrisi Denklemi KM Değerinin Bilinmesinin Önemi: Enzimlerin saflaştırılması Dokularda enzim aktivitesinin saptanması İlaç imalatında Enzim inhibitörlerinin belirlemesi 2.5 ENZİM İNHİBİSYONU Enzim inhibitörleri katalizi etkileyen (reaksiyonu yavaşlatan veya durduran) maddelerdir. Enzimler genel olarak tersinir ve tersinmez şekilde inhibisyona uğrarlar. Tersinir İnhibisyonlar 3 ‘e ayrılır; 2.5.1 Kompetitif inhibisyon (yarışmalı): Kompetetif inhibitör, enzimin aktif bölgesi için substratla yarışırlar. İnhibitör, aktif bölgeyi işgal ettiğinde, substratın enzime bağlanması engellenmektedir. Kompetetif inhibitörler, genellikle substratta benzerlik gösteririler ve enzim inhibitör(El) kompleksini oluşturmak üzere enzimle birleşirler. Yarışmalı inhibisyonda maksimal tepkime hızı değişmez, ama belli bir hıza ulaşabilmek için daha yüksek substrat konsantrasyonu gerekir, dolayısıyla görünür Km artar . Kompetitif inhibisyon (yarışmalı) 2.5.2Unkompetetif inhibisyon(yarı yarışmalı): İnhibitör aktif bölgenin dışında bir yere bağlıdır ve kompetetif inhibitörden farklı olarak inhibitör yalnız ES kompleksine bağlanır. Bu tür inhibisyon tek substratlı tepkimelerde seyrek, çok substratlı tepkimelerde ise daha sık görülür. 2.5.3Non kompetetif inhibisyonlar (yarışmasız): İnhibitör aktif bölge dışında bir yere bağlanır , ancak inhibitör serbest enzime ya da ES kompleksine bağlanır. 2.5.4 Tersinmez İnhibisyonlar; İnhibitör enzimin aktif bölgesine kovalent olarak bağlanır ve dializ,tuz çözeltisiyle veya deterjanla muamele gibi işlemlerle ayrılmazlar yani enzim aktifliğini tamamen yitirir (zehirlenme). Tarımda insektisit (böcek öldürücü) olarak kullanılır (bunlar insanlar için öldürücü toksik maddelerdir). Bu tür bileşiklerden olan eflornitin, parazitik hastalık olan uyku hastalığının tedavisinde kullanılır. 2.6 ENZiM iMMOBiLiZASYONU İmmobilizasyon: Suda çözünen ve çözeltide serbest hareket edebilen enzim moleküllerinin suda çözünmeyen destek görevi gören materyaller yardımıyla suda çözünmez forma dönüştürülmesi işlemidir. Enzimlerin sadece bir kere kullanilmalari, pahali olmalari nedeni ile büyük masraflara neden olmaktadir. Bu nedenle immobilize olarak defalarca kullanilmalari ekonomik olarak daha makul olmakla birlikte enzimatik prosesler sürekli olarak da yapilabilmektedir. 2.6.1 İMMOBİLİZASYONUN AVANTAJLARI Enzim immobilizasyonunun baslica avantajlari sunlardir: 1-Özellikle üretimi zor ve pahalı enzimler için bu önemlidir. 2-Ürün enzimle kontamine olmaz, çünkü enzim matrikste tutulur. 3-Matriks enzimi fiziksel bir bariyer olarak koruduğundan, enzim ekstrem pH ve temparatür gibi etkilere dayanıklı hale gelir. 4-Sürekli fermentasyonlar için enzimi daha kullanışlı hale getirir. 5-İmmobilize enzimler çok daha doğru bir şekilde kontrol edilirler. Enzimleri immobilize etmek için bir çok yöntem geliştirilmiştir. Bu yöntemler şunlardır; 1-Kovalent bağlama: Enzimler kimyasal olarak kovalent bağlarla selüloz, sefadeks, agaroz, poliakrilamid, porlu seramik gibi suda çözünmeyen taşıyıcılara bağlanırlar. 2-Çapraz bağlama: Enzimler glutaraldehit, alifatik diaminler gibi bifonksiyonel reaktiflerle çapraz bağlanırlar. Bu reaktifler enzim molekülleri arasında bağ oluştururlar. 3-Adsorbsiyon: Enzim moleküllerinin taşıyıcıların yüzeyine adsorblanmaları esasına dayanır. Kolay bir yöntemdir. Agaroz, sefadeks türevleri, selüloz türevleri, metal tuzları ve mineraller adsorban olarak kullanılırlar 4-Tutuklama: Enzimler yapay ya da doğal polimer kafesleri içinde tutuklanırlar. Polimer kafesler içine substrat girer ve ürün dışarı çıkar. Çapraz bağlı poliakrilamid jeller, Ca alginat, kappa karragenan bu polimerlerin örneklerindendir 5-Kapsülleme: Enzimler, çeşitli tipteki membranlar içine alınırlar. Bu membranlar yarı geçirgendir. Düşük molekül ağırlıklı substratı ve molekülleri geçirirler. Hegza metilen diamin mikrokapsüllemede kullanılar. Tutuklama Kapsülleme 2.7 ENZİMLERİN UYGULAMA ALANLARI Kağıt endüstrisi Amilaz, Ksilanaz, Selulaz ve ligninazlar Nişasta endüstrisi Amilazlar, amiloglucosideazlar ve glukoamilazlar Et yumuşatması Papain Süt endüstrisi Genç geviş getirici hayvanların midesinden elde edilen Rennin Nişastanın daha düşük viskozteye indererek kağıdın şekillenmesi ve kaplanmasını kolaylaştırır. Nişastayı glukoza ve çeşitli şuruplara dönüştürür. Pişirilecek etin yumuşamasını sağlar. Peynir üretimi, proteinin hidrolizi için. Biyolojik çamaşır tozu: Proteazlar; Bunlar bakteriler tarafından hücre dışına salgılanır Giysilerden protein lekelerinin çıkarılması için. Amilazlar Bulaşık makinası deterjanlarında, dayanıklı nişasta lekelerinin çıkarılmasında. Lipazlar Yağ lekelerinin çıkartılmasını kolaylaştırmak için. Selülazlar Çamaşır yumuşatıcılarında kullanılır. 2.8 ENZİM SEKTÖRÜNE GENEL BAKIŞ Novo Nordisk 1989 yılına Nordisk Gentofte A/Ş ve Novo Industri A/Ş adlı iki Danimarka şirketinin birleşmesiyle oluşmuştur.Novo Nordisk insülin ve diabet ürünleri,hormon preparatları,büyüme hormonları ve sanayi enzimleri alanında dünyanın en büyük üreticilerindendir.Deterjan,nişasta yapımı,tekstil,bira ve şarap yapımı, şeker,deri,yağ ve kağıt yapımı gibi alanlarda kullanılan sanayi enzimlerinde tüm dünyanın ihtiyacının yaklaşık yarısını Novo Nordısk karşılamaktadır.14 kasım 1999 başında Novo Nordısk sağlık ürünleri ve enzim olmak üzere iki çalışma sahasına ayrılmıştır.14 Kasım gününden itibaren Novo Nordısk ve Novozymes olarak iki ayrı şirket olarak faaliyetlerine devam etmektedir TÜRKİYE’DE ENZİM SEKTÖRÜ Türkiye yıllık ithal ettiği yaklaşık 9 bin ton enzim için 66 milyar dolar para ödemektedir. Ülkemizde enzim üretimi gerçekleştiren bir kuruluş vardır (Orba A.Ş.). Kuruluş orta ölçekli bir işletme olup hiçbir know-how almadan tümüyle araştırma ve geliştirme çalışmaları sonucu tasarımlanmış ve faaliyete geçirilmiştir. Gıda ve tekstil sektörü için amilaz enzimini üretmektedir. Kuruluşta son zamanlarda deri ve deterjan sektörü için alkalen fosfataz üretimini kapsayan TTGV destekli bir araştırma projesi tamamlanmış ve bu enzimin de üretimine başlanmıştır. Enzim üretimi yapan Orba'ya ilaveten immobilize enzim teknolojisini kullanan iki kuruluşumuz daha vardır (Fako A.Ş. ve Unifar A.Ş.). Bu kuruluşlar immobilize penisilin asilaz enzimini yurt dışından ithal etmekte yine ithal ettikleri penisilini hidrolizleyerek 6-aminopenisillanik asit (6-APA) üretmektedirler ve ürettikleri 6-APA'ya farklı yan zincir moleküller bağlayarak semisentetik penisilinlerin sentezinde kullanmaktadırlar. KLONLAYARAK ENZİM ÜRETİMİ • • 7 nisan 2009 tarihinde Atatürk üniversitesinde bir grup bilim adamı tarafından yürütülen çalışmada,klonlanarak Karbonik Anhidraz 2 izoenzimi (insan solunumunda görevli ) üretilmesi başarıldı. Klonlama yöntemiyle bir enzimin fazla miktarda elde edilebilmesi sağlanmıştır. YEM ENDÜSTRİSİNE YÖNELİK ENDÜSTRİYEL ENZİMLERİN ÜRETİMİ ( YEM-EN) TÜBİTAK Marmara Araştırma Merkezi (MAM) Gen Mühendisliği ve Biyoteknoloji Enstitüsü (GMBE) tarafından, 'Yem Endüstrisine Yönelik Endüstriyel Enzimlerin Üretimi (YEM-EN)' projesi başlatıldı. Projenin hedefi, hayvan yemlerinde kullanılmak üzere yurt dışından ithal edilen ve yoğun kullanılan Fitaz, Ksilanaz, Beta-Glukanaz enzimlerini ülkemizde üretimini sağlamak, bunları ekonomik, etkin, doğru şekilde üretime katarak tavukçuluk sektörünü dünya ölçeğinde söz sahibi kılmak ve dışa bağımlılığı kendi teknolojimizle aşmaktır. Kanatlı hayvanlarda yıllık yaklaşık 3 milyon 5 yüz bin yem, 700 bin ton enzim tüketimi vardır. Bu tüketimin tamamı yurt dışından karşılanmakta olup 4 milyon dolar gibi bir para dışarıya akmaktadır. Bu proje dışa olan bağımlılığımızı azaltmanın yanında kendi üretimimizi yapmamızı sağlayacaktır. ENZİM EKLENME SEBEBİ Kanatlı hayvanlar aldıkları besini tamamen sindirememektedir. Yani içindeki enzimler yeterli olmamaktadır. Sindirilemeyen kısmın parçalanması ve sindirilmesiyle hayvanın verimi ve ağırlık artışı değişir. Kanatlı hayvanların yemlerinde enzim kullanılması; yemdeki organik maddenin sindirilebilirliğinin arttırılması, hayvansal ürün için daha az yem kullanılması, dışkıyla dışarı atılan ve sindirilemeyen yapıların yol açtığı çevre kirliliğinin ortadan kaldırılması ve dışkı akışkanlığının azaltılmış olması sebebi ile kirli yumurta probleminin azaltılması için oldukça önemlidir. Özellikle buğday, arpa gibi mısıra ve soyaya alternatif hammaddeler kullanıldığında enzim ilavesi kaçınılmazdır. 2.9 MİKROBİYAL ENZİM ÜRETİMİ • • Mikrobiyal yolla enzim üretiminin ilk aşaması uygun katalitik özgüllük ve istenilen fiziksel özellikleri taşıyan, mikroorganizmanın seçimi ile başlar. Seçilen mikroorganizma kısa sürede yüksek verimle enzim üretebilmeli, toksik madde ve antibiyotik üretmemeli, ucuz besi ortamında rahatlıkla çoğalabilmeli, gerek enzim üretimi sırasında gerekse izolasyon ve saflaştırma işlemleri sırasında problem oluşturacak yan ürünler üretmemelidir. • Mikroorganizma düzeyindeki modifikasyonlar genellikle hücre başına üretilen enzim miktarının artırılmasına yöneliktir. Ayrıca kültür ortamı ve fermentasyon koşulları da enzim üretim maliyetini düşürmeye yönelik olan önemli parametrelerdendir. • Farklı mikroorganizmalar tarafından aynı reaksiyonu katalizleyen enzimlere izofonksiyonel enzimler denir. Bu izofonksiyonel enzimler farklı pH optimumları gibi değişik özellikler taşarlar. Bu farklı özelliklerden istenenler mikroorganizma seçiminde kriter olur. 2.9.1 ENDÜSTRİYEL ENZİM ÜRETİM METODLARI 2.9.1.1 Koji prosesi (Solid-state fermentasyon): Klasik yöntemdir. Mikroorganizmalar katı ya da yarı katı tavalardaki besiyerlerinde üretilirler. Bu katı substratlar buğday kepeği, buğday sapı, pirinç kabuğu, arpa, suyu çıkarılmış şeker kamışı vb. dir. Çoğunlukla bu katı substratlar proteazlar, lipazlar, selülazlar ve oksidazlar gibi enzimlerin üretiminde funguslar için kullanılır. Bu tip fermentasyonda kontaminasyondan korunmak, uniform temperatür, havalandırma ve nemlendirme sağlamak zordur. • 2.9.1.2 Fermentör kullanımı: Modern yöntemdir. Bu fermentörlerin kullanımı yukarıda sayılan olumsuzlukları ortadan kaldırır. Mikrobiyal enzim üretiminde başlıca 4 çeşit fermentör kullanılır. Karıştırıcılı tank tipi fermentör, bubble column packed bed air lift KARIŞTIRICILI TANK TİPİ FERMENTÖRLER Büyük ölçekli aerobik proseslerde kullanılır. Mekanik bir karıştırıcı vasıtasıyla uygun karıştırma ve havalandırma sağlanır. PACKED BED VE BUBBLE COLUMN Packed back fermentör : Kültür ortamı ,substrat parçacıklarından oluşan doldulu yatak içerisinden geçirilir. Ürün sürekli yada kesikli proseslerle elde edilir. Bubble column : Alttan hava sağlanarak uygun karışım ve havalandırmanın elde edildiği uzun,silindirik kolonlardır. AİR LİFT FERMENTÖRLER • Havalandırma ve karıştırma havanın reaktör içerisinde aşağı ve yukarı yönlü çevirimi ile sağlanır. • • • • Bir enzim fermentasyonu prosesinin %50-80’i substrat harcamasıdır. Bu nedenle de mikroorganizmanın ucuz besiyerlerinde hızlı bir biçimde üremesi önemlidir. Ucuz besiyerindeki başlıca karbohidratlar; – melas, arpa, mısır, buğday, hidrolize nişasta ve laktoz, azot kaynakları; soya fasulyesi, pamuk tohumu, mısır maserasyon sıvısı, hidrolize maya, gluten, jelatin, kesilmiş süttür. Ayrıca besiyerine inorganik tuzlar, iz elementler ilave edilmelidir TEŞEKKÜRLER…

















![Enzimler-Ders-5 [Uyumluluk Modu]](http://s1.studylibtr.com/store/data/000566618_1-c4b0b448157e157d35a973db78c6671f-300x300.png)


