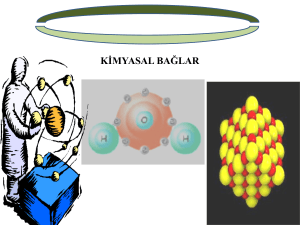
kimyasal türler arası etkileşimler
advertisement

217 3. Ünite KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 1. Kimyasal Tür Nedir?...........................................................................................................74 2. Kimyasal Türleri Bir Arada Tutan Kuvvetler ....................................................................75 3. Güçlü Etkileşimler ..............................................................................................................78 4. Zayıf Etkileşimler ...............................................................................................................85 Konu Değerlendirme Testi - 1 .............................................................................. 90 5. Fiziksel ve Kimyasal Değişimler ........................................................................................92 6. Tepkime Denklemleri ........................................................................................................94 Konu Değerlendirme Testi - 2 .............................................................................. 97 73 Kimyasal Tür Nedir? 218 220 Kimyasal Türler Maddelerin özelliklerini gösteren atom, molekül, iyon ve radikal taneciklerine kimyasal tür denir. Kimyasal Türler ATOM MOLEKÜL İYON RADİKAL Molekül en az 2 atomun belirli geometrik düzende birleşmesiyle oluşturduğu kimyasal türdür. CO2 gibi... İyon nötr bir atom ya da molekülün kimyasal değişim ile elektron alması veya vermesiyle oluşan yüklü taneciklerdir. Na+1 gibi... Pozitif yüklü iyonlara katyon iyonlara anyon adı verilir. Atom : bir elementin bütün özelliklerini gösteren en küçük parçacığına denir. He gibi... Katyon , negatif yüklü Anyon 1+ 2+ 3+ 1– 2– 3– Li+ Mg2+ AI3+ F– O2– N3– Na+ Ca2+ CI– S2– P3– K+ Sr2+ Br– Se2– Rb+ Ba2+ I– Te2– Radikal ortaklanmamış elektronu bulunan kimyasal türe denir. H• , HO• , •NO ... gibi etkinlik Örnek 1 Ödevim: Aşağıdaki iyonların adını yazınız. 1. Anyon İyon a. N5+ 2. Molekül b. N2 3. Katyon c. N3– CO3 Yukarıdaki tabloda verilen maddelerin eşleştirilmesi aşağıdakilerin hangisinde doğru verilmiştir? A) 1-b, 2-c, 3-a B) 1-c, 2-b, 3-a C) 1-a, 2-b, 3-c D) 1-c, 2-a, 3-b E) 1-b, 2-a, 3-c Çözüm 1 1-c, 2-b, 3-a 2– Karbonat NO3– Nitrat OH– Hidroksit 2– SO4 SO32– 2– CrO 4 NH4+ Sülfat H 3O + Hidronyum PO33– Fosfit PO3– 4 Fosfat – MnO4 2– MnO4 – CIO 74 Adı Sülfit Kromat Amonyum Permanganat Manganat Hipoklorit Kimyasal Türleri Bir Arada Tutan Kuvvetler KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 221 222 Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması Kimyasal türler arası etkileşimler Zayıf Etkileşimler Güçlü Etkileşimler İyonik bağ Van der Waals bağları Metalik bağ Kovalent bağ Dipol-dipol bağları Hidrojen bağı İndüklenmiş dipol bağları İyon-dipol bağları İyonlar Arası Bağlar Pozitif ve negatif yüklü taneciklerin elektron alışverişi ile birbirini çekmesi sonucu oluşan bağa iyonlar arası bağ denir. Na CI Na Elektron Na atom dizilimi: 2 - 8 - 1 + Na+ iyon 2-8 CI atom 2-8-7 CI + – [Na] [ CI ] – – CI iyon 2-8-8 Not: Zıt yüklü iki iyon arasındaki çekim kuvveti Coulomb bağıntısı ile bulunur. e : elektron yükü F= e2 4π . ε°. d2 d : iyonların çapları toplamı F : çekim kuvveti εo: dielektrik sabiti NaCl bileşiği animasyon 75 223 226 Örnek 2 Moleküller Arası Bağlar En az iki atomun elektron ortaklaşması sonucu birbirine bağlanmasıyla oluşan bağa kovalent bağ denir. Kovalent bağlı moleküllerin birbirleri arasındaki etkileşimine moleküller arası bağ denmektedir. H – C ≡ C – H C2H 2 O=C=O CO2 Açık bağ yapıları verilen asetilen (C2H2) ve karbondioksit (CO2) bileşiklerinin birer moleküllerindeki, I.toplam bağ, II.toplam atom, III.atom türü sayılarından hangileri farklıdır? (1H, + F F F Çözüm 2 F F + F F I.Toplam bağ II.Toplam atom III.Atom türü F 6C, 8O) H – C ≡ C – H O =C=O 5 4 2C, 2H → 4 C, 2O → 3 C, H C, O Moleküller arası bağ animasyon Metallerdeki Bağlar Metallerin bir elektron denizi içerisinde bir arada tutulmasını sağlayan bağ türüne metalik bağ denir. – + – + – + – + – – + + – + – + – – + – + + + – + + – + yüklü metal iyonu elektron denizi Periyodik tabloda aşağıdan yukarıya ve soldan sağa metalik bağ gücü artacağından metalin erime ve kaynama noktası artar . Örneğin; 11Na in erime noktası 19K nın erime noktasından büyüktür . Aynı şekilde 12Mg nin erime noktası 11Na nın erime noktasından büyüktür . Örnek 3 Metal atomlarındaki hareketli elektronların metallere kazandırdığı üç önemli özelliği yazınız. Çözüm 3 Elektriksel iletkenlik Parlaklık Tel ve levha haline gelebilme 76 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 227 230 Kimyasal türler arası etkileşimler, birbirine bağlanan türe bakılarak iki ana gruba ayrılabilir: 1. Atomlar arası bağlar Bağ enerjisinin birimi kJ mol–1 dir. Bağ oluşum olayları ekzotermiktir. Yani ısı verendir. Oksijen atomu 2. Moleküller arası bağlar Oksijen molekülü 1. tür bağlar, iyonik bileşiklerde, kovalent bileşiklerde ve metallerde atomları bir arada tutan güçlü çekim kuvvetleridir. Oksijen atomu 2. tür bağlar ise molekül yapılı katı ve sıvıların molekülleri arasındaki etkileşimi ifade eder. Bu kuvvetler atomlar arası bağlardan daha zayıftır. Örneğin; Su (H2O) moleküllerini oluşturan hidrojen ve oksijen atomları birbirine atomlar arası sağlam bağlarla bağlı iken farklı su molekülleri arasında zayıf çekim kuvvetleri vardır. •2O(g) 495,04 kJ → O2(g) + 495.04 kj.mol –1 Bağ kırılması olayları Yani ısı alandır. endotermiktir. 495,04 kJ Oksijen atomu Bağ Enerjisi Bir kimyasal bağ oluşumunda açığa çıkan veya herhangi bir kimyasal bağın kopması için geçen enerjiye bağ enerjisi denir. Örnek 4 Oksijen molekülü Oksijen atomu •O2(g) + 495.04 kj.mol –1 → 2O(g) Örnek 5 Aşağıda verilen olaylardan hangisi zayıf etkileşim sınıfına girer? Aşağıda bazı değişimler sırasında alınan veya verilen enerji değerleri verilmiştir. A)Ι2 katısının süblimleşmesi Buna göre, bu değişimlerden hangileri güçlü etkileşim olarak sınıflandırılır? B)H2 ve O2 moleküllerinden H2O oluşması C) Na metalinin elektron vermesi a) Ι2(k) + 150 kJ . mol–1 → 2Ι•(g) D)CO gazının yanması b) NaCI(k) + 760 kJ . mol–1 → Na (g) + CI(g) E)Br2 molekülünün atomlarına ayrışması c) H2O(s) + 40,1 kJ . mol–1 → H2O(g) + – d) CH4(s) + 8 kJ . mol–1 → CH4(g) e) Mg2+(g) + O2–(g) → MgO(k) + 3850 kJ . mol–1 Çözüm 4 Süblimleşme sırasında iyot moleküllerindeki atomlar arasında herhangi bir ayrılma olmaz. Katı haldeki Ι2 molekülleri gaz haline geçer. Çözüm 5 a, b ve e olayları kimyasal olaylardır. Bu nedenle güçlü etkileşimler olarak sınıflandırılırlar. Yaklaşık 40 kJ . mol –1 veya daha fazla enerji gerektiren olaylar güçlü etkileşimlerdir. 40 kJ . mol–1 den daha az enerji gerektiren olaylar ise zayıf etkileşimlerdir. 77 Güçlü Etkileşimler 231 232 Atom / İyonların Katman Elektron Dizilimleri ve Lewis Gösterimleri Tabloyu inceleyelim. ELEKTRON DİZİLİMİ Tür Lewis Gösterimi 1. Katman 2. Katman 3. Katman 4. Katman Na 2 8 1 – Na Na+ 2 8 – – [Na]+ Mg 2 8 2 – Mg Mg2+ 2 8 – – [Mg]2+ CI 2 8 7 – CI – 2 8 8 – [ CI ] S 2 8 6 – S S2– 2 8 8 – CI Tablodaki Na ve Mg atomları son katmanlarındaki elektronları verdiklerinde son katmanları 8 elektron olacak ve oktete ulaşacaklardır. Yine Cl ve S atomları son katmanlarına elektron aldıklarında son katmanları 8 elektron olacak ve oktete ulaşacaklardır. Elementlerin bileşik meydana getirirken son yörüngelerindeki elektron sayılarını, soygazların elektron dizilimlerine (He hariç) benzetme isteğine oktet kuralı denir. Na Mg S– 2 8 Mg CI 78 F CI Mg2+ CI 2– Oktet Kuralı: Na+ Mg [ S ] – 2 8 2 8 – CI 2 8 8 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 233 234 İlk 20 Elementin Katmanlarındaki Elektron Sayıları IA VIIIA 1 1H :1 3p 2 3Li : 2, 1 4Be 11Na 19K IVA VA VIA VIIA 4p 5p 6p 7p 8p 9p 5B : 2, 3 12p : 2, 8, 1 12Mg : 2, 8, 2 6C : 2, 4 13p 13Al : 2, 8, 3 7N 14p 14Si : 2, 8, 4 : 2, 5 8O 15p 15P : 2, 8, 5 : 2, 6 9F : 2, 7 16p 16S : 2, 8, 6 2H :2 10p 10Ne 17p 17Cl : 2, 8, 7 : 2, 8 18p 18Ar : 2, 8, 8 20p 19p 4 IIIA : 2, 2 11p 3 IIA : 2, 8, 8, 1 20Ca : 2, 8, 8, 2 Atomlar Arası Bağlar Bir atom elektron verdiğinde katyon oluşur. Örneğin, Na → Na+ Mg → Mg2+ ✱ Cl atomları bir araya gelince elektron alışverişi olmaz çünkü her iki atomun da oktete ulaşmak için elektron alması gerekir. Bu durumda CI atomları birer elektronlarını ortaklaşarak oktete ulaşırlar ve atomlar arasında kovalent bağ oluşur. Bir atom elektron aldığında anyon oluşur. Örneğin, Cl → Cl – S → S 2– ✱ Na ve Cl atomları bir araya gelince Na+ ve CI – iyonları oluşur ve birinin verdiği elektronu diğeri alır. (elektron alışverişi) ve atomların her ikisi de oktete ulaşırlar ve (–) ve (+) yükler birbirini çektiği için atomlar arasında iyonik bağ oluşur. 79 ✱ Na atomları bir araya gelince ise ne iyonik ne de kovalent bağ oluşur. Bir aradaki Na atomlarının son katmanlarındaki elektronlar atom kümesinin tamamında serbest dolaşıp (–) yüklü elektron denizi oluşturur. Elektronlarını kaybetmiş Na+ iyonları da bu denizde bulunurlar. Elektron denizindeki (–) yük ile (+) yüklü Na atomları arasında metalik bağ oluşur. 235 237 İyonik Bağ Zıt yüklü iyonlar arasındaki iyonik bağ denir. elektrostatik çekim kuvvetine Na Na Atomu dayanan kimyasal bağ türüne CI Na CI Atomu Na CI + CI – Na atomu son yörüngesindeki 1 elektronu CI atomuna verdiğinde her iki atomun da son yörüngesinde 8 elektronun oluşması sağlanmıştır. NaCI Kovalent Bağ Ametal atomları arasında elektron ortaklaşması sonucu oluşan bağa kovalent bağ denir. Kovalent bağlarda , iyonik bağlarda olduğu gibi atomlar arasında elektron alışverişi olmaz. Atomların son katmanlarında bulunan elektronlardan bir veya birkaç tanesi atomlar arasında paylaşılır. Genel olarak, atomların son katmanlarındaki elektron sayısını oktete tamamlamaları için kaç elektron gerekiyorsa o kadar kovalent bağ kurulur. Apolar Kovalent Bağ Bir molekülde bağ elektronlarının iki atom arasında eşit paylaşılmasıyla oluşan bağa apolar kovalent bağ denir. Örneğin; H2 molekülünde kovalent bağ ile bağlanan iki atom da aynıdır. Her bir hidrojen atomunun sadece bir protonu ve bir elektronu olduğundan iki atom da paylaşılan elektronları eşit kuvvetle çeker ve elektronlar eşit paylaşılır. Bir kovalent bağdaki elektronların iki atom arasındaki paylaşım oranına bağlı olarak iki tür kovalent bağ ortaya çıkar. H Birincisi elektronların eşit paylaşıldığı apolar kovalent bağ, + H H H H–H Ortaklaşılan elektronlar ikincisi eşit paylaşılmadığı polar kovalent bağdır. 80 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 238 240 Apolar Kovalent Bağ Örnekleri Oksijen Molekülü (O2) Azot Molekülü (N2) Her iki azot atomunun da son yörüngesinde beş elektron bulunur. Bu atomlar oktete ulaşmak için üçer elektronlarını ortaklaşa kullanmalıdır. Her iki oksijen atomunun da son yörüngesinde altı elektron bulunur. Bu atomlar oktete ulaşmak için ikişer elektronlarını ortaklaşa kullanmalıdır. O + O O O + N O= O N N N Ortaklaşılan elektronlar N + N animasyon N N Örnek 6 Genellikle bir atom, son yörüngesindeki elektronunu sekize tamamlayacak sayı kadar bağ yapar. 1 4 Atomlar arasında oluşan bağda, • 1 çift elektron kullanılmışsa tekli bağ H2 F2 2 3 O2 5 6 CI2 N2 S2 Yukarıdaki çizelgede atomları arasında tekli, ikili ve üçlü bağ bulunan atomların kutucukları belirtiniz. • 2 çift elektron kullanılmışsa ikili bağ • 3 çift elektron kullanılmışsa üçlü bağ Çözüm 6 oluşur. Tekli bağ bulunanlar: H , F , CI , → 1, 4, 5 2 F F O O Tekli Bağ İkili Bağ İkili bağ bulunanlar: O , S 2 2 2 2 → 2, 6 3 Üçlü bağ bulunanlar: N → 3 2 N N Üçlü Bağ 81 Apolar = Aynı atom Polar = farklı atom 241 242 Polar Kovalent Bağ Bir molekülde bağ elektronlarının iki atom arasında eşit paylaşılmaması sonucu oluşan bağa polar kovalent bağ denir. Polar kovalent bağdaki atomların elektronegatiflikleri farklı olduğundan bu bağ türü kutuplu kovalent bağ olarak da adlandırılır. H + F H + CI HCI molekülünde kovalent bağ oluşumu H F H CI H H C HF molekülünde kovalent bağ oluşumu H H Elektronegatiflik, bir atomun bağ elektronlarına sahip çıkma eğiliminin ölçüsüdür. Kovalent bağa katılan iki atomun elektronegatiflikleri arasındaki fark, bağın polarlık derecesini belirler. CH4 molekülünde kovalent bağ oluşumu Polar Kovalent Bağ Örnekleri Amonyak Molekülü (NH3) Azot (N) atomunun son yörüngesinde beş elektronu vardır ve bu nedenle üç bağ yapar. Hidrojen (H) atomları ise He düzenine ulaşmak için birer bağ yapar. N +3 H Karbon dioksit Molekülü (CO2) Karbon (C) atomunun son yörüngesinde dört elektronu bulunur ve bu nedenle dört bağ yapar. Oksijen (O) atomları da son yörüngesinde altı elektronu olduğundan iki bağ yapar. Böylelikle her bir oksijen atomu karbon atomu ile ikili bağ yapmalıdır. H N H O H C O Karbon dioksit molekülünün elektron dizilimi. O=C =O NH3’ün üç boyutlu görünümü 82 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 243 245 Örnek 7 Karbon monoksit Molekülü (CO) CO molekülünde karbon (C) atomunun dört, oksijen (O) atomunun ise iki bağ yapması gerekir. Fakat bu molekül oluşurken O atomundaki elektronlardan birinin C atomuna aktarıldığı varsayılır ve böylece C ile O atomları arasında üç bağ oluşur. C ve O atomları bu molekülde oktetini tamamlamamış olur. C C O Aşağıda verilen moleküllerden hangisinin elektron nokta yapısı yanlıştır? A) B) C) O H H CI O C O CI C CI CI O D) E) H F N HH H Çözüm 7 CI CI Şeklinde tüm atomlar oktetini tamamlamalıdır. C CI CI animasyon Bağ Polarlığı – Molekül Polarlığı İki atomlu moleküllerde bağ polar ise molekül de polardır. Örneğin; HF, NO ve HCI molekülleri İkiden fazla atomu olan moleküllerin polarlığı incelenirken bağların polarlığı yanında molekülün geometrisi de incelenmelidir. Örneğin; CO2 molekülünde bağlar polar olduğu halde molekül apolardır. δ– (2δ–)+ δ+ H δ– F HF molekülünde polarlık δ– O=C =O δ+ Şekilde görülen δ (kısmi), moleküldeki atomların yükünün elektron yükünden daha küçük olduğunu belirtir. δ+ (2δ)– O ≤ δ ≤ 1 bağıntısı her zaman geçerlidir. H2O molekülünde polarlık animasyon 83 246 01 248 01 Örnek 8 Örnek 9 Kovalent bağ ile oluşmuş bazı bileşiklerde atomların elektronları farklı güçlerle çekmeleri sebebi ile molekülde kutuplanma olmasına rağmen moleküldeki simetri sebebi ile bileşik apolar olabilir. CHCl3 bileşiğinin Lewis yapısı aşağıdakilerin hangisinde doğru verilmiştir? Buna göre, aşağıda verilen bileşiklerden hangisi bileşikteki atomlarda kutuplanma olmasına rağmen kendisi apolardır? H H A) Cl C Cl B) Cl C Cl Cl Cl (1H, 6C, 7N, 8O, 9F, 17Cl) A) H2O B) HF D) NH3 O E) HCl H H C H H H F H H H N H H 6C, 17Cl) H H C) Cl C Cl D) Cl C Cl Cl Cl H E) H C Cl H C) CH4 Çözüm 8 (1H, Çözüm 9 H Cl C, H ve Cl atomlarının tümü ortaklaşılan elektronlarla oktetlerini (H için dubletini) tamamlamalıdır. Görüldüğü gibi CH4 bileşiğindeki simetri sebebi ile molekül içi bağlarda kutuplanma olmasına rağmen bileşik apolardır. Metalik Bağ Metaller arasındaki bir ya da daha çok atomu bir arada tutan kimyasal bağ türüne metalik bağ denir. Metalik bağ, elektron bulutu ile pozitif iyonlar arasındaki elektriksel çekim kuvvetidir. Metalik bağ, metalin dövülebilirliği , ısı iletkenliği , elektrik iletkenliği , parlaklığı gibi pek çok özelliğin nedenidir. Elektron bulutu içindeki katyonlar kolayca hareket edebildikleri için metaller genelde yumuşaktır ve kolaylıkla işlenebilir. Metaller neden iletkendir? Metalik katıların elektrik iletkenliği çok yüksektir. Bunun nedeni metallerin son yörüngesindeki elektronların hareketli olması ve bu elektronların tüm yapıya dağılarak bir elektron denizi oluşturmasıdır. Metaller neden parlaktır? Metallerin son yörüngesindeki elektronlarının hareketli olması o metale parlaklık kazandırır. Bir ışık demeti metalin yüzeyine çarptığında elektriksel alan oluşturur ve hareketli elektronlara titreşim hareketi yaptırır. Bu titreşim hareketini yapan elektronlar gelen ışınla aynı frekansta ışın yayar ve gelen ışın yansımış olur. Böylelikle metal yüzeyler parlaklık kazanır. 84 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER Zayıf Etkileşimler 249 250 Moleküller arası çekim kuvvetleri büyük olan maddeler katı, daha az olanlar sıvı, en az olanlar gaz hâlde bulunur. Zayıf etkileşimler fiziksel bağlardır ve maddelerin molekülleri arasında etkilidir. Zayıf Etkileşimler Hidrojen Bağları Van der Waals Etkileşimleri Katı Dipol-dipol Etkileşimi İyon-Dipol Etkileşimi Sıvı Gaz London Kuvvetleri Zayıf etkileşimler genellikle 40 kJ . mol–1 den daha az enerji gerektiren etkileşimlerdir ve bu nedenle fiziksel bağ olarak kabul edilirler. 40 kj . mol –1 den daha fazla enerji gerektiren etkileşimler güçlü kimyasal bağlardır. Br2 oda sıcaklığında sıvı ve gaz halde bulunur. I2 oda sıcaklığında süblimleşebilen bir katıdır. animasyon Van der Waals Etkileşimleri A) Dipol-Dipol Etkileşimleri daha fazla olduğundan bu molekül sıvıdır. Dipol-dipol etkileşimlerinin gücü bağ dipollerinin büyüklüğüne ve molekül geometrisine bağlı olarak değişir. Polar yapıya sahip moleküller arasında görülen çekim kuvvetidir. HCI, H2O ve NH3 gibi polar moleküllerde elektron dağılımı simetrik olmadığından kısmi pozitif (δ+) ve kısmi negatif (δ–) uçlar bulunur. Moleküller arasındaki bu uçlar arasında bir çekim kuvveti oluşur. δ + δ – H – CI Polar kovalent bağ dipol-dipol etkileşimi δ + δ – O=C =O O O CO2 ve SO2 moleküllerini incelemek gerekirse, CO2 apolar , SO2 ise polar moleküldür. SO2 de dipol-dipol etkileşimi etkin olduğundan molekülleri CO2 molekülüne göre daha sağlamdır. Moleküller arası bu etkileşimden dolayı SO2 nin kaynama noktası –10°C, CO2 nin ise –78 °C dir. H – CI Polar kovalent bağ HBr , HΙ , H2S , OF2 , NF3 , PF3 gibi moleküllerde de molekül içi bağlar polar kovalent molekül ise polardır. Bu nedenle molekülleri arasında dipol-dipol kuvveti etkindir. Molekülün polarlığı ne kadar fazlaysa dipol karakteri o kadar yüksektir. S Örneğin; oda koşullarında NO molekülleri gaz iken, CH3CN molekülünün polarlığı 85 251 252 B) İyon-Dipol Etkileşimleri + Bir iyon ile polar molekül arasında görülen etkileşime iyon-dipol etkileşimi denir. – Örneğin; suda çözünen bir tuz olan NaCI katısının katyonları (Na+), H2O moleküllerinin kısmi negatif yüklü O atomları ile; anyonları (CI –) ise kısmi pozitif yüklü H atomları ile etkileşir. Na+ iyon-dipol etkileşimi Na+ iyonu – CI iyonu δ– O CI – Polar kovalent bağ H H δ+ H2O Molekülü NaCl'nin (yemek tuzu) sudaki (H2O) çözeltisinde iyon-dipol etkileşimleri δ+ animasyon C) London Kuvvetleri (İndüklenmiş Dipol Bağları) London kuvvetini ilk açıklayan bilim adamı Fritz London dır. Soygazlar ve apolar moleküller uygun koşullar sağlandığında sıvı veya katı hale geçebilmektedir. Bu da o atom veya molekülleri arasında bir etkileşim olduğunu göstermektedir. Apolar moleküllerde ve soygazlarda anlık geçici dipoller oluşur. Farklı atom veya moleküllerin anlık kısmi yükleri birbirini çeker ve böylece moleküller arası bağlar oluşur. London kuvvetleri her kimyasal tür için mümkündür fakat, başka etkileşimler içeriyorsa o etkileşim her zaman önceliklidir. Bu şekilde geçici polar özellik kazanan moleküller arasında meydana gelen çekim kuvvetlerine London kuvvetleri ya da indüklenmiş dipol-indüklenmiş dipol etkileşimi denir. Sadece London kuvvetlerinin etkin olduğu moleküllerde, molekül büyüdükçe ve toplam elektron sayısı arttıkça London kuvveti artar. Elektrostatik Çekim 2+ e– e– e– e– 1. Helyum Atomu 2+ 2. Helyum Atomu δ – δ + δ – δ + ek bilgi 86 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 253 255 Örnek 10 Örnek 11 I. H2S I. CCl4 II. He II. Ar III. KCl – H2O III. Br2 molekülleri arasında yoğun fazlarda görülen etkileşimleri açıklayınız. IV. CO2 (1H, 2He, 8O, 16S, 17Cl, 19K) (6C, Çözüm 10 I.H2S molekülü Yukarıda verilenlerin London kuvvetleri arasındaki ilişkiyi yazınız. S yapısına sahip polar bir mole- H H küldür. Polar yapılı moleküller arasında yoğun fazda dipol - dipol etkileşimleri etkindir. II.Soygazlar apolardır. Apolar moleküller arasında London kuvvetleri etkindir. 8O, 17Cl, 18Ar, 35Br) Çözüm 11 Elektron sayısı arttıkça London kuvvetleri artar. Buna göre, London kuvvetleri arasındaki ilişki I > III > IV > II şeklindedir. III.KCl kristalleri iyon, H2O polar yapılı moleküldür. İyon kristallerinin polar çözücülerde çözünme olayında iyon - dipol etkileşimleri olur. Hidrojen Bağları Hidrojen (H) atomları, elektronegatiflikleri yüksek olan F, O ve N atomlarıyla H – F, H – O ve H – N bağlarını oluşturduğunda kısmi pozitif (δ+) yük, diğer uç ise kısmi negatif (δ–) yük kazanır. Bunun sonucunda δ+ yüklü H atomu ile δ– yüklü diğer atom arasında bir elektrostatik çekim kuvveti oluşur. Bu çekim kuvvetine hidrojen bağı denir. δ+ O δ – H H N H N H H HHH NH3 bileşiğinde hidrojen bağı H O H δ δ + H N δ+ H H δ Hidrojen bağı Fδ Hδ+ – F + Hidrojen bağı δ– – Fδ Hδ+ δ– F Hδ + – Hδ + Hidrojen bağları H2O bileşiğinde hidrojen bağı HF bileşiğinde hidrojen bağı animasyon 87 256 257 Hidrojen bağı etkin olan maddelerde, moleküller arası etkileşimler başka etkileşim türlerine göre daha baskındır. Hidrojen bağı içeren moleküllerin kaynama noktaları, moleküller arası diğer etkileşim türlerini içerenlere göre daha yüksektir. 100 Kaynama Sıcaklığı (°C) Grup 4A (14) Grup 5A (15) Grup 6A (16) Grup 7A (17) H2O HF 0 H2Te H2Se NH3 H2S HCI PH3 –100 SnH4 HBr GeH4 SiH4 –200 SbH3 HI AsH3 CH4 2 3 4 5 Periyodik sistemde farklı gruplardaki elementlerin hidrojenli bileşiklerinin kaynama noktaları H2O 100 °C, H2S –60 °C de kaynar. Bunun nedeni H2S moleküllerinde dipol-dipol etkileşiminin , H2O moleküllerinde ise dipol-dipol etkileşiminin yanı sıra hidrojen bağlarının daha etkin oluşudur. H O H O O HC3 – C – CH3 (aseton) ile H2O; HCOOH (formik asit) ile H2O; CH3OCH3 (di metil eter) ile H2O molekülleri arasında hidrojen bağı oluşur. H–C O– H CH3 H O H Formik asit ile H2O C=O CH3 Hidrojen bağı H 3C – O H– O Hidrojen bağı H– O CH3 H H Hidrojen bağı Aseton ile H2O Dimetil eter ile H2O 88 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 258 261 Hidrojen Bağına Sahip Maddelerin Fiziksel Özellikleri Hidrojen bağlarının varlığı ve büyüklüğü hidrojen içeren maddelere içermeyenlere göre avantaj sağlar, maddelere bazı fiziksel özellikler kazandırır. Molekülleri arasında hidrojen bağı oluşturabilen maddenin; İyonik bileşikler polar çözücülerde çözünür. Bunun nedeni iyon-dipol etkileşiminin kuvvetli olmasıdır. a) Erime ve kaynama noktası b) Çözünürlüğü Genellikle polar maddeler polar çözücülerde , apolar maddeler ise apolar çözücülerde iyi çözünür. c) Yoğunluğu diğer maddelere göre daha yüksektir. Apolar ve polar maddeler genellikle birbirleriyle karışmazlar. Örneğin apolar CCI4 molekülü, polar olan su içinde hiç çözünmez. Bunun nedeni su molekülleri arasındaki etkileşimin su ve CCI4 arasındaki etkileşimden daha güçlü olmasıdır. Kimyasal Türler Arasındaki Etkileşimlerin Çözünmeye Etkisi Maddelerin birbiri içerisindeki çözünmesinde moleküller arası etkileşimlerin rolü büyüktür. Aralarında çekme kuvveti olan moleküller birbiri içinde kolay çözünürler. Örnek 12 Örnek 13 Aşağıda bazı çözücülerde çözünen maddeler ile çözücü çözünen arasında etkin olan etkileşimin türü verilmiştir. I. CH4 II. HCl Buna göre, hangisinde çözücü - çözünen arasındaki etkileşimin türü hatalıdır? III. NaH IV. H2O Yukarıda verilen maddelerin hangilerinin yoğun fazlarında molekülleri arasında hidrojen bağları vardır? Açıklayınız. Çözüm 12 I.F, O ve N atomları içermeyen apolar bir moleküldür. Molekülleri arasında London etkileşimleri etkindir. II.F, O ve N atomları içermeyen polar bir moleküldür. Molekülleri arasında dipol - dipol etkileşimleri etkindir. Çözücü Çözünen Etkileşim türü A) H2O KCIİyon-dipol B) HCI C) H2ONH3 Hidrojen bağları D) H2OCH3OH Hidrojen bağları E) HBr Dipol - Dipol NH3Dipol-dipol NaCI Çözüm 13 + – A) K – CI ile H2O arasında iyon-dipol B) Polar molekül olan NH3 ile HCl arasında lipol-dipol III.İyonik bağlı bir bileşiktir. IV.Hidrojenin O atomu ile yaptığı bağları içeren polar bir moleküldür. Molekülleri arasında dipol - dipol etkileşimleri de olmakla birlikte hidrojen bağları etkindir. 89 C) NH3 ile H2O arasında hidrojen bağları D) CH3OH ile H2O arsında hidrojen bağları + – E) N – Cl ile HBr arasında iyon-dipol görülür. etkileşimleri Konu Değerlendirme Testi - 1 1. O •OH CI– NH4+ AI3+ •CI ilgili; Yukarıdaki tabloda bazı kimyasal türlere örnekler verilmiştir. Buna göre tablodakilerden, I.iyon, II.radikal I. Güçlü etkileşimler kimyasal bağ tanımına girer. II. İki farklı türün çekirdekleri arasında itme kuvvetleri bulunur. III. Birbirine yaklaşan türler arasında çekme kuvvetleri çok fazla, itme kuvvetleri çok az ise güçlü etkileşimler oluşur. yargılarından hangileri doğrudur? olan kimyasal türlerin sayısı aşağıdakilerin hangisinde doğru olarak verilmiştir? I A) 1 272 4. Kimyasal türler arasında oluşan etkileşimler ile 262 A) Yalnız I B) Yalnız II D) II ve III C) I ve II E) I, II ve III II 5 B) 2 4 C) 3 3 D) 4 2 E) 5 1 2.1H ve 8O atomları arasında oluşan H2O bileşiği ile ilgili, I. Kovalent bağ ile oluşur. II. Bağ yapımında 4 elektron ortaklaşa kullanılır. O şeklindedir. III. Elektron nokta yapısı H H yargılarından hangileri doğrudur? A) Yalnız I B) Yalnız II D) II ve III 5. I. C) I ve II E) I, II ve III II. 3. Atomların elektron dağılımında son katmanda III. yer alan elektronların element sembolü çevresinde noktalarla gösterilmesine Lewis yapısı denir. Buna göre periyodik sistemde yer aldığı grubu belirtilen atomlardan hangisinin Lewis yapısı yanlış gösterilmiştir? Periyodik cetveldeki grubu Yukarıda bazı atomların elektron - nokta gösterimleri verilmiştir. Buna göre, verilen atom çiftleri ve oluşturabilecekleri yapılarla ilgili aşağıdakilerden hangisi yanlıştır? Lewis yapısı A) 1A Li B) 2A Be C) 3A B D) 4A C E) 6A O A) I. de iyonik bağlı bileşik oluşur. B) II. de elektron alışverişi ile bağ oluşur. C) III. de element çiftleri arasında bağ oluşmaz. D) I. ve II. de oluşan bileşiklerin formülleri farklıdır. E) II. de taneciklerin kimyasal özellikleri farklıdır. 90 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 9. Aşağıda verilen kimyasal tür çiftlerinden hangi- 6. sinde tanecikler arasında dipol - dipol etkileşimleri görülebilir? (1H, Katman elektron dağılımı ile bağ yapısı verilen X2 molekülü ve X atomu ile ilgili aşağıdaki yargılardan hangisi yanlıştır? 6C, 7N, 8O, 17Cl) A) CO2 – H2O B) CH4 – H2O C) NH3 – H2O D) CCl4 – H2O E) CCI4 – HCI A)X2 apolar bir moleküldür. B) X bir ametaldir. C)X2 molekülünde X atomları kovalent bağ ile birbirine bağlanmıştır. D)X2 molekülünde X atomları arasında ikili bağ vardır. E) X bir halojen atomudur. 10. Hidrojen bağı, diğer bağlardan ayırt edilebilmesi için -------- şeklinde gösterilir. Aşağıdaki molekül çiftleri arasındaki hidrojen bağlarından bazıları gösterilmiştir. 7. Türler arası etkileşim Güçlü etkileşimler İyonik (1) Kovalent (2) Zayıf etkileşimler Buna göre, hangisinde hidrojen bağı yanlış gösterilmiştir? A) O H CH3 Metalik (3) B) Yukarıdaki şemada türler arası etkileşimlerin sınıflandırılması yapılmıştır. Buna göre, aşağıdaki örneklerden hangisi 1, 2 ve 3 ile gösterilen türlerden herhangi birine ait değildir? O H H C) H H D) F B)F2 molekülündeki atomların arasındaki bağ E) C) HCl molekülündeki atomlar arası bağ H H H H N H H F C 2H 5 N H D) NaCI molekülündeki atomlar arası bağ H N O CH3 A) Cu atomları arasındaki bağ O H H H H H O E)H2O ve CH3OH molekülleri arasındaki bağlar H 8. O H 1 H 2 3 O H C H H 11. Polar moleküller arasında katı ve sıvı halde mo- Yukarıdaki bazı bağ türleri 1, 2 ve 3 ile işaretlenmiştir. Buna göre, I. 1. fiziksel, 2. ve 3. kimyasal bağdır. II. 1. bağ, diğerlerinden daha kolay kopar. III. 1. ve 2. bağlar hidrojen bağıdır. yargılarından hangileri doğrudur? A) Yalnız I B) I ve II D) II ve III C) I ve III lekülleri bir arada tutan etkileşim apolar moleküllere kıyasla daha kuvvetlidir. Bu sebeple polar bileşiklerin erime ve kaynama sıcaklığı, apolar bileşik ve element moleküllerininkinden genellikle daha büyüktür. Buna göre, aşağıda verilen maddelerden hangisinin, aynı koşullarda kaynama sıcaklığı diğerlerininkinden daha büyüktür? (1H, 6C, 8O, 16S) A) H2O E) I, II ve III 91 B) CS2 C) CO2 D) H2 E) O2 Fiziksel ve Kimyasal Değişimler 273 274 Günlük hayatımızda çeşitli etkiler sonucunda maddelerde bazı değişimler olduğunu görürüz. Örneğin, ✱ açık havada bırakılan demirin paslanması, ✱ sıcak bir ortama konulan buz parçasının erimesi, ✱ gümüşün kararması Fiziksel Değişme Maddelerin yapısı değişmeden sadece hal , biçim , şekil , dış görünüşünde meydana gelen değişimlere fiziksel değişim denir. Fiziksel değişmeler sonucunda maddenin kimyasal yapısı değişmez. Örneğin H2O ile formülize edilen suyun katı, sıvı ve gaz hallerinin hepsi aynı formülle gösterilir. değişimleri bunlardan sadece birkaçıdır. Maddelerde meydana gelen değişimler 2 grupta incelenebilir: • Fiziksel Değişimler • Kimyasal değişimler Buz Sıvı su Sıvı buharı Suyun (H2O) katı, sıvı ve gaz hali Fiziksel Değişim Örnekleri Maddelerde meydana gelen değişimlere bir enerji değişimi de eşlik eder. Fiziksel olaylarda moleküller arası etkileşimler (zayıf etkileşimler) söz konusu olduğundan kimyasal olaylara kıyasla daha düşük enerji değişimi vardır. Kağıdın yırtılması Mumun erimesi Şekerin suda çözünmesi Gökkuşağı oluşumu a) H2O(s) + 40,6 kJ/mol → H2O(g) Yoğurttan ayran yapımı – Tebeşirin toz haline getirilmesi b) NaCI(k) + 787 kJ/mol → Na+(g) + CI (g) a örneğindeki değişim fiziksel , b örneğindeki değişim kimyasaldır . Bu nedenle a örneğindeki enerji değişimi b örneğindekine göre daha azdır. Camın kırılması Camın kırılması Şekerin çayda çözünmesi Gökkuşağı oluşumu Buzun erimesi video 92 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 275 277 Kimyasal Değişme Maddenin iç yapısında meydana gelen değişimlere kimyasal değişim denir. Kimyasal değişimde maddelerin fiziksel özelliklerinin yanında atom veya molekül yapıları da değişir. Kömürün Yanması Demirin Paslanması Elmanın Çürümesi Bitkilerin Fotosentez Yapması Kimyasal Değişim Örnekleri Kömürün yanması Demirin paslanması Bitkilerin fotosentez yapması Ekmeğin küflenmesi Suyun elektrolizi Elmanın çürümesi Hamurun mayalanması Yumurtanın pişmesi video Örnek 14 Örnek 15 Suyun elektrolizinde gerçekleşen değişim aşağıdaki olayların hangisinde vardır? Aşağıda verilen değişimleri fiziksel ve kimyasal olarak sınıflandırınız. A)Buzun erimesi B) Naftalinin süblimleşmesi a) Yemek tuzunun suda çözünmesi fiziksel C) Elmadan sirke yapılması b) Sütten yoğurt yapılması kimyasal c) Demirin paslanması kimyasal d) Soyulan patatesin kararması kimyasal e) Hamurun yoğurulması fiziksel f) Suyun buharlaşması fiziksel g) Üzümden sirke yapılması kimyasal D)Mürekkebin su içinde dağılması E) Ekmeğin dilimlenmesi Çözüm 14 Suyun elektrolizi kimyasal olaydır. Elmadan sirke yapılması da aynı şekilde kimyasaldır. 93 F/K Tepkime Denklemleri 278 280 Tepkime Denklemlerinin Yazılması ve Denkleştirilmesi Tepkimelerde, Hacim, sıcaklık, basınç ve molekül sayısı her zaman korunmayabilir. Bir kimyasal olaya karışan maddelere tepkimeye girenler ya da reaktifler denir. Oluşan maddelere ise ürünler ya da reaktanlar denir. Girenler ve ürünlerin formüllerinin yazılı olduğu gösterimlere tepkime denklemi denir. Atom türü ve sayısı Toplam proton, nötron ve elektron sayısı her zaman korunur. Kimyasal tepkimelerde girenlerin kütlesi ürünlerin kütlesine eşittir. Yani kütle korunur. Kimyasal tepkimeler tepkime denklemleri yazılarak gösterilir. Tepkimeler denkleştirilirken girenler ve ürünlerdeki atom sayıları eşitlenir. Tepkimeye girenlerin ürünlere dönüştüğünü belirtmek için girenlerden ürünlere doğru bir ok (→) konulmalıdır. Bileşik formülündeki atom sayıları ile kat sayıları çarpım durumundadır. Atomik haldeki elementlerin ve bileşiklerin başına kesirli sayı gelemez. Ancak moleküler haldeki elementlerin başına kesirli sayı gelebilir. Maddeyi oluşturan en küçük birim esas alınır. Örneğin Hidrojen elementi moleküllü yapıya sahip olduğundan denklemde H değil, H2 şeklinde gösterilir. 2H2(g) + O2(g) → her zaman korunur. 2H2O(g) animasyon Örneğin; C2H6 + O2 → CO2 + H2O 123 123 Girenler (reaktifler) Ürünler tepkimesini denkleştirelim. Karbon ve hidrojen sayıları eşitlenmiş oldu. Fakat oksijen atom sayıları eşit değildir. Ürünlerde toplam 7 oksijen bulunmaktadır. Bu nedenle girenlerdeki 7 O2 nin katsayısına konulmalıdır. Böylece tepkime 2 denkliği sağlanmış olur. C2H6 + Girenler tarafında 2 karbon atomu vardır. Karbon atomu denkliğini sağlamak için sağ taraftaki CO2 formülünün başına 2 kat sayısı konur. C2H6 + O2 → 2 CO2 + H2O Girenler tarafında 6 hidrojen atomu vardır. Sağ taraftaki H2O formülünün başına 3 konularak hidrojen denkliği sağlanmış olur. C2H6 + O2 → 2CO2 + 3 H2O 7 O → 2CO + 3H O 2 2 2 2 Örnek 16 C3H7OH + O2 → CO2 + H2O tepkimesi en küçük tam sayılarla denkleştirildiğinde O2 nin katsayısı kaç olur? Çözüm 16 C3H7OH + 9 O → 3CO2 + 4H2O 2 2 Katsayıları tam sayı yapmak için 2 ile çarpalım. 2C3H7OH + 9O2 → 6CO2 + 8H2O 94 KİMYASAL TÜRLER ARASI ETKİLEŞİMLER 281 284 Örnek 17 Örnek 18 I. 2Ag + 2H2SO4 → X + SO2 + 2H2O I. 2H2O → 2X + O2 II. 3MgO + 2Y → Mg3(PO4)2 + 3H2O II. N2 + 3X → 2Y Yukarıda denkleşmiş olarak verilen tepkimelerdeki X ve Y ile gösterilen bileşiklerin formüllerini bulunuz. III. Y + HCl → Z Yukarıdaki denkleştirilmiş denklemlerde yer alan X, Y ve Z maddelerinin formülleri nelerdir? Çözüm 18 Çözüm 17 I. denklem 2 . 2. H + 2. O = 2. X + 2. O 2H = X X : Ag2SO4 Y : H3PO4 X = H2 II. denklem 2 . N + 3. 2. H = 2. Y N + 3H = Y Y = NH3 III. denklem N + 3H + H + Cl = Z Z = NH4Cl Tepkime Çeşitleri Oluşum (Sentez) Tepkimeleri Bozunma (Ayrışma) Tepkimeleri İki veya daha çok elementin tepkimeye girerek bileşik oluşturduğu tepkime türüne oluşum (sentez) tepkimesi denir. Bazı maddelerin ısı etkisiyle elementlerine veya basit bileşiklere dönüşmesi tepkimelerine bozunma (ayrışma) tepkimeleri denir. → H2 + F2 H2 + 3H2 2HF → 2KCIO3(k) 2NH3 Bir tepkime denkleminde, girenlerin ve ürünlerin fiziksel halleri parantez içinde yazılır. Gaz için (g), sıvı için (s) ve katı için (k) simgeleri kullanılır. N2(g) + 3H2(g) → MgCO3(k) MnO2 , 350 °C ısı 2KCI(k) + 3O2(g) MgO(k) + CO2(g) 2NH3(g) Tepkimenin ilerlemesi için gerekli olan sıcaklık , basınç ve yardımcı maddeler ok üzerinde gösterilebilir. N2(g) + 2O2(g) yüksek sıcaklık 2NO2(g) Kireç Ocakları 95 285 288 Yanma Tepkimeleri Çözünme-Çökelme Tepkimeleri Maddelerin havadaki oksijenle etkileşmesi olaylarına yanma tepkimeleri denir. Suda çözünen iki bileşikten birinin katyonunun diğerinin anyonu ile suda çözünmeyen bir katı oluşturmasına çökme, kalan diğer iyonların suda görülemeyecek kadar küçük tanecikler halinde dağılmasına çözünme denir. C + O2 → CO2 C6H12O6 + 6O2 → 6CO2 + 6H2O 2KI(suda) + Pb(NO3)2(suda) → PbI2(k) + 2KNO3(suda) NaCI(suda) + AgNO3(suda) → AgCI(k) + NaNO3(suda) Asit-Baz Tepkimeleri Suda çözündüğünde H+ iyonu veren maddeler asit , OH– iyonu veren maddeler bazdır . Bir asit ile bazın etkileştiği ve çoğu zaman nötralleşme olarak da adlandırılan tepkimelere asit-baz tepkimeleri denir. HCI(suda) + NaOH(suda) → NaCI(suda) + H2O(s) 2HNO3(suda) + Ca(OH)2(suda) → Ca(NO3)2(suda) + 2H2O(s) Pamukkale Travertenleri Örnek 19 Örnek 20 2H2(g) + O2(g) → 2H2O(g) Aşağıda verilen tepkimelerden hangisi asit-baz tepkimesidir? tepkimesi, A)2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O I. Sentez B) NaCI + AgNO3 → AgCI + NaNO3 II. Yanma C)CaCO3 → CaO + CO2 III. Asit-Baz tepkime türlerinden hangilerine örnek olarak verilebilir? A) Yalnız I B) Yalnız II D) II ve III D)H2 + CI2 → 2HCI E)6CO2 + 6H2O → C6H12O6 + 6O2 C) I ve II E) I, II ve III Çözüm 19 Çözüm 20 A seçeneğindeki tepkime asit-baz tepkimesidir. H2O (su) oluşumu sentez ve yanma tepkimelerine örnektir. 96 289 KİMYA BİLİMİ Konu Değerlendirme Testi - 2 300 1. Aşağıda bazı olaylar ve sınıflandırmaları verilmiş- 4. Kütle tir. C Buna göre, verilenlerden hangisi yanlıştır? Olay Sınıflandırma A A) Elmadan sirke eldesi Kimyasal B) Yoğurttan ayran eldesi Fiziksel B C) Sütten peynir eldesi Kimyasal D) İyotun süblimleşmesi Fiziksel E)Elektroliz Fiziksel Zaman Kimyasal bir tepkimenin Kütle - Zaman grafiği yanda verilmiştir. Buna göre, I. Reaktifler A ve B, ürün C maddesidir. II. B nin tamamı harcanmıştır. III. Başlangıçta alınan A ve B nin toplam kütlesi kadar C oluşur. yargılarından hangileri doğrudur? 2. 1. X2Y(s) + Q1 → X2Y(g) A) Yalnız I 2. X2Y(g) + Q2 → 2X • (g) + Y Yukarıdaki tepkimelerde Q1 ve Q2 ile gösterilen değerler tepkime sırasında alınan enerji miktarlarıdır. Buna göre; I.Q2 > Q1 dir. II. 1. tepkimede zayıf etkileşimler, 2. tepkimede güçlü etkileşimler kırılmıştır. III. 1. tepkimede fiziksel, 2. de kimyasal değişme olmuştur. yargılarından hangileri doğrudur? B) Yalnız II 5. Deniz suyundan Mg metali eldesi işlemleri aşaC) I ve II E) I, II ve III D) II ve III 3. Aşağıda bazı değişmeler ve bu değişimlerin gerçekleşebilmesi için gerekli enerji miktarları verilmiştir. Buna göre, bu değişimlerden hangisinde tepkimeye giren kimyasal türün kimliği değişmemiştir? A)H2O(s) + 43,9 kJ mol–1 → H2O(g) 2– B)MgO(k) + 3850 kJ mol–1 → Mg2+ (g) + O (g) C)H2O(g) + 463,4 kJ mol–1 C) I ve III E) I, II ve III (g) A) Yalnız I B) I ve II D) II ve III ğıda verilmiştir. I. Deniz suyundaki Mg2+ iyonları Ca(OH)2 çözeltisiyle tepkimeye sokularak Mg(OH)2 katısı çöktürülür. II. Çöken Mg(OH)2 katısı çözeltiden süzülerek ayrılır. III. Ayrılan Mg(OH)2 katısı HCl çözeltisiyle tepkimeye sokularak MgCl2 sulu çözeltisi elde edilir. IV.MgCl2 çözeltisinin suyu buharlaştırılarak katı MgCl2 elde edilir. V. Katı MgCl2 eritilir. VI. Erimiş MgCl2 elektroliz edilerek Mg metali elde edilir. Buna göre, işlemlerin fiziksel ve kimyasal olarak sınıflandırılması aşağıdakilerin hangisinde doğru verilmiştir? → H• (g) + OH• (g) D) I2(k) + 151 kJ mol–1 → 2I• (g) E)NaCI(k) + 787 kJ mol–1 → Na+(g) + CI–(g) 97 Kimyasal A) I, II, III Fiziksel IV, V, VI B) I, II, IV III, V, VI C) I, III, VI II, IV, V D) III, IV, V I, II, VI E) III, V, VI I, II, IV 6. I.2H2O → 2X + O2 II.N2 + 3X → 2Y III. Y + HCl → Z 10. I. Nötrleşme tepkimesidir. Yukarıdaki denkleştirilmiş denklemlerde yer alan X, Y ve Z maddelerinin formülleri aşağıdakilerden hangisinde doğru olarak verilmiştir? Y II. Oluşan tuzun bir formülünde 9 tane atom vardır. Bilgileri verilen tepkimenin denklemi aşağıdakilerin hangisi olabilir? A) 3KOH + H3PO4 → K3PO4 + 3H2O X A) H NH B) H NH2NH3Cl C) H2NH3NH4Cl D) 2HCl + Mg(OH)2 → MgCl2 + 2H2O D) H2 NHNHCl E) H2NH3NH3Cl E) Zn + 2KOH → K2ZnO2 + H2 Z Yukarıda verilen tepkimeler en küçük tam sayılarla denkleştirildiğinde H2O ların katsayıları arasındaki ilişki hangisinde doğru verilmiştir? A) I > II > III B) Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O NHCl 7. I.C2H5OH + O2 → CO2 + H2O II.CaC2 + H2O → Ca(OH)2 + C2H2 III.H2SO4 + AI(OH)3 → AI2(SO4)3 + H2O B) III > I > II D) II > I > III C)Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O 11. Nötralleşme reaksiyonları sonucu tuz ve su, organik bileşiklerin yanma reaksiyonları sonucu karbondioksit ve su oluşurken çözünme - çökelme tepkimeleri iyon değişimi ile gerçekleşir. C) III > II > I Buna göre, aşağıdaki reaksiyonlardan hangisinin ürünü yanlış verilmiştir? E) I > III > II Tepkime Ürün A)HNO3 + KOH KNO3 + H2O B)CH4 + O2CO2 + H2O C)NH3 + HCl NH3Cl + H2O D)KΙ + Pb(NO3)2PbΙ2 + KNO3 8. Aşağıdaki verilen denklemler en küçük tam sa- E) KCl + AgNO3 yılarla denkleştirildiğinde hangisinde ürünlerin katsayıları toplamı en fazla olur? AgCl + KNO3 A) AI + HNO3 → AI(NO3)3 + H2 B)N2 + H2 → NH3 C) Ca + H2O → Ca(OH)2 + H2 D) Zn + NaOH → Na2ZnO2 + H2 12. Aşağıda bazı tepkimeler ve türleri verilmiştir. E)C2H4 + O2 → CO2 + H2O Buna göre, hangisinin türü yanlıştır? Tepkime A)C6H12O6(k) + 6O2(g) → 6CO2(g) + 6H2O(g) 9. 2NO2(g) + 1 O2(g) → N2O5(g) B)CaCO3(k) → 2 tepkimesi ile ilgili, CaO(k) + CO2(g) I. Yanma tepkimesidir. II. Molekül sayısı azalmıştır. III. Atom sayısı korunmuştur. yargılarından hangileri doğrudur? A) Yalnız I B) I ve II D) II ve III C)AgNO3(suda) + NaI(suda) → AgI(k) + NaNO3(suda) D)2Fe(k) + 3 O2(g) → Fe2O3(k) 2 E)2HCl(suda) + Mg(OH)2(suda) C) I ve III MgCl2(suda) + 2H2O(s) → E) I, II ve III 98 Tepkime türü Yanma Çözünme Çökme Yanma Nötralleşme